Похожие презентации:
Лабораторная диагностика бруцеллёза
1.
АГЕНТСТВО РЕСПУБЛИКИ КАЗАХСТАН ПО ЗАЩИТЕ ПРАВПОТРЕБИТЕЛЕЙ
Казахский научный центр карантинных и зоонозных инфекций
им. М. Айкимбаева
ЛАБОРАТОРНАЯ ДИАГНОСТИКА БРУЦЕЛЛЁЗА
Руководство для врачей и студентов медицинских ВУЗов
Алматы, 2014
2.
УДК 61-074:616.981.42ББК
Рецензенты:
д. м. н. Л. Е. Некрасова
к. м. н. С. Б. Закарян
Сыздыков М. С., Жолшоринов А. Ж., Атшабар Б. Б., Кузнецов А. Н.,
Казаков С. В., Тугамбаев Т. И., Дерябин П. Н., Даулбаева С. Ф.,
Еспембетов Б. А., Зубова Н. В., Березовский Д. В., Утепова И. Б.
Бруцеллёз человека: руководство для врачей и студентов медицинских
ВУЗов / Агентство Республики Казахстан по защите прав потребителей;
Казахский научный центр карантинных и зоонозных инфекций
им. М. Айкимбаева. – Алматы, 2014. – 47 с.
Руководство разработано в соответствии с учебной программой цикла
«Бруцеллёз» в рамках курса первичной подготовки специалистов по
особо опасным инфекциям КНЦКЗИ и содержит сведения по этиологии
и лабораторной диагностике бруцеллёза человека, включая вопросы
биобезопасности при проведении лабораторных исследований на
бруцеллёз.
Адресовано врачам и студентам медицинских ВУЗов, обучающимся по
специальностям «общая медицина», «общественное здравоохранение», а
также магистрантам и резидентам, обучающимся по специальностям
«инфекционные болезни» и «эпидемиология».
УДК 61-074:616.981.42
ББК
ISBN
© РГКП «Казахский научный центр карантинных и
зоонозных инфекций им. М. Айкимбаева», 2014
2
3.
СодержаниеВведение
1. Общие сведения о возбудителе бруцеллёза
1.1. Морфология
1.2. Таксономия и экология бруцелл
1.3. Культуральные свойства
1.4. Метаболизм бруцелл
1.5. Антигенная характеристика бруцелл
1.6. Чувствительность к фагам
2. Биобезопасность при проведении лабораторных исследований на
бруцеллёз
2.1. История внутрилабораторных заражений бруцеллёзом
2.2. Механизмы заражения бруцеллёзом в естественных условиях и в
условиях лаборатории
2.3. Группы риска по заражению бруцеллёзом и их оценка
2.4. Требования к диагностическим лабораториям, где ведётся работа с
потенциально заражённым материалом
2.5. Требования к микробиологическим и исследовательским
лабораториям, где ведётся работа с культурами бруцелл и заражёнными
животными
2.6. Личная защита персонала от заражения бруцеллёзом
2.7. Деконтаминация при работе с культурами бруцелл и с материалом,
подозрительным на заражение бруцеллёзом
3. Методы выделения возбудителя бруцеллёза
3.1. Материал для лабораторного исследования на бруцеллёз
3.2. Организация забора проб при исследовании на бруцеллёз
4. Методы идентификации бруцелл
4.1. Схема исследования клинического материала на бруцеллёз
4.2. Бактериологические методы исследования
4.3. Серологические методы исследования
3
4.
ВведениеБруцеллёз представляет собой значимое, распространённое по всему
миру, инфекционное заболевание, которое первично поражает животных, и
которым часто заражаются люди вследствие прямого контакта с ними или
употребления в пищу контаминированных пищевых продуктов.
Бруцеллёз человека создаёт значительную угрозу для здоровья людей и
животных, как в мировом масштабе, так и в Содружестве независимых
государств, включая Республику Казахстан. Несмотря на хорошо налаженную
систему эпидемиологического и эпизоотологического мониторинга,
проводимые профилактические и противоэпидемические мероприятия,
бруцеллёз остаётся эндемичной инфекцией людей и животных в Казахстане,
особенно в сельской местности. К сожалению, Казахстан всё ещё входит в
десятку стран с самыми высокими уровнями заболеваемости впервые
диагностированным бруцеллёзом людей.
Исходы бруцеллёза и социальная реабилитация больных данной
инфекцией во многом зависят от правильности и своевременности
постановки диагноза, адекватности объёма медицинской помощи, что
определяется квалификацией врачей и их профессионализмом.
Всё вышеперечисленное побудило коллектив авторов Казахского
научного центра карантинных и зоонозных инфекций создать данное
руководство, в котором в краткой форме изложены важнейшие принципы
организации исследований на бруцеллёз, биологической безопасности их
проведения, забора клинического материала, бактериологической и
серологической диагностики данной инфекции.
Руководство адресовано врачам и студентам медицинских ВУЗов,
обучающимся по специальностям «общая медицина», «общественное
здравоохранение», а также магистрантам и резидентам, обучающимся по
специальностям «инфекционные болезни» и «эпидемиология».
1. Общие сведения о возбудителе бруцеллёза
1.1. Морфология
Род
Brucella
объединяет
группу
мелких,
неподвижных,
грамотрицательных коккобацилл овоидной формы и коротких палочек с
закруглёнными концами (0,5 — 0,7 мкм в ширину и 0,6 — 1,5 мкм в длину). В
мазках бруцеллы располагаются поодиночке, реже парами, короткими
цепочками и в виде небольших скоплений.
Морфология бруцелл обычно неизменно, за исключением старых
культур, где появляются плейоморфные формы.
Они лишены жгутиков, не образуют спор и истинных капсул, хотя при
определённых условиях (воздействие специфическим бактериофагом,
4
5.
выращивание на средах с добавлением 10% иммунной сыворотки) могутобразовывать капсулоподобные структуры. По морфологическим признакам
бруцеллы разных видов неотличимы друг от друга. Представители рода
Brucella окрашиваются анилиновыми красителями равномерно и никогда не
дают биполярного окрашивания.
Будучи кислотоустойчивыми бактериями, по Цилю-Нельсену бруцеллы
окрашиваются в красный цвет, что иногда используют их для
микроскопической дифференциации с другими видами (таблица 1).
1.2. Таксономия и экология бруцелл
Достаточно долго бруцелл относили к неклассифицированным видам. В
настоящее время общепризнанной является следующая классификация:
Царство Bacteria
Тип Proteobacteria
Класс Alphaprotobacteria
Порядок Rhizobiales
Семейство Brucellaceae
Род Brucella
Класс
альфапротеобактерий
представлен
свободноживущими
бактериями, почвенными видами, а также в значительной мере
возбудителями болезней растений. Данный класс, в отличие от
энтеробактерий, характеризуется организацией генетического материала в
виде двух полноценных хромосом, что даёт широкие возможности для
приспособления к неблагоприятным факторам внешней среды.
5
6.
Таблица 1 — Дифференциация бруцелл от других грамотрицательных микроорганизмов (по Alton et al., 1988)Тест
Brucella
Bordetella
bronchiseptica
Campylobacter
fetus
Moraxella
Acinetobacter
Yersinia
enterocolitica O:9
Мелкие
коккобациллы
Мелкие
коккобациллы
Палочки в виде
запятой
Диплококки
Диплококки
Палочки
Подвижность при 37ºC
-
+
+
-
-
-
Подвижность при 20ºC
-
-
-
-
-
+
Ферментация лактозы на
агаре Мак-Конки
-
-
-
±*
±
-
Продукция кислоты на
агаре, содержащем глюкозу
(кроме B.
neotomae)
-
-
-
±
+
Гемолиз на кровяном агаре
-
+
-
±
±
-
Каталаза
+
+
+
±
+
+
Оксидаза
+
(кроме B. ovis, B.
neotomae и
некоторых
штаммов B.
abortus)
+
+
+
-
-
+
(кроме B. ovis и
некоторых
штаммов B.
abortus)
+
-
±
±
+
+
(кроме B.
abortus)
+
-
±
±
+
Морфология
Уреаза
Восстановление нитрата
7.
ТестBrucella
Bordetella
bronchiseptica
Campylobacter
fetus
Moraxella
Acinetobacter
Yersinia
enterocolitica O:9
-
+
-
-
±
-
Агглютинация
бруцеллёзной Sантисывороткой
+
(кроме B. ovis, B.
canis и R-форм
других видов)
-
-
-
-
+
Агглютинация
бруцеллёзной Rантисывороткой
+
(B. ovis, B. canis
и R-формы
других видов)
-
-
-
-
-
Потребление цитрата
- положительные и отрицательные виды внутри рода.
8.
Так, бруцеллы хорошо переносят высушивание, замораживание споследующим оттаиванием без утраты вирулентных свойств; пастбище, на
котором выпасался инфицированный бруцеллёзом скот, становится
безопасным для здорового поголовья лишь спустя 2 месяца.
Важным с точки зрения практики является наличие общих антигенов у
бруцелл с другими представителями класса, прежде всего родами
Pseudomonas и Xanthomonas, что может приводить к перекрёстным
(ложноположительным) серологическим реакциям на бруцеллёз при
инфекциях, вызванных этими возбудителями.
Все представители рода Brucella показывают высокую степень
генетической гомологии (свыше 90%), в связи с чем предлагалось
рассматривать их как биовары одного вида, B. melitensis (Verger et al., 1985).
Однако подобное предложение не нашло поддержки, прежде всего, из-за
различной вирулентности бруцелл и их различной тропности к организму
животных-хозяев (типовые хозяева). Причина этой тропности до сих пор
неизвестна.
Поэтому в настоящее время придерживаются старого деления бруцелл
на виды, прежде всего по их экологическим и культурально-биохимическим
характеристикам (Corbel и Brinley Morgan, 1984) с некоторыми дополнениями
(таблица 2).
В настоящее время род Brucella включает следующие виды: B. melitensis,
B. abortus, B. suis, B. canis, B. ovis, B. neotomae, B. pinnipedialis, B. ceti, B.
microti, B. inopinata, а также почвенные и неклассифицированные виды. Виды
B. ovis и B. canis находятся только в шероховатой (R) форме, остальные — в
гладкой (S) форме (см. раздел 1.3).
B. melitensis имеет 3 биовара (1, 2, 3). Культуры B. melitensis 3-го
биовара, выделенные от животных и людей, обладают высокой
вирулентностью
B. abortus имеет 7 биоваров (1, 2, 3, 4, 5, 6 и 9). Вирулентность 3, 6 и 9
биоваров B. abortus приближается к B. melitensis. Наименьшей
вирулентностью обладает 1 биовар.
B. suis имеет 5 биоваров (1, 2, 3, 4, 5).
B. neotomae, B. ovis и B. canis на биовары не подразделяются
(Объединённый комитет ФАО/ ВОЗ по бруцеллёзу, 6 доклад, 1986 г.).
4 биовар B. suis, выделяющийся преимущественно от северных оленей,
зачастую называт B. rangiferi.
Представители рода Brucella паразитируют исключительно на
млекопитающих. Птицы, хотя и могут инфицироваться бруцеллами, но в
естественных условиях бруцеллёзом не болеют, поскольку происходит
самоочищение организма от инфекта в связи с относительно высокой
температурой тела. Членистоногие (клещи, комары и др.), даже
паразитирующие на больных бруцеллёзом животных, эпидемиологической
опасности не представляют.
8
9.
Хотя бруцеллы могут существовать в организме свыше 600 видов дикихи сельскохозяйственных животных, некоторые из них являются
излюбленными, типовыми хозяевами. Помимо изучения вышеперечисленных
биологических свойств, тропность к тому или иному хозяину является
основанием для отнесения представителей рода Brucella к тому или иному
виду (таблица 2).
Таблица 2 — Экология возбудителей бруцеллёза (по Xavier M., Paixão T.A.,
den Hartigh A.B. et al., 2010)
Вид
Типовой хозяин
Вирулентность для
человека
B. melitensis
Козы, овцы
Высокая
B. abortus
Крупный рогатый скот
Средняя
B. suis
Свиньи
Средняя
B. canis
Собаки
Низкая
B. ovis
Бараны
Не доказана
B. neotomae
Пустынные хомяки
(Neotoma lepida)
Отсутствует
B. pinnipedialis
Тюлени
Низкая
B. ceti
Дельфины, киты
Низкая
B. microti
Обыкновенная полёвка Отсутствует
(Microtus arvalis)
B. inopinata
Неизвестен
Выделена из
инфицированного
грудного импланта
Brucella sp. NVSL 07- Бабуины
0026
Не доказана
К
видам,
наиболее
часто
вызывающим
инфицирование
контактировавших людей, включая лабораторный персонал, относят B.
melitensis, B. abortus, B. suis и B. canis.
Идентификация бруцелл до вида рутинными методами основывается на
ряде биохимических тестов и лизисе фагами.
Для B. melitensis, B. abortus и B. suis идентификация до уровня биовара
базируется на 4 основных тестах: потребность в углекислом газе (CO2),
продукция сероводорода (H2S), редуцирующей способности в отношении
анилиновых красителей (тионин и основной фуксин) и агглютинация
специфическими A и M антисыворотками (таблица 3).
9
10.
Таблица 3 — Дифференциация видов и биоваров рода Brucella (по M. J. Corbel, 2006 и Z. Hubalek et al., 2007)Вид
B. melitensis
B. abortus
Биовар
CO2
H2S
Уреаза
Тионин
Фуксин
A
M
R
1
-
-
+
+
+
-
+
-
2
-
-
+
+
+
+
-
-
3
-
-
+
+
+
+
+
-
1
*
(+)
+
+
-
+
+
-
-
2
(+)
+
+
-
-
+
-
-
3
(+)
+
+
+
+
+
-
-
4
(+)
+
+
-
(+)
-
+
-
5
-
-
+
+
+
-
+
-
6
-
-
+
+
+
+
-
-
+
-
+
-
**
9
-
+
+
+
1
-
+
+
+
(-)
+
-
-
2
-
-
+
+
-
+
-
-
3
-
-
+
+
+
+
-
-
4
-
-
+
+
(-)
+
+
-
5
-
-
+
+
-
-
+
-
B. neotomae
-
-
+
+
-
-
+
-
-
B. canis
-
-
-
+
+
(-)
-
-
+
B. ovis
-
+
-
-
+
(-)
-
-
+
B. pinnipedialis
-
+
-
+
+
+
+
+ или -
-
B. ceti
-
-
-
+
+
+
+
+ или -
-
B. microti
-
-
-
+
+
+
+
+
-
B. inopinata
-
-
+
+
+
+
-
-
+
B. suis
* (+) обычно положительно, (-) обычно отрицательно
** Биовар 3 B. abortus растёт на средах с 25000 тионина, а биовар 6 — нет.
11.
1.3. Культуральные свойстваБруцеллы характеризуются замедленным ростом на питательных средах,
особенно при первоначальном выделении.
Хотя бруцеллы могут расти при широком диапазоне температур (от 20 до
40ºC), температурный оптимум для представителей данного вида составляет
37ºC. В целом бруцеллы мало устойчивы к высокой температуре. В жидкой
среде при +60ºC они погибают через 30 минут, при +80 – 85ºC – через 5
минут, при кипячении мгновенно. Однако бруцеллы бладают большой
устойчивостью к воздействиям низких температур, длительно сохраняются в
пищевых продуктах, в том числе хранящихся в холодильниках и
морозильных камерах. Переносят замораживание с последующим
оттаиванием без утраты вирулентных свойств.
Бруцеллы являются кислотоустойчивыми микроорганизмами; оптимум
pH варьирует в широких пределах: 6,6 — 7,4. Бруцеллы обладают высокой
инвазивностью и могут проникать через неповреждённые слизистые
покровы; относятся к факультативным внутриклеточным паразитам, т. е.
основная ниша для выживания возбудителя — фаголизосомы и цитоплазма
фагоцитов, но бактерии могут также размножаться и вне клетки.
Рост большинства штаммов бруцелл замедлен на средах, содержащих
жёлчные соли и теллурит.
Рост бруцелл на жидких питательных средах обычно беден и ведёт к Rдиссоциации, которая может быть предотвращена аэрацией и нейтральной
реакцией среды.
При пересевах на плотные питательные среды первые колонии бруцелл
могут быть заметны уже спустя 2 дня инкубации. После 4 дней инкубации
колонии бруцелл округлой формы, 1-4 мм в диаметре с гладкими краями (у Sформ), полупрозрачные, слегка опалесцирующие, медового цвета при
просмотре колоний на прозрачных питательных средах в проходящих лучах
солнца. При осмотре в других условиях колонии представляются
перламутрово-белыми.
По типу колоний бруцеллы делятся на «гладкие» (S-формы от
английского «smooth», гладкий) и «шероховатые» (R-формы от английского
«rough», грубый шероховатый). Бруцеллы подвержены изменчивости и могут
переходить из S-формы в R- и L-формы.
Гладкие культуры бруцелл, особенно у вида B. melitensis, имеют
тенденцию к диссоциации, особенно при пересевах, в R-формы и иногда в
мукоидные (M-формы). Изменение морфологии колоний обычно
ассоциировано с изменениями в вирулентности, агглютинабельности и
чувствительности к фагам.
1.4. Метаболизм бруцелл
Тип дыхания у представителей рода Brucella аэробный, и лишь
11
12.
некоторые виды требуют добавления углекислого газа (5-10%) для роста,особенно в первых генерациях. Бруцеллы являются хемоорганотрофами и
предъявляют высокие требования к нутриентам для своего роста: различные
аминокислоты, тиамин, никотинамид, биотин. Некоторые штаммы бруцелл
требуют для роста сыворотки или других органических коллоидов.
Бруцеллы каталазо-положительны и, как правило, оксидазоположительны, однако B. neotomae, B. ovis и некоторые штаммы B. abortus
оксидазо-отрицательны (таблица 1).
В обычных средах бруцеллы не ферментируют углеводы, но окисляют
их, а также ряд аминокислот. Бруцеллы восстанавливают нитраты до
нитритов, за исключением B. ovis и некоторых штаммов B. canis.
Продукция H2S бруцеллами варьирует среди разных видов и биоваров.
B. melitensis не образует H2S (таблица 3).
Активность уреазы у бруцелл варьирует от высокой до низкой.
1.5. Антигенная характеристика бруцелл
Все
гладкие
штаммы
бруцелл
показывают
перекрёстную
агглютинабельность в серологических реакциях с неабсорбированными
поливалентными сыворотками.
R-формы бруцелл также показывают перекрёстную агглютинабельность
с неабсорбированной анти-R сывороткой.
Это обусловлено поверхностными антигенами, входящими в состав
липополисахарида (ЛПС) клеточной стенки бруцелл, которые вовлекаются в
реакцию агглютинации.
ЛПС S-форм бруцелл несёт A- и M-антигены, которые имеют разное
численное распределение среди различных видов (таблица 3). Это позволяет
использовать абсорбированные моноспецифичные A и M антисыворотки для
дифференциации видов и биоваров бруцелл.
Кроме того, серологические перекрёстные реакции отмечаются между
гладкими формами бруцелл и рядом грамотрицательных бактерий,
обладающих общими с бруцеллами поверхностными антигенами: Escherichia
coli O:116 и O:157, Samonella группы N(O:30), Xanthomonas maltophilia,
Vibrio cholerae и особенно Yersinia enterocolitica O:9.
1.6. Чувствительность к фагам
В литературе описано свыше 40 фагов, лизирующих бруцеллы. Все фаги,
специфичные по отношению к бруцеллам, не лизируют бактерии других
видов. Это позволяет использовать лизабельность противобруцеллёзными
фагами в качестве диагностического теста для идентификации и
дифференциации бруцелл.
В рутинных исследованиях для этих целей используются 4 фага:
Тбилиси (Tb), Вейбридж (Wb), Izatnagar1 (Iz1) и R/C.
Первые три используются для дифференциации гладких штаммов
12
13.
бруцелл, а последний лизирует B. ovis и B. canis (таблица 4).Таблица 4 — Дифференциальные характеристики противобруцеллёзных
фагов
Вид
Лизис фагом
Tb
Iz1
R/C
B. melitensis
-
+
-
B. abortus
+
+
-
B. ovis
-
-
+
2. Биобезопасность при проведении лабораторных
исследований на бруцеллёз
Род Brucella объединяет представителей одного рода грамотрицательных
оксидазоположительных, неподвижных, не образующих капсулу, мелких (0,5
—
1,5
мкм)
коккобактерий,
являющихся
факультативными
внутриклеточными паразитами.
Все виды бруцелл относятся к категории B списка возбудителей, которые
могут быть использованы в целях биотерроризма CDC.
Мелкий размер бруцелл обусловливает распространение этого
возбудителя на значительные расстояния с потоком воздуха и повышает
опасность аэрогенного заражения персонала как горизонтально (в пределах
этажа), так и вертикально (в пределах нескольких этажей). Проиллюстрируем
это утверждение примером внутрилабораторного заражения бруцеллёзом,
ставшим классическим.
В период с мая по сентябрь 1988 года у восьми сотрудников
микробиологической лаборатории развился острый бруцеллёз (частота
поражения составила 31%). Клиническая манифестация инфекции
варьировала от появления неспецифических, общеинфекционных симптомов
до развития острого грануломатозного гепатита. У пяти заболевших
сотрудников (63%) гемокультура дала рост B. melitensis третьего биотипа,
вызывающего наиболее тяжело протекающие случаи инфекции.
Проведённое эпидемиологическое расследование «случай — контроль»
показало, что у сотрудников не было иных факторов риска заражения
бруцеллёзом, кроме работы в лаборатории. На основе составления схемы
рабочих мест, опроса заболевших и лабораторных исследований передача
инфекции от человека к человеку, через воду и пищу была признана
маловероятной (рисунок 1).
13
14.
Рисунок 1 — Схема микробиологической лаборатории, в которой произошлавспышка бруцеллёза (крестиками отмечены рабочие места заболевших)
Дальнейшее эпидемиологическое расследование показало, что за 6
месяцев до вспышки замороженный изолят бруцеллы, выделенный от одного
из госпитализированных пациентов, был пересеян вне кабинета
биобезопасности. Этот изолят был идентифицирован как B. melitensis
третьего биотипа, идентичная по своим свойствам изоляту, выделенному
от сотрудников лаборатории. Единственным возможным механизмом
передачи бруцеллёзной инфекции в этой лаборатории был аэрогенный.
Как уже упоминалось выше, различные виды рода Brucella генетически
очень близки друг другу (гомология достигает 98%), хотя и обладают
тропностью к различным видам млекопитающих, так называемым основным
хозяевам. В этой связи Национальный центр биотехнологической
информации США считает бруцелл биоварами одного вида, Brucella
melitensis, однако в связи с различной экологией бруцелл, а также различиями
в их вирулентностью старое деление на виды сохранено.
Представители рода Brucella обладают рядом общих биологических
характеристик, таких как летучесть, крайне низкая инфицирующая доза для
человека, а также способность проникать в организм хозяина различными
14
15.
путями (через слизистые дыхательных путей, конъюнктиву, желудочнокишечный тракт, повреждённую и неповреждённую кожу), что делает ихспособными легко инфицировать персонал лаборатории, обусловливая как
единичные случаи заболевания, так и эпидемические вспышки. Также
сообщается о редких случаях инфицирования бруцеллёзом при
трансплантации органов, половых контактах, грудном вскармливании и
посредством трансплацентарной передачи. Поскольку в обычных условиях
передача от человека к человеку не наблюдается, больной бруцеллёзом
считается неопасным для окружающих.
2.1. История внутрилабораторных заражений бруцеллёзом
За
последние
50
лет
частота
заболеваемости
впервые
диагностированным бруцеллёзом людей в развитых странах значительно
снизилась, благодаря строгому надзору за бруцеллёзом в сельском хозяйстве
и повсеместному внедрению пастеризации молока. Однако бруцеллёз
остаётся наиболее часто регистрируемой внутрилабораторной инфекцией;
примерно 2% всех случаев бруцеллёза в мире обусловлены заражением
именно внутри лабораторий.
Первые документированные случаи заражения лабораторных работников
бруцеллёзом известны, начиная с XIX века, и практически совпадают с
выделением основного возбудителя, Brucella (в те времена Micrococcus)
melitensis и началом изучения его свойств (таблица 5).
Таблица 5 — Некоторые этапы работы с Brucella melitensis и случаи
внутрилабораторного заражения бруцеллёзом
1887 год
D. Bruce выделил Brucella / Micrococcus melitensis
1897 год
A.E. Wright и D. Semple исследуют агглютинабельность
бруцелл и реакцию агглютинации как метод диагностики
бруцеллёза
1897 год
Первое
документированное
внутрилабораторное
заражение бруцеллёзом (укол работника шприцем)
1887
годы
—
1930 Описано 76 случаев внутрилабораторного заражения
бруцеллёзом только в странах Европы
1907 год
Начало использования автоматических (механических)
микродозаторов в Германии для предотвращения
внутрилабораторных заражений. Пипетирование ртом
сохранялось вплоть до 1930-х годов.
1918 год
F. Reinhardt описал 21 тип механических микродозаторов
и сделал вывод, что их использование позволяет
предотвратить внутрилабораторные заражения
15
16.
1919 годСообщение
об
использовании
микробиологического кабинета в Германии
защитного
1921 год
Использование герметичной вентилируемой клетки для
работы с заражёнными животными в Институте Пауля
Эрлиха, Германия
1922
годы
—
1939 Описано 74 случая внутрилабораторного заражения
бруцеллёзом в США
1938
годы
—
1939 Описана первая внутрилабораторная вспышка
бруцеллёза в Michigan State College с вовлечением 94
человек, в том числе 41 студента, участвовавших в
центрифугировании, которое привело к образованию
бактериального аэрозоля. 1 студент погиб.
1940 год
1930
годы
—
1963 год
1979
годы
—
Сообщение
об
использовании
защитного
микробиологического кабинета и защитного костюма,
включавшего резиновые ботинки, перчатки и фартук в
Fort Detrick, США
1978 Описано 426 случаев внутрилабораторного заражения
бруцеллёзом, в т. ч. 5 — со смертельным исходом
S. E. Sulkin описал возможность заражения бруцеллёзом
(среди прочих инфекций) при пипетировании ртом
2004 Описано 143 случая внутрилабораторного заражения
бруцеллёзом, в т. ч. 4 — со смертельным исходом
2.2. Механизмы заражения бруцеллёзом в естественных
условиях и в условиях лаборатории
Естественное заражение
Бруцеллёз — зоонозная инфекция с убиквитарным распространением.
Млекопитающие, особенно крупный и мелкий рогатый скот, свиньи и олени
являются резервуаром бруцелл. Заражение бруцеллёзом реализуется почти
всеми известными механизмами: контактным (прямой и опосредованный
контакт), аэрогенным (вдыхание соломенной трухи, загрязнённой
выделениями больного животного), фекально-оральным (водный и пищевой
пути). В условиях лечебно-профилактических учреждений человек может
заражаться через трансмиссивный механизм (искусственный путь).
Ведущим путём заражения бруцеллёзом у животных является прямой
контакт, т. е. у последних бруцеллёз является типичной половой инфекцией.
Бруцеллы инфицируют кровь, а также многие ткани и секреты
млекопитающих, включая спинномозговую жидкость, лёгочный секрет,
16
17.
плаценту, семенную жидкость и иногда мочу.Передача бруцеллёза от человека к человеку посредством прямого
контакта чрезвычайно редка и относится к области казуистики.
Описанные случаи передачи бруцеллёза от человека к человеку связаны
с половым контактом, трансплацентарной передачей, переливанием крови,
пересадкой костного мозга. Чрезвычайно редко заражение происходит при
грудном вскармливании.
Профессиональное заражение
Бруцеллёз был и остаётся по настоящее время одной из наиболее часто
регистрируемых внутрилабораторных инфекций, его доля в их развитии
достигает 2%. Несмотря на отсутствие зарегистрированных случаев
заболеваний бруцеллёзом, вызванным некоторыми представителями рода
Brucella, среди людей, все они представляют потенциальную опасность
заражения лабораторных работников и случайных посетителей, поэтому при
работе со всеми представителями рода бруцелл, включая вакцинные штаммы,
необходимо соблюдать одинаковые требования безопасности.
Наиболее частой причиной возникновения внутрилабораторного
заражения бруцеллёзом является контакт бруцелл со слизистыми (ротовой
полости,
конъюнктивы)
и
вдыхание
бактериального
аэрозоля.
Инфицирующая доза при вдыхании бактериального аэрозоля бруцелл очень
низкая и составляет от 10 до 100 микробных клеток. Поэтому заражение
бруцеллёзом при работе вне кабинета биологической безопасности может
наступать при посеве культуры петлёй даже при надетых маске и перчатках.
Самоинокуляция контаминированным шприцем — также частая причина
заражения лаборатоных работников, а также ветеринаров, проводящих
вакцинацию скота.
Несмотря на то, что концентрация возбудителя в крови и
спинномозговой жидкости больных бруцеллёзом является небольшой,
контакт с этими биологическими жидкостями представляет опасность для
лабораторных работников в связи с низкой инфицирующей дозой бруцелл.
Следует отметить возрастание опасности контакта с ними по экспоненте при
инкубации как в жидких, так и на плотных питательных средах.
Пути заражения бруцеллёзом
• Вдыхание бактериального аэрозоля (10 — 100 микробных клеток);
• Контакт с культурой бруцелл или заражёнными тканями и жидкостями
слизистых ротовой полости, конъюнктивы и кожи (в том числе
неповреждённой);
• Заглатывание инфекта (пипетирование ртом);
• Трансмиссивное заражение, включая аварии, связанные со случайной
инокуляцией вакцинными штаммами (B. abortus, штаммы 19, RB51 и B.
17
18.
melitensis Rev-1).Помимо развития собственно инфекции, гиперчувствительность к
антигену Rxn бруцелл — возможная, хотя и редкая угроза для лабораторного
персонала. Реакции гиперчувствительности на антигены бруцелл возникают
у работников, контактирующих с животными, заражёнными бруцеллёзом (в
эксперименте или естественным путём), или их тканями.
Летальность при бруцеллёзе
составляет при отсутствии лечения 2%. Основной причиной смерти
является прогрессирующий эндокардит. При внутрилабораторном заражении
летальность выше и достигает 5%, что связано с повышением вирулентности
возбудителя.
2.3. Группы риска по заражению бруцеллёзом и их оценка
При оценке риска заражения бруцеллёзом посетителей лаборатории и
работников, следует учитывать возможность заражения во внелабораторной
среде, в естественных условиях.
Группа профессионального риска
1. Сельскохозяйственные работники, индивидуальные владеольцы скота и
члены их семей;
2. Работники мясоперерабатывающей промышленности;
3. Ветеринарные специалисты;
4. Лабораторные работники и медицинские работники, имеющие контакт
с кровью.
Группа непрофессионального риска
1. Охотники;
2. Потребители пищевых продуктов животного происхождения, не
прошедших термическую обработку (особенно молочных);
3. Путешественники.
При возникновении риска контаминации персонала лаборатории
Brucella spp. необходимо:
1. Провести оценку риска, выявить даты контаминации и определить
уровень риска;
2. Известить об инциденте режимную комиссию;
3. Провести врачебное и лабораторное наблюдение за потенциально
инфицированными лицами по схеме, приведённой ниже;
18
19.
4. В случае необходимостибруцеллёза.
провести
профилактическое
лечение
По уровням риска контаминированные относятся
к лицам с высоким риском заражения:
• работавшие с заразным материалом за обычным бактериологическим
столом (т. е. вне условий BSL-3) или находившиеся в непосредственной
близости от места, где выполнялась подобная работа;
• лица, находившиеся в лаборатории в момент аварии, связанной с
генерацией бактериального аэрозоля;
• лица, выполнявшие вне кабинета биологической безопасности
манипуляции, создающие высокий риск разбрызгивания заразного
материала и / или генерации бактериального аэрозоля (пипетирование,
центрифугирование, встряхивание, смешивание и пр. заразного
материала).
к лицам с низким риском заражения:
• любой работник микробиологической лаборатории, находившийся в
ней во время работы с культурой бруцелл вплоть до момента
уничтожения последней.
Подробнее мероприятия по оценке рисков заражения персонала
приведены в таблице 6.
Таблица 6 — Оценка риска и профилактические мероприятия у лиц,
контактировавших с материалом, потенциально контаминированным Brucella
spp.
Уровень
риска
Высокий
Зона риска
Описание риска
Личное пространство Индивидуальная работа с
культурой бруцелл:
1. Работа с культурой за
обычным
бактериологическим
столом (вдыхание
бактериального
аэрозоля);
2. Пипетирование ртом;
3. Работа в кабинете
биологической
безопасности II типа
без соблюдения
предосторожностей
BSL-3
19
Профилактическое
лечение
Рекомендовано для
лиц, работавших с
культурой
20.
Уровеньриска
Низкий
Зона риска
Описание риска
Профилактическое
лечение
1,5-метровая зона
вокруг работающего
с культурой бруцелл
Работа с культурой бруцелл
вне кабинета биологической
безопасности за обычным
бактериологическим столом,
но работа не предусматривает
выполнение операций,
связанных со значительным
распространением
бактериального аэрозоля*
Рекомендовано для
лиц, находившихся в
1,5-метровой зоне
вокруг работающего
Лабораторный бокс / Работа с культурой бруцелл
комната
вне кабинета биологической
безопасности за обычным
бактериологическим столом с
выполнением операций,
связанных со значительным
распространением
бактериального аэрозоля*
Рекомендовано для
лиц, находившихся в
лаборатории в
момент генерации
аэрозоля
Лабораторный бокс / Присутствие в лаборатории во
комната
время работы с культурой
бруцелл за обычным
бактериологическим столом,
но без влияния факторов
высокого риска
Может потребоваться
для лиц,
находившихся в
лаборатории, в
случае совершения
аварии
Отсутствуе Лабораторный бокс / Работа с культурой бруцелл в
т
комната
кабинете биологической
безопасности II типа с
соблюдением
предосторожностей BSL-3.
Не требуется
* Операции, связанные со значительным распространением бактериального
аэрозоля, включают, но не ограничиваются, следующие: центрифугирование
с использованием незакрытых пробирок; аварии, связанные с разливом или
разбрызгиванием заразного материала (например, трещина в пробирке с
культурой бруцелл); перемешивание в вортексе; диспергирование с помощью
ультразвука. Другие операции, такие как пипетирование бактериальной
суспензии с помощью автоматического дозатора, её ручное встряхивание и
перемешивание, должны быть дополнительно оценены по уровню опасности
для конкретной лаборатории.
2.4. Требования к диагностическим лабораториям, где ведётся
работа с потенциально заражённым материалом
Бруцеллёз протекает как системная инфекция (хрониосепсис); бруцеллы
инфицируют широкий ряд органов и тканей организма хозяина, включая
20
21.
ликвор, семенную жидкость, лёгочный секрет, плаценту и иногда мочу.Значительное число случаев внутрилабораторного заражения бруцеллёзом
связаны с контактом с тканями, в которых размножаются бруцеллы, особенно
с плацентарной тканью. Поэтому при работе с потенциально заражённым
материалом методики, оборудование и технические средства должны
соответствовать уровню BSL-2. Данный уровень биобезопасности
используется при рутинных исследованиях патологического материала,
например, при скрининговых исследованиях. В случае, если биологический
материал заведомо содержит или с высокой степенью вероятности содержит
патогенные бруцеллы (например, при исследовании крови от человека с
симптомами, не исключающими бруцеллёз), оборудование и технические
средства должны соответствовать уровню BSL-3 в связи с высокой
концентрацией возбудителя в 1 г тканей [17, 18].
Операции, которые могут сопровождаться генерацией бактериального
аэрозоля, разливом и разбрызгиванием исследуемого материала, должны
проводиться в кабинете биологической безопасности.
NB! Инактивированная сыворотка для постановки серологических
реакций также относится к потенциально заражённому материалу! Все
серологические исследования на бруцеллёз должны проводиться в кабинете
биологической безопасности.
2.5. Требования к микробиологическим и исследовательским
лабораториям, где ведётся работа с культурами бруцелл и
заражёнными животными
При работе с живыми культурами бруцелл, а также объектами,
контаминированными ими, тканями и биологическими жидкостями людей и
животных, заражённых бруцеллёзом и с подозрением на бруцеллёз,
необходимо соблюдать требования биобезопасности BSL-3.
При работе с экспериментально заражёнными животными методики,
оборудование и технические средства должны соответствовать уровню
ABSL-3.
2.6. Личная защита персонала от заражения бруцеллёзом
К средствам личной защиты персонала лаборатории от заражения
бруцеллёзом относят:
• Медицинские перчатки;
• Хирургический халат;
• Бахилы;
• Респираторы;
• Защитные очки или лицевые щитки.
Весь персонал лаборатории, имеющий контакт с живыми культурами
бруцелл, должен находиться под непрерывным клиническим наблюдением, а
21
22.
также подвергаться регулярным серологическим обследованиям.Персонал должен быть обучен распознаванию основных клинических
проявлений острого бруцеллёза и действующей практике информирования
ответственных лиц в случае возникновения этих симптомов.
Врач, осуществляющий наблюдение за персоналом лаборатории, должен
вести медицинские карточки работников, в которые, помимо данных
клинического и серологического мониторинга, должны вноситься сведения о
видах бруцелл, с которыми работал сотрудник.
2.7. Деконтаминация при работе с культурами бруцелл и с
материалом, подозрительным на заражение бруцеллёзом
Бруцеллы являются близкородственными почвенным бактериям (альфапротеобактериям), поэтому устойчивы к неблагоприятным факторам и
хорошо сохраняются на артифициальных объектах внутрилабораторной
среды. В условиях бытового холодильника (+4°C) на стеклянных и
алюминиевых поверхностях они остаются жизнеспособными до 56 дней, в
условиях комнатной температуры (+22 — 25°C) сохраняются в течение 42 —
56 дней на тех же поверхностях. В условиях отсутствия влияния прямых
солнечных лучей и химически активных соединений бруцеллы способны
выживать на объектах внешней среды до двух лет без утраты вирулентных
свойств. Это делает актуальной проблему деконтаминации лабораторного
оборудования и материалов.
Все виды бруцелл одинаково чувствительны к широкому ряду
дезинфектантов, включая хлорсодержащие растворы, 70% этиловый спирт,
фенолы (наиболее эффективны), формальдегид и ксилены.
Однако следует помнить, что эффективность дезинфектантов в
отношении бруцелл резко снижается в присутствии органического
материала (например, белков крови) и в условиях низких температур.
Деконтаминация лиц, совершивших аварию, связанную с
загрязнением заразным материалом
• Необходимо снять загрязнённую одежду и поместить в двойной
пластиковый мешок, который должен быть промаркирован с указанием
даты.
• Все загрязнённые объекты должны быть сожжены, прокипячены или
автоклавированы (если не подлежат химической дезинфекции).
• На месте обрабатываются руки и лицо контаминированного работника.
Для обработки кожи, контаминированной материалом, подозрительным
на содержание жизнеспособных бруцелл, следует применять 70%
этиловый спирт.
• После первичной обработки кожи сотрудник должен принять горячий
22
23.
душ с мылом.• Контаминированный сотрудник не представляет опасности для других
людей; после обработки кожи и смены одежды изоляция не требуется.
Для деконтаминации оборудования эффективно автоклавирование паром
при температуре 121°C не менее 15 минут или обеззараживание сухим жаром
при 160-170°C не менее 1 часа.
3. Методы выделения возбудителя бруцеллёза
3.1. Материал для лабораторного исследования на бруцеллёз
Исследование крови
Кровь является основным материалом для исследования на бруцеллёз у
людей и животных. Она используется как для посева на гемокультуру, так и
для получения сыворотки для постановки серологических реакций (РозБенгал проба, модифицированная Роз-Бенгал проба, реакция агглютинации
на стекле Хеддльсона, реакция агглютинации в пробирках Райта и др.).
Как правило, для посева крови, забранной асептически, на гемокультуру
бруцелл не требуется селективных сред. Однако в Казахстане принято для
этих целей использовать транспортную среду производства Казахского
научного карантинных и зоонозных инфекций, являющуюся элективной
средой накопления и повышающую высев бруцелл из загрязнённых проб.
Высеваемость культур бруцелл при правильном посеве на транспортную
среду составляет 60-70% на 5-10 сутки после посева.
Чтобы обеспечить правильность посева крови, следует знать и соблюдать
следующие правила:
• посев крови выполнять при подозрении на бруцеллёз одновременно с
постановкой серологических реакций. В 6-12% случаев у больных
бруцеллёзом выделяется гемокультура бруцелл при временно
отрицательных серологических реакциях. Это связано с высокой
степенью бактериемии, подавляющей иммунный ответ;
• частота высеваемости бруцелл зависит от фазы инфекционного
процесса,
характера
клинических
проявлений
и
прямо
пропорциональна количеству посевной дозы крови. В 2 раза чаще
выделяются гемокультуры в остром периоде болезни, на высоте
лихорадки, до начала лечения антибиотиками, в первые три месяца со
дня заболевания, при посеве 10 мл крови больного. Вместе с тем,
нередко можно выделить культуру бруцелл при нормальной
температуре больного, на фоне лечения антибиотиками, при посеве
даже незначительного количества материала, если возникли трудности
его получения (особенно у детей), а также при подостром и первичнохроническим бруцеллёзе;
23
24.
• важно проводить посев крови у постели больного, начиная сфельдшерско-акушерских пунктов и сельских врачебных участков, для
чего необходимо пользоваться «транспортной средой», специально
созданной для облегчения посева и доставки крови и создания условий
для обогащения материала бруцеллами;
• оптимальный срок доставки посевов крови в транспортной среде 1-10
дней. Из-за поздней доставки посевов крови резко снижается
эффективность бактериологического метода и удлиняется срок
выделения гемокультуры;
• посев крови проводить, строго соблюдая правила асептики. При
попадании во флакон посторонней микрофлоры, которая размножается
значительно быстрее бруцелл, выделить возбудителя бруцеллёза
значительно сложнее. Флаконы с признаками роста посторонней
микрофлоры следует пересевать на селективные среды;
• Ответственность за стерильность посевов несёт проводившая его
медсестра. Поэтому на направлении должна быть указана её фамилия и
подпись;
• для забора клинического материала как от людей, так и от животных,
необходимо использовать так называемую систему безопасного забора
крови. Если это невозможно, то необходимо обращать особое
внимание на соблюдение требований биобезопасности при работе со
шприцем. Нельзя засасывать воздух в шприц для проверки
проходимости иглы, а выталкивать его движением поршня к игле, а
также нельзя надевать колпачок обратно на иглу после забора
крови;
• кровь на исследование в лабораторию должна доставляться
исключительно во флаконах с транспортной средой, либо в
специальных
одноразовых
пластиковых
пробирках
системы
безопасного забора крови с искусственно созданным вакуумом
(Vacutainer®). NB! Кровь для исследования на бруцеллёз, доставленная
в шприце с примонтированной иглой, на исследование приниматься
не должна! К сожалению, это наиболее часто нарушаемое требование
организации иследования на бруцеллёз.
Положительный результат бактериологического метода получают
обычно через 5-10 дней, отрицательный выдается спустя 30 дней с момента
посева крови, так как выделение единичных гемокультур возможно и в этот
срок. Поэтому информация о выделении культуры бруцелл обычно не имеет
диагностического значения, поскольку сроки выдачи результатов
превышают срок постановки клинического диагноза в лечебном учреждении.
Однако изучение культур бруцелл имеет важное эпидемиологическое
значение, поэтому посев крови на транспортную среду должен проводиться
обязательно при поступлении на лечение больного с симптомами, не
24
25.
исключающими бруцеллёз.Бактериологическое исследование крови на бруцеллёз включает в себя
два этапа:
Первый: в лечебных учреждениях проводится посев крови больного в
транспортную среду. Флакон с кровью отправляют в лабораторию.
Второй: в лаборатории проводится пересев крови по методу Кастанеда в 2
флакона, содержащие двуфазную питательную среду.
Бифазная или двуфазная среда по Кастанеде состоит из флакона,
содержащего как жидкую, так и плотную питательные среды для посева на
бруцеллёз. Жидкая фаза содержит 1-2% натрия цитрата.
Исследование другого материала, полученного от людей
Бруцеллы можно выделить также из костного мозга, мочи,
спинномозговой жидкости, экссудата из бурситов, грудного молока, жёлчи,
мокроты, трупного материала и др. Посевы проводят на твёрдые и жидкие
питательные среды.
В случае исследования загрязнённого материала для задержки роста
посторонней микрофлоры к среде следует добавлять генцианвиолет из
расчёта 1:200000. Лучше всего этот материал засевать в специально
приготовленные селективные питательные среды; обязательному засеву
подлежат материалы загрязнённые в транспортной среде.
Исследование другого материала, полученного от животных
Помимо крови, для выделения бруцелл из патологического материала,
полученного от животных, используют органы абортированного плода (чаще
содержимое желудка), семенную и синовиальную жидкость. Этот материал
может быть непосредственно засеян на плотные питательные среды, либо в
бифазную среду по Кастанеде.
Исследование молока и молочных продуктов
Необработанное термически молоко и молочные продукты служат
основным источником заражения бруцеллёзом людей, особенно в городских
условиях. Для выделения бруцелл из молока предпочтительно использовать
плотные питательные среды.
Должно исследоваться только молоко от индивидуальных животных;
использование для этих целей сборного молока недопустимо!
Проба молока должна быть отцентрифугирована при 6000 g в течение 15
минут. Сливки и обрат должны быть засеяны раздельно на плотные
питательные среды.
Молочные продукты, особенно сыры, обычно содержат небольшое число
жизнеспособных бруцелл, поэтому после гомогенизации должны засеваться
на обогащённые питательные среды с добавлением 5% объёма стерильной
лошадиной сыворотки и 1% декстрозы, а также, при необходимости,
селективных антибиотиков. Подробнее об исследовании пищевых продуктов
написано ниже.
25
26.
Исследование тканейПробы тканей должны забираться асептически с помощью стерильных
инструментов и, после удаления жира, гомогенизироваться, после чего
разводиться фосфатным буфером в пластиковых мешках. Полученный
материал засевается газоном на плотные питательные среды.
Исследование амниотической жидкости и вагинальных соскобов
Амниотическая жидкость и вагинальные соскобы, полученные от
животных с инфекционными абортами, содержат обычно большое
количество жизнеспособных возбудителей и часто дают положительную
гемокультуру бруцелл. Посев амниотической жидкости целесообразно
проводить в транспортную среду с последующим проведением исследования,
как при посеве крови.
Посев вагинального соскоба проводят непосредственно на поверхность
плотной питательной среды.
Исследование объектов внешней среды и пищевых продуктов на
бруцеллёз
Подготовка различного материала к исследованию на наличие
бруцелл.
Объекты внешней среды, подозрительные на заражённость бруцеллами,
перед постановкой реакции следует обезвредить путём прогревания при
100°С (в кипящей водяной бане) в течение 10 минут. При исследовании
молока для повышения эффективности РПГА рекомендуется прогревать
молоко при 100 градусах 30 минут. При исследовании навоза, шерсти и т.п.
проб используют 5-10 мл забуференного физиологического раствора при рН
7,2. Взвеси выдерживают в течение 1 часа при 100 градусах, затем
центрифугируют при 1,5-3 тысяч оборотов в минуту 10 минут. Надосадочную
жидкость для удаления неспецифических агглютинирующих факторов
истощают несенсибилизированными эритроцитами.
Способы обеззараживания исследуемого материала:
I способ. Жидкости (вода, молоко) прогревают в нативном виде. После
прогревания воду и молоко центрифугируют при 3000 оборотов в минуту 2
часа и берут для исследования осадок. Кусочки органов, брынзу и другой
материал предварительно измельчают в ступке с добавлением 9 объёмов
физиологического раствора, получен ную суспензию прогревают. Прогретую
суспензию фильтруют через 2 слоя марли или бумажный фильтр и исследуют
фильтрат.
II способ. Молоко в количестве 10 мл берут из верхнего слоя и переносят
в центрифужную пробирку, добавляют 3-5 капель сычужного фермента на
0,85%-ном растворе хлорида натрия и помещают в водяную баню на 5 минут
при температуре 38-40°С. Свернувшееся в пробирках молоко обводят
стеклянной палочкой и центрифугируют 10 минут при 3000 оборотах в
минуту. После центрифугирования на дне пробирки образуется плотный
осадок, покрытый слоем прозрачной сыворотки. Сыворотка отбирается в
26
27.
стерильную пробирку и исследуется в РНГА. Для подтвержденияспецифичности
РНГА
ставят
реакцию
торможения
непрямой
гемагглютинации (РТНГА).
Исследование материала из объектов внешней среды на бруцеллёз
проводится бактериологическим и серологическими методами.
Бактериологическое исследование молока и других пищевых
продуктов.
а) Способы забора пищевых продуктов.
Молоко для бактериологического исследования может быть взято
непосредственно из вымени или из сосуда, где оно хранится.
Вымя животного перед взятием пробы молока обмывают тёплой водой и
вытирают, а затем обрабатывают слабым раствором борной кислоты. Первые
порции молока сдаивают. Молоко собирают в стерильные пробирки в
количестве 50-100 мл.
У овец или коз молоко может быть взято также путём пункции вымени
стерильным шприцем.
При взятии пробы из сосуда стерильной пипеткой собирается в
отдельную стерильную посуду верхний слой молока, а затем молоко хорошо
перемешиватся и не менее 100 мл набирается в другую стерильную посуду.
При исследовании молочных продуктов пробы набираются в стерильную
посуду из разных мест, в количестве не менее 100 мл каждой порции.
При исследовании мясного сырья следует учитывать, что бруцел-лы
локализуются главным образом в лимфатических узлах, селезёнке, печени,
половых железах, костном мозге. Поэтому в первую очередь должны быть
исследованы эти органы. Из разных мест для исследования стерильно берут
кусочки органов и лимфатические узлы в стерильную посуду.
При транспортировке пробы упаковываются в герметические ящики с
запирающейся крышкой. Исследование должно производиться тотчас по
получении пробы. При необходимости кратковременного хранения материал
должен содержаться при температуре не выше 4 градусов С.
б) Методы бактериологического исследования пищевых продуктов.
Перед исследованием пищевые продукты твёрдой консистенции (мясо,
брынза, творог и др.) предварительно растираются в стерильной ступке, а
затем эмульгируются в физиологическом растворе. При наличии грубых
частиц исследуемый материал фильтруют через ватный или бумажный
фильтр.
Для концентрации бруцелл исследуемая эмульсия может быть
отцентрифугирована. Центрифугирование производится при 3000 оборотов в
минуту в течение 1-2 часов (чем больше число оборотов и время
центрифугирования, тем большая часть микроорганизмов может быть
осаждена).
Для лучшего осаждения бруцелл перед центрифугированием к
исследуемому материалу может быть добавлена агглютинирующая
27
28.
бруцеллёзная сыворотка из расчёта 1 часть сыворотки на 100 частейисследуемого материала.
Из полученного центрифугата производятся посевы на питательные
среды.
Ввиду заражённости молока и пищевых продуктов посторонней
микрофлорой, которая при посеве материала в питательные среды может
подавить рост бруцелл, рекомендуется параллельно с бактериологическим
методом применять и биологический способ исследования.
Методы посева на питательные среды и биологическая проба
производятся так же, как при бактериологическом исследовании крови и
патологического материала у людей.
Серологические исследования
Простота постановки, достаточно быстрое получение ответа,
специфичность результата, существование надёжных методов контроля
достоверности получаемых результатов делает их незаменимыми в практике
эпидемиологического контроля.
а) Исследование молока на наличие антител к возбудителю бруцеллёза.
Одним из методов исследования молока на бруцеллёз является
постановка кольцевой реакции с целью выявления специфических антител.
Исследование может проводиться в лабораториях особо опасных инфекций, в
ветлабораториях, специалисты которых должны пройти соответствующую
подготовку. При получении положительного результата в кольцевой реакции
для контроля специфичности полученных результатов ставится РПГА
(реакция пассивной гемагглютинации) с эритроцитарным бруцеллёзным
антительным (иммуноглобулиновым) диагностикумом.
Препараты для исследования молока:
1. Антиген бруцеллёзный для кольцевой реакции (КР) с молоком. Антиген
представляет собой взвесь убитых и окрашенных бруцелл типа bovis.
2. Диагностикум эритроцитарный бруцеллёзный иммуноглобулиновый
(антительный) сухой или жидкий.
3. Диагностикум эритроцитарный бруцеллёзный антигенный сухой или
жидкий.
Подготовка диагностикумов к использованию проводится в соответствии
с прилагаемой к препаратам инструкции.
Техника постановки кольцевой реакции
Для исследования необходимо брать цельное, главным образом свежее
молоко или консервированное формалином (из расчёта 0,1 мл 10% раствора
формалина на 10 мл молока). Консервированное молоко пригодно для
исследования в течение 1 суток. Перед исследованием молоко необходимо
тщательно взбалтывать для равномерного распределения сливок. Реакцию
удобнее ставить в бактериологических пробирках. В пробирку вносят 2 мл
молока и добавляют 0,1 мл антигена (2 капли). Затем пробирки встряхивают и
штативы помещают в водяную баню или термостат на 30-40 минут при
28
29.
температуре 37°С, после чего учитывают реакцию по следующей схеме:а) при наличии чётко выраженного синего кольца в верхней части
столбика молока (в слое сливок), в то время как остальная часть молока
остаётся белой, реакция оценивается как положительная (100 или 75%
агглютинации);
b)
при наличии достаточно выраженного синего кольца в слое
сливок (остальная часть молока имеет синеватый цвет) реакция тоже
оценивается как положительная (50% агглютинации);
c)
если синее кольцо в слое сливок слабо выражено и весь столбик
молока имеет синий цвет, еакция оценивается как сомнительная (25%
агглютинации);
d)
если столбик молока остаётся равномерно окрашенным в тот
первоначально синий цвет, который был получен сразу при добавлении к
нему антигена, а слой сливок остаётся белым или
слегка желтоватого цвета, реакция оценивается как отрицательная.
При отрицательном результате кольцевой пробы молоко пригодно к
дальнейшему использованию без ограничений.
Не разрешается исследовать кольцевой реакцией молоко, полученное от
коров,
больных
ящуром,
маститами
и
другими
болезнями,
сопровождающимися повышением температуры тела, а также молоко от
коров, находящихся в процессе запуска, и в первые 12 дней после отёла.
При положительном результате КР для подтверждения специфичности
полученных результатов ставится РПГА с антигенным бруцеллёзным
эритроцитарным диагностикумом. Для постановки реакции молоко
инактивируют при 100°С 30 минут.
При исследовании молока от вакцинированных бруцеллёзной вакциной
коров (при наличии подтверждающего документа) при положительном
результате КР и РПГА с эритроцитарным антигенным бруцеллёзным
диагностикумом ставится РПГА с эритроцитарным иммуноглобулиновым
(антительным) для выявления специфического антигена. При положительном
результате во всех трёх реакциях молоко считается инфицированным.
б) Исследования на наличие антигена возбудителя бруцеллёза
В эпидемиологической практике на наличие бруцеллёзного антигена
могут быть исследованы мясо, мясные и молочные продукты, органы
животных с патологическими изменениями, объекты внешней среды (навоз,
почва, вода, шерсть, корм, подстилка и т.д.).
Исследование проводится методом постановки РПГА с эритроцитарным
бруцеллёзным иммуноглобулиновым (антительным) диагностикумом с
коммерческими препаратами, отвечающими требованиям инструкции по
применению (прилагаются к препарату).
Подготовка препарата.
1. Диагностикум может быть использован в 2,5% концентрации
(макрометод) и 0,5% концентрации (микрометод). Сухой препарат
29
30.
разводится до нужной концентрации согласно указанию на упаковке.Жидкий препарат тщательно встряхивается до образования гомогенной
взвеси. При наличие неразбивающихся комков препарат непригоден
для использования.
2. В качестве стабилизатора при постановке реакций используется твин80, разведённый в соответствии с инструкцией по применению
диагностикума.
3. 50%-ную взвесь формалинизированных эритроцитов барана,
используемую для адсорбции неспецифических антигенов в
исследуемом материале, тщательно встряхивают до образования
равномерной взвеси.
Подготовка материала для исследования. Исследуемый материал (1
грамм) растирают в ступке, добавляют 10 мл 0,9%-ного раствора хлорида
натрия с 1-2% формалина, тщательно перемешивают, оставляют для
отстаивания на 20-30 минут, затем жидкую часть отсасывают в пробирку,
инактивируют на водяной бане при 98°±2°С в течение 20 минут, а после
остывания фильтруют через бумажный фильтр. На 1 мл полученного
фильтрата закапывают по 0,1 мл 50% формалинизированных эритроцитов и
оставляют при комнатной температуре до полного оседания эритроцитов,
после чего материал готов к исследованию.
Постановка РПГА макрометодом.
В 2 лунки полистироловой пластины наливают по 0,4 мл раствора твин80 в разведении 1:50000. В первую лунку добавляют 0,4 мл исследуемого
материала и делают последовательные двукратные разведения переносом по
0,4 мл из одной лунки в другую, исключая последнюю (контроль
диагностикума). Из предпоследней лунки лишние 0,4 мл удаляют, а затем во
все 5 лунок добавляют по 0,05 мл диагностикума эритроцитарного
иммуноглобулинового
2,5%
концентрации.
Содержимое
лунок
гомогенизируют покачиванием пластины и оставляют на 2-3 часа при
температуре (22±4)°С, после чего учитывают результаты.
В шестую лунку (без разводящей жидкости) вносится 0,4 мл
исследуемого материала и закапывается одна капля контрольных эритроцитов
(50% формалинизированные эритроциты, разведённые до концентрации
2,5%)
Таким образом, первые 4 лунки — опытный ряд, в котором определяется
наличие и концентрация бруцеллёзного антигена в исследуемом материале. В
пятой лунке определяется отсутствие неспецифической агглютинации
растворителя с эритроцитами иммуногло-булинового диагностикума, в
шестой — контрольных эритроцитов с исследуемым материалом.
Постановка РПГА микрометодом проводится в таком же порядке, но
используются микротитровальные пластины, объём раствора твин-80 и
исследуемого материала — 0,05 мл, диагностикум добавляется в объёме
0,025 мл. Титрация проводится микротитратором или пипеточными
30
31.
дозаторами.Учёт результатов. Возможны следующие 4 варианта результатов
реакции:
В одной, нескольких или всех лунках опытного ряда (первые 4 лунки)
эритроциты выпадают на дно равно мерным слоем, образуя «зонтик». В
пятой и шестой лунках агглютинации нет (эритроциты выпадают в виде
"пуговки" или узкого колечка). Результат исследования специфический
положительный. Если агглютинация отмечена во всех 4 первых лунках, то
для определения титра реакция ставится повторно в 10 лунках (длинный ряд),
11 и 12-я лунки ставятся аналогично 5 и 6-й лункам короткого ряда.
Поскольку разведение испытуемого материала было 1:10, титр в первой
лунке учитывается как 1:20.
В опытном ряду, а также в 5-й лунке «зонтики», в 6-й лунке «пуговка»
или «колечко». Результат неспецифический за счёт агглютинации
эритроцитов диагностикума с растворителем, не учитывается. Необходимо
провести адсорбцию готового раствора твин-80 50% формалинизированными
эритроцитами, затем повторно провести ис-следование.
В опытном ряду, а также в шестой лунке «зонтики», в пятой лунке «пуговка» или «колечко». Результат неспецифический за счёт агглютинации
формалинизированных эритроцитов снеспецифическими антителами в
исследуемом материале. Результат не учитывается, исследуемый материал
подлежит повторной адсорбции 50% формалинизированными эритроцитами
барана с повторным исследованием
В опытном ряду, пятой и шестой лунках эритроциты выпали в виде
«пуговки» или «колечка». Результат исследования специфический
отрицательный.
Для контроля специфичности РПГА необходимо сопровождать
постановкой РТПГА.
Кроме того, для выявления специфических антител или антигена к
возбудителю бруцеллёза возможна постановка системы реакций с
эритроцитарньши диагностикумами РПГА-РТПГА, РПГА-РНАт, РПГА-РНАг.
3.2. Организация забора проб при исследовании на бруцеллёз
Сбор образцов, необходимых для лабораторной диагностики бруцеллёза,
может осуществляться врачами и медицинскими сёстрами у постели
больного с симптомами, не исключающими бруцеллёз; группами по
расследованию вспышки и исследовательскими командами. При этом
необходимо знать и применять соответствующие методы по обеспечению
безопасности при сборе, хранении и транспортировке образцов клинических
материалов для того, чтобы повысить вероятность успешной диагностики и
минимизировать контакт с возбудителем.
Основные меры предосторожности при заборе клинических
образцов для исследования на бруцеллёз
31
32.
• При сборе и обработке образцов необходимо использовать одноразовыеперчатки и халат, либо завязывающийся на спине с цельным передом,
либо застёгивающийся на пуговицы спереди. Перчатки должны
закрывать манжеты халата.
• Необходимо
также
использовать
дополнительные
средства
индивидуальной защиты (СИЗ), такие очки, маски для лица и
респираторы, в связи высоким риском аэрогенного заражения
бруцеллёзом, а также возможностью заражения бруцеллёзом через
конъюнктиву.
• После завершения работы необходимо снять все одноразовые СИЗ и
поместить в промаркированный пластиковый пакет для последующей
утилизации.
• Необходимо мыть руки до того, как надеть перчатки, и сразу же после
их снятия.
• Необходимо менять перчатки после контакта с каждым пациентом,
после прямого контакта с кровью, жидкостями организма и тканями, а
также до того, как продолжить работу на другом участке тела того же
пациента.
• Сбор образцов может быть связан с использованием игл и других
острых инструментов. Не оставляйте острые предметы с образцами. Не
ломайте, не закрывайте колпачком и не помещайте иглы обратно в
контейнер.
• Необходимо утилизировать острые предметы должным образом, чтобы
избежать случайных уколов иглой или проливания образца.
Необходимо использовать специальные контейнерами с твёрдыми
стенками для острых предметов и утилизировать в них иглы сразу же
после использования.
• Все контейнеры с образцами должны транспортироваться в
герметичных пластиковых сумках с отдельным кармашком для
документов.
• Необходимо немедленно вытереть любую пролитую кровь или другие
жидкости; после этого использовать свежее дезинфицирующее
средство, не обусловливающее коагуляцию крови, чтобы полностью
продезинфицировать место пролива.
Лаборатория несёт ответственность за обеспечение того, что качество
получаемого образца приемлемо для проведения последующего
исследования.
Лаборатория должна отбраковывать при получении следующие
образцы:
• не подписанные;
• образец собран в неправильную пробирку / контейнер или в контейнер
с неправильным консервантом или доставлен в шприце;
32
33.
• сломанные или протекающие контейнеры / пробирки;• с недостаточной информацией о пациенте;
• если информация о пациенте на образце и в форме направления не
совпадают;
• гемолизированная, хилёзная или иктерическая кровь или сыворотка;
• несоответствующий объём образца на количество консерванта;
• недостаточное количество образца для запрашиваемого теста;
• после продолжительной по времени перевозки или неправильного
обращения при перевозке.
Безопасная система забора крови для исследования на бруцеллёз с
использованием вакуумных пробирок (Vacutainer ®)
Что необходимо помнить до сбора образцов крови:
Предпочтительные места для флеботомии – это крупная срединная
локтевая вена или подкожная латеральная вена руки или вены на тыльного
стороне запястья или руки. Не берите кровь из той же руки, куда вводятся
внутривенно препараты.
Для тестирования различных заболеваний могут понадобиться разные
объёмы образца или типы пробирок.
Вакуумные пробирки автоматически заполняются определённым
объёмом крови (после выравнивания давления в пробирке ток крови
прекращается). В зависимости от предназначения, в пробирки могут быть
добавлены разные типы консервантов. Резиновые пробки окрашены в
определённый цвет, соответствующий консерванту в пробирке. Иглы и
держатели должны соответствовать выбранным пробиркам.
Сбор, обработка и транспортировка образцов крови
Сначала продезинфицируйте кожу и возьмите образцы крови для
гемокультуры, а лишь затем возьмите кровь из того же прокола в другие
пробирки.
Выбор системы для забора крови должен основываться на физическом
состоянии пациента. Вакуумная система сбора крови является наиболее
безопасным методом, так как требует меньшего количества манипуляций и
практически исключает контакт медицинского работника с кровью. Однако,
если у пациента тонкие вены, то под влиянием вакуума в пробирке они могут
сжиматься, и забор крови необходимо проводить иглой и шприцем.
Расходные материалы при использовании держателя для игл и
катетера с иглой-бабочкой
Система для сбора системы безопасного забора крови состоит из:
1. вакуумной пробирки или флакона;
2. держателя для игл;
3. иглы-бабочки с катетером (рисунок 2)
33
34.
Рисунок 2 — Материалы для безопасного забора кровиПеред началом работы по забору крови необходимо убедиться в наличии
следующих материалов:
• 70% спирт (изопропиловый спирт или этанол), тампоны / салфетки,
пропитанные 70% раствором спирта, салфетки, марлевые прокладки,
лейкопластырь;
• лабораторный халат, перчатки и другие СИЗ;
• жгут;
• держатель для игл;
• стерильные иглы-бабочки размером 21G (0,7 × 38 мм) или 23G (0,6 × 19
мм) при заборе крови у детей;
• вакуумные пробирки или флаконы для культуры крови с
соответствующей средой;
• этикетки и маркер;
• контейнер для транспортировки ;
• контейнер для острых предметов;
• дезинфицирующее средство.
Объём собранного материала определяется возрастом пациента и его
весом. У взрослых и детей в возрасте 10 лет и старше с массой тела равной
или большей 30 кг обычно забирается 8-10 мл крови (в пробирки для
бактериологического посева и постановки серологических реакций, т. е.
примерно по 4-5 мл в каждую пробирку).
У детей младше 10 лет забирается 2-5 мл, а у новорождённых — 1-2 мл
(используются специальные пробирки маленького объёма).
34
35.
Техника забора крови с использованием держателя для игл икатетера с иглой-бабочкой
1. В течение всей процедуры соблюдайте меры по обеспечению
стерильности для снижения вероятности контаминации.
2. Проверьте личность пациента и запрашиваемые тесты.
3. Подготовьте материалы, необходимые для забора крови, и форму
направления.
4. Посадите пациента на стул или на кушетку или положите на кровать.
Если возможно, рука пациента должна быть опущена.
5. Помойте руки, наденьте одноразовые перчатки.
6. Завяжите жгут вокруг руки пациента на 5 см выше места прокола, а
затем нащупайте и найдите вену. NB! Не берите кровь из руки, в
которую вводились внутривенные препараты.
7. Продезинфицируйте кожу салфеткой со спиртом; дайте спирту
высохнуть в течение 30 секунд.
8. Объём вакуумной пробирки / флакона обычно превышает 10 мл,
поэтому следите за собираемым количеством крови при помощи 5 мл
маркировки на ёмкости. Поставьте метку на ёмкости на желаемом
уровне заполнения, чтобы ее было хорошо видно.
9. Проверьте, нет ли на ёмкости трещин, признаков контаминации,
сильного помутнения, вздутий или продавленных мембран. Не
используйте ёмкость, если вы заметили дефекты. Перед проколом
резиновой мембраны крышки пробирки / флакона, протрите её / его
верхнюю часть (мембрану) спиртом и дайте ему высохнуть (не
используйте йод для очищения верхней части пробирки).
10.Выньте из упаковки стерильную бабочку, введите наконечник Люэра на
держателе в канюлю иглы.
11.Повяжите жгут на подготовленной руке выше места прокола.
Попросите пациента несколько раз сжать кулак.
12.Больше не прикасайтесь к вене, но при необходимости, перед
контактом с веной, протрите пальцы раствором спирта.
13.Удалите защитную плёнку, покрывающую иглу у основания крыльев.
Не держитесь за жёлтое безопасное поле. Осторожно введите иглу в
вену в обработанном месте.
14.Держите ёмкость вертикально. Надавите и держите держатель для игл
над верхней частью емкости, чтобы проткнуть мембрану. Внимательно
следите за направлением потока крови, когда начнёте забор образца
(рисунок 3).
15.Наберите кровь до необходимого уровня, чтобы обеспечить
правильный поток крови и забор необходимого объёма.
16.Выньте заполненную ёмкость из держателя и сразу же введите в него
вторую ёмкость.
17.Заполните вторую ёмкость до необходимого уровня заполнения.
35
36.
18.Если образец крови собирается в пробирки с антикоагулянтом, такимкак ЭДТА, перемешайте образец, аккуратно переворачивая пробирку.
19.Выньте иглу. На место прокола наложите марлевую повязку (не ватный
тампон) и надавите.
20.Попросите пациента держать руку прямой (не согнутой), поднять руку
и другой рукой давить на место прокола в течение 5 минут. Вы можете
использовать лейкопластырь для закрепления марлевой повязки, но
продолжайте давить на место прокола в течение минимум 5 минут.
21.Поместите бабочку в соответствующий контейнер для острых
предметов иглой вперёд. Не закрывайте иглу колпачком!
22.Подпишите маркером пробирку / флакон с кровью, указав на этикетке
информацию о пациенте, либо соответствующий идентификационный
номер, а также дату забора образца.
23.Очистите верхнюю часть ёмкости салфеткой, пропитанной спиртом,
для удаления любых остатков крови.
24.Проверьте, остановилось ли кровотечение у пациента, и наложите
повязку поверх марлевого тампона. Посоветуйте пациенту оставить
повязку на 15 минут.
25.Заполните сопроводительные документы, указав время забора и любую
другую информацию, касающуюся данного образца.
26.Сразу же отправьте образец в лабораторию. Храните пробирки /
флаконы с кровью при комнатной температуре (20-25ºС).
Рисунок 3 — Собранная система безопасного забора крови (игла-бабочка
36
37.
надета на держатель, в который вставлен вакуумный флакон для заборакрови)
Обработка и транспортировка ёмкостей с образцами крови
Образцы крови должны отправляться в лабораторию как можно скорее.
Не охлаждайте образцы в холодильнике. Транспортируйте при комнатной
температуре (20-25ºС) в вертикальном положении, зафиксированными на
штативе.
Обложите ёмкости материалом для амортизации и поместите в
транспортный контейнер абсорбирующую бумагу, чтобы обеспечить
впитывание жидкостей в случае проливания.
Техника посева крови в транспортную среду
Кровь одного больного сеют в один флакон транспортной среды.
Перед посевом отгибают центр металлического колпачка флакона, а
открывшуюся резиновую часть пробки протирают 96° спиртом.
Стерильно берут кровь из локтевой вены в объёме 8-10 (можно меньший
объём), и вводят её той же иглой-бабочкой, которой осуществлялся забор
крови в вакуумные пробирки, без держателя во флакон через резиновую
пробку.
Вынимают иглу с предосторожностями под защитой марлевой салфетки,
смоченной дезинфектантом, т. к. во флаконе создаётся избыточное давление
воздуха, которое ведёт к разбрызгиванию крови, опасному для персонала.
Выравнивание давления во флаконе осуществляется введением во флакон
второй иглы от обычного шприца с канюлей, прикрытой ватным шариком,
смоченным спиртом.
Затем вернуть необходимо на место отогнутый металлический колпачок.
Флакон поставить в термостат при 37°С или оставить при комнатной
температуре (в холодильник не ставить!) до отправки в лабораторию.
Заполнить направление, флакон упаковать так, чтобы не разбить при
транспортировке.
Техника посева крови по методу Кастанеда
В лаборатории, куда был доставлен посев крови в транспортной среде,
или кровь в пробирке / флаконе в стерильных условиях проводят пересев по
методу Кастанеда. Для этого металлический колпачок флакона с кровью
окутывают смоченным спиртом ватным тампоном, чтобы исключить опасное
разбрызгивание крови. Треугольным открывателем для бутылок или
корнцангом осторожно открывают флакон, а колпачок с резиновой пробкой и
ватным тампоном погружают в дезраствор.
Над пламенем спиртовки стерильно пипеткой объёмом 10 мл
содержимое флакона или крови отсасывают и поровну разливают в два
флакона с бифазной (твёрдой и жидкой одновременно) питательной средой.
37
38.
Оба флакона с посеянным материалом инкубируют при 37°С в течениемесяца. При этом один флакон при обычных атмосферных условиях, а второй
— при повышенном содержании углекислого газа, чего достигают внесением
на 1 литр объёма эксикатора 0,4 г двууглекислой соды и 0,35 мл
концентрированной соляной кислоты.
Для этого маленький сосуд с кислотой ставят в эксикатор, крышку
которого приподнимают, и в сосуд быстро всыпают навеску соды, после чего
крышку эксикатора быстро и плотно прикрывают. Для более плотного
прилегания крышки её края смазывают вазелином.
Флаконы с посевами просматривают каждые 3 дня. Если не видно роста
колоний, поверхность агара орошают смесью крови с бульоном, наклоняя для
этого флакон. В отрицательных случаях наблюдение за посевами продолжают
до 30 дней. Выросшие колонии микроорганизмов, которые появляются на
твёрдой питательной среде, пересевают на косяк пробирки для дальнейшей
идентификации.
Посев крови для выделения атипичных форм бруцелл
При бактериологическом обследовании больных, прошедших курс
лечения антибиотиками, через 1 месяц и спустя 4-6 месяцев после окончания
курса антибиотикотерапии, а также больных хронической формой бруцеллёза
в период обострения (особенно при наличии субфебрильной температуры)
перед началом лечения следует проводить посевы крови, пунктатов костного
мозга, натёчников и другого материала на специальную среду для выделения
атипичных форм бруцелл.
Способ посева материала для выделения атипичных форм бруцелл
идентичен с методом выделения гемокультур. Отличие состоит в том, что
используются одновременно полужидкая и полутвёрдая среды. Пробирки
инкубируют при 37°С. Наблюдение проводят так же, как за посевами крови
по методу Кастанеда.
4. Методы идентификации бруцелл
4.1. Схема исследования клинического материала на бруцеллёз
Исследование клинического материала на бруцеллёз включает:
• серологическую диагностику;
• специфическую индикацию возбудителя или его маркёров (ДНК
возбудителя инфекции, его антигенов) в исследуемом материале;
• выделение и идентификацию чистой культуры возбудителя бруцеллёза.
Порядок исследования клинического материала включает:
I этап
38
39.
приём, сортировка, регистрация и кодирование проб;первичная обработка проб и подготовка их к исследованию;
ПЦР с пробами из нативного материала;
постановка реакций агглютинации Роз-Бенгал, Хеддльсона и Райта,
РНГА, ИФА для выявления специфических антител в крови (сыворотки
крови) больного;
• пересев клинического материала с элективной жидкой транспортной
среды для накопления бруцелл на бифазную среду по Кастанеде;
• инкубация бифазной среды с посевом клинического материала при
37°С до 20-30 суток;
• при необходимости заражение биопробных животных (морские свинки,
белые мыши) подкожно в паховую область или внутрибрюшинно —
при исследовании крови, спинномозговой жидкости, костного мозга.
II этап
4 минуты от начала исследования — учёт результатов Роз-Бенгал
пробы;
8 минут от начала исследования — учёт результатов реакции
Хеддльсона;
2-6 ч от начала исследования — учёт результатов ИФА, РНГА, РНАт.;
18-20 ч от начала исследования — учёт результатов реакции
агглютинации Райта;
48 ч от начала исследования — выдача предварительного
положительного ответа на основании положительных результатов
серологических реакций (реакции Роз-Бенга, Райта, Хеддльсона, РНГА,
ИФА, РНАт).
III этап
3-21 суток от начала исследования:
учёт результатов роста на бифазной среде, плотных и жидких
питательных средах;
при наличии роста культуры (или единичных колоний) на питательных
средах производят отбор колоний, сходных по морфологии с колониями
возбудителя бруцеллёза;
приготовление и микроскопия мазков в окраске по Граму из
подозрительных колоний;
отсев отобранных изолированных колоний на плотные питательные
среды для получения чистой культуры;
постановка реакции ориентировочной слайд-агглютинации отобранных
39
40.
изолированныхколоний
с
поливалентной
диагностической
бруцеллёзной сывороткой;
• подтверждение предварительного ответа на основании наличия
характерного роста на плотных питательных средах, наличия в мазках
из колоний мелких грамотрицательных кокковидных палочек,
положительной реакции слайд-агглютинации.
IV этап
5-30 суток от начала исследования:
пересев чистых культур на скошенный агар для хранения и
последующей работы с ними;
определение степени диссоциации выделенных культур;
постановка с культурами возбудителя бруцеллёза, находящимися в
стабильной S-форме, тестов межвидовой дифференциации (см. таблицу
3): отношение к избыточному содержанию углекислоты в воздухе,
способность к образованию сероводорода, редуцирующая активность в
отношении красителей (тионин, основной фуксин), агглютинация
моноспецифическими бруцеллёзными сыворотками (anti-abortus, antimelitensis), чувствительность к бруцеллёзному бактериофагу Тб и, при
наличии, другим фагам (см. таблицу 4);
определение чувствительности к антибактериальным препаратам
дискодиффузионным методом;
при необходимости вскрытие биопробных животных, посев органов и
крови на плотные питательные среды.
V этап
10-40 сут от начала исследования:
• учёт результатов дифференциации культур для определения вида и
биовара возбудителя бруцеллёза;
• учёт посевов материала от биопробных животных;
• выдача окончательного положительного ответа по результатам
бактериологического исследования на основании выделения чистой
культуры бруцелл из посевов нативного материала или от биопробных
животных, или по результатам серологического исследования на
основании положительных результатов серологических тестов либо
выдача окончательного отрицательного ответа на основании отсутствия
специфического роста на питательных средах, отрицательных
результатов серологических реакций на всех этапах исследования,
отсутствия специфического роста в посевах от биопробных животных.
40
41.
4.2. Бактериологические методы исследованияВыделение возбудителя бруцеллёза делает диагноз данного заболевания
бесспорно доказанным. Положительный результат бактериологического
исследования крайне важен в эпидемиологическом отношении. В то же время
отрицательный результат этого метода не дает оснований для заключения об
отсутствии бруцеллёзной инфекции.
Характерной особенностью рода Brucella является медленный рост на
питательных средах, особенно в первых генерациях. При правильно
выполненных посевах крови, костного мозга, мочи и других материалов
бруцеллы обнаруживаются через 5-10, а иногда через 20 - 30 дней после
посева. При этом первые генерации В. abortus и В. ovis способны расти при
наличии в атмосфере повышенного содержания углекислого газа (5-10%), что
является также одним из дифференциальных признаков. Лабораторные
штаммы бруцелл вырастают через 24-48 часов, поскольку происходит их
адаптация к питательным средам.
Для выделения культур бруцелл рекомендуются следующие среды:
Brucella-arap
(Индия),
эритрит
агар
(Махачкала),
печёночный,
мясопептонный, селезёночный, кровяной (5% крови), сывороточнодекстрозный агары, плацентарная среда, агар из картофельного настоя с
сывороткой, селективные среды на печёночной и эритрит агаровой основе и
бульоны. Оптимальная температура выращивания бруцелл 37°С, рН сред 6,8 7,2.
Посевы исследуемого материала следует проводить на предварительно
проверенные питательные среды.
Идентификация бруцелл
Принадлежность выделенных культур к роду бруцелл определяется с
помощью изучения их морфологии, культуральных и антигенных свойств
(см. таблицу 3).
Культуральные свойства
Колонии бруцелл на агаре становятся видимыми через 3-4 суток после
инокуляции лабораторных штаммов; колонии величиной от 3 до 5 мм в
диаметре. Колонии бруцелл в S-форме бесцветные, с гладкой поверхностью,
выпуклые, иногда с нежной зернистостью. В проходящем свете янтарножёлтые, при боковом освещении — серо-белые. На жидких питательных
средах дают равномерное помутнение. Для изучения структуры колонии
можно использовать обычный микроскоп с объективом минимального
увеличения или лупу МБС-1.
Морфология
Бруцеллы имеют коккообразную или палочковидную форму. При
окраске по Граму бруцеллы грамотрицательные, при окраске по Козловскому
бруцеллы сохраняют красную окраску, а другие бактерии окрашиваются в
41
42.
зелёный цвет. Для окраски мазков двумя названными методами делаютфиксированные в спирте мазки из соответствующих колоний.
Окраска мазков по Козловскому
Окрашивают 0,5% водным раствором сафранина, подогревая до
появления пузырьков, промывают дистиллированной водой и докрашивают
водным раствором малахитовой или бриллиантовой зелени в течение 40-50
секунд.
Антигенные свойства
Для постановки реакции слайд-агглютинации используют коммерческую
сыворотку диагностическую бруцеллёзную сухую. Сыворотку разводят
физиологическим раствором 1:25. На предметное стекло наносят каплю
разведённой сыворотки, в которой эмульгируют часть исследуемой колонии.
В положительных случаях (в течение 1 минуты) наступает агглютинация с
образованием хорошо выраженных хлопьев, в отрицательных суспензия
остается гомогенной. Для контроля исследуемую культуру эмульгируют в
капле физиологического раствора или нормальной сыворотки.
Идентификация атипичных форм бруцелл
Принадлежность выделенных культур к атипичным формам бруцелл
определяется с помощью изучения характера роста и морфологии колонии,
микроскопии нативных препаратов, постановке пробы со специфической
сывороткой в реакции агглютинации на стекле, пассажей на элективных для
бруцелл питательных средах с целью реверсии в L-форму, а также
способности к росту на специальной среде.
На твёрдом агаре бруцеллы в атипичной форме растут в виде
изолированных колоний или в виде слизистого кольца на поверхности
столбика. Колонии размером 1-3 мм имеют слизистую консистенцию, тянутся
за петлёй. Иногда атипичные формы бруцелл растут в виде сухих,
врастающих в агар колоний.
Морфологию атипичных форм бруцелл изучают при микроскопии
мазков, окрашенных по Граму, а также с помощью фазово-контрастного
устройства просматривают нативные препараты: на предметное стекло
наносят каплю физиологического раствора, в которой эмульгируют одну
петлю исследуемой культуры, закрывают покровным стеклом и края
заливают парафином.
Из крови больных бруцеллёзом, наряду с типичными, выделяются
культуры, по морфологии представляющие собой полиморфные клетки в
виде шаров, грушевидных и неправильной формы тел размером от 1 до 6
мкм, с цитоплазмой разной оптической плотности, с вакуолями и
зернистостью. Зёрна-гранулы могут располагаться как внутри крупных
клеток, так и лежать свободными массами. В препарате могут находиться
клетки размером от 0,2 до 0,5 мкм, гетероморфные или близкие по
морфологии к нормальным клеткам бруцелл.
42
43.
Такие культуры, для определения их принадлежности к бруцеллампассируют 1-3 раза на элективных для бруцелл питательных средах.
Полученные
ревертанты
изучают
общепринятыми
методами
дифференциации.
Проба со специфической сывороткой
Атипичные культуры бруцелл сохраняют антигенное родство с
исходными
штаммами
бруцелл.
Для
предварительной
быстрой
идентификации атипичных культур бруцелл ставят реакцию слайдагглютинации на стекле со специфической агглютинирующей поливалентной
сывороткой в разведении 1:25.
Необходимо учитывать, что атипичные культуры очень плохо
эмульгируются, что затрудняет учёт реакции. Поэтому сначала петлю
культуры тщательно растереть стеклянной палочкой в небольшом количестве
физиологического раствора и после этого каплю эмульсии перенести в каплю
специфической сыворотки на предметное стекло и параллельно в каплю
нормальной сыворотки или физиологического раствора в качестве контроля.
Скорость специфической реакции агглютинации атипичных культур бруцелл
может быть несколько замедленной. Характер агглютината при
положительной реакции обычен.
Изучение дифференциальных свойств выделяемых культур должно
проводиться не позже 1 месяца с момента выделения. В качестве контроля
при изучении выделенных культур используются эталонные штаммы
В. melitensis 16M, В. abortus 544 и В. suis 1330, относящиеся к первым
биоварам. Сопоставляя свойства изучаемых культур и эталонных штаммов,
устанавливают вид и биовар возбудителя бруцеллёза.
Изучение выделенных культур бруцелл рекомендуется проводить по
предлагаемой схеме:
Исследуемая культура
Посев на косяк. Через 48 часов роста
Идентификация культуры
1. Приготовление мазков
по Граму
2. Ориентировочная
слайд-агглютинация на
стекле с поливалентной
диагностической
бруцеллёзной
сывороткой
3. Развёрнутая реакция
агглютинации с
сывороткой
диагностической
агглютинирующей
Определение диссоциации бруцелл
43
44.
1. Постановка пробы стрипафлавином
2. Реакция
термоагглютинации
3. Окраска колоний
кристаллвиолетом
Дифференциация культур
1.
2.
3.
4.
5.
Потребность в СО2.
Образование H2S.
Проба с фагом Тб.
Характер роста на бульоне и агаре.
Редуцирующая активность в отношении красок (фуксин1:50000,
тионин 1:25000, 1:50000).
6. Реакция агглютинации с моноспецифическими сыворотками
В. melitensis и В. ovis.
Культура бруцелл, поступившая для изучения, пересевается на
скошенный агар. Через 2-е суток выросшая культура подлежит
идентификации (см. выше) и определению диссоциации.
Определение диссоциации бруцелл
Проба с трипафлавином
На предметное стекло наносят каплю 0,2% раствора трипафлавина, в
котором
эмульгируется
одна
петля
испытуемой
культуры.
У
диссоциированных культур (R) быстро, в течение 1-2 минут, наступает
агглютинация с образованием хорошо выраженных хлопьев.
Взвесь из S-форм остается гомогенной. Изучаемые культуры могут
содержать диссоциированные и недиссоциированные клетки, т.е. находиться
в S и R- форме.
Реакция термоагглютинации
Взвесь 2-х суточной культуры бруцелл в физиологическом растворе в
объёме 2-3 мл с содержанием 1,7 × 109 м.к./мл прогревают в пробирке на
водяной бане при 90°С в течение 30 минут. Результаты учитывают через 3060 минут и окончательно через 24 часа пребывания при комнатной
температуре. В эти сроки наступает, при наличии диссоциации, ясно
выраженная агглютинация клеток бруцелл, тогда как суспензия бруцелл
недиссоциированных штаммов остается гомогенной.
Дифференциации подлежат культуры бруцелл, находящиеся только в Sформе.
При
необходимости
дифференциации
до
биовара
частично
диссоциированных культур из общей популяции отбирают колонии в Sформе. При этом пользуются методом окраски колоний кристаллвиолетом.
Окраска колоний кристаллвиолетом (по Уайт-Вилсону)
Рабочее разведение краски готовят в день исследования путем
разведения основного раствора стерильной дистиллированной водой в 10 раз.
44
45.
Разведённую краску наливают пастеровской пипеткой на поверхностькультуры, выросшей на агаре в чашке Петри. После 5-ти минутной
экспозиции чашку слегка наклоняют и пастеровской пипеткой осторожно
отсасывают краску в цилиндр с дезраствором. Гладкие колонии в S-форме
окрашиваются в светло-жёлтый или светло-зелёный цвет. Колонии в R-форме
принимают окраску от тёмно-фиолетовой до светло-синей. Метод позволяет
судить о составе популяции изучаемой культуры, для чего подсчитывают
число колоний в S и R-форме. S-колонию отсевают на косяк с агаром для
проведения дальнейшей дифференциации культур.
Дифференциация культур бруцелл
Образование сероворода
Взвесь бруцелл из испытуемой 2-х суточной агаровой культуры в
физиологическом растворе 1,7 × 109 м.к./мл засевают в пробирку стандартной
петлёй (2 мм) на скошенную поверхность агара. Затем берут полоску
фильтровальной
бумаги,
пропитанную
насыщенным
раствором
уксуснокислого свинца и высушенную, и зажимают между пробиркой и
ватной пробкой так, чтобы нижний её конец свободно свисал над верхним
краем посева и не касался агаровой среды. Ватная пробка должна быть
рыхлой, не задерживающей выхода углекислоты из пробирки. Пробирки с
посевами ставят в термостат при температуре 37°С. Показателем образования
сероводорода является почернение нижнего, свисающего над посевом конца
бумажки. Интенсивность образования H2S оценивается измерением
почерневшей части бумажки. Результаты учитываются через 2 дня в течение
6 дней. При каждом учёте почерневшую бумажку заменяют новой. Для
окончательной оценки способности культуры к образованию H 2S все три
показателя суммируются.
Для Brucella suis (биовар 1) суммарный показатель образования
сероводорода составляет примерно от 12 до 20 мм, для Brucella abortus
(биовар 1) — около 5-7 мм. Штаммы В. melitensis, как правило, совсем не
образуют сероводорода или же вызывают только лёгкое побурение бумажки.
У штаммов В. neotomae показатель образования сероводорода в среднем
равен 5-8 мм.
Чувствительность к бруцеллёзному бактериофагу
Для определения чувствительности бруцелл к фагу используют
бруцеллёзный бактериофаг вида abortus Тб раса №3.
Для постановки пробы с фагом используют 24-48 часовую агаровую
культуру бруцелл, из которой готовят взвесь 1 млрд м.к. в 1 мл
физиологического раствора. 0,2 мл взвеси наливают на поверхность агара и
тщательно растирают шпателем или 0,4 мл взвеси наносят на чашку Петри с
агаром. Чашки тщательно раскачивают для полученияавномерного газона,
лишнюю посевную жидкость удаляют пастеровской пипеткой. Засеянные
чашки подсушивают при комнатной температуре или при 37°С. После
45
46.
подсушивания в течение 1 часа на одну половину чашки наносят каплюцельного фага, на другую — фаг, разведённый в 1000 раз физиологическим
раствором. Чашки быстро наклоняют и капли фага стекают по дорожке.
Места нанесения фага и путь стекания капель можно заранее расчертить на
наружной стороне чашки. Посевы инкубируют при 37°С 24-48 часов.
Учёт результатов: сплошной лизис — (++++), лизис с небольшим
количеством колоний бруцелл — (+++), резко ослабленный рост — (++),
слабый лизис — (+) и отсутствие лизиса — отрицательный результат.
Характер роста бруцелл в бульоне
Взвесь бруцелл из 2-х суточной агаровой культуры в физиологическом
растворе с содержанием 1,7 × 109 м.к./мл. засевают в количестве 0,1 мл в
пробирку с бульоном. Рост бруцелл в бульоне вызывает его равномерное
помутнение. Бруцеллы в R-форме в бульоне могут давать осадок на дне с
просветлением в верхней части пробирки.
Редуцирующая активность в отношении красок
Для этого метода применяют твёрдые питательные среды: агар
Хоттингера, печёночный агар; краски — основной фуксин и тионин в
концентрации: фуксин 1:50000; тионин — 1:25000. Взвесь бруцелл из 2-х
суточной агаровой культуры с содержанием 1,7 × 109 м.к./мл засевают
стандартной петлёй на поверхность агара. На одну чашку можно
одновременно засевать 4-6 культур, предварительно разделив чашку Петри на
4-6 секторов. Для контроля делают посев испытуемой культуры на агар,
обеспечивающий высокие ростовые качества культуры без красок. Посевы
помещают в термостат при 37°С. Учёт полученных результатов проводят
через 3-е суток инкубации.
Схема учёта:
• Интенсивный рост по всему штриху — (++++).
• Интенсивный рост в начале и более слабый в конце штриха — (+++).
• Менее интенсивный в начале или слабый рост по всему штриху — (+
+).
• Очень слабый рост по ходу штриха или отдельные колонии — (+).
Развёрнутая реакция агглютинации с сывороткой диагностической
бруцеллёзной агглютинирующей
Для постановки реакции готовят взвесь 2-х суточной культуры в
физиологическом растворе с содержанием 1,7 × 109 м.к./мл. Эту взвесь
инактивируют при 60°С 1 час. В ряд пробирок наливают по 0,5 мл
физиологического раствора. Сыворотку диагностическую бруцеллёзную
агглютинирующую разводят физиологическим раствором 1: 25 и в объёме 0,5
мл вносят в первую пробирку и титруют, получая соответственно титры: 1:50,
1:100, 1:200, 1:400 до предельного титра, указанного на этикетке сыворотки.
Во все пробирки добавляют по 0,5 мл взвеси бруцелл. Разведение сыворотки
удваивается. Пробирки со смесью сыворотки и антигена выдерживают в
термостате при температуре 37°С — 18-20 часов. Затем проводят учёт
46
47.
реакции. Учёт результатов и их оценку проводят невооружённым глазом последующей схеме:
а) полное просветление жидкости с крупно- или мелкозернистыми
хлопьями (++++);
б) почти полное просветление жидкости с ясно заметными хлопьями (++
+);
в) незначительное просветление жидкости с заметной зернистостью (++);
г) мутная жидкость с едва заметной зернистостью (+);
д) равномерно гомогенная взвесь (-).
Реакция оценивается как положительная при агглютинации не менее,
чем на два креста (++).
Реакция агглютинации с моноспецифическими сыворотками
Макрометод. Реакцию ставят в 4 пробирках. Разведение
соответствующих сывороток должно быть 1:20, 1:40, 1:80, 1:160. Для этого
каждую монорецепторную сыворотку, разведённую 1:10 в объёме 0,5 мл
титруют в физиологическом растворе, разлитом по 0,5 мл. Затем во все
пробирки добавляют по 0,5 мл инактивированной (60°С - 1 час) исследуемой
2-хсуточной культуры бруцелл в физиологическом растворе с содержанием
1,7 × 109 м.к./мл. Титр моноспецифической сыворотки удваивается,
постановка реакции сопровождается контролем с эталонными штаммами
Brucella melitensis 16M и В. abortus 544. Реакцию учитывают через 18-20
часов выдерживания в термостате. Учёт реакции аналогичен учёту в
развёрнутой реакции агглютинации с агглютинирующей сывороткой. При
оценке результатов необходимо пользоваться таблицей ВОЗ по
дифференциальным свойствам видов рода Brucella и их биоваров.
Микрометод. Для постановки реакции используют одноразовые
полистироловые
пластинки
для
иммунологических
исследований.
Ингредиенты разливают микродозаторами. Реакцию ставят в 2 параллельных
рядах.
Моноспецифические сыворотки последовательно разводят 0,5%
карболинизированным физиологическим раствором с рН 7,0 до их
предельного титра, начиная с 1:10, 1:20 и т.д. в объёме 0,05 мл.
В качестве антигена применяют смыв в физиологическом растворе 2хсуточной агаровой культуры бруцелл изучаемого штамма в концентрации
1,7 × 109 м.к./мл по стандарту мутности для бруцелл. Смыв прогревают в
водяной бане при 67°С 1 час. Антиген добавляют по 0,05 мл во все лунки.
Разведение сыворотки удваивается: 1:20, 1:40 и т.д. Реакцию ставят с
контролем:
1. контроль с эталонным штаммом В. melitensis 16M;
2. контроль с эталонным штаммом В. abortus 544;
3. контроль сыворотки — 0,05 мл сыворотки из разведения 1:10 и 0,05 мл
физиологического раствора;
4. контроль антигена - 0,05 смыва культуры и 0,05 мл физиологического
47
48.
раствора.Содержимое лунок хорошо перемешивают на шуттель-аппарате 2
минуты при 210 качаниях в минуту или бережно, но тщательно
перемешивают вручную. Пластинки инкубируют в термостате при 37°С 18-20
часов, затем 1,5-2 часа при комнатной температуре.
Учёт результатов. В случае положительной реакции образуется зонтик с
белым оттенком на фоне просветления жидкости. Отрицательный результат пуговка. Положительной реакция считается, начиная с разведения сыворотки
1:20. Этот результат должен быть в обоих дублирующих рядах.
4.3. Серологические методы исследования
Основными серологическими методами исследования при бруцеллёзе у
людей являются: реакция агглютинации — пластинчатая Хеддльсона (РХ) и
объёмная пробирочная Райта (РА), реакция непрямой (пассивной)
гемагглютинации (РНГА), реакция связывания (РСК) или длительного
связывания комплемента (РДСК), Роз-Бенгал проба (РБП), антиглобулиновая
проба Кумбса, ракция нейтрализации антигена (РНАг), иммуноферментный
анализ (ИФА), реакция иммунофлуоресценции (РИФ) и др. Однако ни одна
из этих реакций в отдельности не обеспечивает выявления всех больных, т. к.
каждая характеризует особое иммунологическое состояние, которое
неодинаково в различные периоды инфекционного процесса.
Так реакция Райта высокоспецифична, появляется в первые дни
заболевания и служит основным диагностическим методом на ранних
стадиях острого или при обострении хронического бруцеллёза. При помощи
этой реакции можно проследить за динамикой антител и фазой
инфекционного процесса.
Реакция Хеддльсона значительно чувствительнее реакции Райта,
становится положительной одновременно с ней, а в некоторых случаях
раньше и держится дольше, особенно при хронической инфекции, проста по
технике постановки, может быть применена во всех лабораториях и в
экспедиционных условиях. Однако она менее специфична, носит
качественный характер и не дает возможности судить о высоте
агглютинационного титра.
Что касается РСК, то на определённых этапах заболевания она
превосходит по своей чувствительности реакцию Райта, но не заменяет её,
так как комплементсвязывающие антитела, появляющиеся в крови позднее,
чем агглютинины, сохраняются значительно дольше и с постоянством
выявляются у больных хроническим бруцеллёзом.
Гемагглютинирующие антитела можно обнаружить у больных острым и
подострым бруцеллёзом. При хронических формах и резидуальных явлениях
они обнаруживаются реже, но чаще чем агглютинины. Часто
гемагглютинины выявляются в тех случаях, когда остальные реакции дают
отрицательный или сомнительный результат.
48
49.
Высокая чувствительность пробы Кумбса при бруцеллёзе доказана как убольных, так и у людей, находившихся в контакте с инфицированным
материалом или больными животными, а также у лиц, проживающих в
районах, неблагополучных по бруцеллёзу сельскохозяйственного скота.
Антиглобулиновая
проба
Кумбса
предложена
в
качестве
диагностического метода при хронических и латентных формах бруцеллёза
для углубленного обследования людей и животных в целях ретроспективного
выявления контакта с антигеном, изучения иммунологической структуры
населения.
Реакция Хеддльсона (РХ)
В качестве антигена применяют единый (для РХ и РА) бруцеллёзный
диагностикум.
Для объективной оценки результатов реакции и подтверждения
надёжности диагностикума необходимо параллельно с испытуемыми
пробами использовать заведомо отрицательную и положительную
агглютинирующие сыворотки.
Обязательны 2 контроля:
а) контроль с каждой сывороткой для исключения спонтанного
образования хлопьев в физиологическом растворе;
б) контроль антигена для исключения спонтанной агглютинации
применяемого антигена (один для каждой серии при любом количестве
сывороток).
Для постановки реакции используют тщательно вымытое и
обезжиренное обычное оконное стекло, которое расчерчивают на 5 (по
горизонтали) квадратов величиной примерно 4 × 4 см каждый. На первом
квадрате слева записывают номер, на следующие микропипеткой или 1 мл
градуированной пипеткой наносят сыворотку в дозах: 0,04, 0,02, 0,01 и 0,02
мл (контроль сыворотки). К первым трём дозам сыворотки добавляют по
одной капле антигена (примерно 0,03 мл), к последней дозе — одну каплю
физиологического раствора. Контроль антигена ставят, добавляя одну каплю
физиологического раствора к одной капле диагностикума. Начиная с
минимальной дозы, сыворотку смешивают с антигеном стеклянной палочкой.
Стекло около 2-х минут держат, слегка покачивая, над электрической
плиткой или пламенем спиртовки для равномерного нагревания всей его
поверхности до 37°С. При положительной реакции в первые же минуты
появляются хлопья (агглютинат), окрашеные в синий цвет; при
отрицательной - жидкость остаётся равномерно мутной. Максимальный срок
наблюдения - 8 минут. Агглютинацию оценивают следующим образом:
a)
полное просветление жидкости с крупно-или мелкозернистыми
хлопьями (100% агглютинации) ++++;
b)
почти полное просветление жидкости с хорошо выраженными
хлопьями (75% агглютинации) +++;
49
50.
c)незначительное просветление жидкости с заметными хлопьями
(50% агглютинации) ++;
d)
мутная жидкость с едва заметной зернистостью +;
e)
равномерно мутная жидкость.
Предельным считается разведение сыворотки, давшее агглютинацию не
менее чем на 50% (++). Полученные разведения сыворотки несопоставимы с
их разведением в пробирках или планшетах (реакция Райта), поэтому они не
могут быть выражены в титрах.
Оценка результатов РХ по схеме:
a)
отсутствие агглютинации во всех дозах сыворотки — реакция
«отрицательная»;
b)
агглютинация в первой дозе (0,04 мл сыворотки) — результат
«сомнительный»;
агглютинацияна ++, +++ во второй или третьей дозах (0,02-0,01 мл
сыворотки) — результат «положительный»;
c)
агглютинация на 4 креста (++++) во всех дозах сыворотки —
результат «резко положительный».
Реакция Райта (РА)
Для успешного проведения РА необходимо соблюдать следующие
правила:
1. Пробирки
должны
быть
тщательно
вымытыми,
сухими,
простерилизованными в сушильном шкафу или автоклаве.
2. Кровь для исследования берут из локтевой вены или из пальца. Для
свёртывания крови и отстаивания сыворотки пробирки выдерживают
30-40 минут при комнатной температуре, образовавшийся сгусток
отделяют от стенок стальной спицей и пробирки помещают в
холодильник. На следующий день отстоявшуюся сыворотку
отсасывают в другие пробирки и исследуют в свежем или
консервированном виде. Для консервирования применяют: а) сухую
борную кислоту (2-4% к объёму сыворотки) до получения
насыщенного раствора и образования на дне пробирки небольшого
осадка. Можно консервировать фенолом, мертиолятом или азидом
натрия; б) однократное замораживание.
3. Неконсервированные сыворотки должны исследоваться в течение 3-5
дней с сохранением при 4-8°С. Консервированные пригодны в течение
месяца, замороженные-в течение 3 дней однократного оттаивания.
Гемолизированные, мутные, проросшие сыворотки искажают результат
и не подлежат исследованию.
Феномен агглютинации состоит в том, что бруцеллы в присутствии
специфических антител склеиваются и оседают на дно пробирки, образуя
характерный осадок в форме раскрытого зонтика, хорошо видимого
макроскопически.
50
51.
Реакцию ставят методом «равных объёмов» (0,5 мл антигена + 0,5 млсыворотки). В пробирках делается не менее 6 разведений, т. к. реакция может
быть отрицательной в малых и положительной в больших разведениях — так
называемые «проагглютинационные зоны» (прозоны).
Постановку реакции начинают с разлива физиологического
карболинизированного (0,5%) раствора. Для каждой сыворотки берут 7
пробирок. Во вторую, третью, четвёртую, пятую, шестую и седьмую
пробирки наливают градуированной пипеткой по 0,5 мд физиологического
раствора; в первую, в которой готовят основное разведение, — 2,3 мл и
добавляют 0,2 мл испытуемой сыворотки, что соответствует разведению
1:12,5. Затем из пробирки с основным разведением (после тщательного
перемешивания) переносят по 0,5 мл смеси во вторую и седьмую (контроль
сыворотки). Содержимое второй пробирки перемешивают и переносят 0,5 мл
в третью пробирку, откуда аналогичным образом переносят в четвёртую, а
затем в пятую и шестую пробирки. После перемешивания лишние 0,5 мл из
шестой пробирки и 1,0 мл из первой выливают (вместе с пипеткой
погружают в дезинфицирующий раствор). Таким образом получены
разведения сыворотки: 1:12,5, 1:25, 1:50, 1:100, 1:200, 1:400, 1:1,25.
Диагностикум (предварительно разведённый согласно наставлению 1:10)
добавляют по 0,5 мл во все пробирки, кроме последней, в результате чего
объём в них будет равен 1 мл. Соответственно изменяется (удваивается) и
разведение сыворотки, т. е. получается 1:25, 1:50, 1:100, 1:200, 1:400, 1:800,
1:25.
Для исключения спонтанной агглютинации реакцию Райта ставят с
двумя контролями:
1. Контроль качества сыворотки (последняя 7-я пробирка) с каждой
испытуемой сывороткой; при наличии хлопьев, эритроцитов,
посторонних примесей результаты реакции агглютинации не
учитывают.
2. Контроль антигена – для каждой его серии, но один для всей группы
исследуемых сывороток (0,5 мл физиологического раствора + 0,5 мл
диагностикума).
Сыворотки с антигеном смешивают путём встряхивания и помещают в
термостат (37°С) на 18-20 часов. После инкубации пробирки выдерживают 12 часа при комнатной температуре и проводят учёт реакции. При отсутствии
термостата пробирки в летнее время можно оставить на 24-36 часов при
комнатной температуре, в другое время года - использовать водяную баню
(при 37°С в течение 4 часов), после чего оставить пробирки при комнатной
температуре до следующего дня.
Результаты реакции учитывают визуально на основании просветления
жидкости и выраженности осадка агглютинированных микробов при лёгком
встряхивании пробирки по следующей схеме:
a)
полное просветление жидкости с осевшими на дно микробными
51
52.
клетками в виде "зонтика", разбивающегося на крупные глыбки привстряхивании; обозначается четырьмя крестами (++++) — 100%
агглютинации;
b)
почти полное просветление жидкости с таким же характером
осадка, но "зонтик" при встряхивании распадается на более мелкие глыбки;
обозначается тремя крестами (+++) — 75% агглютинации;
c)
частичное просветление жидкости с ясно заметным оседанием
микробов в виде рыхлого "зонтика"; обозначается двумя крестами (++) —
50% агглютинации.
d)
видимая на глаз агглютинация, но без просветления жидкости и
без заметного оседания микробной взвеси; обозначается одним (+) крестом
— 25% агглютинации.
e)
равномерно мутная жидкость без просветления; обозначается
знаком минус (-). Антиген может осаждаться на дно пробирки точечкой, не
образуя "зонтика". При встряхивании осадок легко поднимается вверх в виде
косички.
За титр антител принимают последнее разведение сыворотки, в котором
наступила агглютинация не менее чем на 2 креста (++).
При серологической диагностике бруцеллёза в разных странах возможно
применение нестандартных антигенов, поэтому при исследовании одной и
той же сыворотки могут быть получены неодинаковые результаты. По
решению Комитета экспертов биологической стандар-тизации ВОЗ
определение степени агглютинации рекомендуют производить по стандарту
мутности, а результаты реакции выражать в международных единицах (ME).
Комитет экспертов ВОЗ по биологической стандартизации установил
международную стандартную сыворотку, которая в 1 мл содержит 1000 ME.
Эта сыворотка получена от коров, экспериментально заражённых В. abortus
544 (1 биовар).
Каждая страна должна иметь национальную сыворотку, подтитрованную
к международной и содержащую 1000 МЕ/мл.
Количество международных единиц в сыворотке определяется по
формуле (а × б) / в = количество МЕ/мл, где а — количество ME в
стандартной сыворотке, б — титр исследуемой сыворотки, в — титр
стандартной (национальной) сыворотки.
Стандарт мутности готовят и ставят в термостат одновременно с одной
реакцией. Степень просветления в пробирках с исследуемыми сыворотками
определяют визуально путем сравнения со стандартами и результаты
выражают в крестах.
Титром сыворотки является максимальное её разведение, дающее 50 %
агглютинации — просветления, оцениваемое на два креста (++). При
применении стандартизированного диагностикума титры исследуемых
сывороток соответствуют количеству международных еди-ниц антител
(МЕ/мл). Так, титры 1:50, 1:100, 1:200 и т.д. соответственно равны 50, 100,
52
53.
200 и т.д. МЕ/мл.При оценке результатов РА рекомендуется следующая схема:
• титр сыворотки 1:25 - результат сомнительный;
• титр сыворотки 1: 50 - 1:100 - 1:200 - результат положительный;
• титр сыворотки 1: 400 и выше - результат резко положительный.
Центрифужный метод постановки реакции агглютинации можно
применять для быстроты получения результатов. Техника постановки ничем
не отличается от классической. Однако разведение сыворотки следует делать
в коротких пробирках, чтобы они свободно входили в центрифужные гнезда.
После добавления антигена штативы с исследуемыми пробами
помещаются в термостат при 37°С. Спустя 30 минут пробы центрифугируют
при 3000 оборотов 5 минут; 1000-1500 оборотов -20-15 минут. Учёт
результатов реакции проводят сразу после центрифугирования. В
положительных реакциях жидкость становится прозрачной, на дне пробирки
образуется плотный осадок с ровными краями; при встряхивании он с трудом
разбивается на мелкие комочки или хлопья. При отрицательной реакции,
несмотря на центрифугирование, полного просветления жидкости не
происходит. Микробы осаждаются в центре пробирки, образуя осадок в виде
пуговки, который при встряхивании легко поднимается кверху в виде
косички, образуя равномерную муть.
Для практической повседневной работы, особенно при массовых
исследованиях, незаменим микрометод постановки РА, благодаря которому
упрощается и ускоряется постановка реакции, отпадает необходимость в
применении большого количества посуды (один планшет может заменить 96
пробирок, концевых пипеток) и их последующей обработке, легко
обеспечивается воспроизводимость, стандартизация и объективность
результатов, сокращается использование ингредиентов в 10 раз. Результаты
обоих вариантов (в пробирках и микрометода) полностью совпадают.
Постановка
реакции
в
микрообъёмах
осуществляется
с
использованием микротитратора Такачи или пипеточных дозаторов (одно-4-8
канальных) в планшетах для иммунологических реакций методом равных
объёмов (0,05 мл антигена + 0,05 мл сыворотки). Во все лунки, кроме первой,
наливают по 0,05мл карболизированного физиологического раствора.
Добавляют сыворотку, разведённую 1:12,5 по 0,05 мл в 1-ю, 2-ю, и 8-ю
(контроль сыворотки) лунки. Затем исследуемую сыворотку титруют в 6
лунках (со 2-ой по 7-ю). Из предпоследней 7-й лунки оставшиеся после
титрования 0,05 мл жидкости выливают в дезраствор.
Таким образом, в лунках получают разведение сыворотки 1:12,5-1:800.
Исходную взвесь стандартизированного диагностикума разводят как обычно
в 10 раз карболизированным физиологическим раствором и добавляют по
0,05 мл во все лунки, кроме 8-й, в результате чего объём будет равен 0,1 мл.
Соответственно изменяется (удваивается) и разведение сыворотки, т.е.
получается 1:25- 1:1600.
53
54.
Как и при обычной методике ставят два контроля:1. контроль сыворотки (последняя 8-я лунка) — с каждой испытуемой
сывороткой;
2. контроль антигена — для каждой новой его серии, но один для всех
групп исследуемых сывороток (0,05 мл физиологического раствора +
0,05 мл диагностикума).
Сыворотки с антигеном смешивают путём лёгкого встряхивания
планшет, обязательно закрывают крышкой и помещают в термостат на 16-20
часов. На следующий день учёт результатов реакции: положительная реакция
— агглютинация в виде "зонтика"; отрицательная — голубой осадок на дне
лунки в виде точечной пуговки.
Роз-Бенгал проба (РПБ).
Установлено, что в кислой среде неспецифическая агглютинация
блокируется, тогда как выраженность специфической реакции не изменяется.
В США, а затем и у нас, была разработана пластинчатая реакция
агглютинации с плазмой крови и кислым забуференным (рН 3,6) антигеном,
окрашенным бенгальским розовым, Роз-Бенгал проба (РБП), которую по
рекомендации Комитета ФАО/ВОЗ применяют для диагностики бруцеллёза
животных и людей почти во всех странах мира.
РБП обладает способностью в короткие сроки после заражения выявлять
специфические антитела и, благодаря реакции антигена, ингибировать
проявления неспецифических антител. Она отличается простотой
постановки, чёткостью, быстротой, стабильностью результатов. В
медицинской практике РБП рекомендуется использовать как дополнительный
экспресс-метод в комплексе с другими серологическими реакциями для
выявления скрытых форм бруцеллёза.
Компоненты для РБП: 1) испытуемые сыворотки; 2) положительная
агглютинирующая бруцеллёзная и негативная сыворотка; 3) антиген для РБП,
представляющий собой суспензию в буферном растворе инактивированных
нагреванием и фенолом бруцелл, окрашенных бенгальским розовым.
Стандартный антиген агглютинируется на 4 креста с сывороткой 100 ME, 1-2
креста — с сывороткой 50 ME и не дает реакцию с сывороткой 28,5 ME.
Реакцию проводят на чистых сухих металлических эмалированных
пластинках или изразцовых плитках с лунками при комнатной температуре.
Исследуемые сыворотки крови в дозе 0,02 - 0,03 мл вносят на дно лунки,
затем в каждую лунку — равное количество антигена, тщательно смешивают
активными движениями ручного полисмесителя на 5 или 25 проб или
стеклянной палочкой до получения однородной смеси, распределяя её при
этом по всей поверхности лунки.
Пластинку покачивают в течение 4 минут осторожными вращательными
движениями вручную или при помощи автоматического прибора,
предназначенного для этой цели. При положительной реакции появляются
54
55.
хлопья агглютината розового цвета, чётко выделяющиеся на белом фонелунки. Агглютинацию, наступившую позже 4 минут, не учитывают. При
отсутствии агглютинации (смесь гомогенна, равномерно окрашена) реакцию
считают отрицательной. Параллельно ставят контроль антигена с нормальной
(отрицательной) и положительной агглютинирующей сыворотками в тех же
дозах, а также контроль антигена на спонтанную агглютинацию (к 0,03 мл
антигена добавляют 0,03 мл физиологического раствора).
После учёта реакции пластинки дезинфицируются погружением на 5
минут в 3% раствор фенола или 1% раствор хлорамина, затем тщательно
промывают водопроводной водой, высушивают и используют повторно. При
нечётко выраженной агглютинации проводят повторное исследование.
При получении резко положительной РБП, как показывает практика,
титры антител в РА будут не менее чем 1:50 - 1:100. Если РБП будет
отрицательной, а РХ положительной, то РА также будет отрицательной или её
титры не превысят 1:25. Сыворотки, с которыми получены отрицательные
результаты в РХ и РБП, в РА не исследуют.
Модификация реакции агглютинации с использованием Роз-Бенгал
антигена (МРБП)
На полоску быстро- и среднефильтрующейся фильтровальной бумаги,
отступая от нижнего края на 2 см, наносят последовательно не более 6 капель
(по 0,02 мл) окрашенного антигена на расстоянии 2 см друг от друга. После
впитывания пятен, не допуская их высыхания, туда же наносят каплю
исследуемых сывороток. Обязательны два контроля: положительная
агглютинирующая сыворотка с высоким титром и отрицательная. Полоски
фильтрованной бумаги в вертикальном положении сразу же опускают в
физиологический раствор с 1% раствором карболовой кислоты, закрепляя
полоски таким образом, чтобы пятна оставались над поверхностью
жидкости. Учёт результатов осуществляют визуально в течение 5 минут. При
резко положительном результате реакции пятно антигена не вымывается,
интенсивность окраски сохраняется, его контуры остаются чёткими,
окрашенного столбика нет, при положительном - антигенное пятно частично
размыто, но контуры его сохранены, столбик не превышает 1 -2 см. При
отрицательном результате антиген вымывается в столбик 5-7 см, контуры
исчезают.
МРБП имеет ряд преимуществ: фильтровальные полоски являются
документированным подтверждением, т.к. полоски бумаги можно высушить
и сохранить; метод технически прост, легко воспроизводим в любых
условиях с минимальной затратой труда и времени, дает чёткие результаты и
устраняет субъективизм при их оценке, одновременно сочетая в себе
чувствительность и специфичность. Если результат МРБП резко
положительный, то в РА и РПГА антитела будут обнаружены в высоких
титрах. При положительной МРБП титры РА и РПГА не превысят 1:50.
Таким образом, сочетание двух качественных реакций (РХ и РБП) или
55
56.
одна МРБП в экстренных случаях, когда требуется срочный ответ, помогаютклиницисту быстро оценивать активность процесса и поставить диагноз с
большой степенью достоверности без предварительного анализа титров
антител.
Антиглобулиновая проба Кумбса
В диагностике бруцеллёза у людей и животных, особенно при
хроническом течении инфекции, когда реакция аглютинации может быть
отрицательной или положительной в низких титрах, важное место следует
отвести выявлению неполных антител. При постановке реакции Кумбса
используют предварительно оттитрованную антиглобулиновую сыворотку
против глобулинов человека (например, антиглобулиновая сыворотка,
применяемая для выявления резус антител или сыворотка для иммуноэлектрофореза против глобулинов человека). В начале ставят реакцию
агглютинации (Райта). После её учёта (через 20 часов) берут не менее трех
пробирок первых разведений при отрицательном результате или не менее
трех пробирок, начиная со слабо положительного результата (+, ++). Эти
пробирки центрифугируют при 3000 об/мин, в течение 20 минут для
осаждения антигена. Недостаточную жидкость осторожно отсасывают с
помощью пастеровской пипетки и отбрасывают, затем в каждую пробирку
наливают по 1 мл физиологического раствора, тщательно встряхивают и
снова центрифугируют, к осадку отмытого антигена добавляют 0,5 мл
антиглобулиновой сыворотки в рабочем титре, пробирки тщательно
встряхивают и помещают в термостат на 18-20 часов. Учёт реакции проводят
так же, как при реакции агглютинации.
Контроль антиглобулиновой сыворотки: наряду с испытуемыми
сыворотками берут в опыт сыворотку, содержащую неполные антитела с
известным титром.
Контроль антигена: взвесь антигена в физиологическом растворе
подвергают отмыванию центрифугированием, как в основной реакции, после
чего добавляют 0,5 мл антиглобулиновой сыворотки. При учёте реакции в
контроле антигена наблюдается равномерное помутнение.
Для титрования антиглобулиновой сыворотки (против глобулинов
человека) необходимо иметь сыворотку крови человека, заведомо
содержащую неполные антитела к бруцеллам в высоком титре.
Вначале титруют положительную бруцеллёзную сыворотку в реакции
агглютинации (Райта). При этом делают несколько рядов разведений
сыворотки (приблизительно -8 рядов). (Схема 1).
После учёта РА во всех рядах отбирают пробирки, в которых отсутствует
агглютинация (в схеме 1 — начиная с 1:400) и отмывают антиген согласно
методике постановки реакции Кумбса. Затем (схема 2) делают несколько
разведений титруемой антиглобулиновой сыворотки (в нашем примере от
1:10 до 1:250) и добавляют по 0,5 мл каждого разведения этой сыворотки в
56
57.
один ряд пробирок с оставшимся после отмывания антигеном. Объёмжидкости в пробирках должен быть равен 0,5 мл. Пробирки встряхивают и
помещают в термостат при 37°С. Результаты учитывают так же, как реакцию
агглютинации. За титр антиглобулиновой сыворотки принимают её
наибольшее разведение (в нашем примере 1:80 - 4 ряд), которое выявляет
неполные антитела в максимальном титре (1:3200). Для реакции Кумбса
антиглобулиновая сыворотка применяется в удвоенном титре (1:40).
Схема 1. Результаты реакции агглютинации
№№
рядов
Разведения сыворотки, содержащей неполные антитела
1:50
1:100
1:200
1:400
1:800
1:1600
1:3200
1:6400
1.
4+
4+
2+
-
-
-
-
-
2.
4+
4+
2+
-
-
-
-
-
3.
4+
4+
2+
-
-
-
-
-
4.
4+
4+
2+
-
-
-
-
-
5.
4+
4+
2+
-
-
-
-
-
6.
4+
4+
2+ .
-
-
-
-
-
7.
4+
4+
2+
-
-
-
-
-
8.
4+
4+
4+
-
-
-
-
-
Схема 2. Результаты реакции Кумбса
№№
рядов
Разведения
антиглобулиновой
сыворотки
Разведения сыворотки, содержащей неполные антитела
1:400
1:800
1:1600
1:3200
1:6400
1.
1:10
4+
4+
4+
4+
2.
1:20
4+
4+
4+
4+
-
3.
1:40
4+
4+
4+
4+
-
4.
1:80
4+
4+
3+
2+
-
5.
1:100
4+
3+
2+
-
-
6.
1:150
4+
3+
-
-
-
7.
1:200
3+
2+
-
-
-
8.
1:250
-
-
-
-
-
57
-
58.
Реакция непрямой гемагглютинации (РНГА)В отличие от общепринятых серологических реакций, где в качестве
диагностикумов применяют взвеси или экстракты микробных клеток, в РНГА
используют
эритроциты
барана,
сенсибилизированные
(после
соответствующей обработки) бруцеллёзным антигеном. Микробный или
растворимый антиген адсорбируется на поверхности эритроцитов, которые в
таком
«нагруженном»
состоянии
приобретают
способность
агглютинироваться специфичной иммунной сывороткой. Реакцию учитывают
по образованю агглютинированными эритроцитами осадка в виде зонтика на
дне планшеты, в то время как в контроле без иммунной сыворотки они
оседают в центре, образуя пуговку с ровными краями.
Гемагглютинирующие антитела обнаруживают у больных острым и
подострым бруцеллёзом в 90-100 % случаев. При хронических формах и
резидуальных явлениях они встречаются реже, однако значи-тельно чаще,
чем агглютинины. РНГА позволяет выявлять также антитела в сыворотке
крови людей, вакцинированных против бруцеллёза (в РА — в 7-10%, в РНГА
— в 25-33% случаев).
В последние годы при использовании коммерческих диагностикумов,
чувствительность которых колеблется в значительных пределах, титры
гемагглютининов, даже у больных острым бруцеллёзом, зачастую не
превышают таковые в РА. Поэтому в тех случаях, когда имеется
положительная РА и налицо клинические проявления бруцеллёза,
достаточные для постановки диагноза, подключать РНГА не надо.
Для постановки РНГА необходимо иметь: а) бруцеллёзный
эритроцитарный
антигенный
диагностикум;
б)
контрольные
(несенсибилизированные) эритроциты; в) нормальную сыворотку кролика; г)
бруцеллёзную сыворотку.
Для титрования сывороток применяют растворитель (стабилизатор) —
нормальная сыворотка кролика, инактированная при 56°С в течение 30 минут
и разведённая 1:100 - 1:150 забуференным (рН 7,0 - 7,2) физиологическим
раствором. В качестве стабилизатора используют также твин 1/10000 или
бычий сывороточный альбумин (БСА - 0,03%).
Испытуемые сыворотки разводят физиологическим раствором 1:25 (0,1
мл сыворотки + 2,4 мл физиологического раствора) и инак-тивируют в
течение 30 минут при 56°С. Перед исследованием сыворотки адсорбируют
50% взвесью контрольных эритроцитов. К 1,2 мл инактивированной
сыворотки добавляют 0,2 мл 50% взвеси эритроцитов, встряхивают и
оставляют на 30 минут при комнатной температуре. Затем смесь
центрифугируют при 1000-1500 об/минут. Можно оставить сыворотки с
эритроцитами на ночь в холодильнике (+4°С), в этом случае
центрифугирование исключается.
Эритроцитарный
диагностикум
перед
применением
разводят
58
59.
физраствором (рН 7,0-7,2) согласно указанию на этикетке и получают 2,5%или 0,5 % взвесь, которую применяют в РНГА. Контрольные
(несенсибилизированные) эритроциты также разводят до 0,5% или 2,5%
взвеси для контроля сывороток.
Реакцию ставят макро- или микро методом в прозрачных
полистироловых пластинках с лунками. Каждую сыворотку исследуют не
менее, чем в 6-8 разведениях, начиная с 1:25.
Микрометод: во все лунки разливают по 0,05 мл растворителя. Затем в
первую лунку (контроль сыворотки) вносят 0,05 мл испытуемой сыворотки,
предварительно инактивированной и разведённой 1:25, перемешивают и 0,05
мл выливают. Во вторую лунку также добавляют 0,05 мл испытуемой
сыворотки (1:25), перемешивают, переносят 0,05 мл в третью и титруют
сыворотку до конца ряда; из последней лунки 0,05 мл выливают. Таким
образом, получают ряд последовательных двукратных разведений
испытуемой сыворотки, начиная с 1:50, в объёме 0,05 мл.
В первые лунки добавляют 0,05 мл контрольных эритроцитов. В каждую
лунку, начиная со второй, добавляют по 0,05 мл 0,5% диагностикума.
Эритроциты и диагностикум следует добавлять так, чтобы капли не стекали
по стенке, а падали непосредственно в жидкость.
Пластины осторожно, но тщательно встряхивают до полного
перемешивания содержимого лунок, следя за тем, чтобы не было
разбрызгивания жидкости, и оставляют при комнатной температуре. Учёт
реакции проводят через два часа.
При постановке РПГА предусматривают контроли:
а) контроль качества растворителя проводят в двух лунках.
К 0,05 мл растворителя добавляют в первую лунку 0,05 мл 0,5% взвеси
диагностикума, во вторую - 0,05 мл контрольных эритроцитов;
б) контроль специфичности РНГП для каждой исследуемой сыворотки.
К 0,05 мл испытуемой сыворотки в наибольшей её концентрации (1:50)
добавляют каплю контрольных 0,5% несенсибилизированных эритроцитов. Во всех случаях эти контроли должны быть
отрицательными;
в) качество диагностикума проверяют путём титрования специфической
бруцеллёзной сыворотки (агглютинационный титр не ниже 1:1600), начиная с
разведения 1:50 до 1:51200. Затем в каждую лунку добавляют по 0,05 мл 0,5%
взвеси диагностикума.
При учёте результатов серологических реакций может быть применен
диагностикум, дающий реакции с бруцеллёзной сывороткой до титра ниже
чем 1:6400 - 1:12800,т.е. на 2-3 разведения выше, чем титр в РА.
Оценку реакции проводят по схеме:
++++ — эритроциты покрывают все дно лунки равномерным слоем,
иногда наблюдается зонтик;
+++ — эритроциты выстилают все дно лунки равномерным слоем, но
59
60.
площадь его меньше, чем при 4-крестовой реакции, зонтик также меньше;++ — агглютинат небольшой, расположен в центре лунки;
+ — вокруг осадка эритроцитов в центре виден небольшой агглютинат.
Отрицательная реакция - осадок эритроцитов на дне лунки в виде пуговки
или маленького колечка.
За титр сыворотки принимают её последнее (наибольшее) разведение с
агглютинацией не менее чем на три креста (+++). Оценка результатов
исследования сывороток на бруцеллёз в РПГА у людей 1:50 — реакция
сомнительная, титр 1:100 и выше — положительная. При записи результатов
РПГА следует указывать титр сыворотки.
Ошибки при постановке РПГА: не готовят забуференный (рН 7-2)
физиологический раствор; испытуемые сыворотки не истощают несенсибилизированными
формалинизированными
эритроцитами;
не
правильно разводят и используют стабилизирующий раствор, который
должен храниться не более 1-2 дней (при применении кроличьей сыворотки
или БСА, с твином - дольше).
Макрометод: сыворотку также исследуют не менее чем в 6-8
разведениях, начиная с 1:50. Сначала нормальную разведенную 1:100
инактивированную сыворотку кролика разливают во все лунки по 0,5 мл.
Затем в первую лунку (контроль сыворотки) вносят 0,5 мл испытуемой
сыворотки, предварительно инактивированной и разведённой 1:25,
перемешивают и 0,5 мл выливают. Во вторую лунку также добавляют 0,5 мл
испытуемой сыворотки (1:25), перемешивают, переносят, 0,5 мл в третью
лунку и титруют сыворотку до конца ряда, из последней лунки 0,5 мл
выливают в дезинфицирующий раствор.
Таким образом, получают ряд последовательных двукратных разведений
испытуемой сыворотки, начиная с 1:50, в объёме 0,5 мл.
В первые лунки (контроль сыворотки) добавляют микропипеткой по 0,5
мл контрольных эритроцитов. Затем в каждую лунку, начиная со второй, с
помощью микропипетки добавляют по 0,05 мл диагностикума. Пластины
осторожно встряхивают для дополнитель-ного перемешивания содержимого
лунок, следя, чтобы не было разбрызгивания жидкости, и оставляют при
комнатной температуре. Учёт реакции проводят через 2 часа.
При постановке РПГА предусматриваются следующие контроли:
а) контроль качества нормальной сыворотки кролика (1:100) проводят в
двух лунках. К 0,5 мл сыворотки добавляют в первую лунку 0,05 мл 2,5%
взвеси диагностикума, во вторую - 0,05 мл контрольных эритроцитов;
б) качество диагностикума проверяют путём титрования специфической
бруцеллёзной сыворотки, начиная с разведения 1:50 до 1:100000. Затем в
каждую лунку добавляют по 0,05 мл 2,5% взвеси диагностикума.
Реакция считается специфической, если в контролях исследуемых и
контрольной сыворотки отсутствует гемагглютинация, а титр специфической
сыворотки и реакция будет соответствовать титру, указанному на этикетке
60
61.
флакона эритроцитарного диагностикума.Оценка реакции проводится по такой же схеме, что и микрометод:
4+ — эритроциты покрывают все дно лунки равномерным слоем, иногда
наблюдается зонтик.
3+ — эритроциты выстилают все дно лунки тонким равномерным слоем,
но площадь его меньше, чем при 4-х крестовой реакции, размеры зонтика
также меньше.
2+ - агглютинат небольшой, расположен в центре лунки.
1 + — вокруг осадка эритроциты в центре виден небольшой агглютинат.
Отрицательная реакция — осадок эритроцитов на дне лунки в виде
пуговки или маленького кольца.
За титр сыворотки принимают её последнее разведение с оценкой
реакции не менее чем 3+. Оценка результатов исследования сывороток на
бруцеллёз в РПГА у людей: титр 1:50 - реакция сомнительная, титр 1:100 и
выше - реакция положительная. При записи результатов РПГА следует
указывать титр сыворотки.
Примечание: В целях экономии диагностикума можно сначала добавить
лишь в 2-3 первые лунки, а при получении положительного результата внести
его во все остальные лунки, чтобы при повторном учёте реакции через
следующие 2 часа получить окончательный титр сыворотки.
Реакция нейтрализации антигена (РНАг) применяется для выявления
полных и неполных антител, где в качестве диагностикума используют полии моноклональные бруцеллёзные сыворотки, "насаженные" на эритроциты.
Сущность РНАг — в специфической нейтрализации добавляемого антигена в
количестве 2АЕ. Предварительное исследование материала проводят
макрометодом.
При проведении реакции в 1 лунке в нее вносят 0,2 мл исследуемой
сыворотки в разведении 1:10, а при постановке в 2-х лунках, в первую вносят
0,4 мл сыворотки в разведении 1:10, во вторую - 0,2 мл раствора твина в
разведении 1:10000-1:25000 или НКС в разведении 1:150, и из первой лунки
0,2 мл переносят во вторую, а лишние 0,2 мл удаляют. Затем во все лунки
добавляют по 0,2 мл взвеси убитой культуры бруцелл с содержанием в этом
объёме 2АЕ (см.ниже).
Смесь оставляют на 30 минут при температуре 37 ± 0,5°С или на 1 час
при температуре 22± 4° С, после чего в лунки добавляют по 0,05 мл
диагностикума бруцеллёзного иммуноглобулинового. Содержимое лунок
гомогенизируют покачиванием пластины и оставляют её на 2-3 часа при
температуре 22 ± 4°С, после чего учитывают результат. Его учитывают
знаком "-", но оценивают как положительный, т.е. это является
свидетельством наличия в исследуемой сыворотке специфических антител.
При установлении наличия антител в предварительном опыте проводят
РНАг в развернутом ряду макро - или микрометодом.
61
62.
РНАг (макрометод). В 8-10 лунок пластины вносят по 0,2 млстабилизатора. В первую лунку вносят 0,2 мл исследуемой сыворотки в
разведении 1:10 и делают последовательные двукратные разведения
переносом по 0,2 мл, исключая последнюю лунку. Из предпоследней лунки
лишние 0,2 мл удаляют. Затем во все лунки добавляют по 0,2 мл убитой
культуры бруцелл с содержанием в этом объёме 2 АЕ антигена, оставляют на
30 минут при темпера-туре (37± 0,5) °С. Затем добавляют по 0,05 мл
диагностикума, содержимое лунок встряхивают постукиванием о край
пластины и оставляют при температуре (22± 4) °С. Учёт проводят через 2-3
часа. Последнюю лунку с отсутствием гемагглютинации учитывают как титр
сыворотки, при этом титр антител в первой лунке принимают за 1:40.
Учитывая важность соответствия добавляемого количества антигена
2АЕ, определение величины АЕ и её контроль следует проводить при каждой
постановке РНГА.
Определение величины АЕ проводят следующим образом: проводят
РНГА в 6 лунках с добавлением в первую лунку взвеси убитой культуры
бруцелл концентрацией 1х107м.к.в 1 мл. Последняя лунка с положительной
гемагглютинацией содержит 1 ME. Например: последняя такая лунка 4-я.
Отсюда 1АЕ содержит 250000 м.к. в 0,4 мл или 625000 м.к. в 1 мл. Чтобы
получить рабочую взвесь, содержащую в 0,2 мл 2 АЕ антигена, концентрация
в 1мл должна быть равной 2,5х106 м.к.
Контроль рабочей взвеси, добавленной в РНАг, проводят при каждом
проведении реакции. Для того её испытывают в РНГА в 5-6 лунках. При
правильном её приготовлении полноценная гемагглю-тинация должна быть в
2-х лунках. При положительной РНГА в одной лунке (добавлено 1 АЕ) титр
сыворотки снижают в два раза, при положительной реакции более, чем в 3-х
лунках, или отсутствии даже в одной лунке, готовят свежую рабочую взвесь
антигена с её контролем и перестановкой РНАг.
Учёт результатов. Результат РНАг считают положительным в
максимальном разведении материала, когда эритроциты выпадают в виде
"пуговки" или узкого колечка с ровным краем. Его учитывают знаком "-"
(минус), но оценивают как положительный, что является свидетельством
наличия в исследуемой сыворотке специфических антител. При
отрицательном результате РНАг эритроциты выпадают равномерным слоем,
занимая не менее 2/3 специфической поверхности лунки.
РНАг (микрометод). 18 лунок микротитровальной пластины вливают по
0,025 мл стабилизатора. Затем в первую лунку добавляют по 0,025 мл
исследуемой сыворотки в разведении 1:10 и делают последовательные
двукратные разведения переносом по 0,025 мл из первой по последнюю
лунки, из которых лишние 0,025 мл удаляют. Последняя лунка - контрольная
проба. После этого во все лунки добавляют по 0,025 мл взвеси культуры
бруцелл с содержанием в этом объёме 2АЕ. Пластины оставляют на 30 минут
при тем-пературе (37± 0,5) °С или на 1 час при температуре (22 ± 4) °С. Учёт
62
63.
результатов проводят через 2-3 часа после добавления препарата. Последнююлунку с отрицательной гемагглютинацией учитывают как титр сыворотки,
при этом титр антител в первой лунке принимают за разведение 1:40.
Контроль рабочей взвеси убитой культуры бруцелл проводят при каждом
проведении РНАг, аналогично как при проведении РНАг макрометодом.
Проводят РНГА в объёме 0,05 мл с использованием убитой культуры бруцелл
концентрацией 1 × 108 м.к. в 1мл. Последняя лунка с положительным
результатом РНГА равна 1 АЕ. Например, при проведении РНГА последняя
лунка с положительной гемагглютинацией была 4-ой, что соответствует
6,25x106 м.к. в 1 мл. Для получения 2 АЕ в объёме 0,025 мл нужно взять
микробную взвесь 1x108 м.к. развести в 4 раза.
Учёт результатов: РНАг считается положительным в максимальном
разведении материала, когда эритроциты выпадают на дно лунок в виде
"пуговки". Его учитывают знаком "-" (минус), но оценивают как
положительный. При отрицательной РНАг эритроциты выстилают дно лунок
равномерным слоем.
Иммуноферментный анализ (ИФА)
Метод используют для диагностики всех форм заболевания, а также при
эпидемиологическом обследовании населения и при отборе лиц для
вакцинации против бруцеллёзной инфекции.
Для постановки ИФА используют диагностическую тест-систему,
иммуноферментную для определения бруцеллезных антител. Выявление
специфических антител в сыворотках людей происходит за счёт
взаимодействия бруцеллезного антигена (ЛПС), адсорбированного на
полистироловом планшете (плоскодонном) с антителами исследуемой
сыворотки. Образовавшийся комплекс «антиген + антитело» выявляют с
помощью антител против иммуноглобулинов человека, меченных
пероксидазой хрена.
Тест-система представляет собой набор ингредиентов для проведения
ИФА на твердофазном носителе и включает в себя: бруцеллёзный ЛПС (либо
планшет, сенсибилизированный этим антигеном), антитела против
иммуноглобулинов
человека,
меченных
пероксидазой
(конъюгат),
контрольные (положительную и отрицательную) сыворотки человека, набор
солей, необходимых для приготовления буферных растворов, субстрат —
ортофенилиндиамин (ОФД). Твин-20, бычий сывороточный альбумин (БСА),
планшеты для ИФА однократного применения.
Техника постановки ИФА
Сенсибилизация твёрдой фазы. В лунки планшета вносят с помощью
дозатора по 200 мкл раствора бруцеллезного антигена в концентрации 10
мкг/мл в 0,02М растворе фосфатно-солевого буфера (ФСБ), pH 7,2.
Адсорбцию антигена на планшетах проводят в течение 2 часов в термостате
при температуре 37 °C или при 4 °C в течение 18 часов. Затем антиген
63
64.
удаляют встряхиванием планшета с последующей трехкратной отмывкой (по5 мин.) раствором ФСБ, содержащим 0,1% детергента - твит-20.
Внесение исследуемого материала. Испытуемые сыворотки, разведенные
1:200, вносят по 100 мкл в первую лунку ряда и далее последовательно путем
двукратных разведений на ФСБ + твин, содержащий 1% бычьего
сывороточного альбумина (БСА), раститровывают. Параллельно на каждом
планшете ставят отрицательный и положительный контроль. Планшеты
встряхивают и выдерживают при 37 °C в течение 1 часа. После чего жидкость
удаляют и отмывают планшеты, как указано в п. 1.
Внесение конъюгата. В каждую лунку планшета вносят по 100 мкл
раствора конъюгата в рабочем разведении (конъюгат разводят на ФСБ + твин
и 1% БСА). Планшеты помещают в термостат на 40 мин., после чего
жидкость удаляют, а планшеты отмывают 4 - 5 раз, как указано в п. 1.
Проявление реакции. В каждую лунку вносят по 100 мкл субстратного
раствора, содержащего 0,04% ОФД и 0,04% H2O2 в 0,1М цитратнофосфатном буфере, pH 5,5. Инкубацию проводят при комнатной температуре
15 - 30 мин. и останавливают реакцию внесением 50 мкл 0,5 моль/л серной
кислоты.
Учёт и оценка результатов ИФА. Результат реакции можно учитывать
визуально с помощью сравнивания окраски в опытных и контрольных
лунках, а также с помощью спектрофотометра типа Multiscan при длине
волны 492 нм. Появление желто-оранжевого окрашивания в опытных лунках
при его отсутствии в лунках с отрицательными контролями свидетельствует о
положительной реакции. При фотометрическом учете результатов проба
считается положительной, если оптическая плотность (ОП) в 2 и более раз
превосходит наивысшее значение ОП отрицательных контролей.
Диагностическим титром в ИФА считается разведение сыворотки более
чем 1:400.
Использование ИФА в эпидемиологической практике. При проведении
массовых обследований на бруцеллез для постановки ИФА может быть
использована не сыворотка крови, а цельная кровь. Для этого кровь из
пальца, с помощью микропипетки, в объеме 10 мкл вносится в
микропробирку с физиологическим раствором в объеме 1 мл. Пробирку
встряхивают и затем либо центрифугируют при 1000 об./мин. 5 мин., либо
дают отстояться в холодильнике при 4 °C в течение 18 часов. Таким образом
получают разведение сыворотки 1:200. Для постановки ИФА используют
надосадочную жидкость. ИФА как скрининг-тест можно ставить в 2 лунках
микропланшета, при получении сомнительного или положительного
результата ИФА повторяют в количественном варианте с последующей
раститровкой надосадочной жидкости. При получении положительного
результата необходимо исследовать сыворотку крови.
64






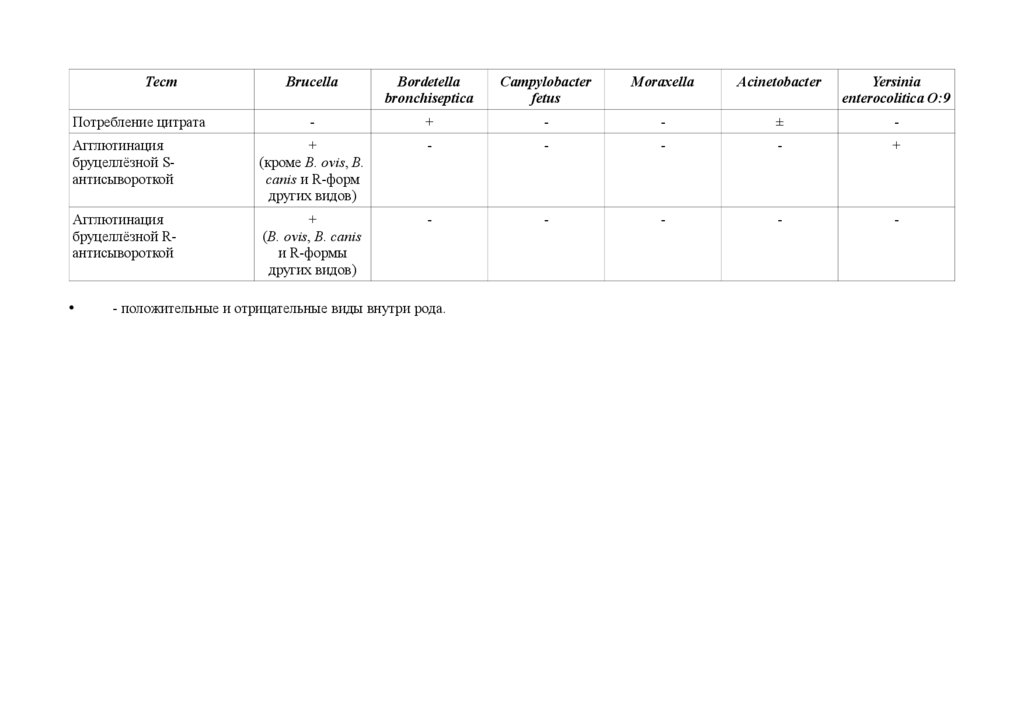












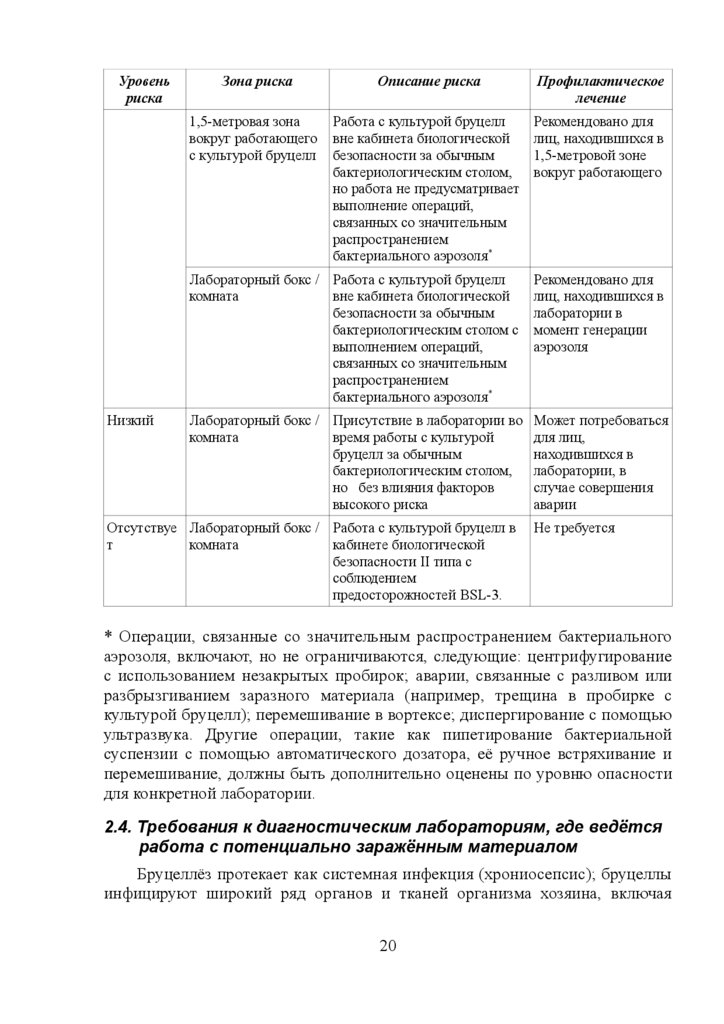















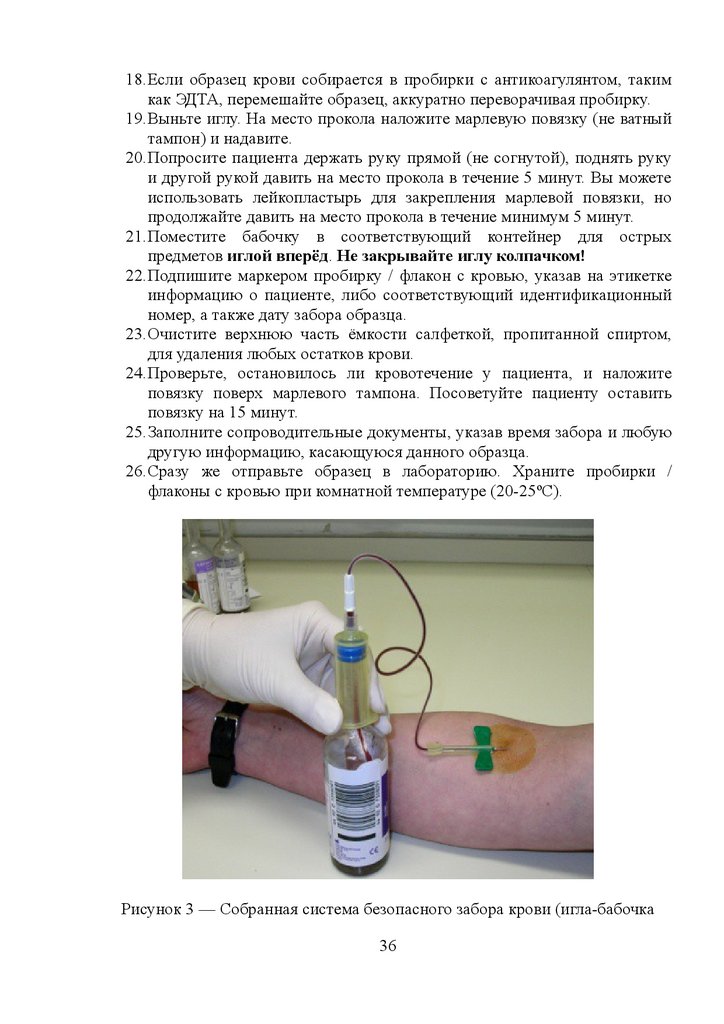




























 Медицина
Медицина








