Похожие презентации:
Изменчивость бактерий. (Лекция 4)
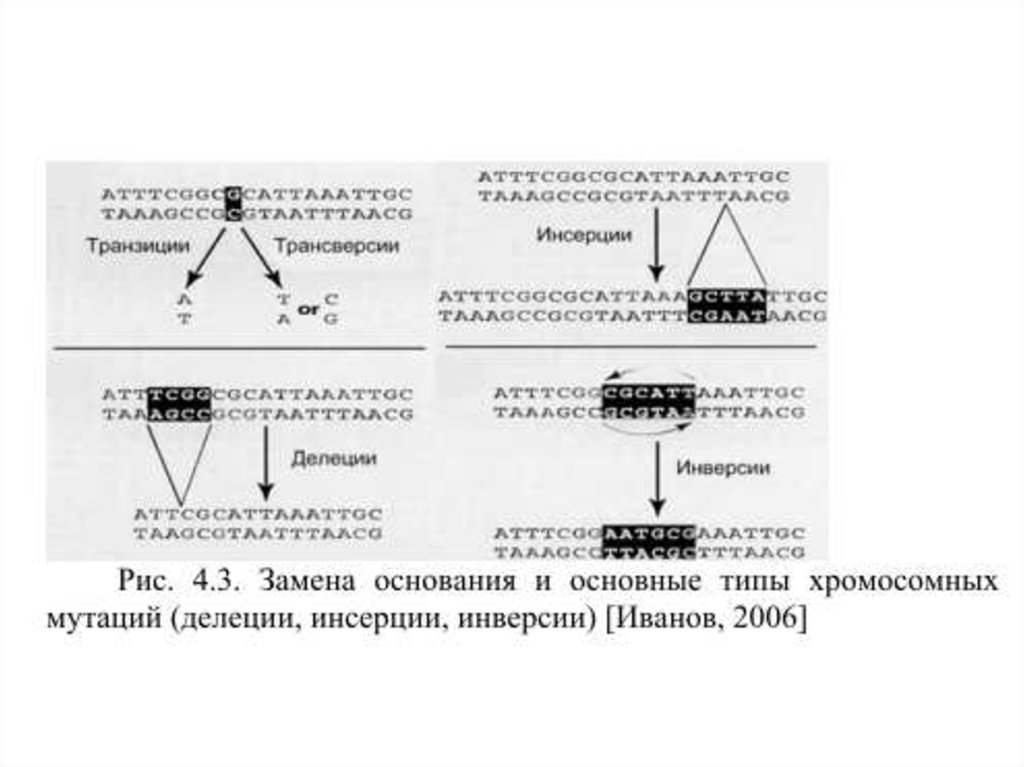
1.
2.
3.
4.
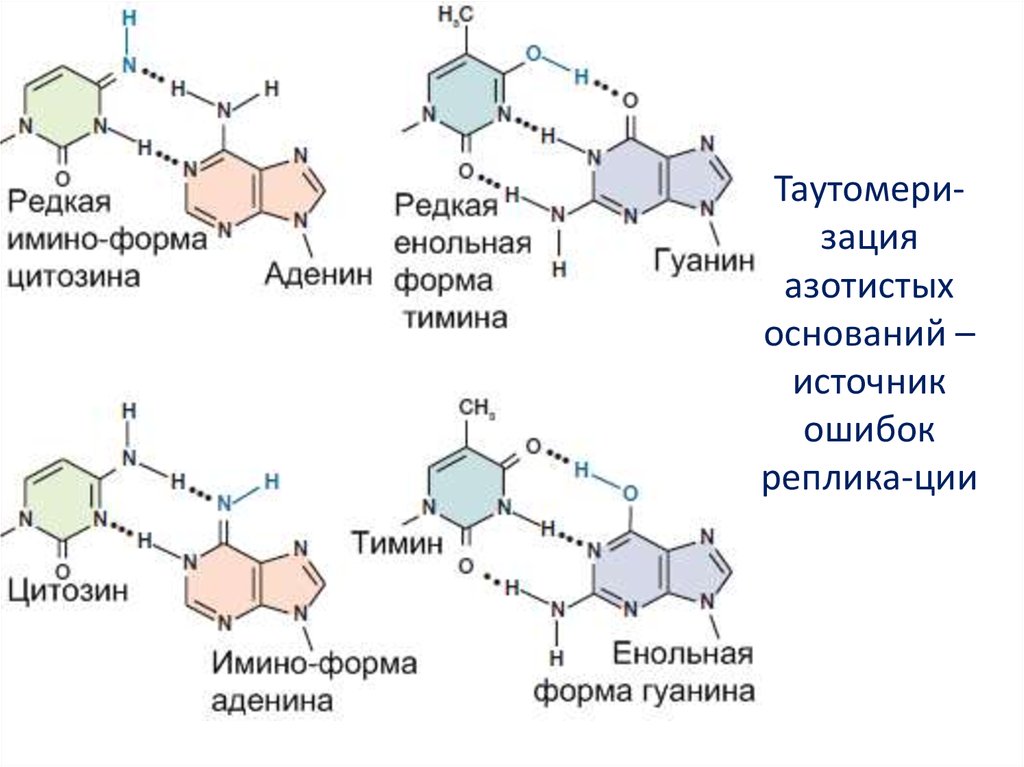
5. Таутомери-зация азотистых оснований – источник ошибок реплика-ции
Таутомеризацияазотистых
оснований –
источник
ошибок
реплика-ции
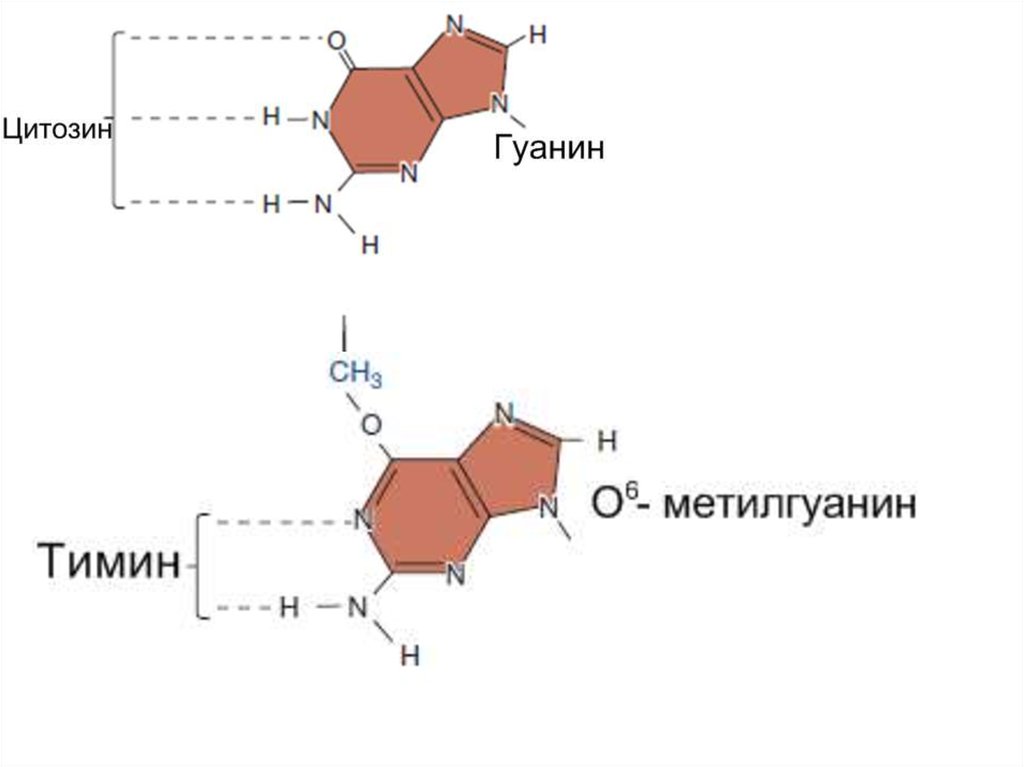
6. Енолизация гуанина
Временная енолизация гуанина приводит к формированиюGC – AT транзиции (мутант). Мутация проявляется во втором
поколении, если GT не будет репарирована в первом поколении.
7. Мутагены
МутагенЭффект
5-Бромурацил
Аналог основания
2-Аминопурин
Аналог основания
Этил метансульфонат
Алкилирующий агент
Оксид азота
Дезаминирующий агент
Профлавин
Интеркалирующий агент
Акридин оранжевый
Интеркалирующий агент
УФ-излучение
Формирование пиримидиновых димеров
Гамма-излучение
Делеции оснований, одноцепочечные
разрывы, сшивки ДНК, хромосомные
разрывы.
8. 5-Бром урацил
9.
10. Мутагены
11. Тиминовые димеры
12. Репарация ДНК
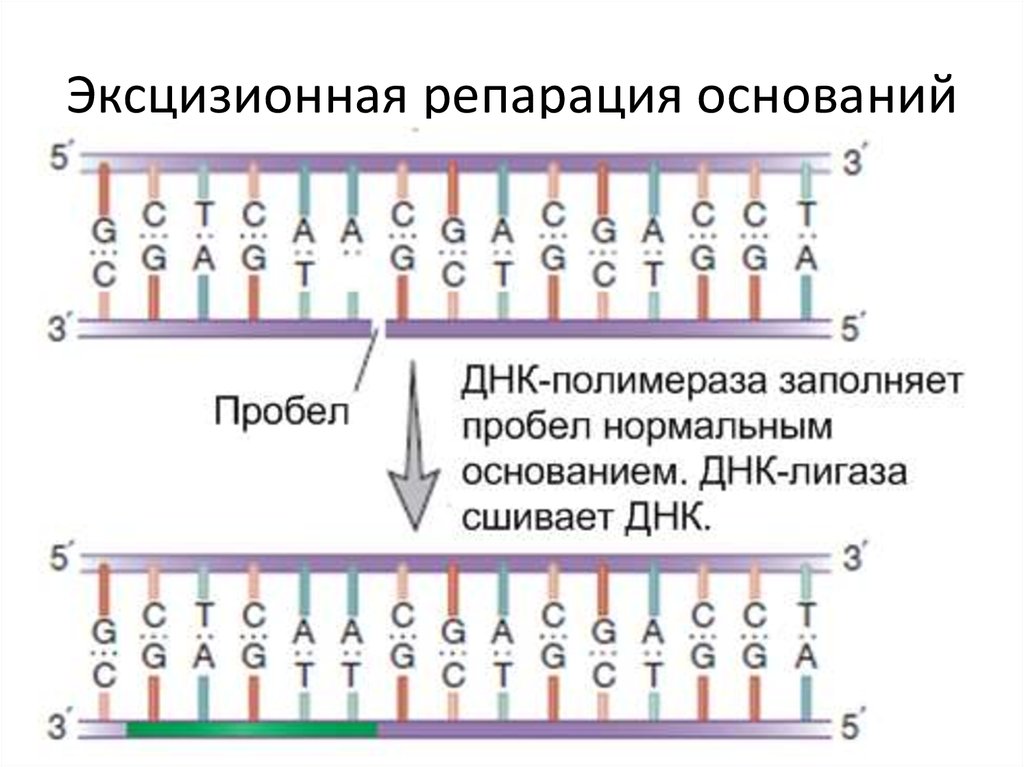
• Клетки имеют механизмы исправляющие повреждения ДНК.• Эксцизионная репарация – исправляет повреждения одной из
цепей (пиримидиновые димеры, АР-сайты и т.д.), использует
вторую цепь в качестве матрицы для заполнения пробелов.
• Фотореактивация в ответ на возникновение повреждений
(пиримидиновых димеров).
• Репарация неспаренных нуклеотидов (mismatch repair).
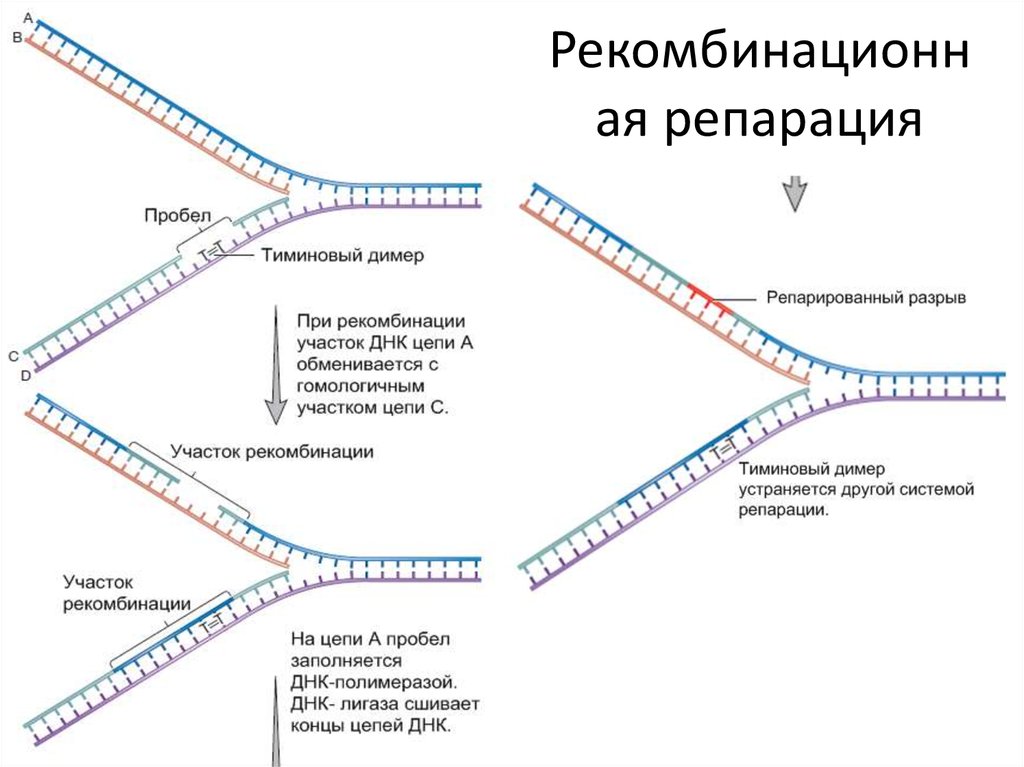
• Рекомбинационная
неповрежденная цепь).
репарация
• SOS-репарация.
При
множественных
останавливается синтез ДНК.
(используется
повреждениях
13.
14. Эксцизионная репарация оснований
15. Рекомбинационная репарация
Рекомбинационная репарация
16. Репарация ДНК
SOS-репарация.• При
множественных
повреждениях
останавливается
репликация ДНК. Это вызывает активацию регулона
содержащего до 20 генов, участвующих в процессе репарации.
• Синтез ДНК при SOS-репарации подвержен ошибкам что
приводит к повышению частоту мутаций (непрямой мутагенез).
Возможно
это
увеличивает
частоту
положительных,
адаптивных мутаций в популяции бактериальных клеток.
17. Рост генетического разнообразия
Рекомбинация.• Генетический материал разных молекул ДНК комбинируется
в гибридной молекуле ДНК.
• У эукариот – рекомбинация в мейозе. У прокариот –
рекомбинация 3 типов, по молекулярным механизмам схожа с
рекомбинацией эукариот.
Горизонтальный перенос генов.
• Конъюгация.
• Трансформация.
• Трансдукция.
18. Рекомбинация у прокариот
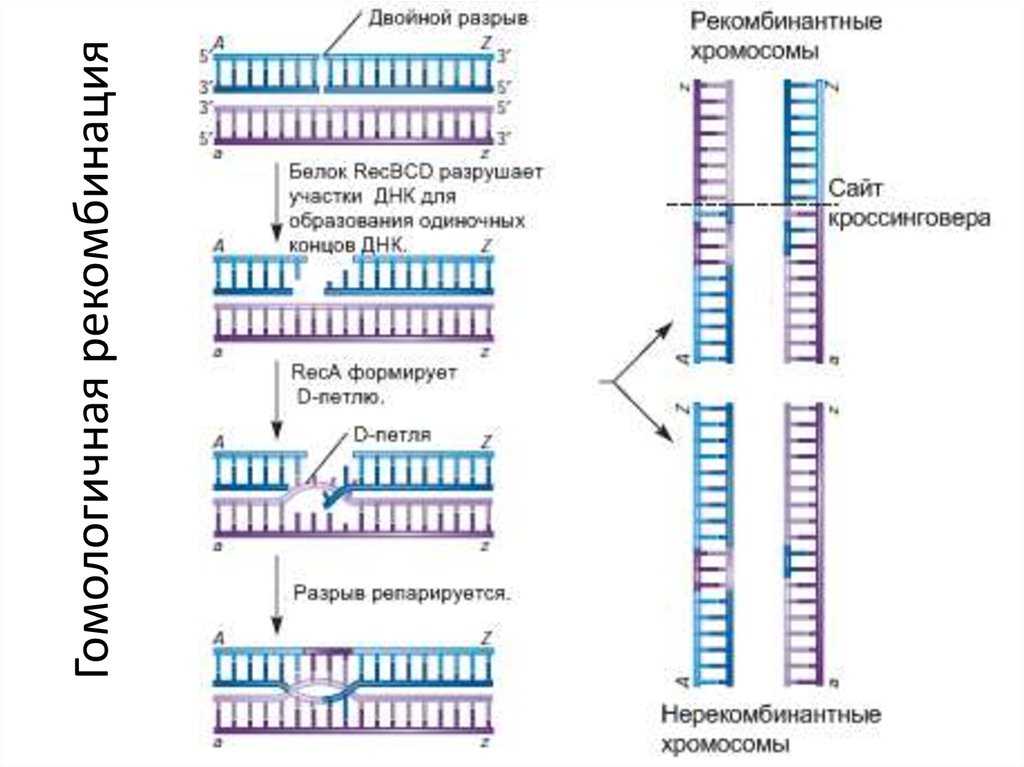
• Гомологичная рекомбинация. Реципрокный обмен участкамихромосом
с
аналогичными
нуклеотидными
последовательностями. Возможен нереципрокный обмен с
короткими участками ДНК.
• Сайт-специфическая рекомбинация. Интеграция многих
вирусных геномов. Донор имеет небольшой участок,
гомологичный ДНК хозяина.
• Транспозиция. С участием мобильных элементов генома.
19. Гомологичная рекомбинация
20. Нереципрокная гомологичная рекомбинация
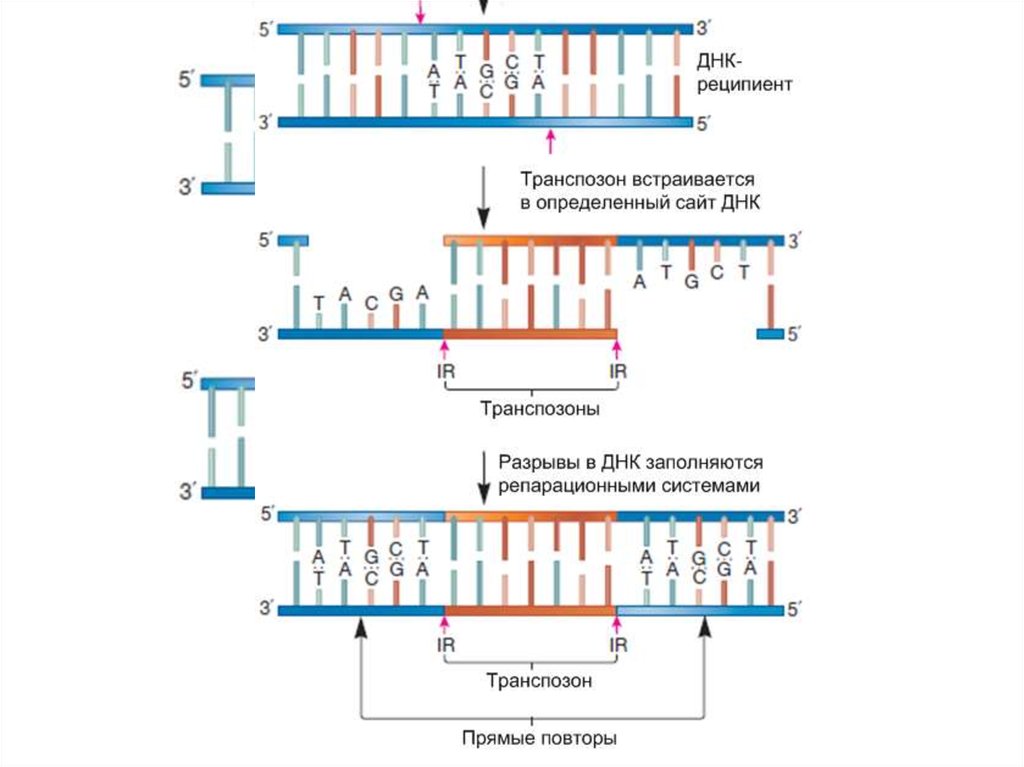
21. Транспозиция
• Рекомбинация не зависящая от гомологии участков ДНК.• Происходит во многих сайтах генома.
• Происходит с участием мобильных элементов генома –
транспозонов.
• Мобильные элементы могут
хромосомной и нехромосомной ДНК.
перемещаться
между
• Мобильные элементы внедряются в геном хозяина, меняя
генную структуру или подчиняя экспрессию генов новым
регуляторным элементам.
22. Транспозоны
Транспозоны:• Инсерционные (IS);
• Составные (Tn) ;
• Репликативные.
Инсерционные и Составные перемещаются путем обычной
транспозиции (вырезать-вставить). Транспозаза катализирует
вырезание, участок опознавания составляет 5-9 п.н.
Репликативные
транспозиции.
–
посредством
репликативной
23. Инсерционные транспозоны (IS)
• Открыты в 1970г. П.Сталинжером, Г.Сэдлером иДж.Шапиро. Обычно несколько is-элементов содержиться в
бактериальной хромоосмею Размеры 750-1550 п.н.
• На концах инвертированные последовательности (IR)
необходимые для переноса. В центральной части ген
транспозазы, необходимый для распознавания is-элементов и
взаимодействия с is-элементами в процессе перемещения.
24. Составные транспозоны
• Содержатдополнительные
гены
(устойчивости
антибиотикам
или
токсинам),
фланкированные
последовательностями.
к
IS
• Частота перемещения зависит от типа транспозона.
Считается, что они произошли от 2 ассоциированных
инсерционных транспозона, включая область кодирующих
генов между ними.
25. Репликативный транспозон
• Перемещаются посредством механизма репликативнойтранспозиции. Процесс катализируется белком ресольвазой
(сайт-специфическая рекомбинация).
• Исходный транспозон остается в
реплицируясь на участке ДНК-мишени.
исходном
сайте,
26. Простая транспозиция
27.
28. Функции транспозонов
• Могут встраиваться в гены, вызывая мутациистимулируя хромосомные перестройки, делеции.
или
• Могут переносить стоп-кодоны либо промоторные участки,
что влияет на транскрипцию или трансляцию гена-мишени.
• Часто перемещаются между плазмидами, которые могут
содержать несколько транспозонов.
• Могут перемещаться между плазмидами и хромосомами,
создавать плазмиды устойчивости, содержащие несколько
генов устойчивости к антибиотикам.
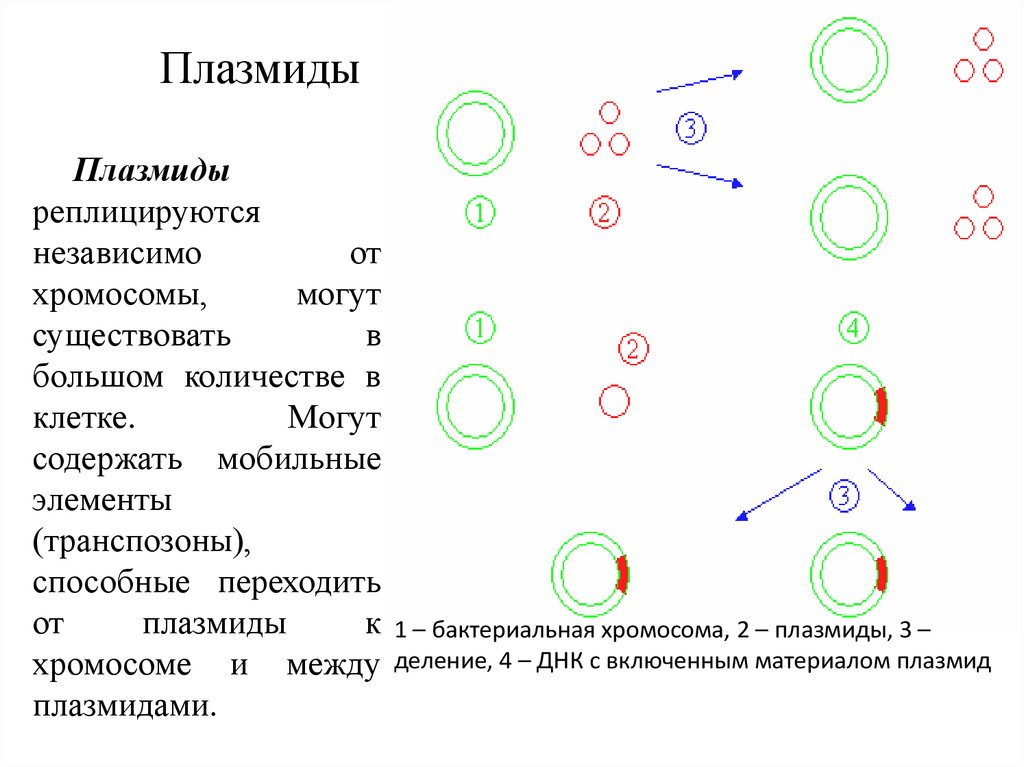
29. Плазмиды
Плазмидыреплицируются
независимо
от
хромосомы,
могут
существовать
в
большом количестве в
клетке.
Могут
содержать мобильные
элементы
(транспозоны),
способные переходить
от
плазмиды
к
хромосоме и между
плазмидами.
1 – бактериальная хромосома, 2 – плазмиды, 3 –
деление, 4 – ДНК с включенным материалом плазмид
30. Плазмиды
• Небольшие молекулы ДНК (от 1 000 п.н. до неск. сот тыс.п.н.), способные к самостоятельной репликации (репликон).
• Существуют
хромосом.
в
свободном
состоянии
или
в
составе
• Эписомы – плазмиды способные к обратимой интеграции в
хромосому.
• Крупные плазмиды, содержащие
хозяйства» – называют хромосомами.
гены
«домашнего
• Плазмиды состоят из модулей: обязателен репликативен,
другие опциональны.
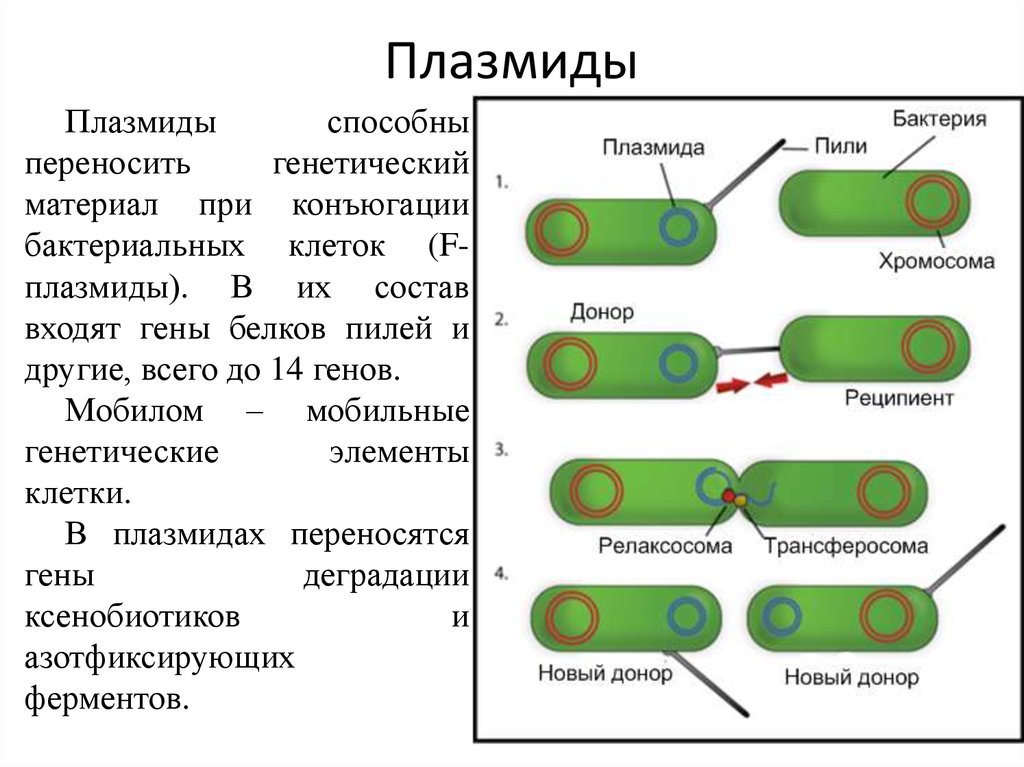
31. Плазмиды
Плазмидыспособны
переносить
генетический
материал при конъюгации
бактериальных клеток (Fплазмиды). В их состав
входят гены белков пилей и
другие, всего до 14 генов.
Мобилом – мобильные
генетические
элементы
клетки.
В плазмидах переносятся
гены
деградации
ксенобиотиков
и
азотфиксирующих
ферментов.
32.
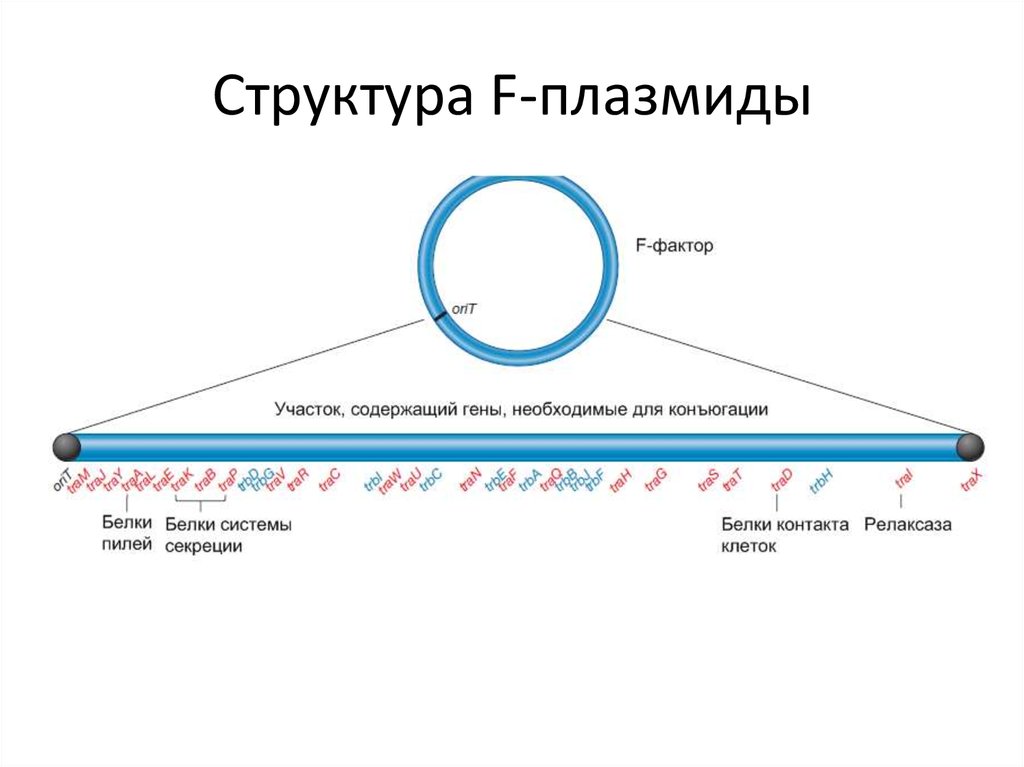
33. Структура F-плазмиды
34. Горизонтальный (латеральный) перенос генов
Конъюгация.• Прямой перенос ДНК во время временного физического
контакта клеток.
Трансформация.
• Перенос свободных молекул ДНК.
Трансдукция.
• Перенос молекул ДНК с участием бактериальных вирусов.
35. Горизонтальный (латеральный) перенос генов
• Перенос генов между 2 прокариотическими организмами.Важный механизм увеличения генетического разнообразия у
прокариот.
• Часть геном – экзогенот переноситься от донора к
реципиенту и интегрируется в эндогенот. Мерозигот
временное диплоидное состояние части наследственного
материала прокариот.
• Бактерии
способны
обмениваться
участками
наследственного материала, в том числе генами устойчивости к
антибиотикам.
Обмен
может
происходить
между
непатогенными и патогенными формами.
36. Образование мерозигот
37. Конъюгация бактерий
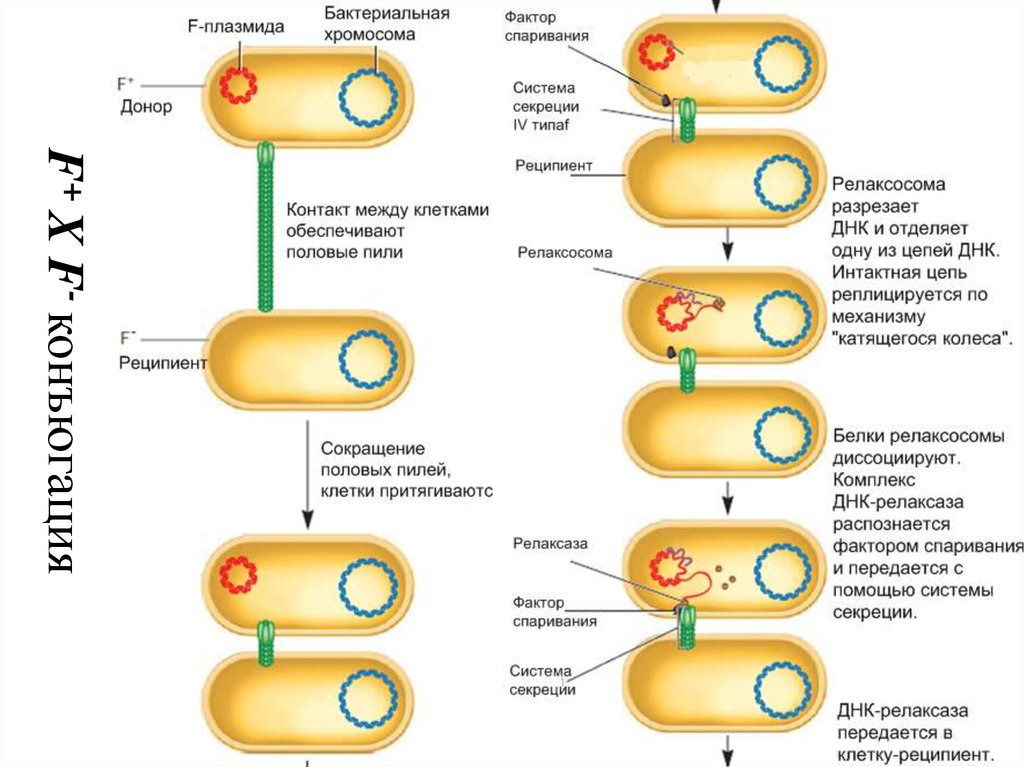
• Конъюгация – перенос генетического материала междубактериальными клетками при помощи прямого клеточного
контакта.
• Включает F-фактор (F-плазмиду), половые пили и систему
секреции IV типа.
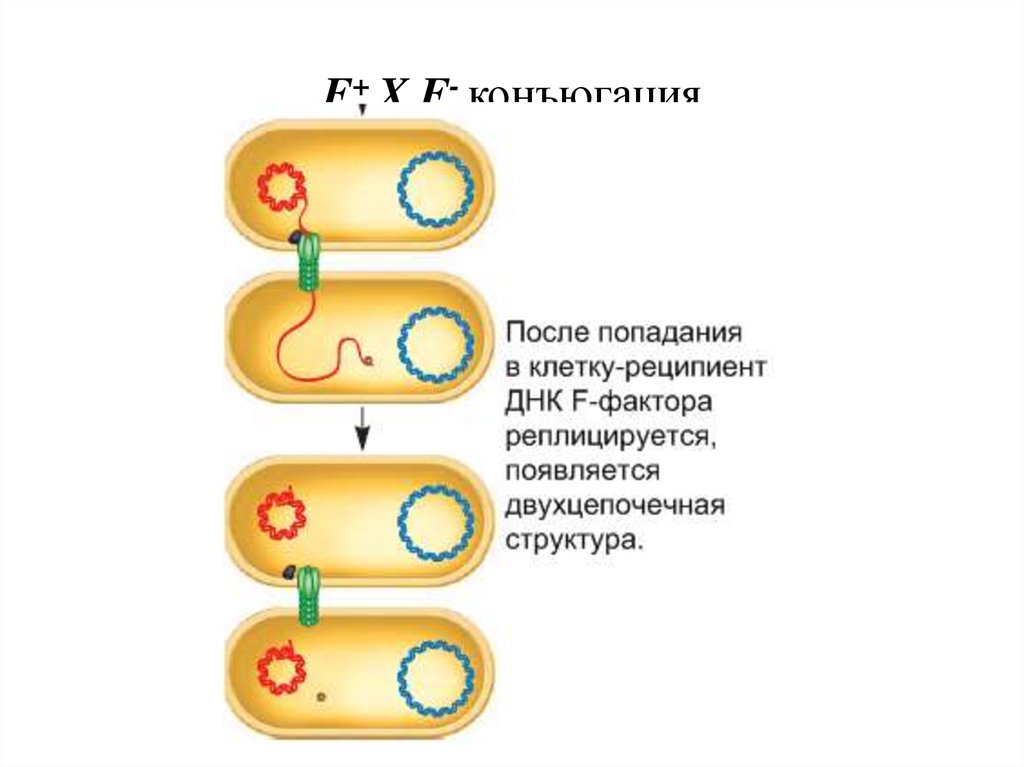
• При F+ X F- конъюгации, F-плазмида существует независимо
от бактериальной хромосомы и переноситься в клетку
реципиента целиком, гены донора обычно не переносятся.
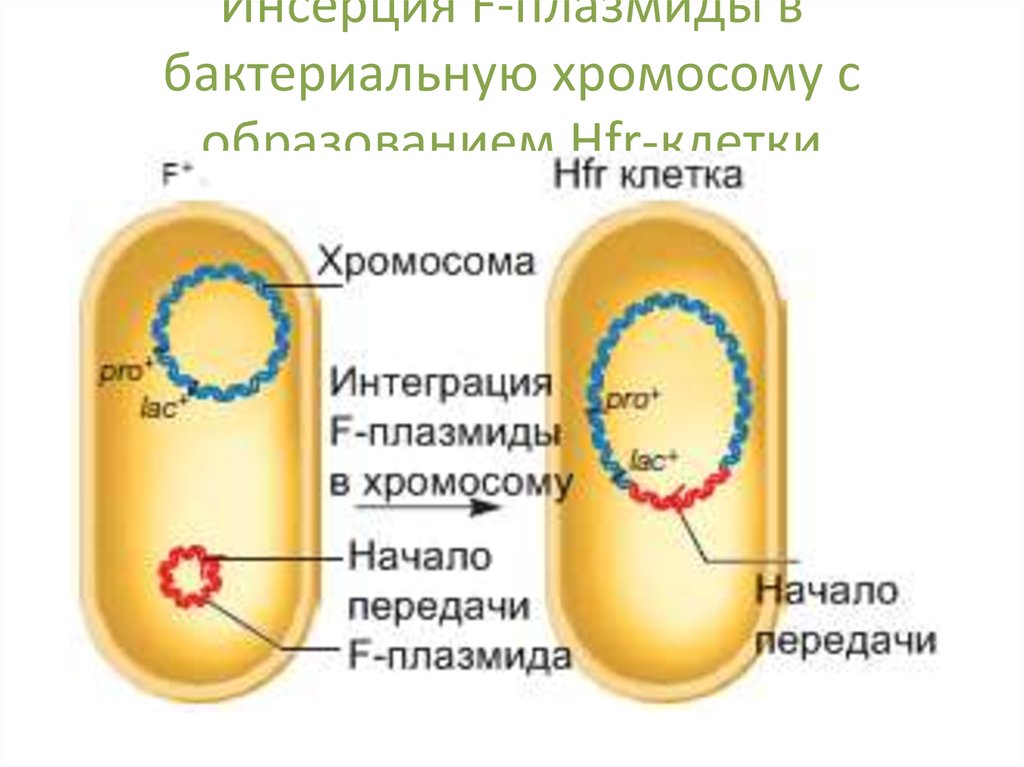
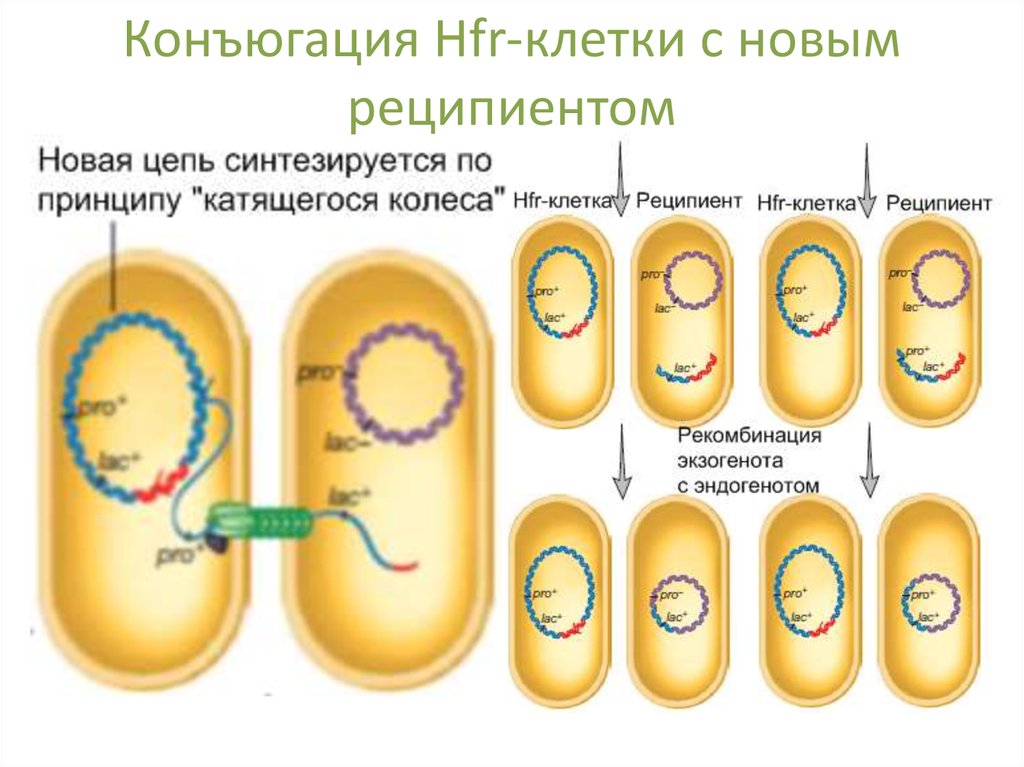
• При Hfr-конъюгации, происходит частичная репликация
донорской ДНК, переноситься только цепь ДНК (Hfr),
содержащая гены плазмиды и хозяина, F-плазмида
интегрирована в хромосому хозяина и не переноситься
целиком.
38. Эксперимент Д. Ледерберга и Э. Тэйтума (1946), доказавший явление конъюгации
39. Эксперимент Б. Дэвиса, показавший роль физического контакта при конъюгации
40. Конъюгация E.coli
41. F+ X F- конъюгация
F+ X F- конъюгация42. F+ X F- конъюгация
43. Инсерция F-плазмиды в бактериальную хромосому с образованием Hfr-клетки
44. Конъюгация Hfr-клетки с новым реципиентом
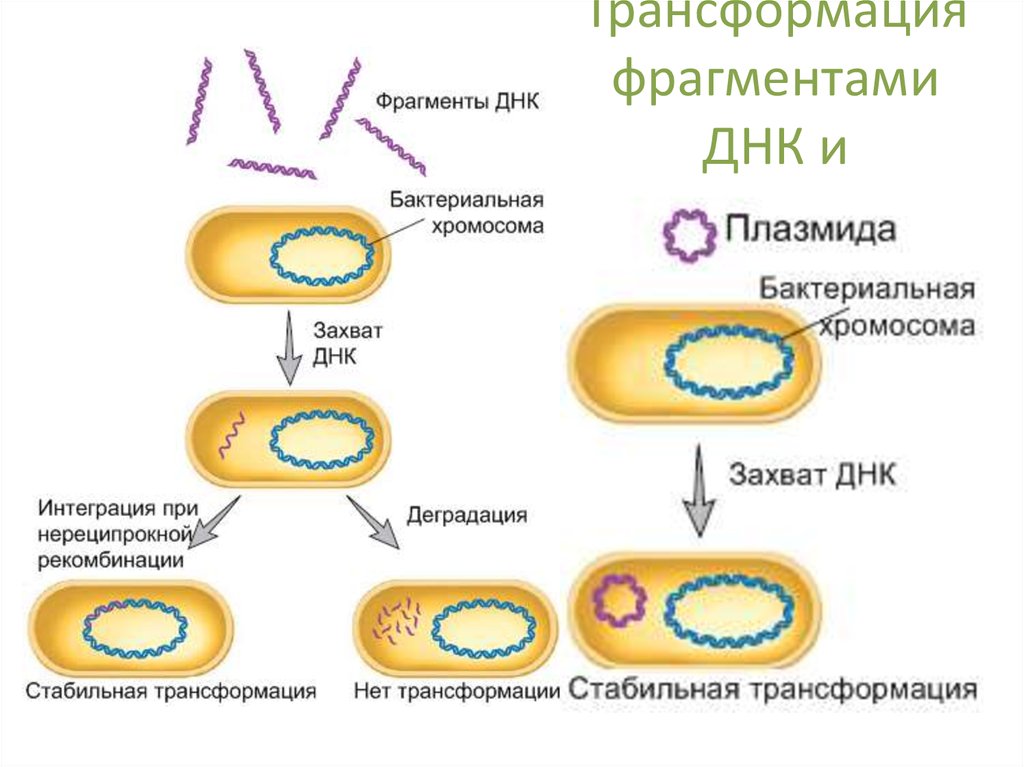
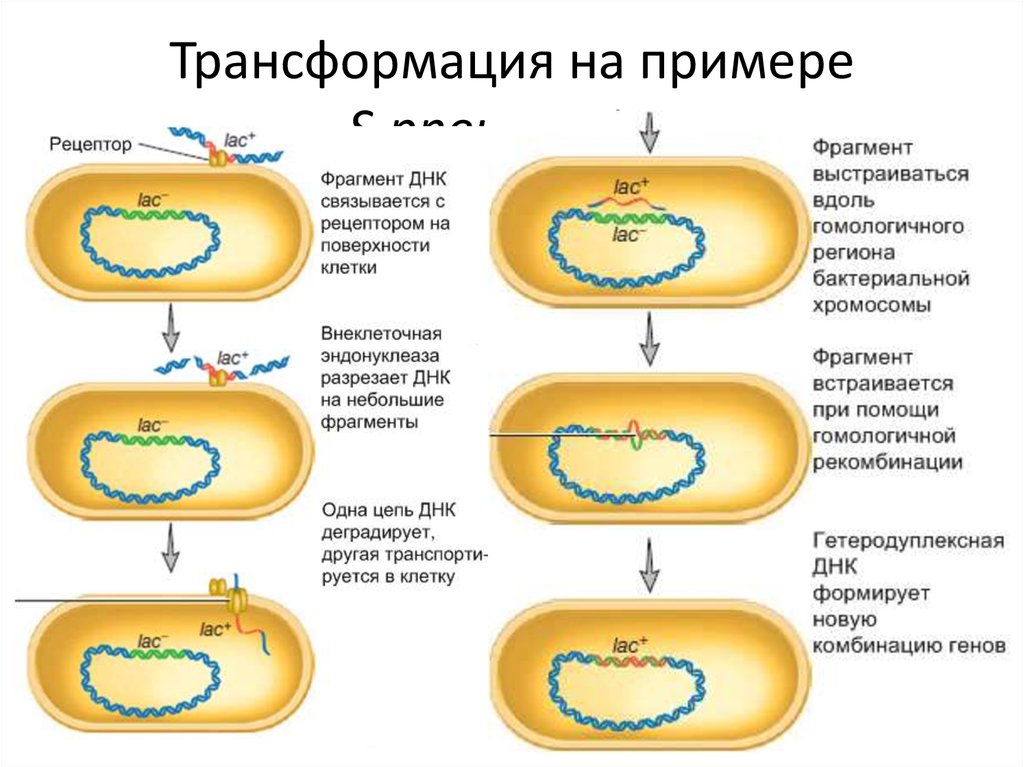
45. Трансформация
• Впервые явление трансформации описано Ф. Гриффитом в1928.
• Перенос ДНК без участия дополнительных структур.
Внесенная ДНК включается в геном и может наследоваться.
• Часто фрагменты ДНК выходят во внешнюю среду при
лизисе клетки, при попадании в «компетентную» клетку
вызывают трансформацию. Средняя частота трансформации
«компетентных клеток» 10-3.
• Компетентность зависит от размеров популяции, при
достижении больших размеров 107-108 кл./мл., на поверхности
экспрессируется белок отвечающий за трансформацию.
Происходит в почвенных и водных экосистемах.
46. Трансформация фрагментами ДНК и плазмидами
47. Трансформация на примере S.pneumoniae
48.
49. Бактериальная трансформация
50. Перенос ДНК в клетку
• Для переноса ДНК через клеточные оболочки имеютсясложные системы, включающие ферменты нуклеазы,
транслоказы и другие, а также некоторые структурные белки
образующие канал для перемещения ДНК.
51. Трансдукция
• Трансдукцию осуществляют бактериофаги, переносящиеневирусную информацию. Фаги – вирусы бактерий, используют
аппарат синтеза белка и репликации ДНК клетки.
• Ошибки в жизненном цикле фага могут приводить к
попаданию в капсид вируса фрагментов ДНК бактерии.
• Вирулентные фаги вызывают лизис клетки после
увеличения количества фаговых частиц в клетке – литический
цикл.
• Умеренные фаги внедряются в геном хозяина, совместно
реплицируются длительное время – лизогенный цикл.
• Профаг – внедренный в хромосому геном вируса.
52.
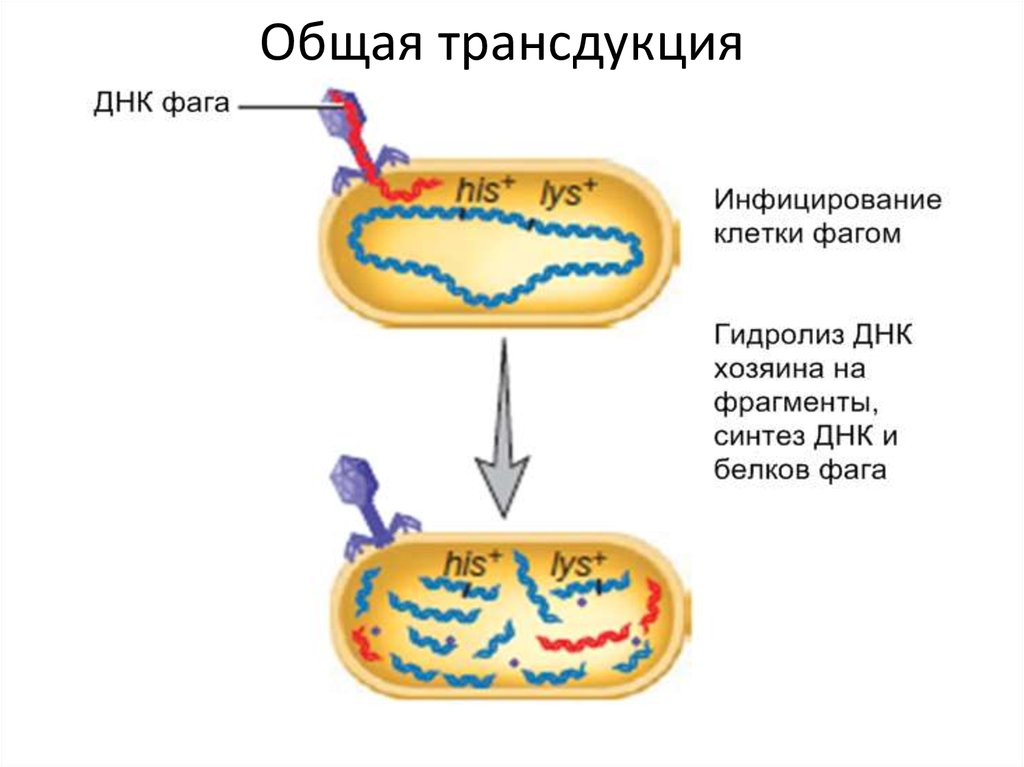
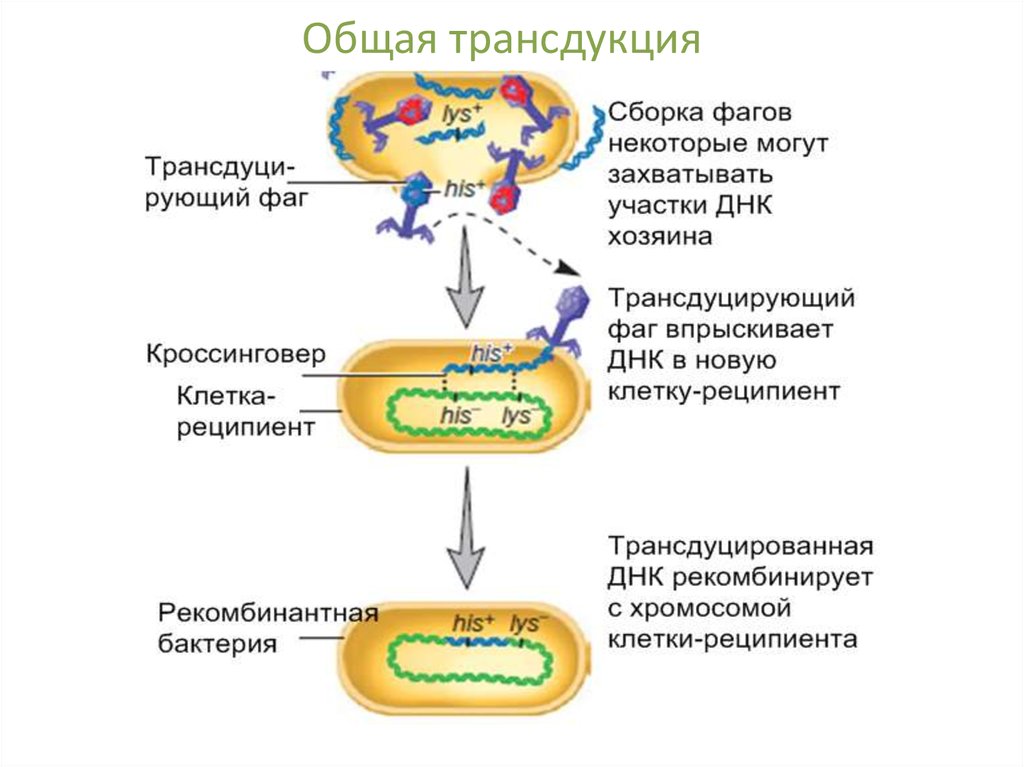
53. Общая трансдукция
• Описана в 1951г. Дж.Ледербергом и Н.Циндером.• Неспецифический перенос разнообразных генов хозяина.
• Во время лизиса клетки-хозяина обломки ДНК хозяина (0,5 –
2,5 %) укладываются под капсидную оболочку вместе с ДНК
фага.
• Характерна для литических циклов. Наследование
внесенной ДНК происходит только при условии успешной
гомологичной рекомбинации с ДНК клетки-хозяина.
• Если ген не может быть интегрирован в геном хозяина –
абортивная трансдукция.
54. Общая трансдукция
55.
Общая трансдукция56.
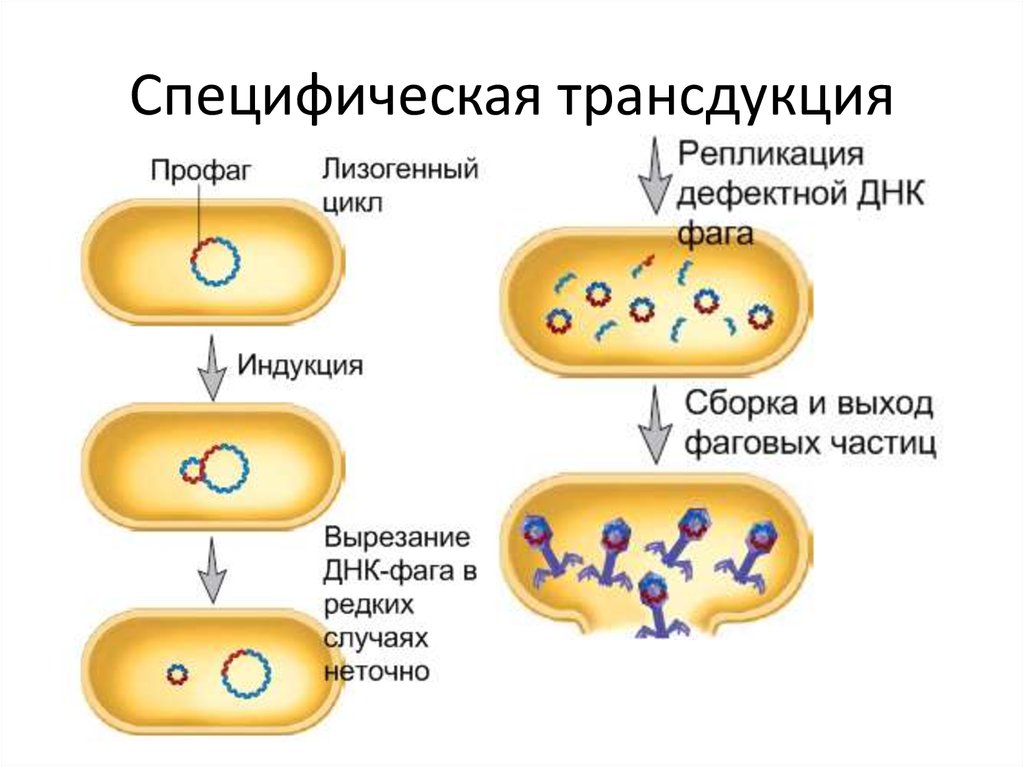
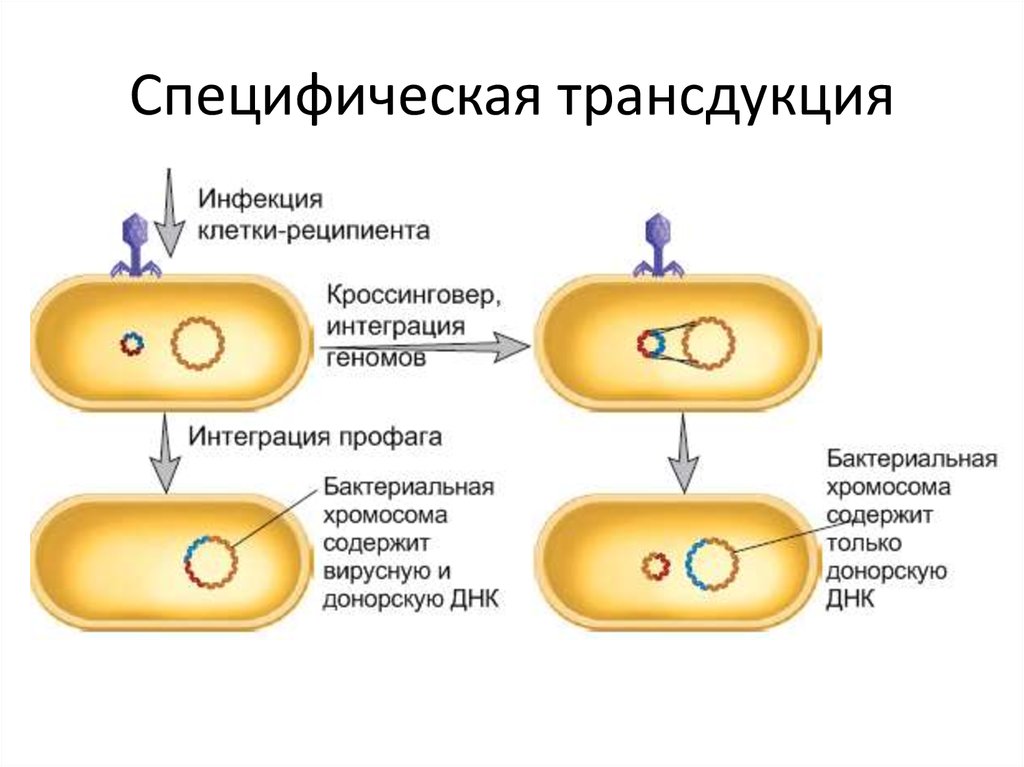
57. Специфическая трансдукция
• Перенос ограниченного числа генов, расположенных вучастке включения ДНК фага в хромосому бактерии.
• Происходит в результате ошибки лизогенного цикла, когда
профаг покидает хромосому хозяина, вырезание может быть
неточным, захватывая участок ДНК хозяина (5-10%).
• Наиболее известный пример – фаг лямбда, который
размножается 2 способами: при литическом цикле присутствует
в виде автономной молекулы ДНК, которая обеспечивает синтез
фаговых частиц. При лизогенном цикле ДНК фага
интегрирована в хромосому и реплицируется пассивно.
• Дефектный фаг может содержать гены, следующие на
хромосоме за точкой внедрения и профагом.
58. Специфическая трансдукция
59. Специфическая трансдукция
60.
61. Опыт Джона Кернса (1988 г.)
В работе использовался мутантный штамм lac- бактерий,неспособных к метаболизму лактозы, такие бактерии не
растут на средах, содержащих лактозу в качестве
единственного источника энергии. При пересеве таких
бактерий на среду с лактозой вырастают только
бактерии -ревертанты lac+.
После пересева и суточного роста наблюдалась картина,
аналогичная опыту Лурии и Дельбрюка, однако через 2 и 3
суток роста количество устойчивых колоний значительно
возросло.
62. CRISP-кассеты
• В 2005 году сотрудниками Danisco РудольфомБарангу и Филиппом Хорватом проводились
опыты с культурами Streptococcus thermophilus.
Эти работы имели практическую цель получить
штаммы
бактерии,
применяемой
для
производства молочных продуктов, устойчивой к
бактериофагам.
• В результате были открыты CRISP-кассеты – участки
ДНК, одержащие короткие фрагменты (спейсеры),
схожие у бактерии и фага. Считается, что набор
спейсеров отвечает за способность фага поражать
бактерию.











































 Биология
Биология








