Похожие презентации:
Металлургия цинка
1. Металлургия цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВМеталлургия цинка
2. Общие сведения
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОбщие сведения
2
3. Физические свойства
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВФизические свойства
• Серебристо-белый металл, блестящий в изломе
• В холодном состоянии цинк ломок, при Т=100–150 °C –
пластичен и его можно легко прокатывать, а при Т≥250 °C –
становится хрупким и его можно толочь в порошок
• Температура плавления – 419,4 °C
• Температура кипения – 906 °C
• Плотность твердого цинка – 7,133 г/см3
• Теплопроводность цинка составляет 24,2 %, а
электропроводность 27,9 % от тепло- и электропроводности
серебра
3
4. Химические свойства
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВХимические свойства
• В сухом воздухе цинк не изменяется, но во влажном воздухе,
содержащем углекислоту, поверхность цинка покрывается
пленкой ZnCO3×3Zn(ОН)2, хорошо защищающей металл от
дальнейшего окисления
• Стандартный электродный потенциал –0,763 В
• Валентность – 2
• Цинк обычной чистоты активно реагирует с растворами кислот
и щелочей:
Zn
Zn
4
Кислота
Щелочь
Соль
Гидроксоцинкат
5. Минералы цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВМинералы цинка
Сфалерит
α-ZnS
5
Вюрцит
β-ZnS
Смитсонит
ZnCO3
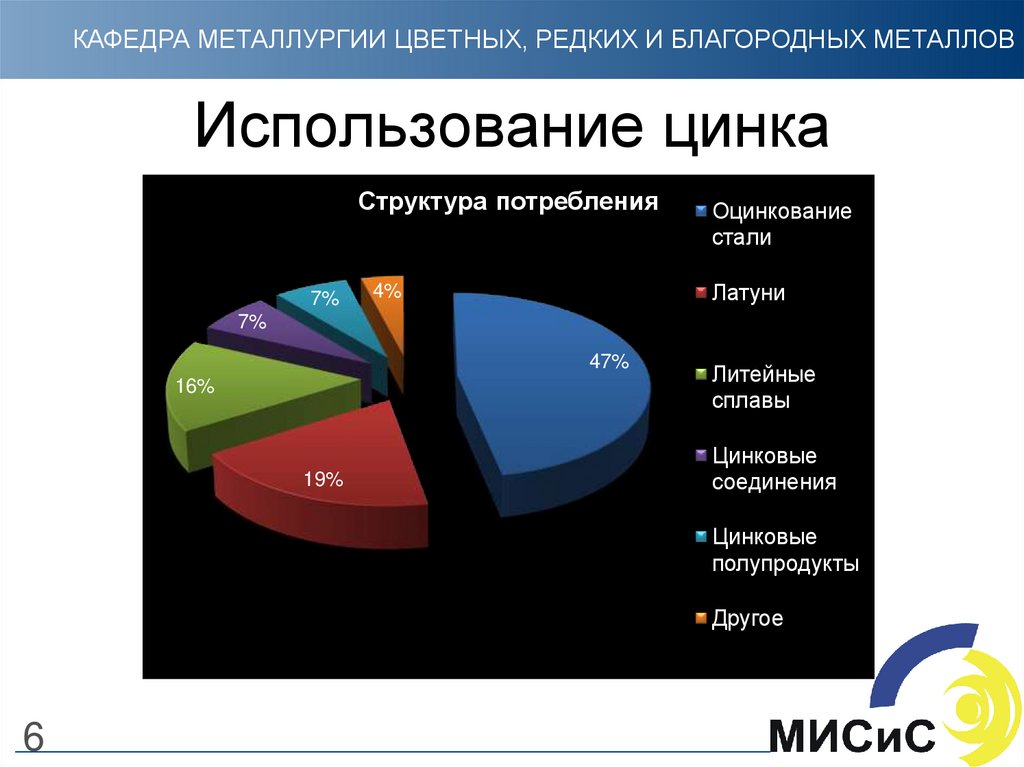
6. Использование цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВИспользование цинка
Структура потребления
7%
Оцинкование
стали
Латуни
4%
7%
47%
16%
19%
Литейные
сплавы
Цинковые
соединения
Цинковые
полупродукты
Другое
6
7.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВИспользование цинка
Области потребления
23%
45%
7%
25%
Строительство
Транспорт
Машиностроение
Электроника и товары бытового назначения
7
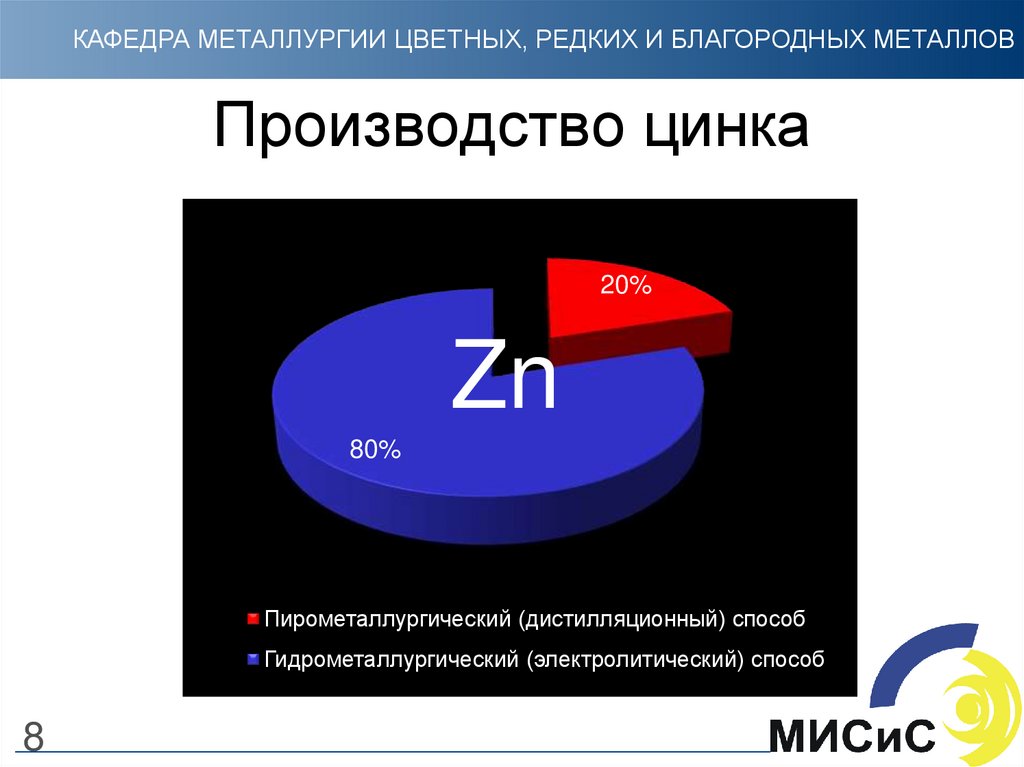
8. Производство цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПроизводство цинка
20%
Zn
80%
Пирометаллургический (дистилляционный) способ
Гидрометаллургический (электролитический) способ
8
9. Пирометаллургический способ получения цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПирометаллургический способ получения цинка
Пирометаллургический (дистилляционный) способ основан на
химических реакциях:
2ZnS + 3O2 = 2ZnO + 2SO2 + 890 кДж
ZnO + C = Zn + CO – 238 кДж
ZnO + CO = Zn + CO2 – 65 кДж
СO2 + C = 2CO – 172,4 кДж
9
10. Гидрометаллургический способ получения цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВГидрометаллургический способ получения цинка
Гидрометаллургический (электролитический) способ основан
на химических реакциях:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + H2SO4 = ZnSO4 + H2O
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
10
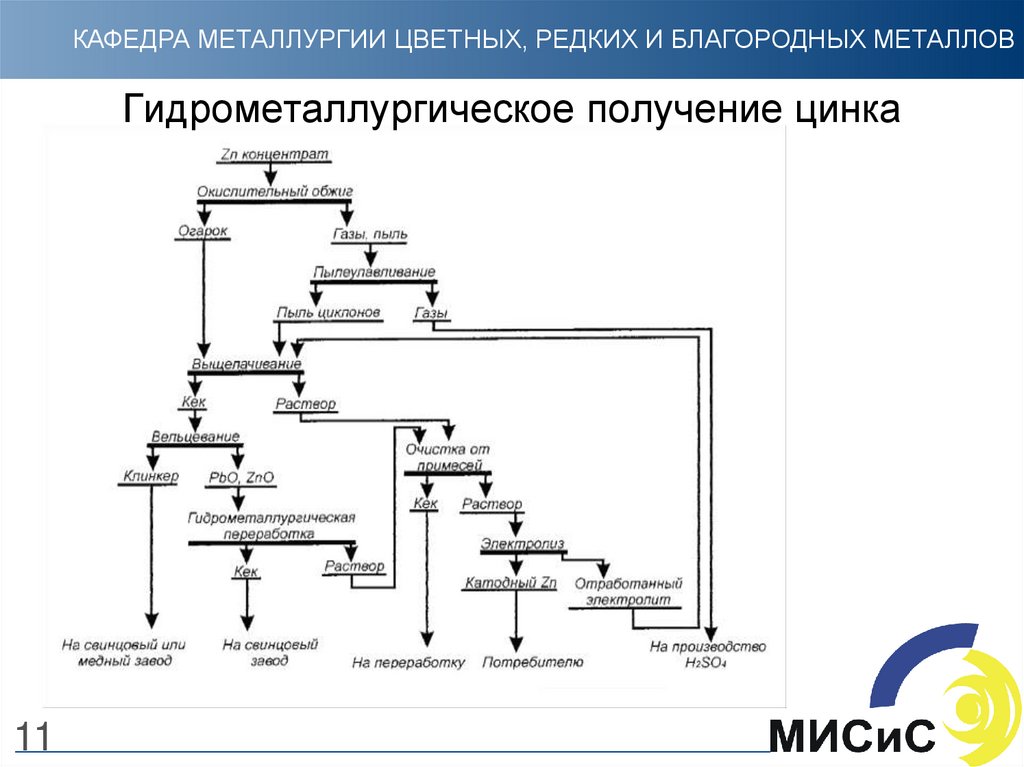
11. Гидрометаллургическое получение цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВГидрометаллургическое получение цинка
11
12. Обжиг сульфидных цинковых концентратов
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОбжиг сульфидных цинковых концентратов
Обжиг является первой операцией в любой схеме получения цинка и представляет собой
чисто окислительный процесс, при котором стремятся как можно полнее удалить серу.
Обжиг цинковых концентратов перед дистилляцией (в пирометаллургической схеме)
преследует следующие цели:
1) возможно более полное удаление серы (до 1 %) с переводом цинка и других металлов из
сернистых соединений в оксидные;
2) отгонку из концентратов свинца, кадмия, мышьяка, сурьмы и некоторых редких элементов;
3) получение крупных частиц или кусков с пористой структурой;
4) получение концентрированных по содержанию сернистого ангидрида газов, пригодных для
производства серной кислоты.
Обожженный цинковый концентрат (частично) подвергается агломерирующему обжигу на
круглых или прямолинейных спекательных машинах. Иногда обжиг проводится в одну стадию с
агломерацией, при этом концентрат должен быть разубожен по сульфидной сере до 5-6 %
оборотным агломератом, то есть шихта примерно состоит из 20 % сырого концентрата и 80 %
оборотного агломерата. Агломерат представляет собой зерна величиной 4-12 мм. Это придает
шихте дистилляции большую пористость. Температура агломерирующего обжига 1200-1400 °С.
12
13. Обжиг сульфидных цинковых концентратов
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОбжиг сульфидных цинковых концентратов
При гидрометаллургической переработке окислительный обжиг проводят с частичной
сульфатизацией, чтобы сульфатом цинка компенсировать потери сульфат-иона в замкнутом цикле
выщелачивания и электролиза растворов сульфата цинка (около 3-4 % сульфатной серы).
Цель обжига:
1) окислить полностью мышьяк и сурьму и удалить их в виде летучих соединений;
2) как можно меньше получить при обжиге ферритов цинка, не растворимых в слабых
растворах серной кислоты, и силикатов цинка, образующих при растворении коллоидные
растворы;
3) получить огарок в виде мелкого порошка (-0,15 мм ) для лучшего выщелачивания;
4) получить концентрированные по сернистому ангидриду газы, пригодные для производства
серной кислоты.
Сульфидный цинковый концентрат обжигают в окислительной среде при избытке кислорода
и при высокой температуре.
Температура обжига 850-970 °С.
13
14. Обжиг сульфидных цинковых концентратов
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОбжиг сульфидных цинковых концентратов
14
СУЛЬФАТООБРАЗОВАНИЕ
Сульфаты цинка образуются при обжиге по следующим реакциям:
2SO2 + O2 = 2SO3 + 193 кДж,
ZnO + SO3 = ZnSO4 + 243 кДж.
Сульфаты металлов при повышенных температурах обжига (более 750 °С) диссоциируют.
На сульфатообразование оказывают каталитическое воздействие оксиды железа, меди, цинка,
обожженный концентрат, нагретые стенки печи и др., способствующие окислению сернистого
ангидрида в серный, в результате чего достигается необходимое образование сульфата цинка.
ФЕРРИТООБРАЗОВАНИЕ
Оксид цинка при температурах выше 650 °С с оксидом железа образует феррит цинка по реакции
ZnO + Fe2O3 = ZnO×Fe2O3.
Снижать ферритообразование при обжиге за счет понижения температуры не представляется
возможным. Понизить ферритообразование можно сокращением времени контакта оксидов цинка и
железа за счет быстрого обжига и аппаратурного оформления.
Если цинк присутствует в концентрате в виде марматита – mZnS×nFeS, то ферритообразование
неизбежно.
При обжиге железистых цинковых концентратов образование ферритов цинка неизбежно и наиболее
эффективным средством его уменьшения является интенсивный обжиг при максимально допустимой
температуре.
СИЛИКАТООБРАЗОВАНИЕ
Образование силикатов металлов (ZnO×SiO2) резко увеличивается с повышением температуры
обжига и уменьшением крупности материала. Для сокращения силикатообразования при обжиге
следует шихтовать различные концентраты таким образом, чтобы шихта содержала меньше
кремнезема.
15. Аппаратурное оформление процесса
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВАппаратурное оформление процесса
Печь КС
1 – подина;
2 – форсунка для розжига печи;
3 – загрузочная камера;
4 – корпус печи;
5 – отверстие для выхода газов;
6 – сливной порог;
7 – змеевик (охладитель слоя);
8 – воздушная камера;
9 – задвижка с
пневмоприводом;
10 – футеровка печи;
11 – свод.
15
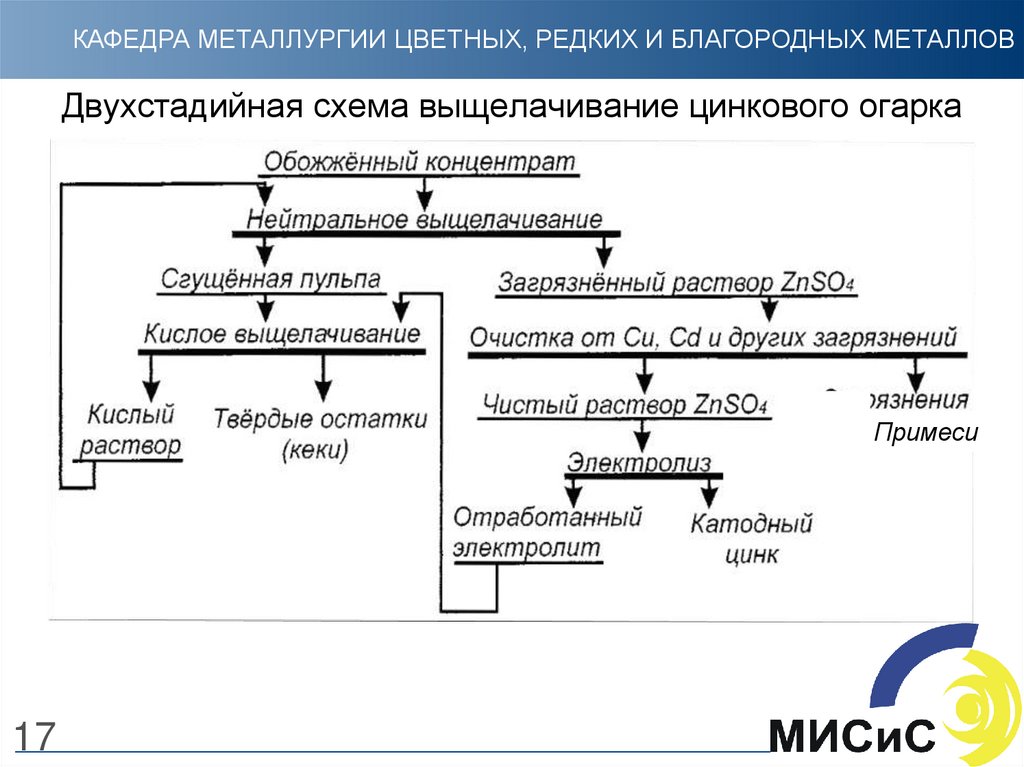
16. Выщелачивание цинкового огарка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВВыщелачивание цинкового огарка
• Выщелачивание огарка и пылей проводится по непрерывной (или
периодической) противоточной замкнутой технологической схеме.
• Для более полного перевода цинка в раствор выщелачивание огарка
проводится в 2 стадии: одно нейтральное и одно кислое.
• Иногда проводят выщелачивание в одну стадию (нейтральное), чаще в
периодическом режиме.
• В процессе двухстадийного выщелачивания получают:
1) нейтральные растворы от первого (нейтрального) выщелачивания,
поступающие на дальнейшую переработку;
2) кислые растворы (слив сгустителей, фильтраты), оборотные и
промывные воды, поступающие на нейтральное выщелачивание;
3) сгущенный промытый осадок от кислого выщелачивания – кек.
16
17. Двухстадийная схема выщелачивание цинкового огарка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДвухстадийная схема выщелачивание цинкового огарка
Примеси
17
18. Химизм процесса
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВХимизм процесса
ZnO
ZnS
18
H2SО4
Н2О
ZnSО4
H2SО4
ZnSО4
Q
Н2S
19. Технология двухстадийного выщелачивания цинкового огарка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВТехнология двухстадийного выщелачивания цинкового
огарка
На нейтральное выщелачивание поступают, часть отработанного электролита, фильтраты
кислого выщелачивания вместе с кислым раствором, оборотные растворы, промывные воды и
огарок.
При нейтральном выщелачивании преследуют цель очистки растворов сульфата цинка от
примесей железа, алюминия, мышьяка, сурьмы, кремнекислоты методом гидролиза, что можно
провести лишь в нейтральной среде (рН = 5,2-5,4).
При нейтральном выщелачивании выделяется тепло, нагревающее раствор до 50-60 °С, которое
способствует переводу коллоидного кремнезема в кристаллическую модификацию, также
коагуляции выпадающих из раствора гидрооксидов металлов.
Нейтральная пульпа после классификатора (отделяются пески) поступает на сгущение. Верхний
слив сгустителя направляют на очистку от примесей и электролиз, а нижний слив (пульпа)
вместе с песками – на кислое выщелачивание.
При кислом выщелачивании стремятся максимально перевести цинк в раствор и получить
отвальные по содержанию цинка кеки.
Выщелачивание проводят в пневматических или механических агитаторах.
19
20. Аппаратурное оформление процесса
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВАппаратурное оформление процесса
Пачук
1 – сопло;
2 – аэролифт;
3 – футеровка;
4 – корпус из железобетона;
5 – загрузочныи желоб;
6 – вентиляционное отверстие;
7 – крышка;
8,12 – крепление трубы;
9 – верх аэролифта;
10 – выпускной желоб;
11 – змеевик;
13 – крепление сопла;
14 – разгрузочный патрубок
20
21. Аппаратурное оформление процесса
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВАппаратурное оформление процесса
Агитатор
1 – привод;
2 – загрузочный люк;
3 – змеевик;
4 – корпус;
5 – футеровка;
6 – диффузор;
7 – мешалка;
8 – разгрузочное отверстие;
9 – отвод конденсата;
10 – подвод пара;
11 – крышка
21
22.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПульпа
5
1
6
2
Цинковая пыль
Соль Шлиппе
7
3
Полиакриламид
H 2SO 4
Отработанный
электролит
4
Цинковая пыль
MnO 2
Оборотные
растворы
Отработанный
электролит
4-5
Огарок
Медно-кадмиевый
кек на переработку
Оборотные
растворы
KOH
12
Кислый
раствор на
смыв огарка
13
8
Оборотные
растворы
10
11
Воздух
9
Свинцовый кек
на плавку
14
Железистый кек в
шламохранилище
(или на утилизацию)
22
Очищенный раствор
в цех электролиза
Воздух
Экспликация оборудования
цеха выщелачивания
1. Конус
2. Дробилка
3. Реактор
4. Пачук
5. Агитатор
6. Сгуститель
7. Насос
8. Аэролифт
9. Фильтр-пресс
10. Дисковый вакуум-фильтр
11. Сушилка
12. Шнековый транспортёр
13. Сборник
14. Сушилка
23. Методы очистки растворов от примесей
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВМетоды очистки растворов от примесей
• Гидролитическая очистка – процесс взаимодействия воды с
катионами металлов, сопровождающийся образованием
труднорастворимых гидроксидов
• Очистка раствора цементацией – окислительно-восстановительный
процесс, сопровождающийся ионизацией и растворением более
электроотрицательного металла и осаждением из раствора в
эквивалентном количестве более электроположительного металла
• Химические способы очистки раствора – применение специальных
реагентов, образующих с примесями труднорастворимые соединения
• Вывод части раствора из технологического цикла – удаление
примесей, накапливающихся в растворе при его циркуляции в схеме:
выщелачивание – электролиз
23
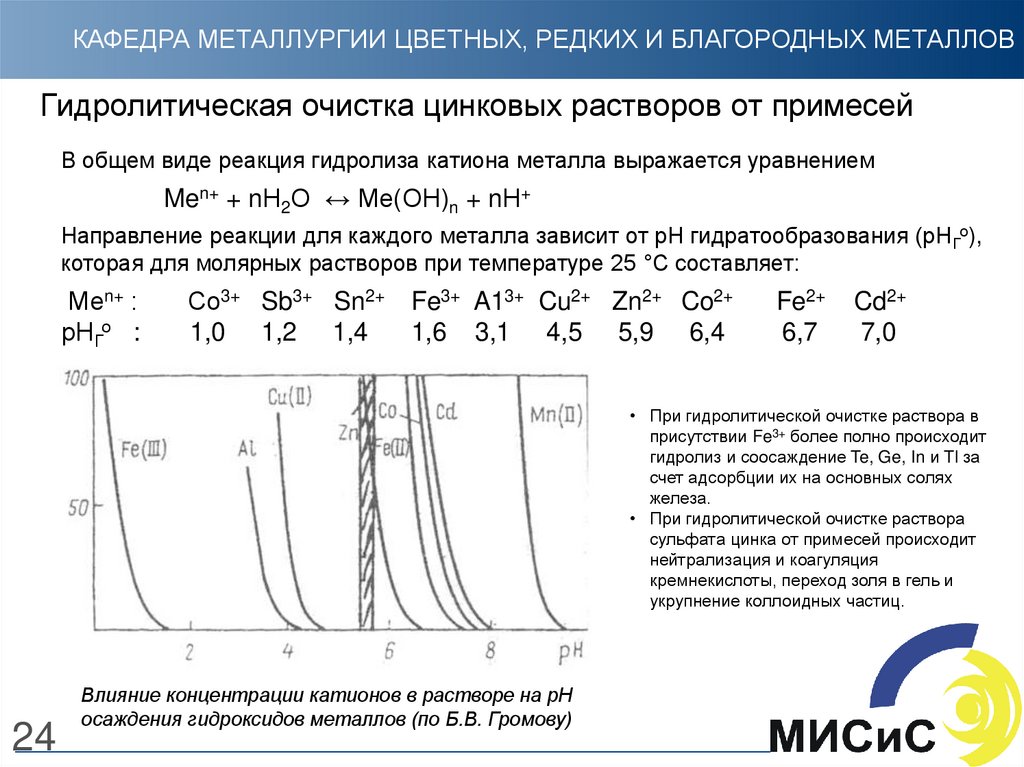
24. Гидролитическая очистка цинковых растворов от примесей
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВГидролитическая очистка цинковых растворов от примесей
В общем виде реакция гидролиза катиона металла выражается уравнением
Men+ + nН2О ↔ Ме(ОН)n + nН+
Направление реакции для каждого металла зависит от рН гидратообразования (рНГо),
которая для молярных растворов при температуре 25 °С составляет:
Меn+ :
рНГо :
Со3+ Sb3+ Sn2+
1,0 1,2 1,4
Fe3+ A13+ Cu2+ Zn2+ Co2+
1,6 3,1 4,5 5,9 6,4
Fe2+
6,7
Cd2+
7,0
• При гидролитической очистке раствора в
присутствии Fe3+ более полно происходит
гидролиз и соосаждение Te, Ge, In и Tl за
счет адсорбции их на основных солях
железа.
• При гидролитической очистке раствора
сульфата цинка от примесей происходит
нейтрализация и коагуляция
кремнекислоты, переход золя в гель и
укрупнение коллоидных частиц.
24
Влияние концентрации катионов в растворе на рН
осаждения гидроксидов металлов (по Б.В. Громову)
25. Гидролитическая очистка цинковых растворов от примесей
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВГидролитическая очистка цинковых растворов от примесей
В процессе нейтрального выщелачивания при постепенном повышении рН
растворов до 5,2-5,4 образуются и выпадают в осадок гидроксиды Co3+, As3+, Sb3+,
Sn2+, Fe3+, Аl3+. Катионы Сu2+ гидролизуется частично.
Для полного удаления железа вводят в пульпу окислитель (марганцевую руду и марганцевый
шлам, содержащие МnО2 – пиролюзит). В кислой среде происходит реакция:
2FeSO4 + МnО2 + 2H2SO4 = Fe2(SО4)3 + MnSO4 + 2Н2О
Для более интенсивного окисления железа растворы продувают воздухом или технологическим
кислородом в агитаторах с пневматическим перемешиванием (пачуках)
Гидролиз катионов Fe3+ протекает по реакциям:
Fe2(SO4)3 + 6H2О = 2Fe(OH)3 + 3H2SO4
3H2SO4 + 3ZnO = 3ZnSO4 + 3H2O
________________________________________________
Fe2(SO4)3 + 3H2О + 3ZnO = 2Fe(OH)3 + 3ZnSO4
Аналогично гидролизуются алюминий, мышьяк и сурьма:
Al2(SO4)3 + ЗН2О + 3ZnO =2Аl(ОН)3 + 3ZnSО4,
As2(SО4)3 + 3H2O +3ZnO = 2As(OH)3 +3ZnSO4,
Sb2(SO4)3 + 3H2O +3ZnO = 2Sb(OH)3 + 3ZnSO4
25
В условиях нейтрального выщелачивания осаждаются основные сульфаты металлов,
например, Fe(OH)SO4, так как чистые гидроксиды осаждаются только из очень разбавленных
растворов
26. Очистка цинковых растворов цементацией цинковым порошком
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОчистка цинковых растворов цементацией цинковым порошком
В основе процесса цементации лежит ионизация металла-цементатора:
Zn → Zn2+ + 2е
(ионы Zn2+ переходят в раствор, но электроны остаются в металле,
заряжая его отрицательно)
• Самопроизвольный переход ионов Zn2+ в раствор прекратится, когда потенциал металла E° Zn2+/Zn достигнет
–0,763 В (в стандартных условиях: 25 °С, а Zn2+ = 1 моль/л)
• В нестандартных условиях электродный потенциал цинка определяется уравнением Нернста:
E Zn2+/Zn = E° Zn2+/Zn + (RT/nF) lg а Zn2+ ,
где R – универсальная газовая постоянная 8,31 Дж/(моль·К); n – число электронов реакции;
F – число Фарадея (96487 Кл/моль)
• Дальнейшая ионизация Zn происходит при приеме избыточных электронов металлического цинка катионом
более электроположительного металла (Cd2+, Сu2+, Ni2+) и водорода. Восстанавливаясь катионы металловпримесей выделяются из раствора на поверхности металлического цинка в виде металла:
Men+ + ne → Me
Стандартные электродные потенциалы металлов, присутствующих в сульфатном
цинковом растворе:
Меn+ :
Na+ Mg2+ Mn2+ Zn2+ Cd2+ Со2+ Ni2+ Fe3+ Со3+ Cu2+ Ag+
E°Men+/Me : -2,71 -2,36 -1,18 -0,76 -0,40 -0,28 -0,25 -0,04 0,33 0,34 0,8
26
27. Очистка цинковых растворов цементацией цинковым порошком
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОчистка цинковых растворов цементацией цинковым порошком
27
При очистке раствора от меди и кадмия протекают реакции:
Cu2+ + Zno = Cuo + Zn2+
CuSO4 + Zn = ZnSO4 + Cu
CdSO4 + Zn = ZnSO4 + Cd
CuSO4 + Cd = CdSO4 + Cu
Медь легко удаляется из растворов и цементируется раньше кадмия, так как Cu является
более благородным металлом, поэтому на практике очистка проводится, как правило, в
несколько стадий
Кадмий удалить полностью цементацией трудно, так как он способен вновь переходить в
раствор. Обратному растворению кадмия способствуют присутствующие в растворе мышьяк,
сурьма, германий
При наличии редких металлов в растворе происходит их цементация цинком: таллий
осаждается полностью с медью и кадмием, также частично осаждаются галлий и индий
Цементацией цинком кобальт и никель, как наиболее благородные металлы, извлечь из
раствора не удается из-за возникновения поляризационных явлений и очистка от них может
быть произведена только с добавкой мышьяка, сурьмы, теллура или ртути, активирующих
процесс (соль Шлиппе – ортосульфоантимонат натрия Na3SbS4·9H2O, антимонат натрия Na3SbO4)
Цементационную очистку растворов проводят в агитаторах с механическим перемешиванием,
так как кислород воздуха окисляет металлические осадки и способствует их обратному
растворению, а также увеличивает расход цинковой пыли
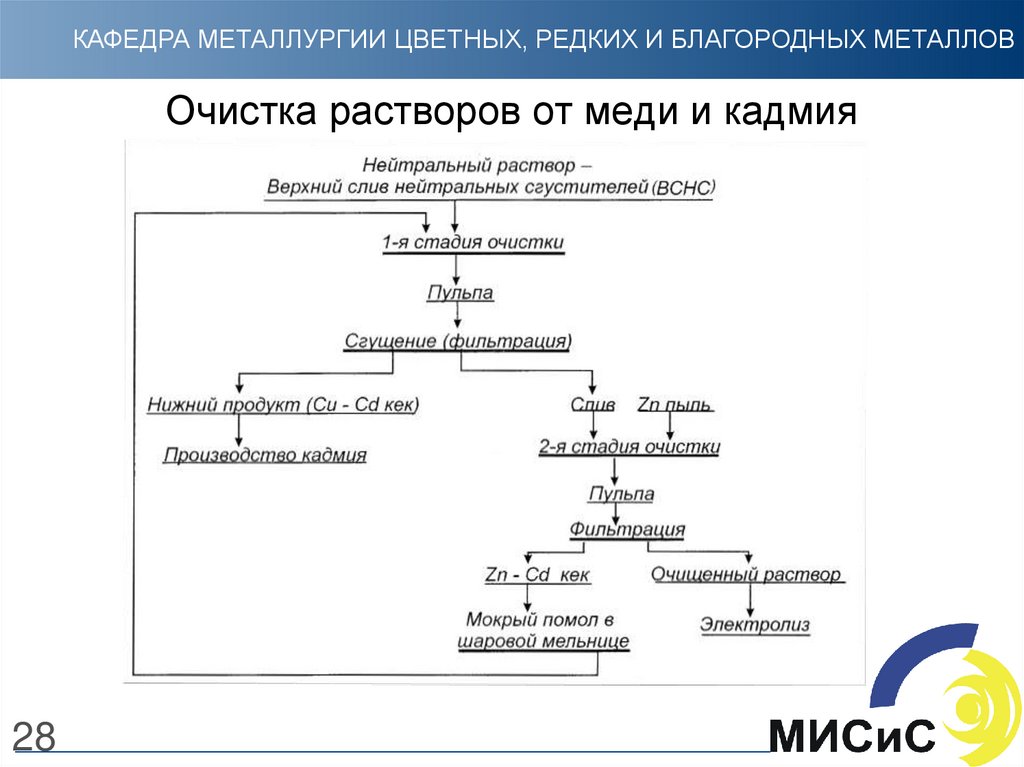
28. Очистка растворов от меди и кадмия
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОчистка растворов от меди и кадмия
28
29. Химические способы очистки цинковых растворов
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВХимические способы очистки цинковых растворов
Очистка от кобальта. Допустимый предел накопления кобальта в растворе составляет 3-4 мг/л
На заводах СНГ применяют ксантогенатный метод с использованием хорошо растворимых в
воде этилового или бутилового ксантогенатов натрия или калия : C2H5OCS2K или C4H9OCS2K,
с добавкой медного купороса
CoSO4 + 4C2H5OCS2K + CuSO4 = (C2H5OCS2)3Co↓ + C2H5OCS2Cu↓ + 2K2SО4
Остаточное содержание кобальта в очищенном растворе составляет 3-4 мг/л.
Ксантогенаты тяжелых металлов в кеках (3-5 % Со, 6-8 % Сu и 20-25 % Zn) переводят в еще более
нерастворимые сульфиды:
2(C2H5OCS2)3Co + 3Na2S = CoS3 ↓ + 6C2H5OCS2Na
За рубежом (Канада, Австралия ) очистку растворов от кобальта проводят α-нитрозо-βнафтолом, осаждающим кобальт в виде труднорастворимой соли - Co(C10H6OHNO)3, с
получением кобальтового концентрата с содержанием металла до 40 %. Остаточное
содержание кобальта в очищенном растворе составляет 1-2 мг/л
Очистка от хлора
• Наиболее эффективный способ очистки раствора с помощью сернокислого серебра
Ag2SO4 + 2NaCl = 2AgCl↓ + Na2SО4
• Осаждения хлора в виде полухлористой меди:
- с использованием медных кеков кадмиевого производства при наличии свободной кислоты
(3-5 г/л) по реакции
Сu2+ + Сu + 2Сl- = Сu2Сl2↓
- введением в раствор медного купороса и цинковой пыли
2CuSО4 + Zn +2 Сl- = Cu2Cl2↓ + ZnSO4 + SО42-
29
30. Химические способы очистки цинковых растворов (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВХимические способы очистки цинковых растворов (продолжение)
Очистка от фтора
Очистку раствора проводят оксидом или сульфатом кальция по реакциям:
2NaF + СаО + Н2О = CaF2 ↓ + 2NaOH
2NaF + CaSO4 = CaF2 ↓ + Na2SO4
Остаточная концентрация фтора в растворе до 20 мг/л
Вывод части раствора из технологического цикла
Способа очистки раствора от примесей (Na, K, Mg, Mn) без извлечения цинка не найдено.
30
Часть раствора выводят из производственного цикла и подвергают отдельной переработке
электролизом при повышенных плотностях тока, увеличенной циркуляции и повышенном
расходе ПАВ на истощение электролита до 8-12 г/л Zn. Отработанный электролит
подвергают испарению до содержания в растворе 900 г/л H2SO4, затем раствор охлаждают
и из него выпадает до 80 % сульфата магния и 80-90 % сульфата цинка. Осадки
отфильтровывают, а раствор возвращают в процесс.
Часть выводимого из производственного цикла раствора перерабатывают с получением
различных товарных солей, в числе которых основным является цинковый купорос для
обогатительных фабрик.
31. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Состав очищенного нейтрального раствора сульфата цинка, поступающего на электролиз:
- г/л: Zn– 120-170, Mn – 2-5
- мг/л: Cd – 0,1-2,0; Cu – 0,05-0,1; Ni – 0,01-0,5; Co – 0,1-4,0; Ge – 0,05-0,1; Sb – 0,01-0,15;
As – 0,05-0,2; Fe (II) – до 50; F – 20-50 и Cl – 100-150
Электролит - водный раствор сернокислого цинка (50-60 г/л) и серной кислоты (100-170 г/л), в
котором присутствуют ионы:
ZnSO4 = Zn2+ + SO42H2SO4 = 2H+ + SO42H2O = H+ + OH-
Под воздействием постоянного электрического тока протекают процессы:
на катоде:
на аноде:
Zn2+ + 2е = Zn°
2H+ + 2е = Н2
OH- – е = 1/2О2, + Н+ или
Н2О – 2е = 1/2O2 +2H+
В целом реакция электролиза:
ZnSO4 + Н2О = Zn + 1/2 О2 + H2SO4
31
32. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
В процессе электролиза применяют свинцово-серебряные аноды (0,5-0,9 % Ag), с материалом
которых происходят изменения (пассивация):
- вначале
РЬ° – 2е + SО42- = PbSO4 - из-за малой величины произведения растворимости сульфата
анод покрывается пленкой сульфата свинца
- при последующем повышении потенциала анода происходит дальнейшее окисление свинца
Рb2+ – 2е + (SО42-)2 = Pb(SО4)2
Pb° – 4е + 2(SО42-) = Pb(SО4)2, которая гидролизуется с образованием диоксида свинца:
Pb(SО4)2 +4Н2О = Pb(OH)4(PbО2 ×2Н2O) + 2H2SO4, на аноде растворяется пленка PbSO4 и
Процесс пассивации протекает 48 часов
образуется пленка РbО2 – плотная и электропроводная
При электролизе необходимо создать условия для преимущественного протекания на
катоде восстановления катионов цинка и почти полного подавления процесса разряда
катионов водорода за счет увеличения (по абсолютной величине) перенапряжения
разряда ионов водорода при поляризации катода
Перенапряжение водорода на конкретном катоде – это разность потенциалов разряда ионов водорода
на используемом катоде из определенного раствора и стандартным потенциалом разряда ионов
водорода из того же раствора. Перенапряжение водорода достигается поляризаций катода –
смещением его потенциала в более электроотрицательную область за счет создания определенных
условий
32
33. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
• Перенапряжение водорода зависит от:
1) материала катода:
катод
Au
Ag
Ni
Cu
∆φн ,B
0,02
0,15
0,21
0,23
Cd
0,48
Pb
0,64
Zn
0,70
2) катодной плотности тока: чем выше катодная плотность тока (Dк), тем выше перенапряжение водорода
(уравнение Тафеля):
∆φн = a + b lgDk,
где a и b – коэффициенты
3) поверхности катода: чем более шероховатая поверхность катода при осаждении рыхлого осадка, тем
больше его фактическая поверхность, а значит меньше истинная плотность тока на единицу поверхности катода,
следовательно, меньше перенапряжение водорода
4) температуры электролита: с повышением температуры электролита перенапряжение водорода снижается
5) состава электролита:
а) в более кислом электролите увеличивается его электропроводность и снижается перенапряжение водорода
б) присутствие в электролите металла, который может выделиться одновременно с цинком или раньше его и на
котором перенапряжение водорода меньше, чем на цинке вызывает усиленное выделение водорода на катоде.
Выделившийся раньше цинка металл образует с ним микрогальваническую пару, в которой цинк, как более
электроотрицательный, играет роль анода и переходит в раствор, а на катодном участке выделяется водород.
в) с прибавлением в электролит до некоторого предела ПАВ (клей, желатин) увеличивает перенапряжение
водорода
33
34. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Перенапряжение водорода (продолжение)
В кислых водных растворах катион водорода существует в растворе только в химически
связанном с водой состоянии, образуя ион гидроксония – (Н3О)+, который электростатически
связан с некоторым количеством воды – (Н3О)+×nН2О.
Выделение на катоде водорода состоит из нескольких стадий:
1) дегидратация иона гидроксония в силовом поле катода
(Н3О)+×nН2О → (Н3О)+ + nН2О;
2) разложение иона гидроксония и разряд катиона водорода
(Н3О)+ → H2О + Н+ +е →Н(Ме);
3) объединение адсорбированных поверхностью катода атомов водорода в молекулу
Н + Н → Н2(Ме);
4) десорбция молекул водорода и переход их в раствор до насыщения и затем выделение
газообразного водорода на поверхности катода.
34
Перенапряжение водорода возникает, если одна из этих стадий имеет ограниченную скорость.
Считают, что активации подлежит вторая стадия процесса.
35. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Выход по току (ВТ) – отношение количества цинка, фактически полученного при
электроосаждении, к количеству цинка, которое должно было бы выделиться теоретически,
выраженное в процентах:
BT (%)
P
100 ,
a Q
где Р – количество выделившегося цинка, г;
Q – количество электричества, а-ч;
а – электрохимический эквивалент цинка 1,220 г/а-ч
ВТ всегда меньше 100 % из-за протекания на катоде одновременно с основным процессом
разряда ионов цинка побочных электрохимических процессов:
2H+ + 2e = H2,
Fe3+ + e = Fe2+
и вторичных химических реакций:
Zn + 1/2 О2 = ZnO
ZnO + H2SO4 = ZnSO4 +H2O
• ВТ зависит от многих факторов:
1) от концентрации ионов цинка и водорода (кислотности) в электролите
По мере снижения содержания цинка в электролите и повышения его кислотности снижается ВТ. Особенно резко ВТ
падает при концентрации цинка ниже 50-30 г/л. Происходит это за счет постепенного снижения перенапряжения
водорода на катоде, а также за счет усиления растворения катодного цинка кислым электролитом. С повышением
кислотности электролита необходимо повышение плотности тока
2) от катодной плотности тока
С повышением плотности тока возрастает ВТ, так как возрастает перенапряжение водорода, а поляризация при
осаждении цинка возрастает незначительно
35
36. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Выход по току (продолжение)
3) от температуры электролита
С повышением температуры электролита ВТ падает из-за снижения перенапряжения водорода, поэтому необходимо
охлаждение электролита
4) от количества примесей в электролите
Железо снижает выход по току вследствие того, что на аноде происходит окисление его до Fe3+:
Fe2+ – e = Fe3+
а на катоде – восстановление до Fe2+:
Fe3+ + e = Fe2+ на что расходуется электроэнергия
Марганец влияет на ВТ аналогично железу:
на аноде
Mn2+ – 2e = Mn4+ ( преимущественно ),
Мn2+ – 5е = Мn7+ (раствор иногда розовеет)
на катоде Мn7+ + 5е = Мn2+
Медь даже при небольшом содержании резко снижает ВТ.
Аналогично действуют примеси мышьяка, сурьмы, серебра и германия. Одновременно с падением ВТ
появляются мелкие отверстия в слое осажденного цинка. Полученный из таких растворов цинк сильно растворяется
в кислотах.
Кобальт – крайне нежелательная примесь: катодный цинк получается сильно «разъеденным», резко снижается ВТ и
повышается расход электроэнергии. Вредное действие кобальта в значительной степени снижается ПАВ
5) от состояния катодной поверхности
При увеличении поверхности катода за счет шероховатости и дендритных образований уменьшается истинная
катодная плотность тока, что приводит к снижению перенапряжения водорода, а, следовательно, и выхода по току.
36
37. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Напряжение на ванне при электролизе и расход энергии
Напряжение на ванне (Uв):
Uв = (φа – φк) + (∆φа – ∆φк) + I·Rэл + I·Rшлм + I·Rконт + I·Rпров ,
где φа – потенциал анода, В
φк – потенциал катода, В
∆φа – поляризация анода, В
∆φк – поляризация катода, В
I – сила тока, А
Rэл – сопротивление электролита, Ом
Rшлм – сопротивление шлама, Ом
Rконт – сопротивление в контактах, Ом
Rпров – сопротивление проводников, Ом
Доли слагаемых напряжения на ванне:
(φа – φк) + (∆φа – ∆φк) – 75-77 %
I·Rэл – 15-17 %
I·Rшлм – 1-5 %
I·Rконт + I·Rпров – 1-2 %
37
38. Электролиз растворов сульфата цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЭлектролиз растворов сульфата цинка
Напряжение на ванне зависит от
-
плотности тока
-
температуры
-
кислотности электролита
-
расстояния между электродами
С увеличением плотности тока и расстояния между электродами напряжение на ванне
возрастает и снижается с повышением кислотности электролита и его температуры
Теоретическое напряжение электролиза составляет 2,45 B (напряжение разложения сульфата
цинка), практическое – 3,3-3,6 B.
Расход энергии определяется по формуле (W):
W = Q ·Uв ·103/P,
где Р – количество выделившегося цинка, т;
Q – количество электричества, а-ч;
Uв – напряжение на ванне, В
Теоретический расход энергии составляет около 2000 кВт-ч/т, фактический –3000-3400 кВт-ч/т.
Коэффициент полезного действия тока на цинковых заводах составляет 60-65 %
38
39. Железобетонная электролизная ванна
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВЖелезобетонная электролизная ванна
1 – корпус; 2 – рама; 3 – винипластовая прокладка; 4 – изолятор; 5 – отверстие
для стока электролита; 6 – сливной носик
39
40. Свинцово-серебряный анод
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСвинцово-серебряный анод
1 – медная освинцованная штанга; 2 – винипластовый ограничитель;
3 – анодная пластина из свинцово-серебряного сплава
40
41. Алюминиевый катод
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВАлюминиевый катод
1 – алюминиевая штанга; 2 –медный контакт; 3 – резиновая рейка;
4 – алюминиевая матрица
41
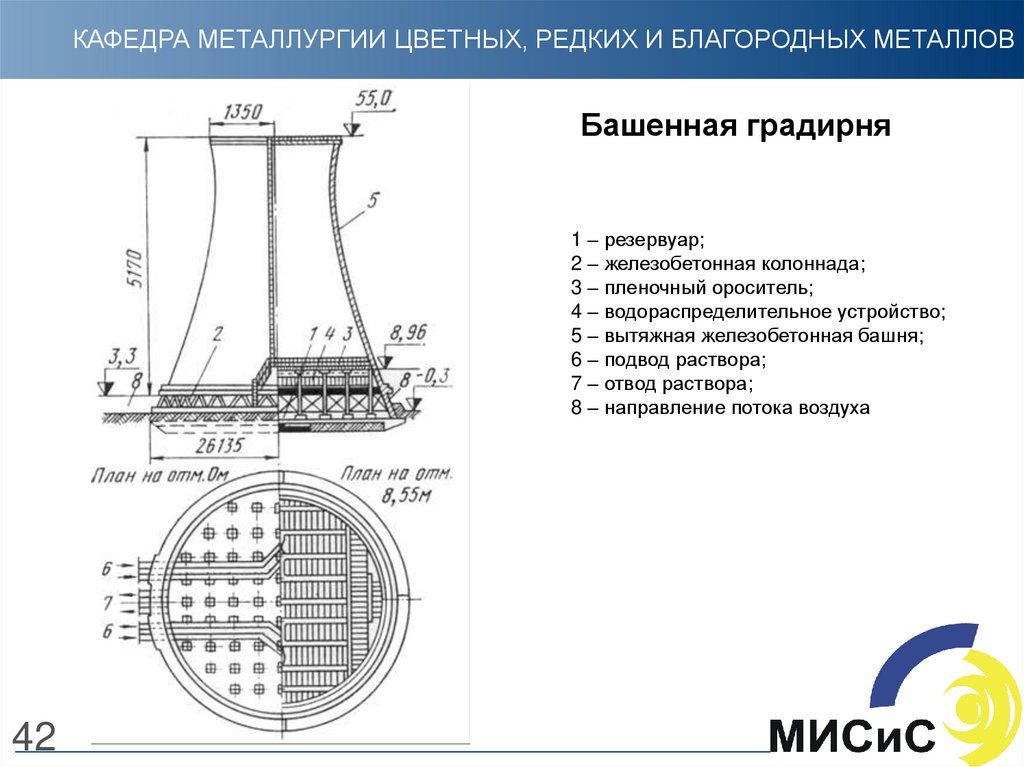
42. Башенная градирня
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВБашенная градирня
1 – резервуар;
2 – железобетонная колоннада;
3 – пленочный ороситель;
4 – водораспределительное устройство;
5 – вытяжная железобетонная башня;
6 – подвод раствора;
7 – отвод раствора;
8 – направление потока воздуха
42
43. Турбулентный контактный абсорбер для охлаждения электролита
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВТурбулентный контактный
абсорбер для охлаждения
электролита
1 – люк;
2 – входное отверстие;
3 – первая площадка;
4 – шары из пластмассы;
5 – лестница;
6 – лестничная клетка;
7 – вторая площадка;
8 – каплеуловитель;
9 – выходное отверстие;
10 – форсунка для электролита;
11 – решетка;
12 – люк;
13 – смотровое окно;
14 – корпус;
15 – индикатор уровня жидкости;
16 – манометр;
17 – насос
43
44. Схема вакуум-испарительной установки
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСхема вакуум-испарительной установки
1 – главный конденсатор;
2 – средний конденсатор;
3 – малый конденсатор;
4 – эжектор;
5 – сепаратор;
6 – испаритель;
7 – чан с холодным
электролитом;
8 – чан с горячим электролитом;
9 – барометрический чан;
10 – чан с нейтральным
раствором;
11 – резервуар для повторного
использования
конденсированной воды
44
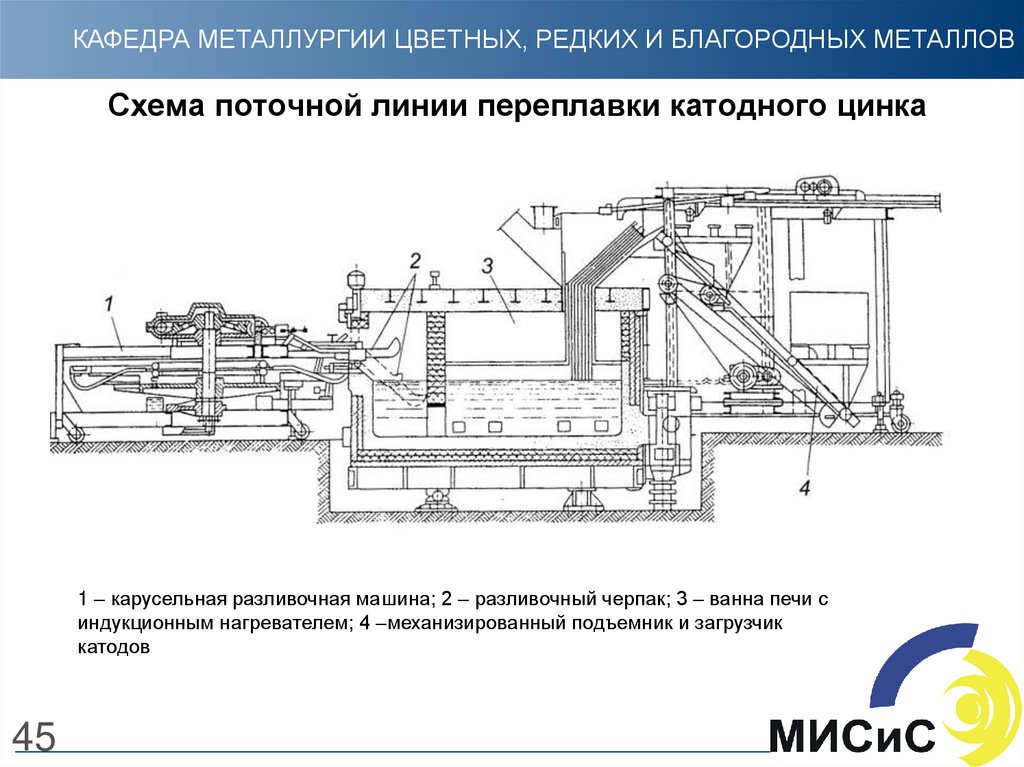
45. Схема поточной линии переплавки катодного цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСхема поточной линии переплавки катодного цинка
1 – карусельная разливочная машина; 2 – разливочный черпак; 3 – ванна печи с
индукционным нагревателем; 4 –механизированный подъемник и загрузчик
катодов
45
46. Пирометаллургический способ получения цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПирометаллургический способ получения цинка
Пирометаллургический (дистилляционный) способ основан на
химических реакциях:
2ZnS + 3O2 = 2ZnO + 2SO2 + 890 кДж
ZnO + C = Zn + CO – 238 кДж
ZnO + CO = Zn + CO2 – 65 кДж
СO2 + C = 2CO – 172,4 кДж
46
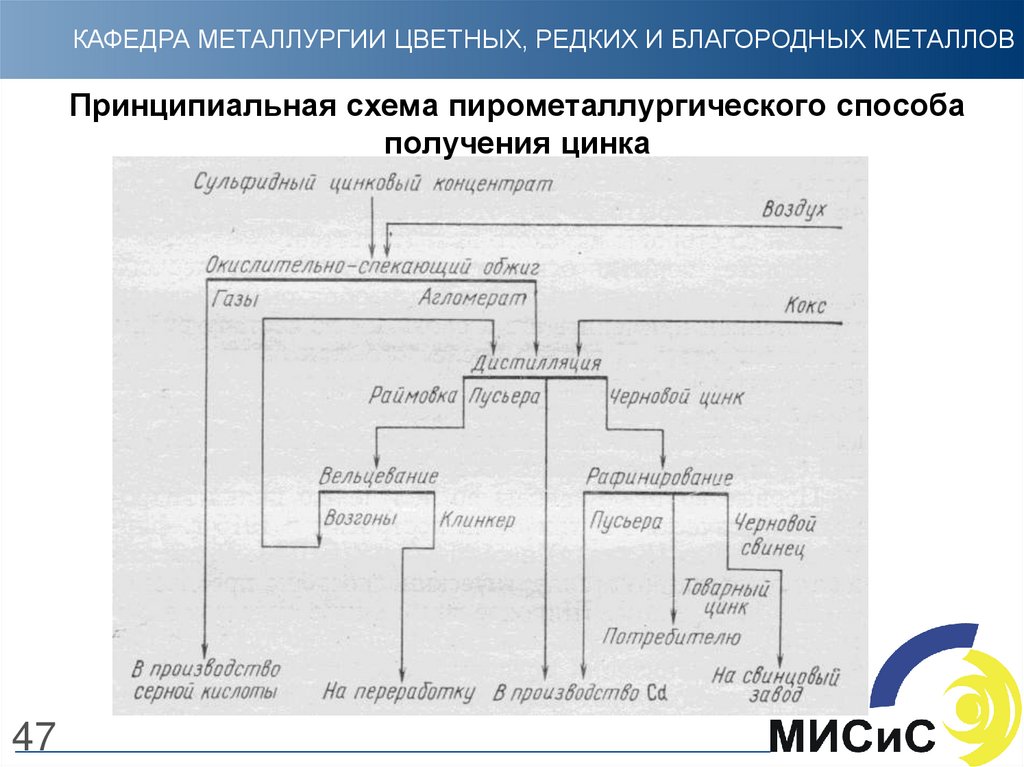
47. Принципиальная схема пирометаллургического способа получения цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПринципиальная схема пирометаллургического способа
получения цинка
47
48. Особенности обжига перед дистилляцией
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОсобенности обжига перед дистилляцией
• Обжиг сульфидных цинковых концентратов проводят в две стадии
• Применяемые технологические схемы обжига цинковых концентратов:
1. Концентрат предварительно обжигают в многоподовых или печах КС до
содержания 8-10 % серы, после чего его спекают без добавки в шихту кокса или угля
за счет сгорания сульфида
2. Концентрат предварительно обжигают в многоподовых или печах КС намертво и
огарок спекают с использованием кокса
3. Концентрат подвергают прямому обжигу со спеканием на агломерационной
машине после предварительного перемешивания с измельченным оборотным
агломератом в соотношении: 80 частей агломерата и 20 частей концентрата
• Агломерирующий обжиг проводят при температуре 1200-1300 °С
• Цинковый агломерат - плохо спеченный в небольшие куски материал, легко
поддающийся измельчению и состоящий из оксидов цинка (в основном) и других
металлов, находящихся в свободном или связанном в ферритную и силикатную формы
состоянии, а также частично присутствуют сульфиды и сульфаты металлов.
• Для обжига применяют круглые или прямолинейные агломашины
48
49.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВКруглая агломерационная машина
1 – скребок;
2 – бункер;
3 – зажигатель
49
50. Дистилляция цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДистилляция цинка
Дистилляционный способ получения цинка основан на физикохимических свойствах металлического цинка и его соединений:
1. Оксид цинка восстанавливается до металла при температурах выше 950 °С
2. Металлический цинк кипит при температуре 906 °С
При восстановлении цинк находится в парообразном состоянии, а пустая
порода остается, как правило, в твердом остатке, называемом раймовкой
Цинк – трудно восстанавливаемый металл, требующий высокой
концентрации СО в газах
Пары металлического цинка энергично окисляются СО2, кислородом воздуха
и парами воды – восстановление ведут в закрытых сосудах
Шихта состоит из цинкового агломерата и богатых цинком оборотных
материалов цинкового производства, к которым добавляют восстановитель
(коксик или антрацитовый штыб – (мелочь)) в количестве 35-40 %
50
51. Дистилляция цинка (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДистилляция цинка (продолжение)
Дистилляционный процесс включает четыре основные стадии:
1. Восстановление оксида цинка до металла
2. Испарение (возгонка) металлического цинка
3. Удаление парогазовой смеси из реакционной зоны
4. Конденсация паров металлического цинка
• Оксид цинка восстанавливается оксидом углерода по реакции
ZnO + CO = Zn + CO2 ,
скорость которой зависит от реакции газификации углерода
СО2 + C = 2CO
• Оксид цинка может восстанавливаться и железом
ZnO + Fe = Zn + FeO
• Ферриты (и силикаты) цинка восстанавливаются оксидом углерода :
ZnO×Fe2O3 + СО = ZnO + 2FeO + CO2
ZnO ×SiO2+ CO = Zn + SiO2 + CO2
51
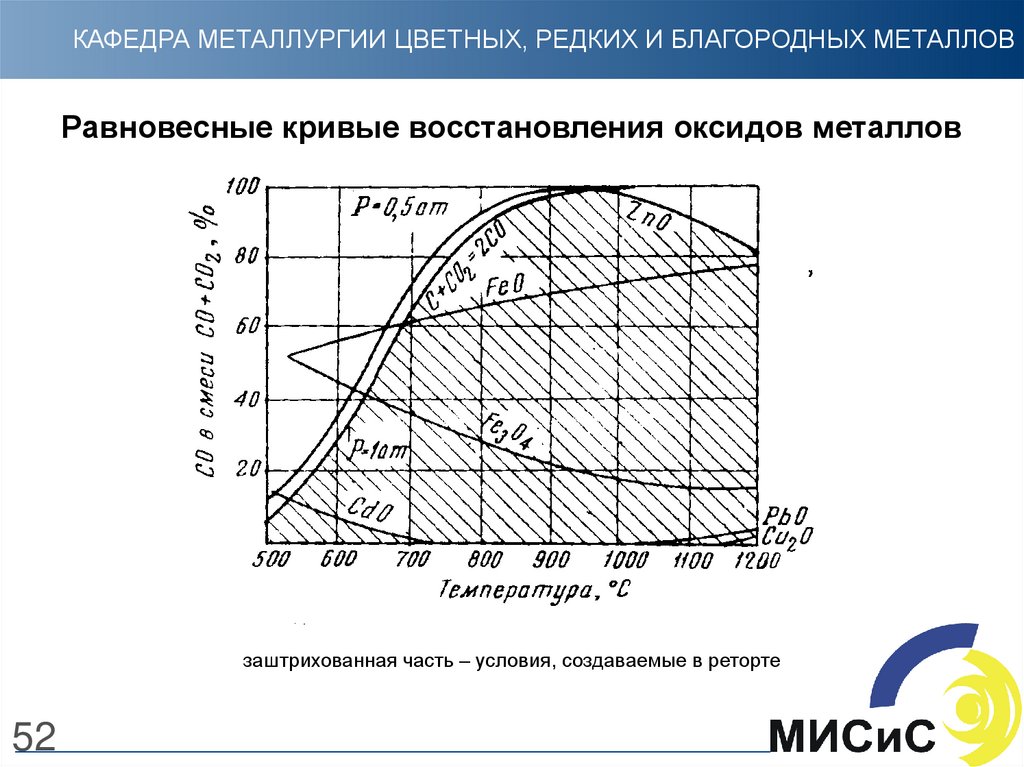
52.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВРавновесные кривые восстановления оксидов металлов
заштрихованная часть – условия, создаваемые в реторте
52
53. Дистилляция цинка (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДистилляция цинка (продолжение)
• Оксид цинка может восстанавливаться и железом
ZnO + Fe = Zn + FeO
• Сульфидный цинк практически не восстанавливается и переходит в
раймовку (так же, как и алюминат цинка – цинковая шпинель)
• Сульфатная сера так же вредна, как и сульфидная, так как она
переводит цинк в раймовку по реакциям:
ZnSO4 = ZnO + SO2 + 0,5O2
2SO2 + 2C = 2CO2 + S2
2Zn + S2 = 2ZnS
и (или)
ZnSO4 + 4СО = ZnS + 4CO2
ZnSO4 + 4C = ZnS + 4CO
ZnSO4 + 2C = ZnS + 2CO2
53
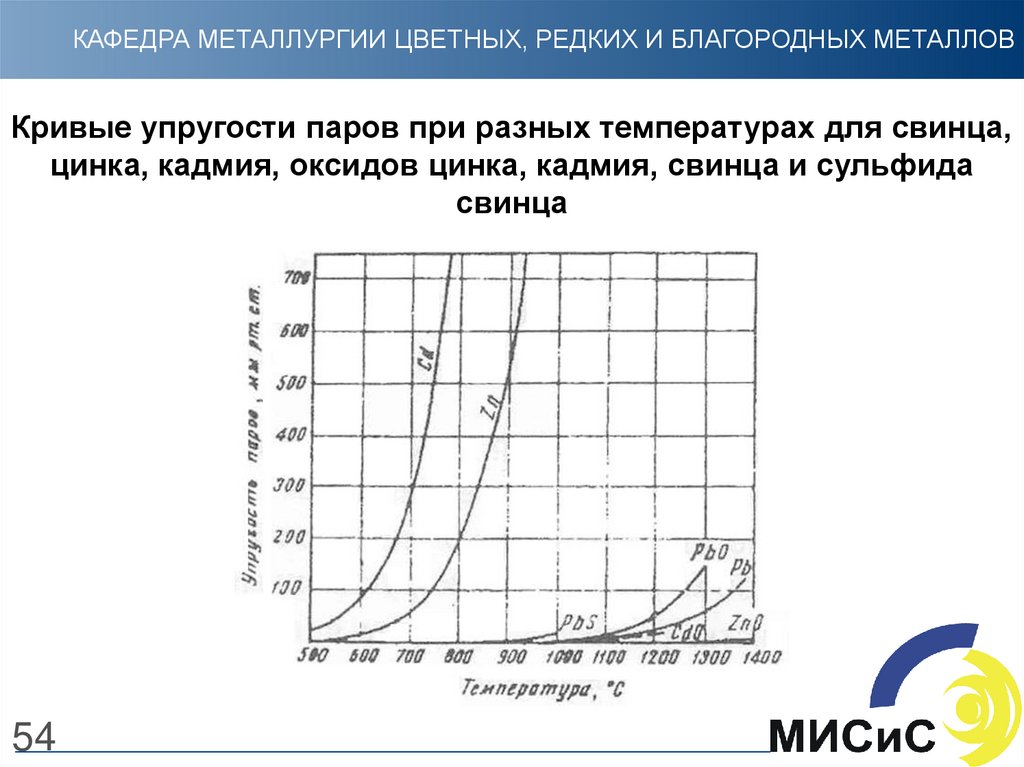
54.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВКривые упругости паров при разных температурах для свинца,
цинка, кадмия, оксидов цинка, кадмия, свинца и сульфида
свинца
54
55. Поведение металлов-примесей при дистилляции
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПоведение металлов-примесей при дистилляции
Свинец частично испаряется и, конденсируясь, загрязняет цинк. Большая часть
свинца остается и переходит в раймовку
Медь нелетуча и вся остается в раймовке, а сульфиды переходят в штейн.
Кадмий легко восстанавливается до металла из свободного или связанного оксида
CdO + CO = Cd + CO2
Кадмий имеет высокую упругость пара и легко летуч. При восстановлении кадмий получается в
парообразном состоянии и, частично конденсируясь с цинком, загрязняет его. Значительная доля
кадмия переходит в пыль (пусьеру), которая заметно им обогащена и служит сырьем для получения
кадмия
Мышьяк и сурьма содержатся в агломерате в виде нелетучих оксидов и
арсенатов, антимонатов металлов типа MeO×As2O5 и MeO×Sb2O5. При дистилляции
эти соединения восстанавливаются до летучих трехоксидов и металлов, возгоняясь,
они загрязняют цинк и пусьеру.
Золото и серебро при дистилляции остаются в твердых остатках процесса –
раймовке, а при частичном расплавлении шихты они переходят в свинец и штейн.
55
56. Конденсация паров цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВКонденсация паров цинка
65
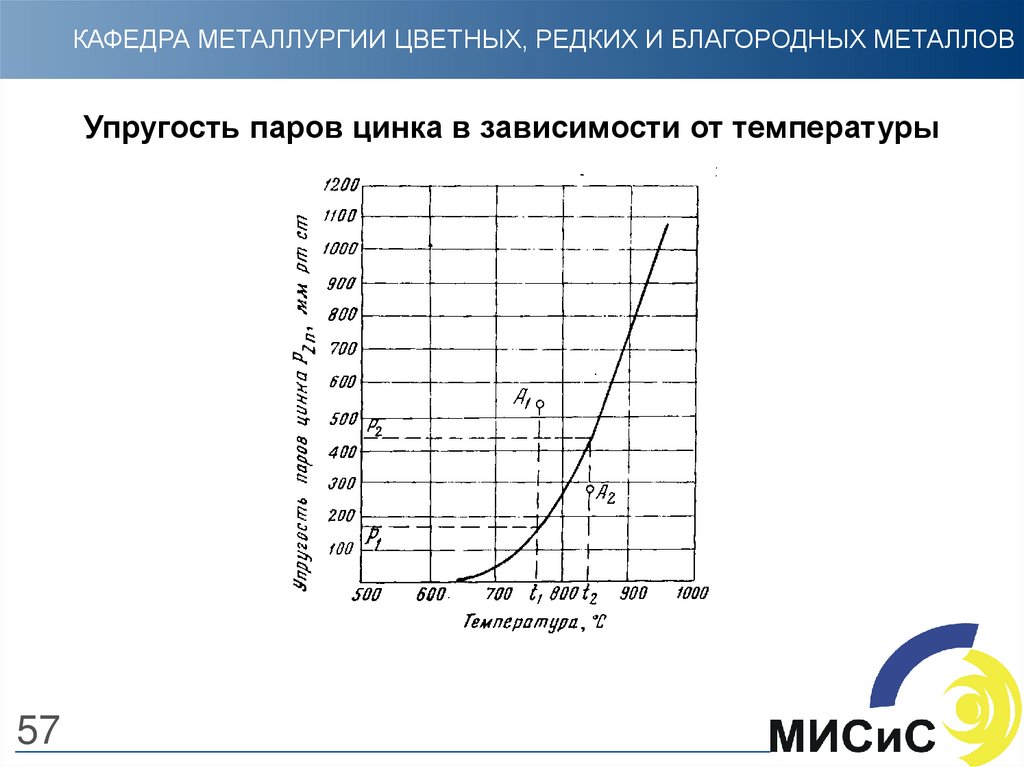
Цинк в момент восстановления находится в парообразном состоянии. Согласно приведенной
зависимости (слайд 57), каждой температуре соответствует определенное давление пара цинка.
При нарушении этого равновесия система не будет находиться в стабильном состоянии и в ней
возникнут процессы, приближающие систему к состоянию равновесия
Например, точка А1, находясь выше кривой давления паров, т.е. в области пересыщенного пара,
характеризует неравновесное состояние системы, в которой должен протекать процесс
конденсации, понижающий упругость пара. Этот процесс будет протекать до тех пор, пока не будет
достигнуто давление пара Р1, отвечающее температуре t1
Точка А2, находясь в области ненасыщенного пара, характеризует состояние системы, в которой
при данной температуре t2 давление пара меньше упругости насыщенных паров. Поэтому при
наличии конденсированной фазы в системе будет происходить процесс испарения, протекающий
до тех пор, пока давление пара в системе не достигнет величины Р2, отвечающей температуре t2.
Если нет конденсированной фазы, то при охлаждении А2 наступит момент, когда пары станут
насыщенными и при дальнейшем охлаждении часть их конденсируется.
Температура, при которой существует равновесие между парообразной и конденсированными
фазами с определенным давлением паров, называется точкой росы.
Эта точка или температура фиксирует начало конденсации при охлаждении паров с определенным
давлением. При охлаждении перегретых (ненасыщенных) паров цинка равновесие между
парообразной и конденсированной фазами с давлением, равным 105 Па, наступит при 906 С.
Эта температура и будет точкой росы для чистых цинковых паров при их давлении 105 Па.
57.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВУпругость паров цинка в зависимости от температуры
57
58. Дистилляция цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДистилляция цинка
Дистилляционная печь:
1, 2 – подсводовые каналы
для газа, воздуха и отвода
продуктов горения;
3 – реторта;
4 – конденсатор;
5 – чугунные полки для
конденсатора;
6 – выгрузка раймовки;
7 – алонж
58
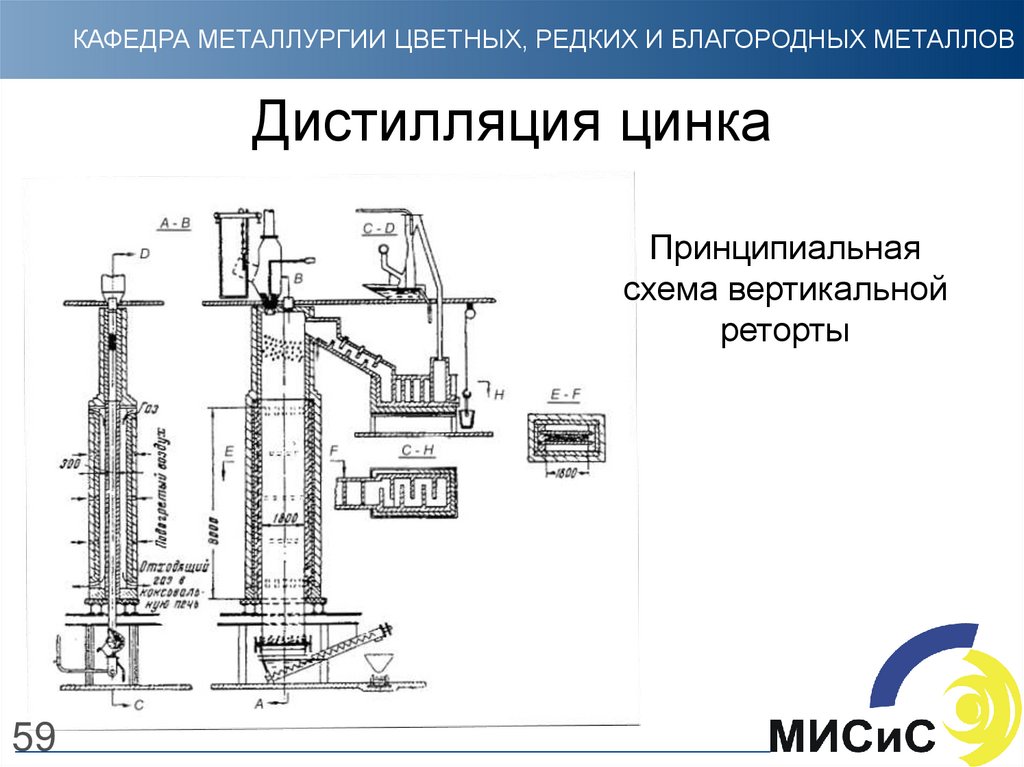
59. Дистилляция цинка
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДистилляция цинка
Принципиальная
схема вертикальной
реторты
59
60.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСхема шахтной электропечи для производства цинка
1 – бункера агломерата, кокса;
2 – прокалочная печь;
3 – горелка;
4 – питатель;
5 – верхние электроды;
6 –нижние электроды;
7 – водоохлаждаемый опорный обод;
8 – вращающийся разгрузочный стол;
9 – ковшовый транспортер;
10 – кольцевой газосборник;
11 – конденсатор
60
61.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСтык шахтной печи с вакуумным конденсатором
1 – змеевики для охлаждения цинка;
2 – зумпф-холодильник;
3 – конденсатор;
4 – печь
61
62.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВРуднотермическая печь для процесса «Стерлинг»
1 – печь;
2 – контейнер;
3 – электроды;
4 – трансформатор;
5 – конденсатор;
6 – зумпфы;
7 – летки
62
63.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСтруйный конденсатор к печи “Стерлинг”
63
64.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВРазбрызгиватель для цинка
1 – опорная рама;
2 – текстропный привод;
3 – пробка;
4 – стальной полый водоохлаждаемый вал;
5 – графитовый разбрызгиватель;
6 – графитовый чехол вала;
7 – донная торцовая защитная пробка
64
65. Плавка в шахтных печах с жидкостной конденсацией цинка (Процесс «Imperial-Smelting»)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПлавка в шахтных печах с жидкостной конденсацией цинка
(Процесс «Imperial-Smelting»)
65
Сущность процесса. Свинцово-цинковую шихту обжигают и агломерируют. Агломерат
в смеси с коксом плавят в шахтной печи. Получающиеся при этом свинец и шлак
выпускают для разделения в передний отстойник, а газ направляют в конденсатор,
орошаемый свинцом. Цинк, конденсируясь и частично адсорбируясь, растворяется в
свинце. При охлаждении сплава в ликвационной ванне цинк отделяется, свинец
возвращается в конденсатор. Газы после конденсатора очищают от пыли и сжигают
для подогрева подаваемого в печь воздуха и кокса.
Шахтная печь имеет переменное поперечное сечение, по конструкции аналогична
свинцовоплавильным печам, и снабжена колошником – закрытого типа. Верхняя часть
шахты выполнена из шамотного кирпича, нижняя - из кессонов. Площадь сечения в
плоскости фурм (нижнего ряда) 7-12,6 м2, высота реакционной зоны 5,1-5,5 м,
количество фурм 18-30 шт. Фурмы водоохлаждаемые и заглублены внутрь печи.
Производительность агрегата по шихте 100-300 т/сутки.
Особенности технологии. Агломерат и раскаленный кокс (800 °С) периодически
засыпают в воронку, поочередно питающую два двойных колокольных затвора. Дутье
подогрето до 550-650 °С, давление его автоматически регулируется таким образом,
чтобы количество газов, образующихся в процессе плавки (около 160 м3/мин),
поддерживалось постоянным; так как давление дутья изменяется в зависимости от
сопротивления столба шихты.
66. Схема процесса «Imperial-Smelting»
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСхема процесса «Imperial-Smelting»
Агломерат и кокс
Уловитель пусьеры
Кюбель
Газы
Конденсатор
Шахтная
печь
Пусьера
Сифон
Горячее
дутье
Черновой
свинец
Ликвационная ванна
Отстойник
65
Шлак
Цинк
67. Вид промышленной установки «Imperial-Smelting»
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВВид промышленной установки «Imperial-Smelting»
66
68. Особенности технологии процесса «Imperial-Smelting» (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОсобенности технологии процесса «Imperial-Smelting» (продолжение)
В условиях шахтной плавки прочность и пористость агломерата, а также
газопроницаемость шихты должна быть выше, чем в ретортном процессе.
1) Прочный и пористый агломерат получают из смеси цинкового и свинцового
концентратов или из свинцово-цинкового концентрата с отношением Zn/ Pb примерно
как 2:1. Агломерат содержит, %: 35-40 Zn, 15-20 Pb, 7-8 SiO2, 9-10 CaO и менее 1 S.
2) Необходимая газопроницаемость шихты достигается использованием кусков
агломерата и кокса крупностью 60-90 мм.
• Для снижения пылеуноса и предохранения паров цинка от окисления в верхней части
шахты создают фильтрующий слой шихты загружая раскаленный кокс, агломерат не
греют.
• Для предотвращения охлаждение парогазовой смеси и, соответственно, возможного
окисления цинка, в верхний ряд фурм печи вдувают воздух (около 12 % от общего
расхода).
• Для более полного восстановления цинка (без восстановления железа), необходимо
конечные стадии процесса проводить при высокой температуре, для чего требуется
иметь достаточно тугоплавкий шлак - с температурой плавления 1250 °С и состава, %:
30-32 СаО, 20-25 SiO2, 20-32 FeO (II) и 6-11 Al2O3. Шлаки содержат 6-7 % Zn, 0,5-0,8 %
Pb, 0,5 % Cu.
• При нормальном режиме (температуре кокса 800 °С, дутья 600 °С) расход кокса
составляет около 100 % от массы восстановленного и переведенного в возгоны цинка.
68
69. Особенности технологии процесса «Imperial-Smelting» (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВОсобенности технологии процесса «Imperial-Smelting» (продолжение)
69
Присутствие свинца в шихте способствует получению прочного агломерата, он попутно
извлекается при дистилляции цинка. Находящийся в шихте оксид свинца
восстанавливается в верхних горизонтах печи без дополнительной затраты топлива по
экзотермической реакции
PbO + CO = Pb + CO2 + Q
Содержащие пары цинка газы по футерованному газоходу поступают в два или один
конденсатор, футерованный карборундовым кирпичом. Конденсатор заполнен жидким
свинцом, разбрызгиваемым мешалками. Проходящие газы быстро охлаждаются до
450 °С, а цинк конденсируется и адсорбируется каплями свинца. Образующийся при
этом свинцово-цинковый сплав (2,3-2,4 % цинка) при температуре 560-570 °С насосами
откачивается из ванны, охлаждается до 440-450 °С и за счет снижения растворимости
в свинце цинк ликвирует. Свинец с содержанием цинка 2 % возвращается в
конденсатор.
На каждую тонну сконденсированного цинка перекачивается около 400 т и
разбрызгивается около 1000 т свинца.
Резкое охлаждение паров уменьшает окисление цинка и 87 % цинка из пара
конденсируется в металл, 8-9 % переходит в дроссы, 4-5 % выносится из конденсатора
в виде пусьеры.
70. Показатели процесса «Imperial-Smelting»
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПоказатели процесса «Imperial-Smelting»
При плавке в черновой (сырой) цинк извлекается 91-93 % металла, 6,5 % теряется в
шлаке и 2,5 % составляют неучтенные потери
В черновой свинец переходит 89 % металла, в цинке растворяется 5,5 %, 3 % свинца
теряется в шлаке и 2,5 % – неучтенные потери
Выход шлака составляет около 70 % от массы содержащегося в агломерате цинка
Достоинства и недостатки процесса «Imperial-Smelting»
70
Достоинства
Возможность комплексной переработки сложного по составу сырья (коллективные
концентраты, полупродукты обогащения и металлургического производства)
высокая производительность печей и степень их механизации
умеренный расход топлива
Недостатки
высокие требования к качеству агломерата и кокса
низкое качество чернового цинка
необходимость высококвалифицированного обслуживания
По состоянию на 1995 г. по патенту IS работало 12 печей: в Австралии, Замбии,
Франции, ФРГ, Японии, Канаде и др. странах с годовой производительностью около
400 тыс. т цинка и 200 тыс. т свинца.
71. Переработка цинксодержащих шлаков свинцовой плавки
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПереработка цинксодержащих шлаков свинцовой плавки
Шлаки свинцовой шахтной плавки содержат 10-14 % Zn, 1-2 % Pb, 0,5 % Cu, а также
Cd, Sn, In, Tl, Ge и благородные металлы. Для извлечения цинка, свинца применяют
процессы:
1) Фьюмингование (газ-процесс), в котором цинк и свинец переводят в газовую фазу из
жидкого шлака путем продувки последнего воздушно-пылеугольной смесью или
конверсированным природным газом. Это основной способ переработки шлаков
2) Вельцевание (перекатывание). Этот процесс применяют для переработки твердых
цинксодержащих материалов. В этом процессе цинк и свинец также переводят в
газовую фазу путем нагрева цинксодержащего материала в смеси с мелким коксиком
или углем в трубчатой печи диаметром 2,5-4,5 длиной 30-90 м и наклоненной на 3-5 °.
Уловленные оксидные возгоны перерабатывают на цинковом заводе с получением
цинка и остатков, которые снова направляют в свинцовое производство
3) Электротермический процесс (Стерлинг процесс). При минимальном расходе кокса
(4-5 %), необходимом для реакций восстановления, в электропечи происходит
возгонка цинка и при охлаждении парогазовой смеси возникают благоприятные
условия для конденсации цинка в виде металла. При переработке шлаков
Лениногорского свинцового завода, которые содержfли 11 % Zn и 3 % Pb. Пары цинка
конденсировались в орошаемом жидким цинком конденсаторе. Возгонка цинка
составила 85 %, из них около 83 % конденсируется в жидкий металл. Расход
электроэнергии составил 1200 кВт-ч на тонну цинка.
71
72. Шлаковозгоночный процесс - фьюмингование
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВШлаковозгоночный процесс - фьюмингование
72
Сущность процесса фьюмингования. В ванну расплавленного шлака, нагретого до
температуры 1250-1300 °С и содержащего оксиды металлов, вдувается воздух в смеси
с восстановителем (угольная пыль или продукты неполного сжигания природного газа).
Количество вводимого воздуха меньше стехиометрического для полного сжигания
восстановителя, поэтому углерод угольной пыли сгорает до СО, а природный газ – до
СО и Н2, которые восстанавливают присутствующие в шлаке оксиды металлов.
Основные реакции:
С + О2 = СО2
СО2 + С = 2СО
СН4 + 0,5О2 = СО + 2Н2
ZnO + CO = Znпар + CО2
ZnO + H2 = Znпар + H2O
Аналогично восстанавливаются и соединения свинца.
Железо частично восстанавливается до металлического, которое реагирует с оксидами
и сульфидами свинца и цинка по реакциям:
РbО + Fе = Рb + FеО
РbS + Fе = Рb + FеS
ZnS + Fe = Zn + FeS
73. Шлаковозгоночный процесс - фьюмингование
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВШлаковозгоночный процесс - фьюмингование
73
Технология процесса. Процесс фьюмингования периодический, осуществляемый
циклами. Цикл включает четыре стадии:
1) заливку шлака
2) разогрев шлака
3) восстановление и отгонку цинка
4) выпуск шлака
Шлак непосредственно из отстойника плавильных печей или из миксера ковшами
заливают в шлаковозгоночную печь по водоохлаждаемому желобу. Заполнение печи
шлаком проводят до уровня 0,9-1,6 м. В разогретую печь заливают 35-90 т жидкого
шлака и сжатым воздухом через фурмы специальной конструкции диаметром 55100 мм продувают уголь, измельченный до -0,074 мм (85 %). При восстановлении
природным газом устанавливают фурмы-топки, с помощью которых получают и подают
в расплав конверсированный газ
На стадии разогрева шлака в печь подают 80-100 % воздуха от необходимого для
сгорания угля (коэффициент избытка 0,8-1,0). При этом расплавляются все твердые
частицы шлака и температура ванны повышается до 1250-1300 °С
На стадии восстановления в ванну подают воздух с коэффициентом избытка 0,6-0,75 и
ведут продувку шлака в течение 1,5-3,0 часов
74.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВШлаковозгоночная печь (фьюминг-печь)
1 – опоры основания печи; 2 – напорный водяной коллектор; 3 – кессонированный
газоход; 4 – загрузочная воронка; 5 – упорные домкраты; 6 – колонна каркаса
печи; 7 – заливочная ложка шлака; 8 – заливочное окно; 9 – фурменные кессоны;
10 – выпускные кессоны; 11 – подовые кессоны; 12 – желоба для отвода
охлаждающей воды; 13 – коллекторы воздушные и углевоздушные; 14 – фурмы;
15 – выпускные отверстия (лётки)
74
75. Технология процесса (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВТехнология процесса (продолжение)
75
Фьюминговая печь – это аппарат шахтного типа с площадью горизонтального
сечения 3-24 м2 (2,4 х (1,2-9,6)) и высотой до 9 м
Подина печи выполнена из чугунных плит, охлаждаемых с помощью залитых в чугун
трубок, по которым циркулирует вода. Стенки печи, колошник закрытого типа и газоход
выполнены из кессонов
В боковых стенах печи непосредственно у подины установлены фурмы специальной
конструкции диаметром 55-100 мм в количестве 11-36 штук или топки-фурмы (по одной
на кессон)
Окно для заливки цинксодержащего шлака находится на высоте 1,5-2,0 м от пода печи
в торцевой стене
Имеются желоба для заливки цинковистого шлака и выпуска отвального шлака
Печь позволяет наряду с текущими шлаками перерабатывать твердые шлаки (до 20 %
в загрузке), поэтому в торцовой части для них предусмотрен люк
На колошнике печи и газоходе, отводящем газы в камеру котла-утилизатора, имеются
отверстия, через которые организованно подается в печь воздух для окисления
летящих паров цинка и свинца, сульфидов металлов, а также оксида углерода. Вся
система находится под небольшим разрежением, благодаря чему предотвращается
выделение газов и паров в атмосферу цеха
76. Технология процесса (продолжение)
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВТехнология процесса (продолжение)
76
После фьюмингования отвальный шлак выпускается из печи и направляется в отвал
Газы после сжигания летучих и оксида углерода, имеющие температуру более 1200 °С,
отводятся в котлы-утилизаторы, где они охлаждаются до 320 °С и затем
дополнительно отдают тепло в экономайзере (до 120 °С) для подогрева дутьевого
воздуха, откуда поступают на очистку от пыли в рукавные фильтры
Основное количество свинца отгоняется из шлака за 30-40 мин продувки, что связано с
высокой летучестью паров оксида и сульфида свинца. Отгонка кадмия завершается в
течение первых минут
Медь и благородные металлы при фьюминговании остаются в шлаке, что является
одним из недостатков процесса. Для их извлечения рекомендуется обрабатывать
жидкие шлаки перед продувкой сульфидами в присутствии восстановителя с целью
выделения меди, серебра и золота в штейн или сплав
Такие оксиды, как CaO и FeO, в шлаке способствуют отгонке цинка, а присутствие в
шлаке Fe2О3 и SiO2 снижает скорость и степень его отгонки. Шлаки, содержащие более
30-35 % SiO2 , настолько вязки, что их невозможно перерабатывать во фьюминг-печи
77.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВСхема цепи аппаратов передела фьюмингования шлаков
1 – электрообогреваемый отстойник шахтной печи; 2 - ковш; 3 – мостовой кран; 4 –
заливочная ложка; 5 –шлаковозгоночная печь; 6 – газоход; 7 – камера дожигания
СО и котел-утилизатор; 8 – подогреватель воздуха для шлаковозгонки; 9 –
эксгаустер; 10 – рукавный фильтр; 11 – бункер возгонов; 12 – тележка; 13 – бункер
пыли; 14 – электрообогреваемый отстойник шлаковозгоночной печи; 15 –
грануляционный желоб;16 – зумпф гранулированного шлака (бассейн)
77
78. Достоинства фьюминг-процесса
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВДостоинства фьюминг-процесса
78
Не требует подготовки сырья для переработки, так как использует жидкий шлак
шахтной печи
Используется физическое тепло жидкого шлака для ведения процесса
Большая часть тепла от сжигания топлива и окисления паров металлов используется
котлами-утилизаторами, что увеличивает КПД установки
Извлечение свинца составляет 90-98 %, цинка - 88-94 %, германия - 60 %, практически
полностью извлекаются кадмий и индий
Расход топлива составляет 20-25 % от массы перерабатываемого шлака
Производительность установки – 25-45 т шлака в сутки на каждый квадратный метр
площади пода печи
79.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВВельц-процесс
Восстановительно-дистилляционный процесс – вельцевание, нашел широкое
распространение для переработки цинковых кеков, при котором можно отогнать летучие
компоненты и получить возгоны, состоящие в основном из оксидов цинка и свинца, а в
остатке получить клинкер, содержащий медь и благородные металлы. Кроме кеков,
вельцеванием могут перерабатываться и другие цинксодержащие материалы, в которых
цинк находится в окисленном состоянии: раймовка, цинковистые шлаки свинцовой плавки,
окисленные свинцово-цинковые руды
• Обрабатываемые материалы измельчают (5-10 мм), смешивают с восстановителем и
загружают в трубчатую печь. При вращении печи шихта перекатывается, оксиды
металлов контактируют с углеродом и восстанавливаются. Количество восстановителя
в шихте зависит от легкоплавкости ее и составляет 30-45 % от перерабатываемого
материала
• Температура в печи зависит от плавкости шихты и поддерживается на пределе ее
плавления (1000-1150 °С) с тем, чтобы не образовывалась жидкая фаза,
способствующая настылеобразованию. Дополнительно на подтопку расходуется 510 % топлива от веса шихты
• Печь наклонена к горизонту на 3-5 °. Длина ее 30-90 м, диаметр 2-3,5 м. Внутри печь
футерована огнеупорным кирпичом (шамот, магнезит). Скорость вращения печи около
1 об/мин
79
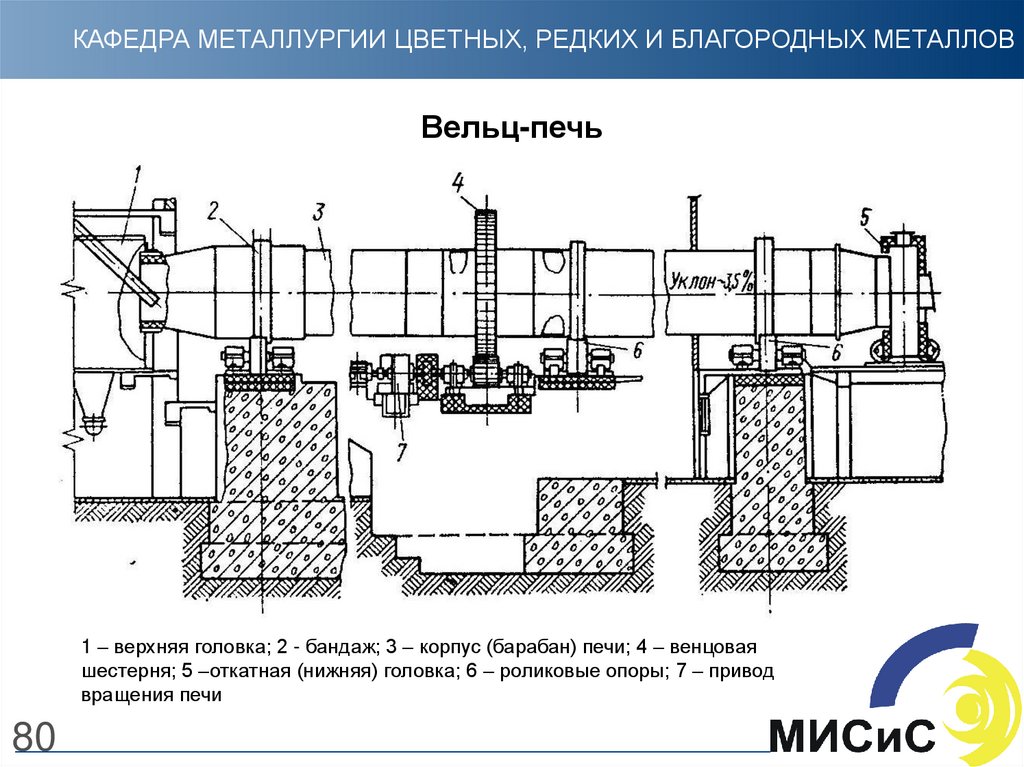
80.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВВельц-печь
1 – верхняя головка; 2 - бандаж; 3 – корпус (барабан) печи; 4 – венцовая
шестерня; 5 –откатная (нижняя) головка; 6 – роликовые опоры; 7 – привод
вращения печи
80
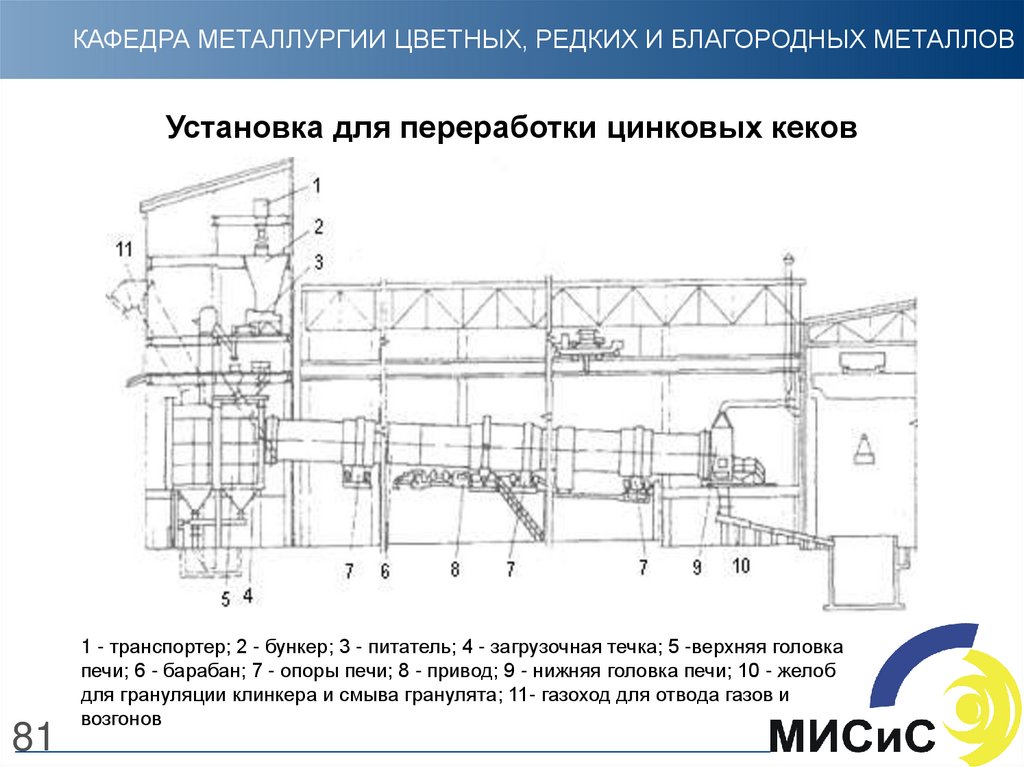
81.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВУстановка для переработки цинковых кеков
81
1 - транспортер; 2 - бункер; 3 - питатель; 4 - загрузочная течка; 5 -верхняя головка
печи; 6 - барабан; 7 - опоры печи; 8 - привод; 9 - нижняя головка печи; 10 - желоб
для грануляции клинкера и смыва гранулята; 11- газоход для отвода газов и
возгонов
82.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВПереработка конденсаторной пыли и пусьеры
Конденсаторная пыль и пусьера состоит из металлических зерен, покрытых тонкой
оболочкой оксида цинка. Если эту оболочку разрушить, то отдельные зерна образуют при
плавлении жидкий цинк. Разрушение оксидных пленок достигается при перекатывании
пыли внутри вращающегося и герметично закрытого барабана при относительно
невысоких температурах
• Барабан представляет собой цилиндр из жароупорного чугуна длиной 2 м и диаметром
1 м, футерованный внутри карборундовым кирпичом, с двумя крышками, в которых
выполнены отверстия для загрузки исходных материалов и выгрузки продуктов
процесса
• Цилиндрическая часть барабана размещена в топке печи, где за счет сжигания
углеродистого топлива поддерживается температура около 600 °С для создания внутри
барабана температурного режима на уровне 450 °С. Опорные узлы барабана и привод
вращения находятся снаружи печи
• Скорость вращения барабана в среднем составляет 8 об/мин
• Загрузка барабана и выгрузка продуктов проводится вручную
• Длительность операции составляет 8 ч (вместо 24 ч в реторте)
• Извлечение цинка от общей массы исходных материалов составляет 75 %, от
металлической составляющей – 92 %
82
83.
КАФЕДРА МЕТАЛЛУРГИИ ЦВЕТНЫХ, РЕДКИХ И БЛАГОРОДНЫХ МЕТАЛЛОВБарабанная печь для переработки конденсаторной пыли и пусьеры
1 – лётка; 2 – отверстие для загрузки шихты; 3 – барабан; 4 – аварийный приямок
83




































































 Промышленность
Промышленность








