Похожие презентации:
Неметаллы. Агрегатные состояния неметаллов
1.
Неметаллы2.
Агрегатные состояния неметалловТвёрдое
Жидкое
Газообразное
B, C, Si, S, I
Br
Cl, H, O, N
3.
СераБром
Йод
Хлор
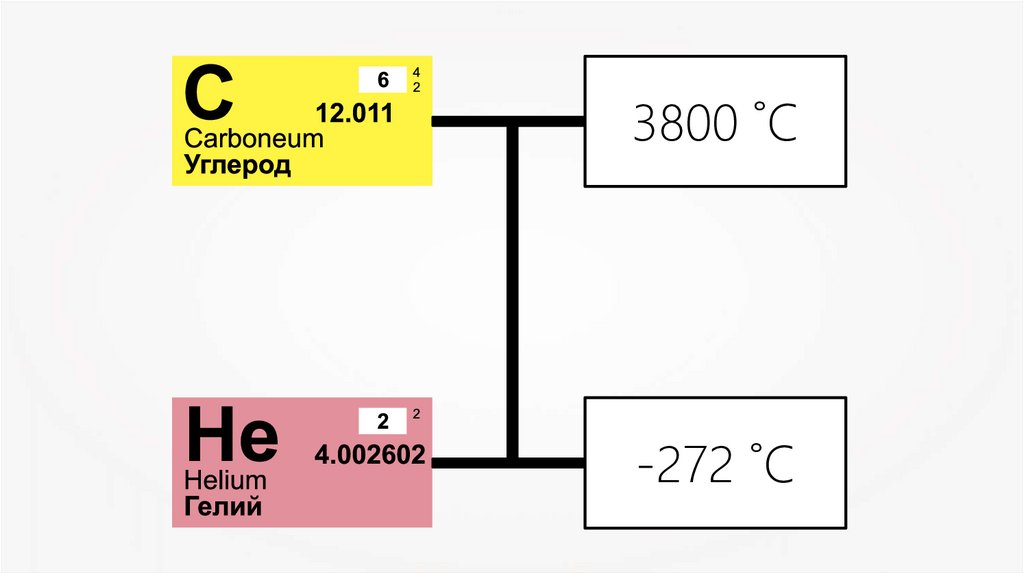
4.
3800 ˚С-272 ˚С
5.
Благородные газы — VIII группа периодической системы, они инертны. Галогеныи кислород, наоборот, очень химически активны. Сера, углерод и кремний,
как правило, вступают в реакции при повышенных температурах.
6.
РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВSi Te B As H P I
Se
C
S
Br
Усиление электроотрицательности
Cl
N O
F
7.
Окислительные свойства неметалловПри взаимодействии с металлами:
0
0
+2 -2
2Mg + O2 = 2MgO
При взаимодействии с водородом:
0
0
+1
-2
S + H2 = H2S
0
0
+1 -1
H2 + Cl2 = 2HCl
При взаимодействии с неметаллами с меньшим значением
электроотрицательности:
0
0
+4 -1
С + 2F2 = CF4
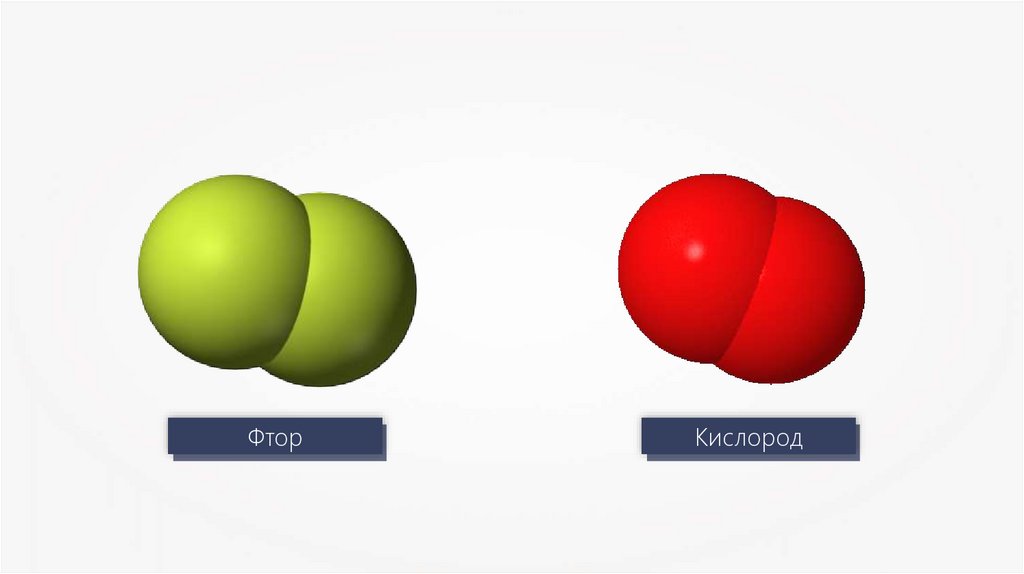
8.
ФторКислород
9.
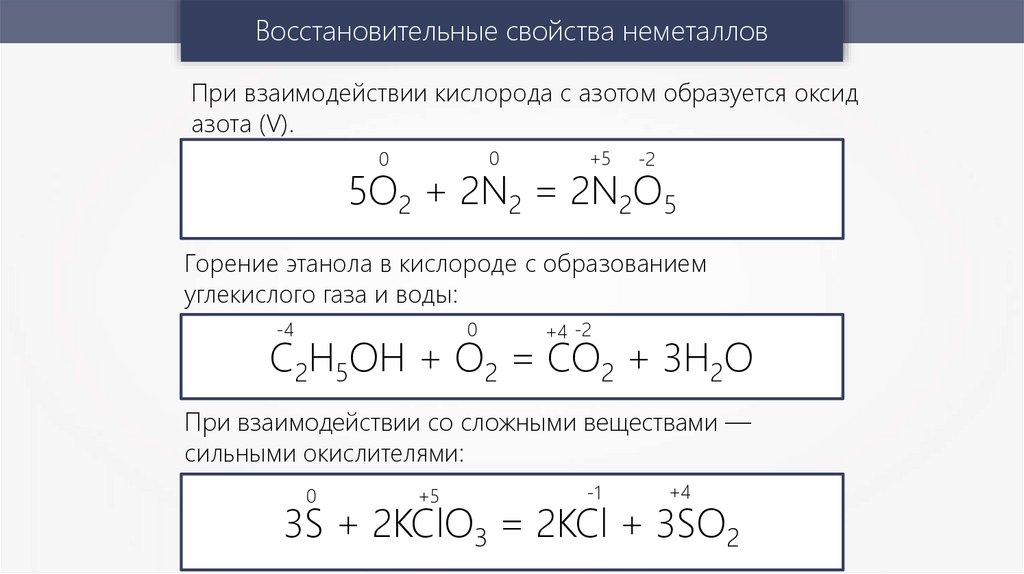
Восстановительные свойства неметалловПри взаимодействии кислорода с азотом образуется оксид
азота (V).
0
0
+5
-2
5O2 + 2N2 = 2N2O5
Горение этанола в кислороде с образованием
углекислого газа и воды:
-4
0
+4 -2
C2H5OH + O2 = CO2 + 3H2O
При взаимодействии со сложными веществами —
сильными окислителями:
0
+5
-1
+4
3S + 2KClO3 = 2KCl + 3SO2
10.
Значение электроотрицательности в группе галогенов сверху-вниз уменьшается, что говорито том, что галоген, стоящий ниже в группе, будет проявлять восстановительные свойства.
11.
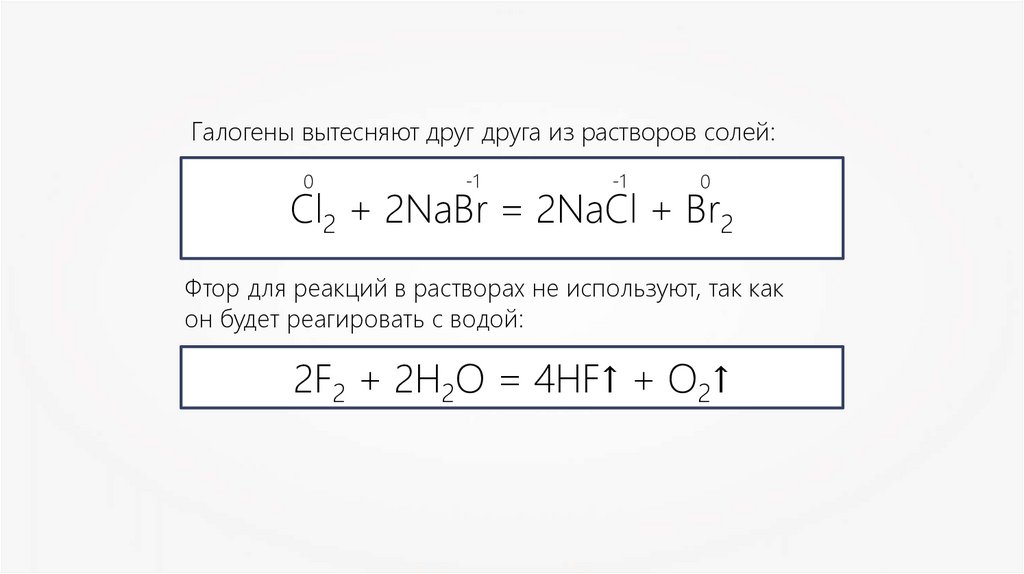
Галогены вытесняют друг друга из растворов солей:0
-1
-1
0
Сl2 + 2NaBr = 2NaCl + Br2
Фтор для реакций в растворах не используют, так как
он будет реагировать с водой:
2F2 + 2H2O = 4HF↑ + O2↑







 Химия
Химия