Похожие презентации:
Общая характеристика неметаллов
1.
Удивить готов он нас Он и уголь, и алмаз,Он в карандашах сидит,
Потому что он —
графит. Грамотный
народ поймет То, что
это углерод
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без кислорода
В воздухе он главный
газ, Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках
живет Важный элемент азот
2.
Неметаллыобщая
характеристика
3.
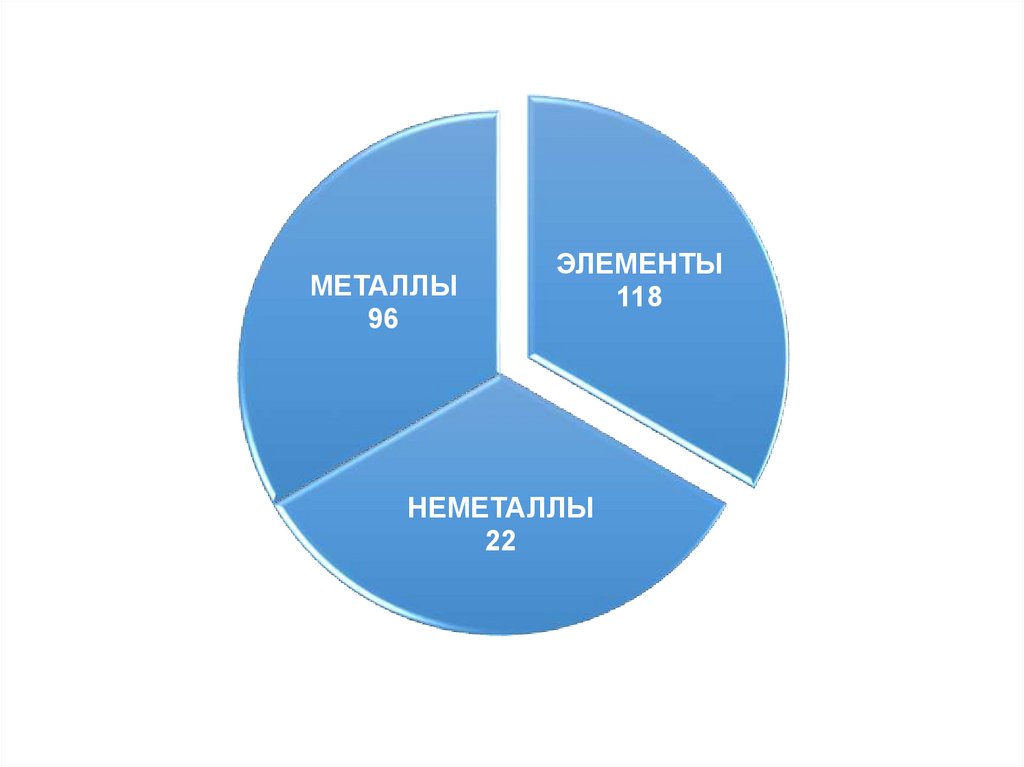
МЕТАЛЛЫ96
ЭЛЕМЕНТЫ
118
НЕМЕТАЛЛЫ
22
4.
Кислород и кремний составляют 76% от массыземной коры (О – 49%, Si – 27%)
C,H,O,N, – биогенные элементы, составляют 98,5% от
массы растений и 97,6% от массы тела животных
5.
Положение НеМе в ПСХЭ Д.И. МенделееваГр у п п ы э л е м е н т о в
I
1
II
III
IV
V
VI
VII
VIII
1
2
Н 1,00797 He 4,0026
1 (H)
5
6
7
8
Водород
9
Гелий
2
2
В 10,811 С 12,0112 N 14,0067 O 15,9994 F 18,9984 Ne 10
20,163
3
3
14 Р 15 S 16 Cl 17 A 1
Si 28,086
30,9738
32,064
35,453
39,948
Кремний Фосфор
Сера
Хлор
Аргон8
r
Бор
4
Углерод
4
Азот
Кислород
6
5
5
5 Xe 131,30
5
T 127,60
I 126,904
2
Ксенон4
Иод 3
eТеллур
7
8
6
8
A 8210 Rn [222]
5 Радон6
tАстат
9
7 10
ЛВ
С
Неон
3
3
3
3
K 83,80
As 74,9216
Se 78,96
B 79,904
3 Селен4 Бром5 Криптон6
Мышьяк
r
r
5
Высшие
оксиды
Фтор
R2 O
RO
R2 O3
RO2
R2 O5
RO3
R2 O7
RH4
RH3
H2 R
HR
RO4
6.
Особенности атомного строения неметалловНебольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение
электроотрицательности
7.
- 3 период , VIIА группа35
+17 Сl
p+ = 17; n0 = 18; ē = 17
2ē 8ē 7ē
+17
2ē 8ē 7ē
2
2
6
2
5
1s 2s 2p 3s 3p
↓↑ ↓↑ ↓↑ ↑
3s2
3p5
8.
Физические свойства простых веществ неметаллов.Агрегатное состояние
Газы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
9.
Цвет неметалловБелый
Фосфор
Черный
Фосфор
Желто-зеленый
Хлор
Графит
10.
КрасныйЖелтый
Фиолетовый
Фосфор
Сера
Йод
Бесцветный
Углерод
11.
Температура плавления• 3 8000 С – у графита
• - 2100 С - азота
12.
Типы кристаллических решетокМолекулярная решетка
Атомная решетка
Молекулы
Атомы
Слабые межмолекулярные
взаимодействия
Прочная ковалентная
связь
Примеры
Кислород
Азот
Фосфор
Сера
Йод
Углерод (алмаз)
Кремний
Бор
Физические
свойства
Малая прочность
Низкие температуры
кипения и плавления
Высокая летучесть
Высокие температуры
кипения и плавления
Частицы в
узлах
решетки
Связь между
частицами
13.
АллотропияАллотропия (от др.-греч. αλλος — «другой»,
τροπος — «поворот, свойство») — существование
одного и того же химического элемента в виде
двух и более простых веществ, различных по
строению
и
свойствам
(аллотропные
модификации).
разные типы кристаллических решеток
разная структура кристаллических решеток
разный состав молекул
14.
Разные типы кристаллических решетокР - фосфор
Красный фосфор
- атомная
Белый фосфор
- молекулярная
15.
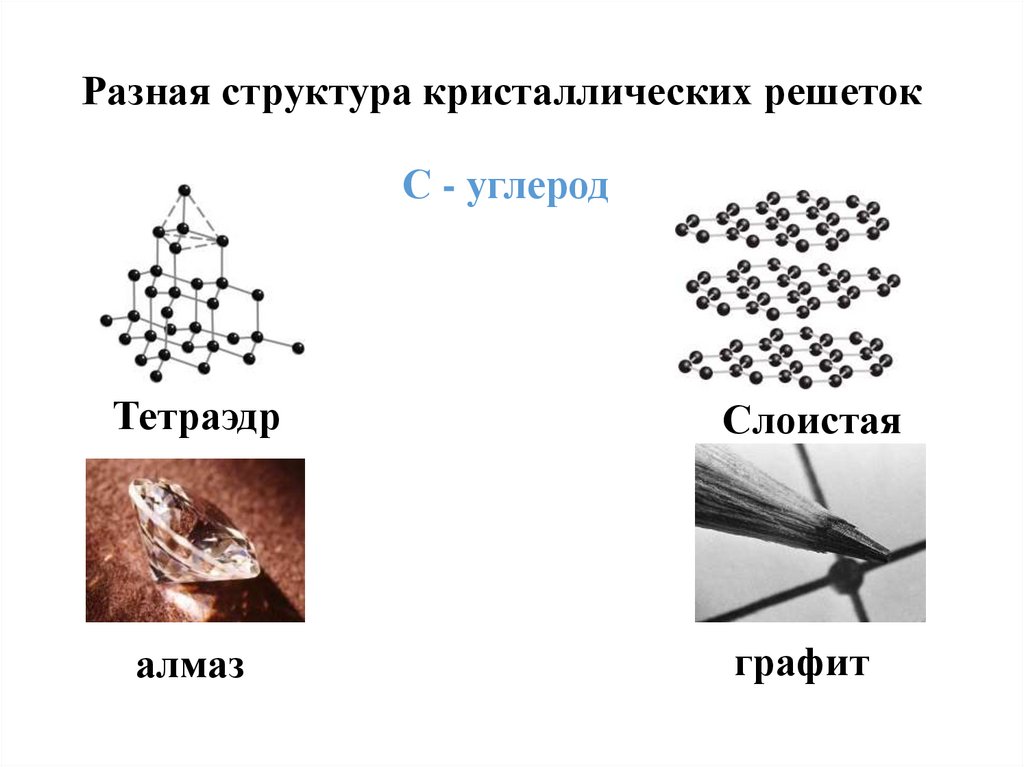
Разная структура кристаллических решетокС - углерод
Тетраэдр
Слоистая
алмаз
графит
16.
Разный состав молекулО - кислород
Кислород
Озон
О2
О3
17.
Химические свойства неметаллов.Неметаллы могут выступать в качестве окислителей
или восстановителей.
Эти способности определяются
электроотрицательностью неметалла:
F → O → N → Cl → Br → S → C → H
электроотрицательность уменьшается.
18.
Окислительные свойства.1. Взаимодействие с металлами
2K + S0 = K2S-2
3Ca + N20 = Ca3N2-3
2Fe + 3Cl20 = 2FeCl3-1
19.
2. Взаимодействие с другими неметаллами.0
+6 -1
0
S + 3F2 = SF6
фторид серы (VI)
у F электроотрицательность больше, чем у S – F окислитель
0
+1 -2
0
S + H 2 = H2 S
у S электроотрицательность больше, чем у Н – S окислитель
0
0
+2 -1
S + Cl2 = SCl2
хлорид серы (II)
у Сl электроотрицательность больше, чем у S – Cl
окислитель
20.
3. Окисление сложных веществ.-2
0
-1
0
-2
+4
2F2 + 2H2O = 4HF + O2
-4
0
CH4 + 2O2 = 2H2O + CO2
-1
0
-1
0
2KBr + Cl2 = 2KCl + Br2
21.
Восстановительные свойства.1. Взаимодействие с другими неметаллами
0
0
+2 -2
N2 + O2 ↔ 2NO
2. Восстановление сложных веществ.
3H2 + WO3 = 3H2O + W
С + 2H2SO4 = CO2 + 2SO2 + 2H2O
S + 2KClO3 = 3SO2 + 2KCl
бертолетова
соль
22.
Окислительно-восстановительная двойственность.0
-1
+1
Cl2 + 2KOH хол. р-р = KCl + KClO + H2O
0
-1
+5
Cl2 + 6KOH гор. р-р = 5KCl + KClO3 + 3H2O
23.
Домашнее задание.Принести 2-ю часть учебника. Разобрать общую
характеристику неметаллов по презентации. Выучить
её.
Решите задачу:
Образование азотной кислоты протекает в соответствии с
термохимическим уравнением реакции:
2H2O (ж) + 4NO2 (г) + O2 (г) = 4HNO3 (г) + 258 кДж. Определите
массу оксида азота (IV), вступившего в реакцию; если
выделилось 2580 кДж теплоты.
24.
1. В ядре атома химического элемента содержится125 нейтронов, что на 40 единиц больше числа
протонов. Что это за элемент?
2. Запишите уравнение реакций между
следующими веществами:
а) натрием и хромом
б) углеродом и оксидом меди (II)
в) сероводородом и кислородом.
Напишите схемы электронного баланса






















 Химия
Химия








