Похожие презентации:
Алюминий и его свойства
1. «Алюминий и его свойства»
9 класс«Алюминий и его
свойства»
Бозаджи Н.М.,
учитель химии,
высшая категория
2.
Великие законы мирозданья в сущности,наивны и просты.
И порой Вам не хватает знанья
для разгадки этой простоты.
3. Прослушав легенду, попробуйте отгадать о каком элементе 3-й группы идет речь?
4.
“Однажды к древнеримскому императору Тибериюправившему Римом в 14–27 гг. н. э., пришёл
ремесленник и принёс чашу
невиданной красоты, изготовленную из серебристого и
на удивление лёгкого металла. На вопрос императора о
названии чудесного
металла ремесленник ответил, что
металл получен им из …глины и пока
не имеет названия. “Дальновидный”
император,испугавшись, что новый металл,
который можно получать из обыкновенной глины,
обесценит серебро и подорвёт могущество Рима,
повелел:
чашу уничтожить, ремесленника обезглавить, а его
мастерскую сравнять с землёй!”
5. Как вы думаете о каком металле идет речь?
Верно!Речь сегодня пойдет,
ОБ АЛЮМИНИИ
6. Тема урока: «Алюминий и его свойства»
30.10.13г.Тема урока:
«Алюминий и его свойства»
7. В результате изучения темы вы будете способны:
Давать хар-ку алюминия какхим.элементу по ПСХЭ
Давать хар-ку алюминию как простого в-ва
по плану:
- получение
- физические свойства
- химические свойства
- применение алюминия
Быть толерантными! Анализировать и делать
выводы! Отстаивать свою точку зрения!
Уважать мнение других!
8. I. Характеристика химического элемента:
1.Порядковый номер № = 132.Относительная
Ar (Al) = 27
27
атомная масса
3.Заряд ядра атома Z = +13
+13
р+ = 13
4.Число протонов
5.Число электронов ē = 13
6.Число нейтронов n0 =27-13=14
0
9. II.Нахождение в природе
По распространенности в земной коре алюминийзанимает 3-е место после кислорода и кремния
среди всех атомов и 1-е место — среди металлов.
Встречается только в составе соединений.
10. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
АЛЮМОСИЛИКАТЫКОРУНД Al2O3
– прозрачные кристаллы
11. III. Получение алюминия:
Впервые алюминий был получендатским физиком Гансом Эрстедом в
1825 году действием амальгамы калия
на хлорид алюминия с последующей
отгонкой ртути. Название элемента
образовано от лат. aluminis — квасцы.
AlCl3 + 3K = 3KCl + Al
В настоящее время алюминий
получают электролизом оксида:
эл.ток
2Al2O3 = 4Al + 3O2 – 3352 кДж
12.
эл.ток2Al2O3
4Al + 3O2
13. IV. Физические свойства алюминия:
Агрегатное состояниеЦвет
Блеск
Плотность
Твердость
Пластичность
Прочность
Растворение в воде
Теплопроводность
Магнитные свойства
Электропроводность
Работа с учебником: стр. 47-48
14. IV. Физические свойства алюминия:
Алюминий –• металл серебристо- белого
цвета,
• лёгкий ( q= 2,7 г/ см3),
• ковкий,
• пластичный,
• электро- и теплопроводный,
легко поддаётся обработке,
образует лёгкие и прочные
сплавы,
• магнитных свойств нет.
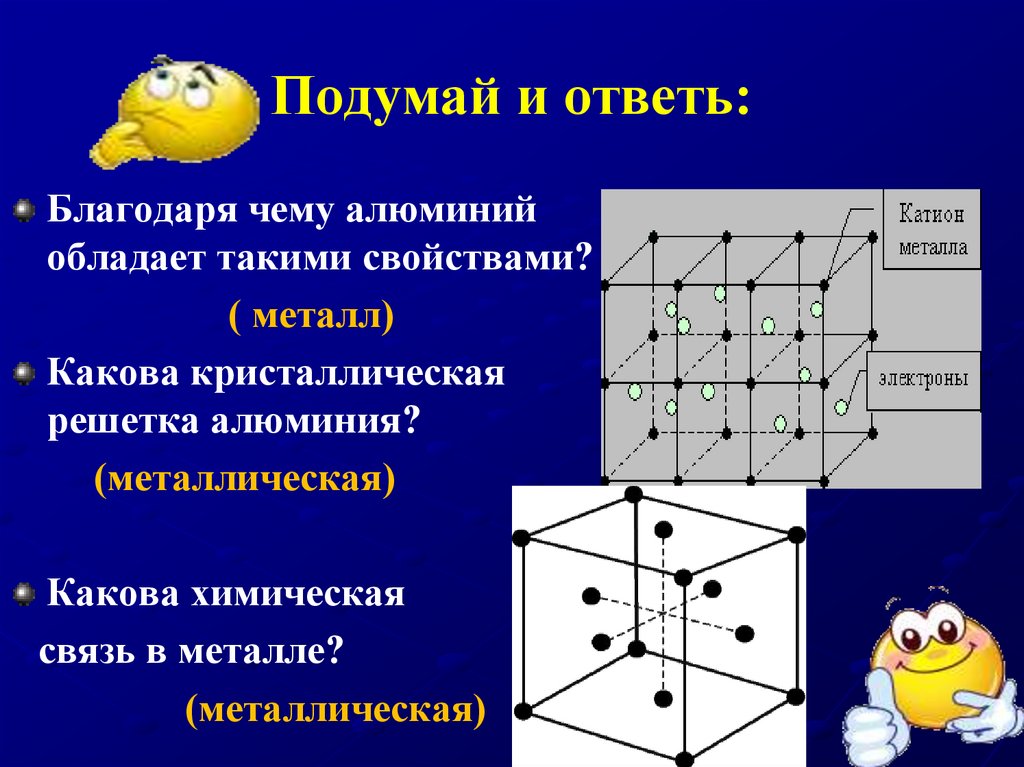
15. Подумай и ответь:
Благодаря чему алюминийобладает такими свойствами?
( металл)
Какова кристаллическая
решетка алюминия?
(металлическая)
Какова химическая
связь в металле?
(металлическая)
16. V. Химические свойства алюминия:
Алюминий – активный металл?0
Al Al
27
3ē
13
+3
2ē
8ē 3ē
ок-ся
вос-ль
17.
Ребята,Ребята,берегите
берегите
зрение!
зрение!
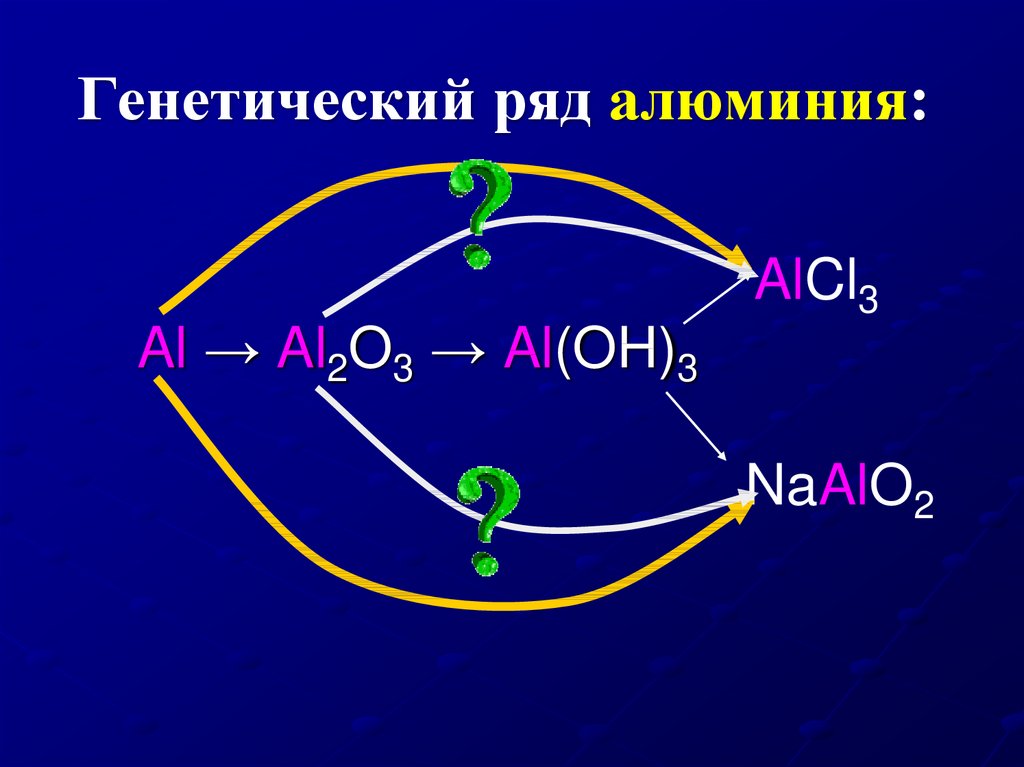
18. Генетический ряд алюминия:
Al → Al2O3 → Al(OH)3AlCl3
NaAlO2
19.
А.Взаимодействие с простыми веществамиРеакция
алюминия
С серой
С йодом
С бромом
t0
С
кислородом
воздуха
2Al+3S = Al2S3
2 Al+3I2 = 2Al I3
(видео)
2Al+3Br2 = 2Al Br3
(видео)
4Al+3O2 = 2Al2O3
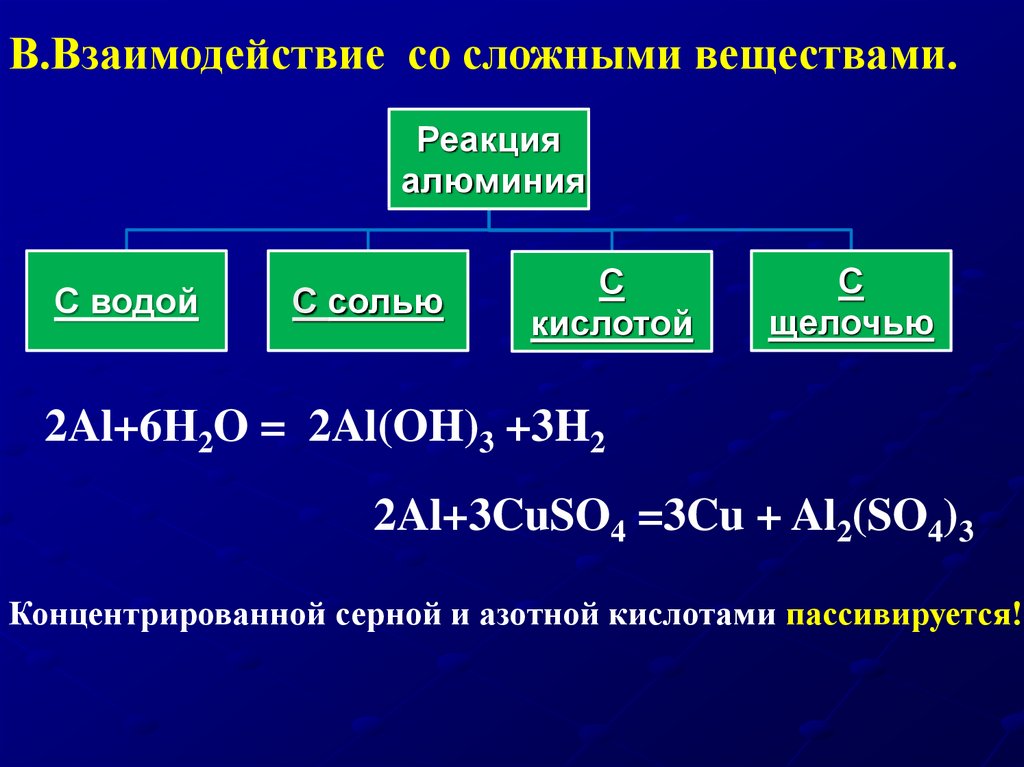
20.
В.Взаимодействие со сложными веществами.Реакция
алюминия
С водой
С солью
С
кислотой
С
щелочью
2Al+6Н2O = 2Al(OH)3 +3H2
2Al+3CuSO4 =3Cu + Al2(SO4)3
Концентрированной серной и азотной кислотами пассивируется!
21. Амфотерность алюминия:
Al → Al2O3 → Al(OH)3AlCl3
NaAlO2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
2Al+2NaOH + 2H2O = 2NaAlO2 + 3H2
22. Активность алюминия
Вывод: Алюминий - активный металл,реагирует со многими простыми и
сложными веществами.
В реакциях является восстановителем
неметаллов и менее активных
металлов.
Алюминий амфотерный металл –он
реагирует и с кислотами и с
основаниями.
23. VI. Применение алюминия
для производства легких сплавов (дюралюмин, силумин)в самолето– и автомобилестроении
для покрытия чугунных
и стальных изделий с
целью повышения их
коррозионной стойкости
для изготовления
контейнеров, фольги
в строительной
промышленности
24. NB!Сплавы на основе алюминия
Алюминиево-магниевыеАлюминиево-марганцевые
Алюминиево-медные
Сплавы системы Al-Zn-Mg
Алюминиево-кремниевые сплавы
(силумины)
Комплексные сплавы на основе
алюминия: авиаль, дюралюминий
25. Алюминий в мировой культуре
Поэт Андрей Вознесенский написал в 1959году стихотворение «Осень», в котором
использовал алюминий в качестве
художественного образа:
…А за окошком в юном инее
лежат поля из алюминия…
26. Алюминий в мировой культуре
Виктор Цой написал песню «Алюминиевыеогурцы» с припевом:
Я сажаю алюминиевые
огурцы
На брезентовом поле
Я сажаю алюминиевые
огурцы
На брезентовом поле
27. Токсичность Al
Отличается незначительным токсическимдействием, но многие растворимые в
воде неорганические соединения
алюминия сохраняются в растворённом
состоянии длительное время и могут
оказывать вредное воздействие на
человека и теплокровных животных
через питьевую воду. Наиболее ядовиты
хлориды, нитраты, ацетаты, сульфаты
28. Экспресс- опрос
1.Сколько электронов на последней оболочке у атомаалюминия. А.1 В.4 C. 3 D. 6
2. С какими из указанных веществ реагирует алюминий?
А. СаО
C. HCl
В. Cl2
D. Fe(OH)3
3. Какие из указанных металлов являются более
активными, чем алюминий?
А. Na
В. Ca
C. Cu
D. Fe
4. Наиболее характерная степень окисления алюминия:
А. +1
В. +3
C. +2
D. +4
5. Алюминий в химических реакциях проявляет
свойства:
А. окислителя
C. инертного соединения
В. восстановителя
D. окислителя и восстановителя
1
C
2
B, C
3
А, В
4
В
5
В
29. Подведем -итоги
Над какой темой мы сегодня работали?Что нового мы узнали об алюминии?
Решили ли мы проблему об активности
алюминия?
К каким выводам пришли?
Оцените свою работу на уроке!
30.
«Острова»о. Грусти
о.Тревоги
о.Просветления
о.Бермудский
треугольник
31.
Домашнее заданиеРазобрать
и выучить конспект.
Выучить параграф: § 2.8
Выполнить упр: 1,3,2* стр. 51.





























 Химия
Химия








