Похожие презентации:
Карбоновые кислоты. Нахождение в природе
1.
КАРБОНОВЫЕ КИСЛОТЫ2.
3.
4.
5.
6.
• Карбоновые кислоты – это вещества,содержащие в молекуле одну или
несколько карбоксильных групп.
• Общая формула:
CnH2n+1COOH
RCOOH.
7.
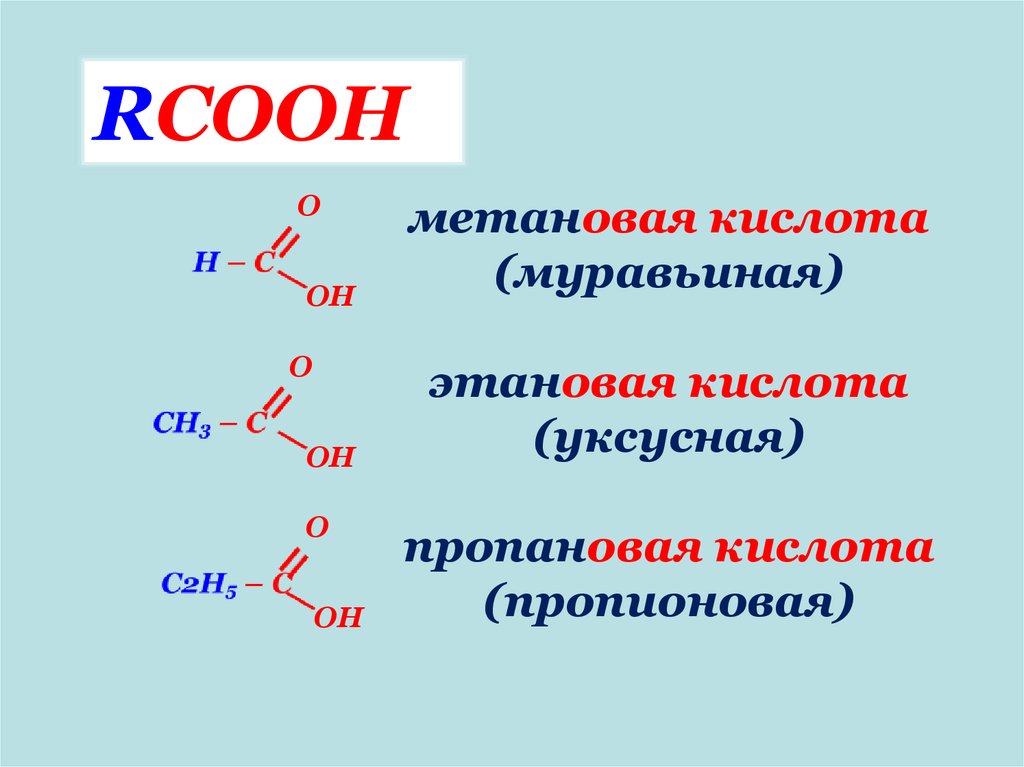
RCOOHO
OH
O
OH
O
OH
метановая кислота
(муравьиная)
этановая кислота
(уксусная)
пропановая кислота
(пропионовая)
8.
М (Cn H2n+1 CОOH )=116 г/ моль12n+2n+1+12+16+16+1=116
14n+46=116
14n=70
n=5
C5H11COOH гексановая кислота
9.
МЕТАНОВАЯ КИСЛОТА(МУРАВЬИНАЯ КИСЛОТА)
10. Например:
21
СН3 – СООН
ЭТАНОВАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА
4
3
2
1
СН3 – СН2 – СН2 – СООН
БУТАНОВАЯ КИСЛОТА
МАСЛЯНАЯ КИСЛОТА
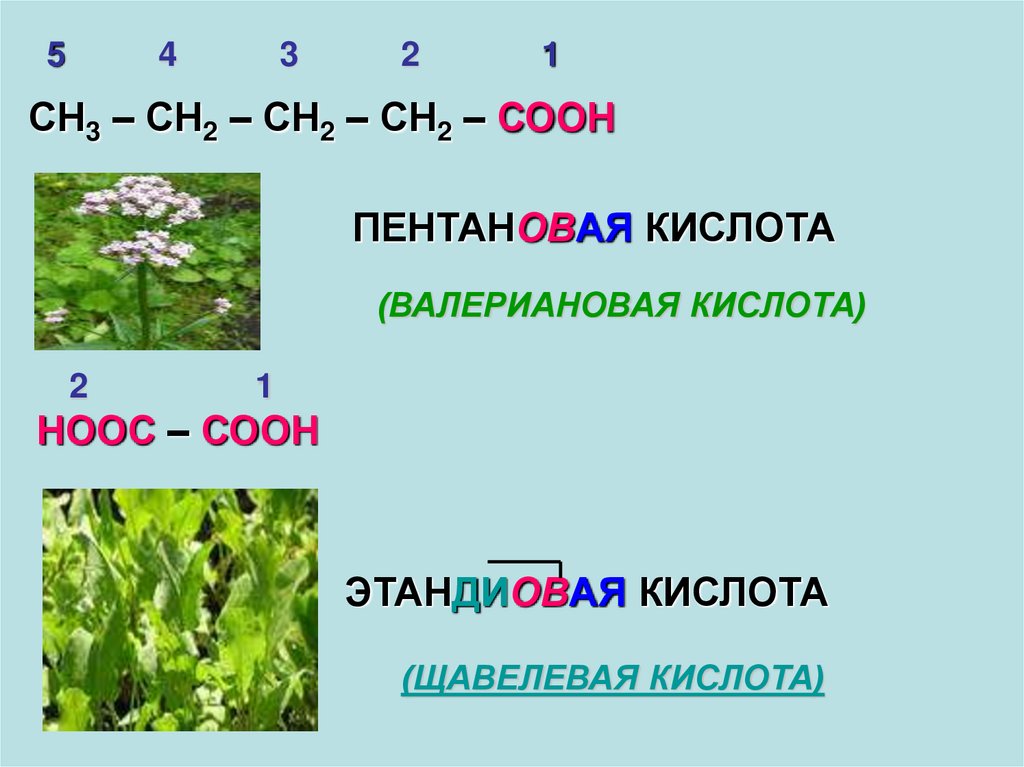
11.
54
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
2
1
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
12.
32
1
СН3 – СН (ОН) – СООН
2 – ГИДРОКСОПРОПАНОВАЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)
13. НАХОЖДЕНИЕ В ПРИРОДЕ
14.
Муравьиная кислота (метановая кислота)Муравьиная кислота
присутствует также
в тончайших волосках
крапивы, в пчелином
яде, сосновой хвое, в
небольших
количествах найдена
в различных фруктах,
тканях, органах,
выделениях
животных и
человека.
15.
16.
Лимонная кислотаCOOH
HOOC – CH2 – C – CH2 – COOH
OH
Муравьиная кислота
Н –– COOH
Щавелевая кислота
HOOC –– COOH
Ацетилсалициловая
кислота
СООН
ОСОСН3
Винная кислота
HOOC – СН - СН –– COOH
ОН ОН
Янтарная кислота
HOOC – СН2 - СН2 –– COOH
Бензойная
кислота
СООН
Молочная кислота
СН3 - СН –– COOH
ОН
Яблочная кислота
HOOC – СН - СН2 –– COOH
ОН
Аскорбиновая
кислота
НО ОН
Н
=О
НОН2С-НОНС
Уксусная кислота
H3C –– COOH
О
17.
КЛАССИФИКАЦИЯОДНООСНОВНЫЕ
СН3 – COOH
МНОГООСНОВНЫЕ
HOOC – СН2 – COOH
18. КЛАССИФИКАЦИЯ
ПРЕДЕЛЬНЫЕС2Н5СООН
пропановая кислота
НЕПРЕДЕЛЬНЫЕ
С2Н3СООН
пропеновая кислота
19. КЛАССИФИКАЦИЯ
ПРЕДЕЛЬНЫЕС17Н35СООН
СТЕАРИНОВАЯ
КИСЛОТА
НЕПРЕДЕЛЬНЫЕ
С17Н33СООН
ОЛЕИНОВАЯ КИСЛОТА
С17Н31СООН
ЛИНОЛЕВАЯ КИСЛОТА
С17Н29СООН
ЛИНОЛЕНОВАЯ
КИСЛОТА
20.
ФИЗИЧЕСКИЕ СВОЙСТВА21.
С1 –С4 –
Жидкости с характерным
резким запахом, хорошо
С3 растворимые в воде
Вязкие
маслянистые
С9 жидкости с неприятным
запахом, плохо растворимые
в воде
C10 и >
Твердые
вещества,
не имеющие запаха, не
растворимые в воде
22.
«ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ»цель: изучить свойства карбоновых кислот
23.
НСООНформиат
СН3СООН
ацетат
24.
НСООНформиат
СН3СООН
ацетат
25.
НСООНформиат
СН3СООН
ацетат
26.
1.Молекулы кислот в водном растворедиссоциируют
CH3COOH → H+ + CH3COO-
27.
2.Кислоты реагируют с металлами2CH3COOH + Mg → (CH3COO)2Mg + H2↑
ацетат магния
28.
3. Кислоты реагируют с основными иамфотерными оксидами
2CH3COOH + MgO→ (CH3COO)2Mg + H2O
29.
4. Кислоты реагируют с гидроксидамиCH3COOH + NaOH → CH3COONa + H2O
30.
5. Кислоты реагируют с солями более слабых илетучих кислот
CH3COOH + NaHСО3 → CH3COONa + Н2O+ СО2
31.
6. Кислоты реагируют со спиртамиCH3COOH + С5Н11ОН →CH3COOС5Н11 + H2O
32.
6. Муравьиная кислота подобноальдегидам легко окисляется
(реакция «серебряного зеркала»)
НСООН + Ag2О → НОСООН + 2Ag↓
Н2О СО2
угольная кислота
33.
ПРИМЕНЕНИЕстр 197
МУРАВЬИНАЯ
КИСЛОТА
ЩАВЕЛЕВАЯ
КИСЛОТА
УКСУСНАЯ
КИСЛОТА
34. Муравьиная кислота:
• в текстильной промышленности (вкачестве протравы при крашении тканей);
• в кожевенной (при дублении кож);
• в пищевой (для консервирования фруктов);
• в медицине;
• в производстве некоторых полимеров
35. Уксусная кислота:
• в пищевой промышленности (дляконсервации);
• для получения полимеров, красителей,
сложных эфиров, ацетатного шелка,
негорючей фото - и кинопленки;
• Широко используются соли уксусной
кислоты:
- ацетаты железа, хрома, алюминия в качестве
протравы при крашении ткани;
- ацетат меди – для борьбы с вредителями с/х;
- ацетат свинца – для изготовления свинцовых
белил
36. Щавелевая кислота:
• для отбеливания тканей;• в производстве красителей;
• в кожевенной и деревообрабатывающей
промышленности;
• для удаления ржавчины и накипи;
• в пищевой промышленности.


































 Химия
Химия








