Похожие презентации:
Трансаминирование. Тема 13
1. Трансаминирование.
Биохимическое значение и механизмдействия аминотрансфераз.
Диагностическое значение
аминотрансфераз в сыворотке крови.
2.
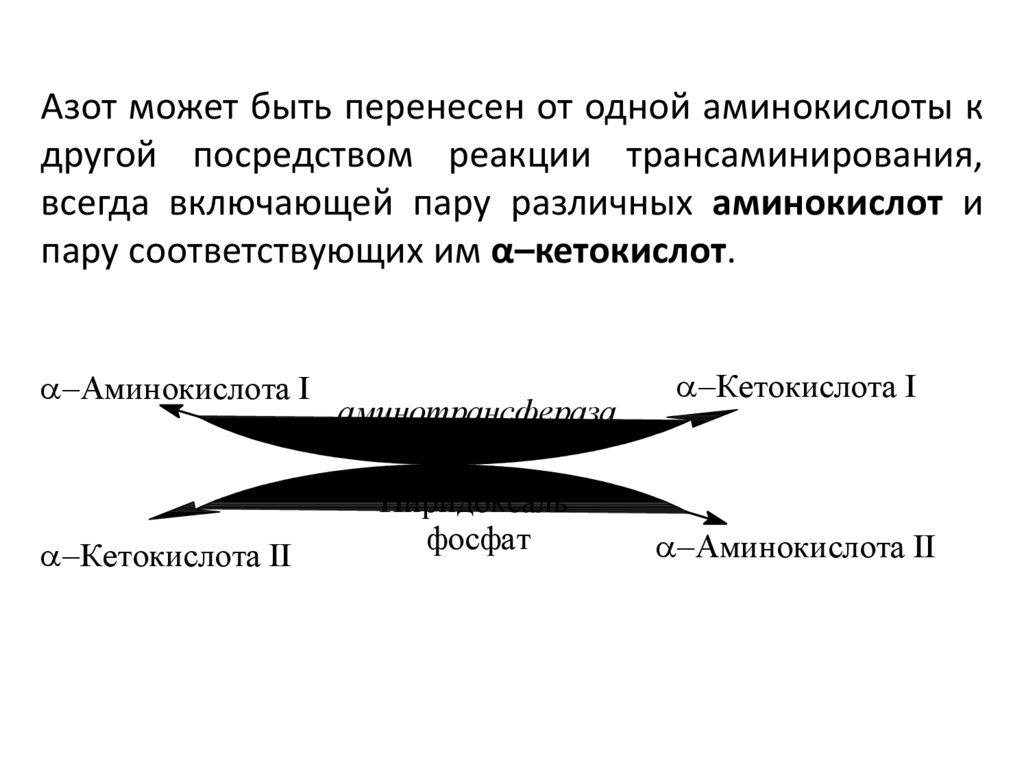
Азот может быть перенесен от одной аминокислоты кдругой посредством реакции трансаминирования,
всегда включающей пару различных аминокислот и
пару соответствующих им α–кетокислот.
Aминокислота I
Кетокислота II
аминотрансфераза
Пиридоксаль
фосфат
Кетокислота I
Aминокислота II
3.
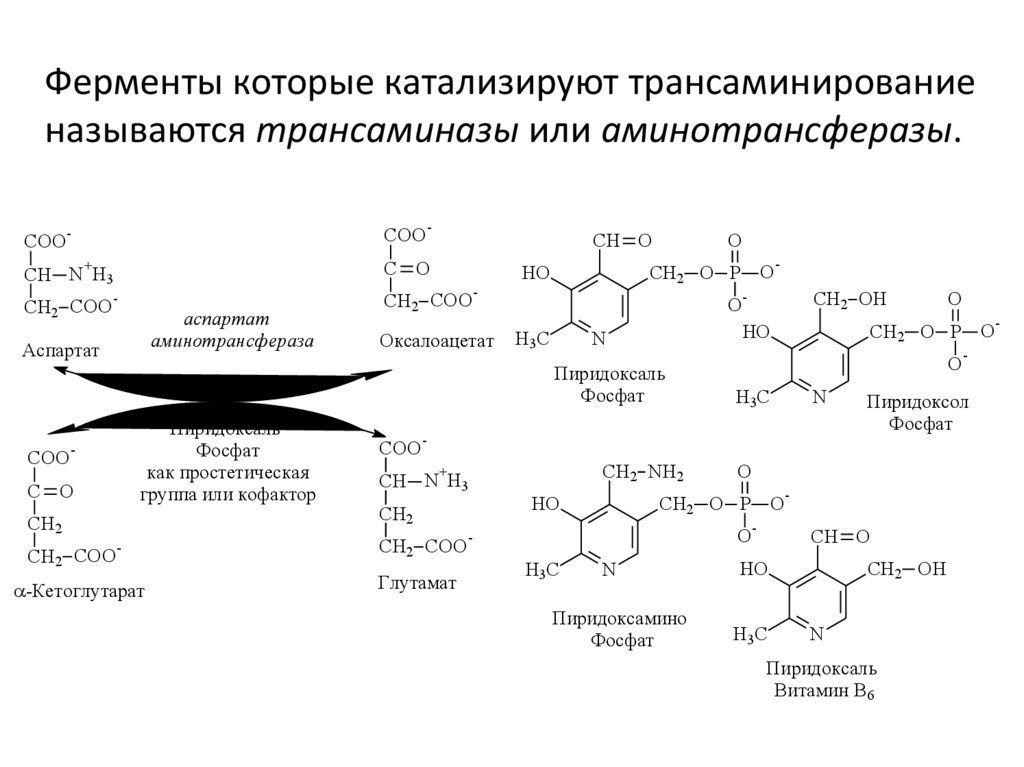
Ферменты которые катализируют трансаминированиеназываются трансаминазы или аминотрансферазы.
COO
COO
-
-
CH O
CH N H3
C O
CH2 COO
CH2 COO
+
аспартат
аминотрансфераза
Аспартат
CH2 O P O
HO
-
Оксалоацетат
O
O
H3C
COO
C O
Пиридоксаль
Фосфат
как простетическая
группа или кофактор
CH2
CH2 COO
-Кетоглутарат
COO
CH2 OH
-
O
H3C
N
-
CH2 NH2
+
CH N H3
CH2
CH2 COO
Глутамат
O
-
H3C
N
Пиридоксамино
Фосфат
-
-
CH O
HO
H3C
-
Пиридоксол
Фосфат
O
CH2 O P O
HO
O
CH2 O P O
HO
N
Пиридоксаль
Фосфат
-
-
CH2 OH
N
Пиридоксаль
Витамин В6
-
4.
• Одной из пар обычно служат глутамат иα–кетоглутарат.
• Реакция трансаминирования легко обратима и
может быть использована как для синтеза так и
распада аминокислот.
• Большинство аминокислот участвуют в реакциях
трансаминирования, за исключением L-Лизина.
• Пиридоксаль фосфат служит кофакторм в реакциях
трансаминирования и является производным
витамина B6.
5.
Роль глутамата.1. Глутамат играет ключевую роль в метаболизме
азота в аминокислотах.
2. Глутамат отбирает аммиак от других аминокислот
в реакции трансаминирования.
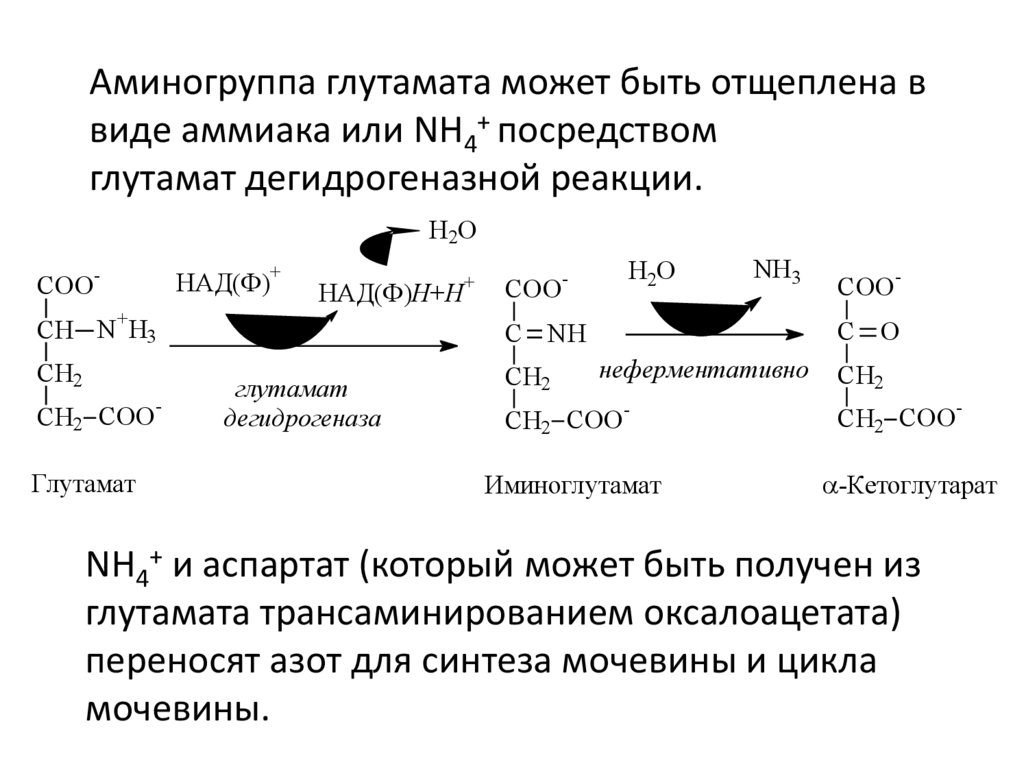
3. Аминогруппа глутамата может быть отщеплена в
виде аммиака или NH4+ посредством
глутамат дегидрогеназной реакции.
6.
Аминогруппа глутамата может быть отщеплена ввиде аммиака или NH4+ посредством
глутамат дегидрогеназной реакции.
H2O
COO
+
-
НАД(Ф)
НАД(Ф)H+H
+
CH N H3
CH2
CH2 COO
Глутамат
-
+
COO
H2O
-
NH3
CH2
-
C O
C NH
глутамат
дегидрогеназа
COO
неферментативно
CH2 COO
-
Иминоглутамат
CH2
CH2 COO
-
-Кетоглутарат
NH4+ и аспартат (который может быть получен из
глутамата трансаминированием оксалоацетата)
переносят азот для синтеза мочевины и цикла
мочевины.
7.
Глутамат транспортирует и предоставляет азот длясинтеза многих аминокислот.
• NH4+ может предоставлять азот для синтеза
аминокислот взаимодействием c α–кетоглутаратом с
образованием глутамата в глутамат дегидрогеназной
реакции.
• Глутамат может передавать азот в реакции
трансаминирования на α–кетокислоты с образованием
соответствующих α–аминокислот.
COO
-
COOH
C O
+
CH2
CH2 COO
-
-Кетоглутарат
CH NH2
CH3
-Аланин
-аланин
аминотрансфераза
COO
-
COO
+
CH N H3
CH2
CH2 COO
Глутамат
-
+
-
C O
CH3
Пируват
8.
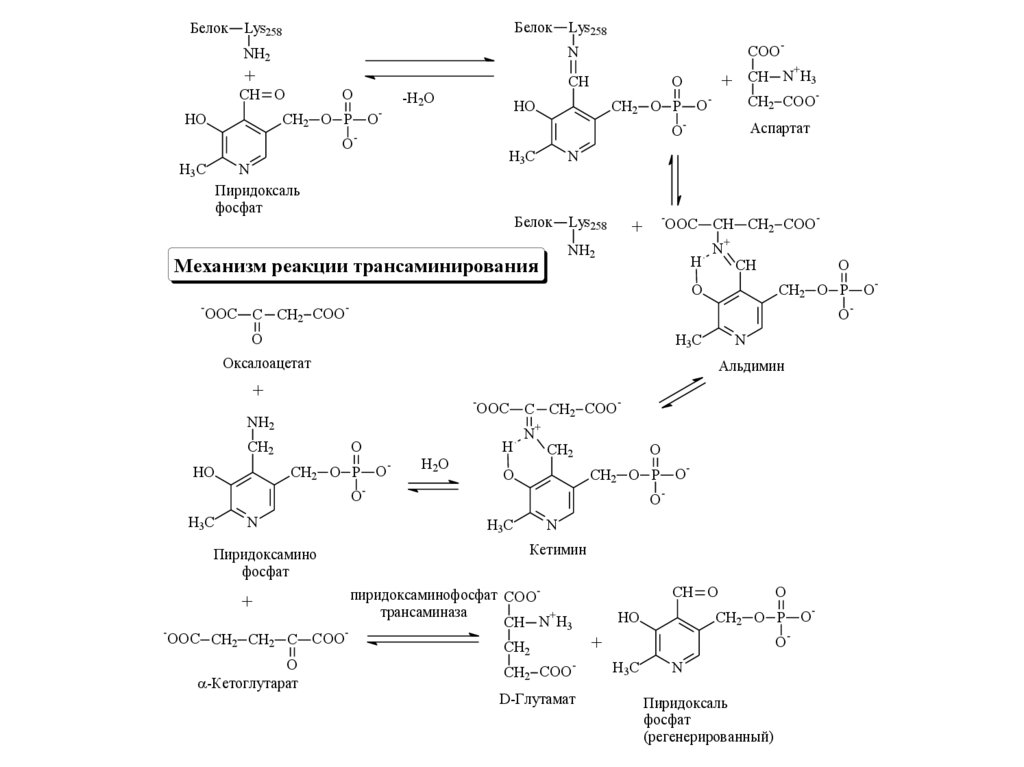
БелокБелок
Lys258
NH2
N
+
CH
CH O
O
CH2 O P O
HO
O
H3C
Lys258
-H2O
-
COO
CH2 O P O
HO
O
-
H3C
N
Пиридоксаль
фосфат
+
CH N H3
+
O
CH2 COO
-
-
Аспартат
Белок
Lys258
-
+
OOC
NH2
H
CH CH2 COO
N
C CH2 COO
CH
CH2 O P O
O
O
H3C
N
Оксалоацетат
Альдимин
+
-
NH2
O
H3C
N
O
-Кетоглутарат
H 2O
N
COO
-
+
CH2
O
CH2 O P O
O
-
O
-
-
N
Кетимин
+
OOC CH2 CH2 C
-
C CH2 COO
H3C
Пиридоксамино
фосфат
-
OOC
H
O
CH2 O P O
HO
O
-
CH2
-
-
+
O
OOC
-
N
Механизм реакции трансаминирования
-
-
пиридоксаминофосфат COOтрансаминаза
+
CH N H3
CH2
CH2 COO
-
D-Глутамат
CH O
O
CH2 O P O
HO
+
O
H3C
N
Пиридоксаль
фосфат
(регенерированный)
-
-
-
-
9.
10.
Примеры аминотрансферазАланин аминотрансфераза
L-Аланин + α-Кетоглутарат ↔ Пируват + L-Глутамат
Аспартат аминотрансфераза
L-Аспартат + α-Кетоглутарат ↔
Оксалоацетат + L-Глутамат
Тирозинаминотрансфераза
L-Тирозин + α-Кетоглутарат ↔ p-Гидроксифенилпируват + LГлутамат
Лейцинаминотрансфераза
L-Лейцин + α-Кетоглутарат ↔ α-Кетоизокапронат + L-Глутамат
11.
Клиническое значение определения активноститрансаминаз.
Для клинических целей наибольшее значение имеют
две трансаминазы – аспартат-аминотрансфераза
(AcAT) и аланин-аминотрансфераза (АлАТ),
катализирующие соответственно следующие
обратимые реакции:
Аспартат аминотрансфераза
L-Аспартат + α-Кетоглутарат ↔ Оксалоацетат + LГлутамат
Аланин аминотрансфераза
L-Аланин + α-Кетоглутарат ↔ Пируват + L-Глутамат
12.
Уже через 3–5 ч после развития инфаркта миокарда уровень АсАТв сыворотке крови резко повышается (в 20–30 раз). Максимум
активности обеих трансаминаз крови приходится на конец
первых суток, а уже через 2–3 дня при благоприятном исходе
болезни уровень сывороточных трансаминаз возвращается к
норме. Напротив, при затяжном процессе или наступлении
повторного инфаркта миокарда наблюдается новый пик
повышения активности этих ферментов в крови. Этим
объясняется тот факт, что в клинике трансаминазный тест
используется не только для постановки диагноза, но и для
прогноза и проверки эффективности лечения.
При поражениях клеток печени, например при гепатитах, также
наблюдается гипертрансаминаземия (за счет преимущественного
повышения уровня АлАТ), но она имеет более умеренный и
затяжной характер, а повышение активности трансаминазы в
сыворотке крови происходит медленно.







 Медицина
Медицина Химия
Химия