Похожие презентации:
Строение атома
1. Строение атома
2. Sir Joseph John Thomson
Первая модель строения атома –«пудинг с изюмом» - придумана
английским физиком Джозефом
Джоном Томсоном. В конечном
счёте она оказалась неверной,
но была важна для дальнейших
исследований Резерфорда.
Sir Joseph John
Thomson
3.
Согласно Томсону атомпредставляет собой шар
размером порядка 10-8 см.
По этому шару распределён
положительный заряд, а
внутри
шара,
подобно
изюминкам,
находятся
электроны.
Суммарный
заряд электронов в точности
равен
положительному
заряду шара, поэтому атом в
целом
электрически
нейтрален.
4. Ernest Rutherford
Верна ли модель Томсона?Как в действительности
распределены положительные и
отрицательные заряды внутри
атома?
Ernest Rutherford
Для ответов на эти вопросы, ученик
Томсона, знаменитый английский
физик Эрнест Резерфорд предложил
бомбардировать атом
высокоэнергетичными α-частицами
и смотреть, как они будут
отклоняться положительным
зарядом атома.
5. Опыт Резерфорда
Смотрим тут!https://youtu.be/Ll7-6W7KQ5s
6. В ходе эксперимента обнаружили:
1. В отсутствии фольги – на экране появлялсясветлый
кружок
напротив
канала
с
радиоактивным веществом.
2. Когда на пути пучка альфа-частиц поместили
фольгу, площадь пятна на экране увеличилась.
3. Помещая экран сверху и снизу установки,
Резерфорд обнаружил, что небольшое число
альфа-частиц отклонилось на углы около 900.
4. Единичные частицы были отброшены назад.
7.
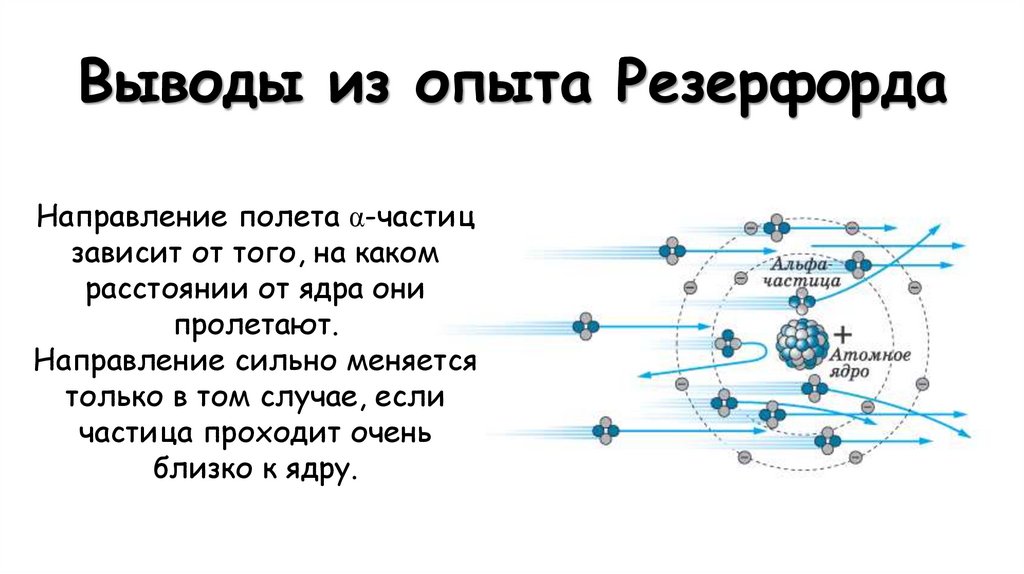
8. Выводы из опыта Резерфорда
Направление полета α-частицзависит от того, на каком
расстоянии от ядра они
пролетают.
Направление сильно меняется
только в том случае, если
частица проходит очень
близко к ядру.
9. Планетарная модель
В центре атома − крошечное положительнозаряженное ядро, вокруг которого, словно
планеты вокруг Солнца, движутся электроны.
Между ядром и электронами действуют силы
кулоновского притяжения, но упасть на ядро
электроны не могут за счёт своего движения −
точно так же, как и планеты не падают на
Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду
электронов (атом электрически нейтрален).
Однако электроны могут быть выбиты из своих
орбит и покинуть атом − тогда атом
превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть
общей массы атома.
10.
Планетарная модель атома столкнулась сочень серьёзными трудностями.
Если считать, что механика Ньютона и
электродинамика Максвелла работают
внутри атома (+соответствующие
вычисления), то получается весьма
озадачивающий результат: расход энергии
электрона на излучение (с последующим
падением электрона на ядро) потребует
совсем малого времени ~ 10−8 с.
За это время атом должен полностью
«коллапсировать» и прекратить своё
существование. Т.о., классическая физика
предрекает неустойчивость атомов,
устроенных согласно планетарной модели.
Этот вывод находится в глубоком
противоречии с опытом: на самом деле
этого не наблюдается.
11.
НЕОБХОДИМОпризнать, что внутри
атомов перестают
действовать известные
законы классической
физики. Микромир
подчиняется совсем
другим законам.
12. Niels Henrik David Bohr
Я нашел выход из этогозатруднительного
положения в 1913 году.
Niels Henrik David
Bohr
Нильс Бор не смог разработать
последовательной теории для
атома, но предложил три постулата,
резко расходящиеся с механикой и
электродинамикой, которые, тем не
менее, позволяли правильно
описать простейший из атомов —
атом водорода.
13. Первый постулат Бора
Всякий атом (и вообще, всякая атомная система)может находиться не во всех состояниях с любым,
наперёд заданным значением энергии. Возможен
лишь дискретный набор избранных состояний,
называемых стационарными, в которых энергия
атома принимает значения E1, E2, . . . , En, . . .
Находясь в стационарном состоянии, атом не
излучает электромагнитные волны.
14. Второй постулат Бора
При переходе атома из стационарногосостояния с большей энергией En в
стационарное состояние с меньшей
энергией Ek, то разность этих энергий
может высвободиться в виде излучения.
В таком случае излучается фотон с
энергией
hν = En – Ek
Эта формула работает и при
поглощении света: атом переходит из
состояния Ek в состояние с большей
энергией En, а фотон при этом исчезает.
15. Модель атома водорода по Бору
Атом водорода состоит из ядра с зарядом+e, которое называется протоном, и одного
электрона с зарядом −e (e = абсолютной
величины
заряда
электрона).
При
построении своей теории атома водорода
Бор
сделал
три
дополнительных
предположения.
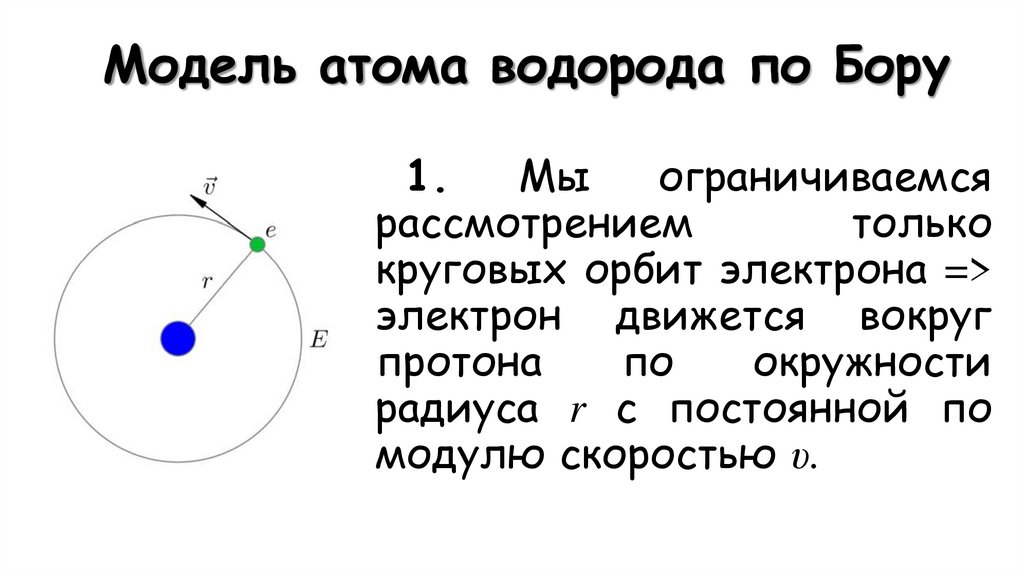
16. Модель атома водорода по Бору
1.Мы
ограничиваемся
рассмотрением
только
круговых орбит электрона =>
электрон движется вокруг
протона
по
окружности
радиуса r с постоянной по
модулю скоростью υ.
17. Модель атома водорода по Бору
2. Величина mυr, которая равнапроизведению импульса электрона
mυ на радиус орбиты r, называется
моментом импульса электрона.
18. Третий постулат Бора
Моментимпульса
электрона
может
принимать лишь дискретный набор значений,
кратных
«перечёркнутой»
постоянной
Планка:
m r n (n 1, 2, 3,...)
19. Модель атома водорода по Бору
3. Классическая физика перестаёт работатьвнутри
атома,
но
вопреки
этому
мы
предполагаем, что электрон притягивается к
протону с силой, вычисляемой по закону Кулона,
а движение электрона подчиняется второму
закону Ньютона. Из этих предположений
выводится набор допустимых значений энергии
атома водорода:
2
2
4
ke
k me
En
2 2
2rn
2 n

















 Физика
Физика








