Похожие презентации:
Халькогены
1. Халькогены
2. Элементы VI – А группы
1S11 H
2
3
4
5
6
2S22P1 nS2nP2
B
C*
Si*
nS2nP3
nS2nP4
nS2nP5
N
P*
As*
O*
S*
Se*
Te*
Ро
F
Cl
Br
I
At
Атомы этих элементов содержат на внешнем
уровне 6 электронов
3.
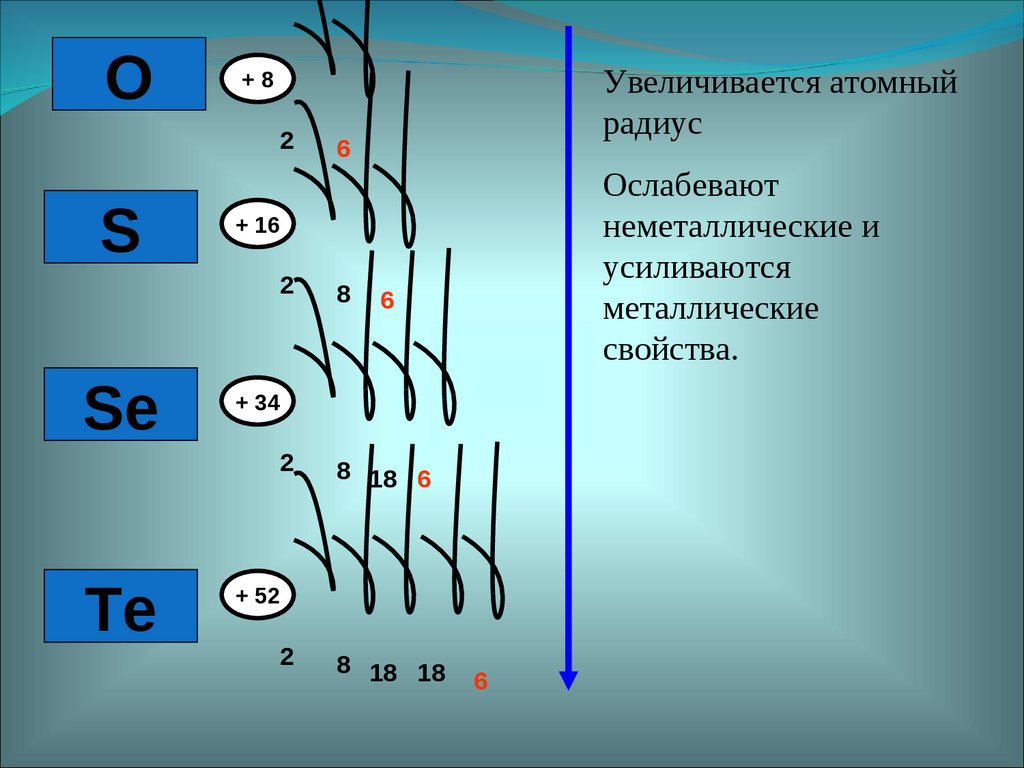
O2
S
Se
Te
Увеличивается атомный
радиус
+8
6
Ослабевают
неметаллические и
усиливаются
металлические
свойства.
+ 16
2
8
2
8 18 6
6
+ 34
+ 52
2
8 18 18
6
4.
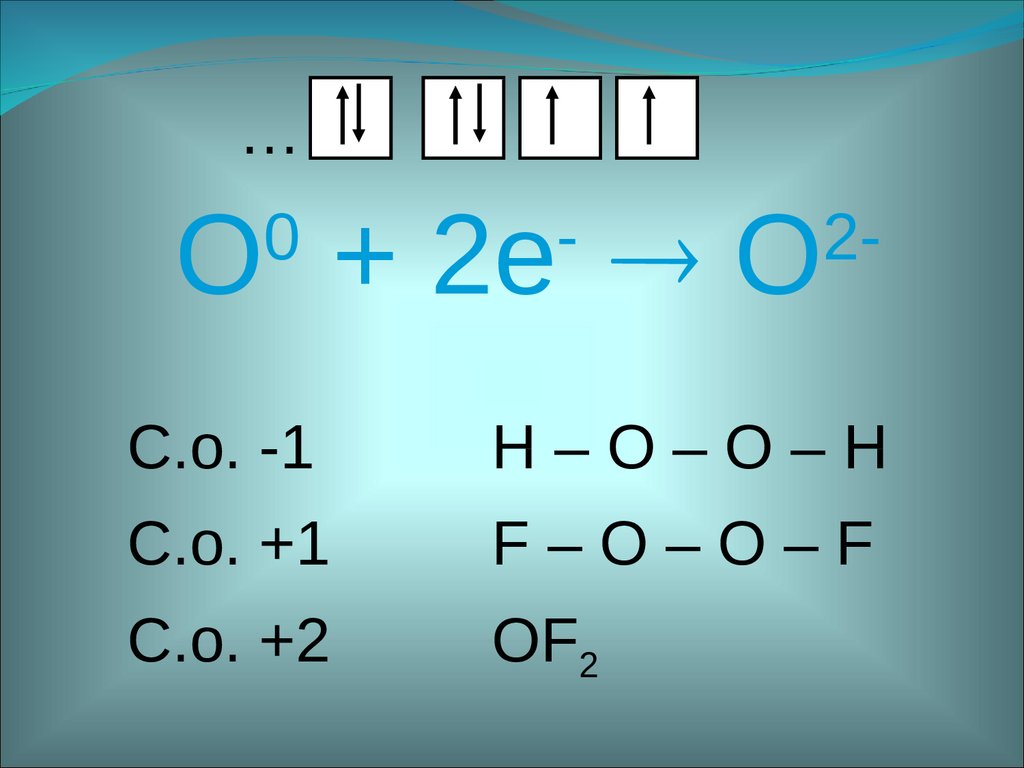
…O + 2е O
0
-
2-
С.о. -1
H–O–O–H
С.о. +1
F–O–O–F
С.о. +2
OF2
5.
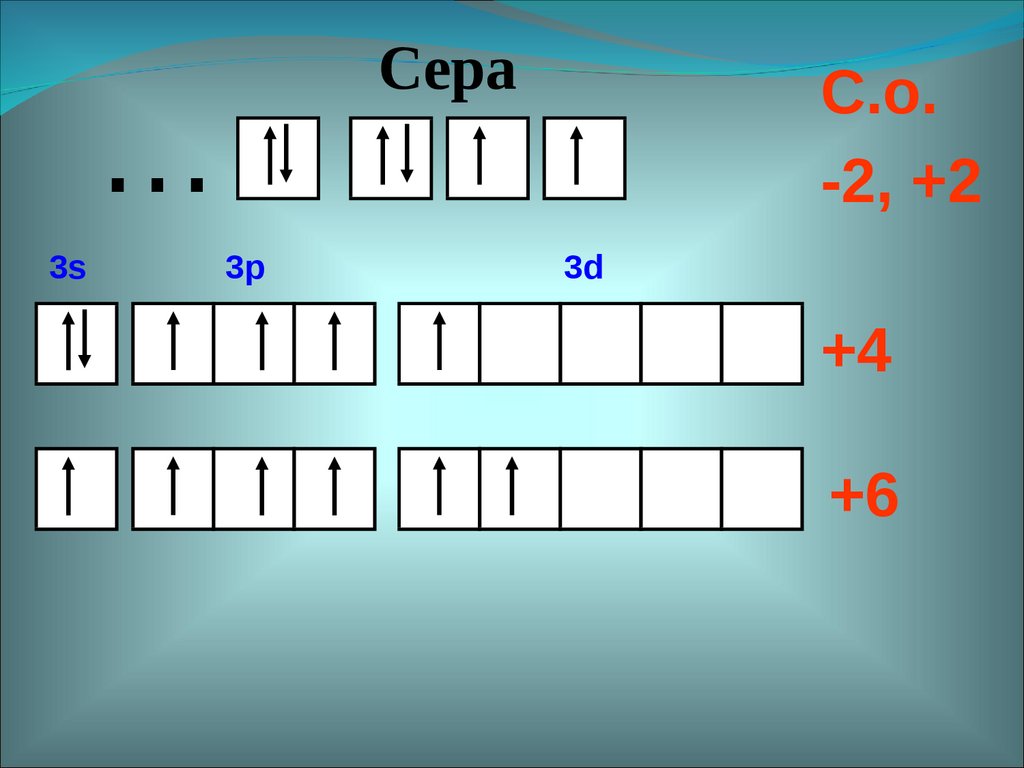
Сера…
3s
3p
С.о.
-2, +2
3d
+4
+6
6. Аллотропия кислорода. Кислород и озон
7. Аллотропные формы кислорода
Кислород образует две аллотропныемодификации (причина- строение
молекулы)
8. Аллотропия серы. Кристаллическая, пластическая и моноклинная
http://www.intellect-video.com/4289/27-Poluchenie-plastiche
koy-sery-online/
9.
«Халькогены» греч. «рождающие руды»Основные руды – соединения данной подгруппы – оксиды и
сульфиды
Красный железняк (гематит)
Fe2O3
10. Магнитный железняк(магнетит) - Fe3O4
11. Серный колчедан ( пирит) - FeS2
12. Медный колчедан (халькопирит)-CuFeS3
13. Цинковая обманка(cфалерит)- ZnS
14. Свинцовый блеск (галенит)- PbS
15. Киноварь – HgS
16. Гипс – CaSO4 *2 H2O
17. Глауберова соль (мирабилит)- Na2SO4* 10H2O
18. Самородная сера Cелен
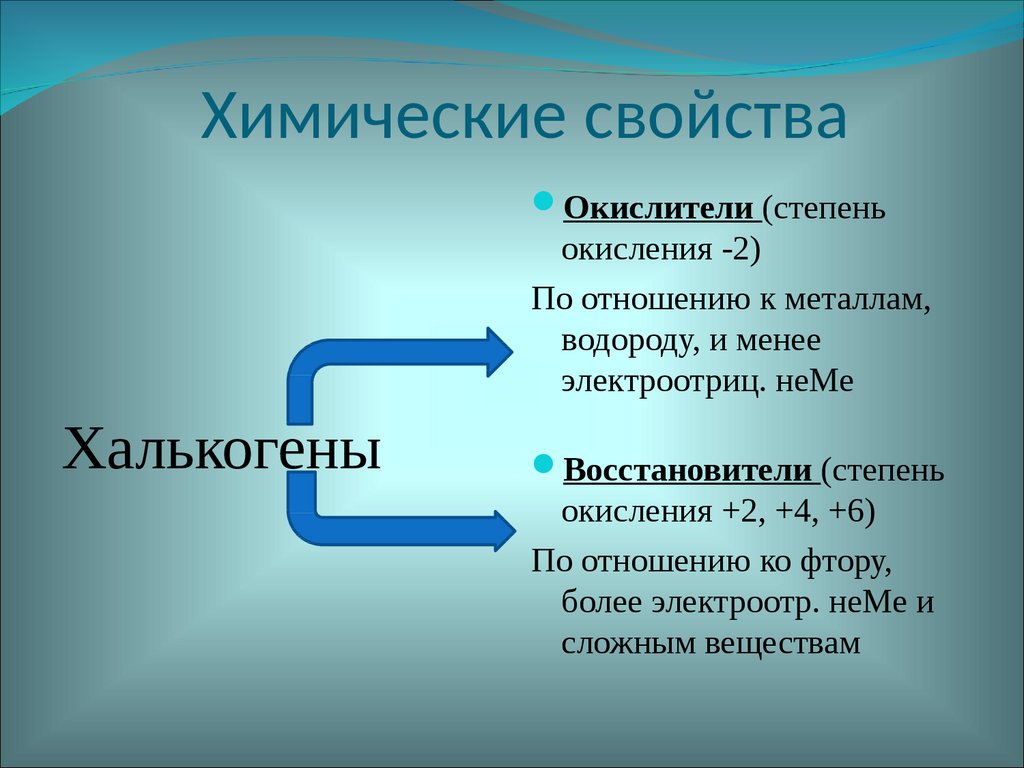
19. Химические свойства
Окислители (степеньокисления -2)
По отношению к металлам,
водороду, и менее
электроотриц. неМе
Халькогены
Восстановители (степень
окисления +2, +4, +6)
По отношению ко фтору,
более электроотр. неМе и
сложным веществам
20. Химические свойства серы
ОкислительСо всеми Ме, кроме Au и Pt
А) S + Cu→
http://www.youtube.com/watch?v=quQ9GBdlnxE
Б) S + Zn→
http://www.youtube.com/watch?v=xfOFS2mGuw0
В) S + Na →
http://www.videolica.com/videos/uoA__29o09s/%D0%B
2%D0%B7%D0%B0%D0%B8%D0%BC%D0%BE%D0
%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D
0%B8%D0%B5-%D1%81%D0%B5%D1%80%D1%8B%D1%81-%D0%BD%D0%B0%D1%82%D1%80%D0%
B8%D0%B5%D0%BC
Восстановитель
А) S + O2→для
религиозных обрядов
http://www.youtube.com/watch?v=5nVtpd3xu
D8
Б) S + KClO3→основа
«работы» спички
В) 2KNO3 + 3C + S →
K2S + 3CO2↑ + N2
21.
22. Биологическое значение серы
Входит в состав белков (белки волос, рогов, шерсти)Составная часть витаминов, ферментов и гормонов (инсулин)
Принимает участие в окислительно – восстановительных
процессах ( при недостатке хрупкость и ломкость костей и
выпадение волос)
Серой богаты бобовые растения (горох, чечевица), овсяные
хлопья, яйца.