Похожие презентации:
Характеристика элемента по его положению в периодической системе химических элементов (1)
1.
2. Химический элемент
Химический элемент – это атомы одноговида (одинаковые атомы)
Атомыалюминия
углерода
Атомы
3.
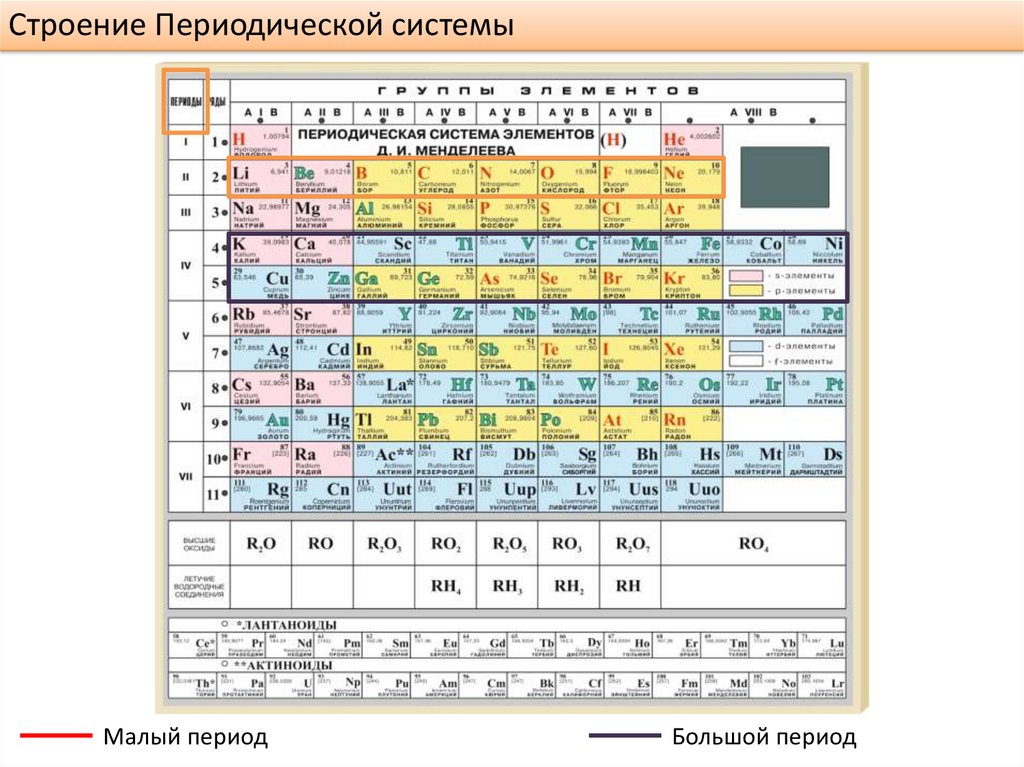
Строение Периодической системыМалый период
Большой период
4.
Строение Периодической системы5.
Алгоритм составления плана характеристикихимического элемента:
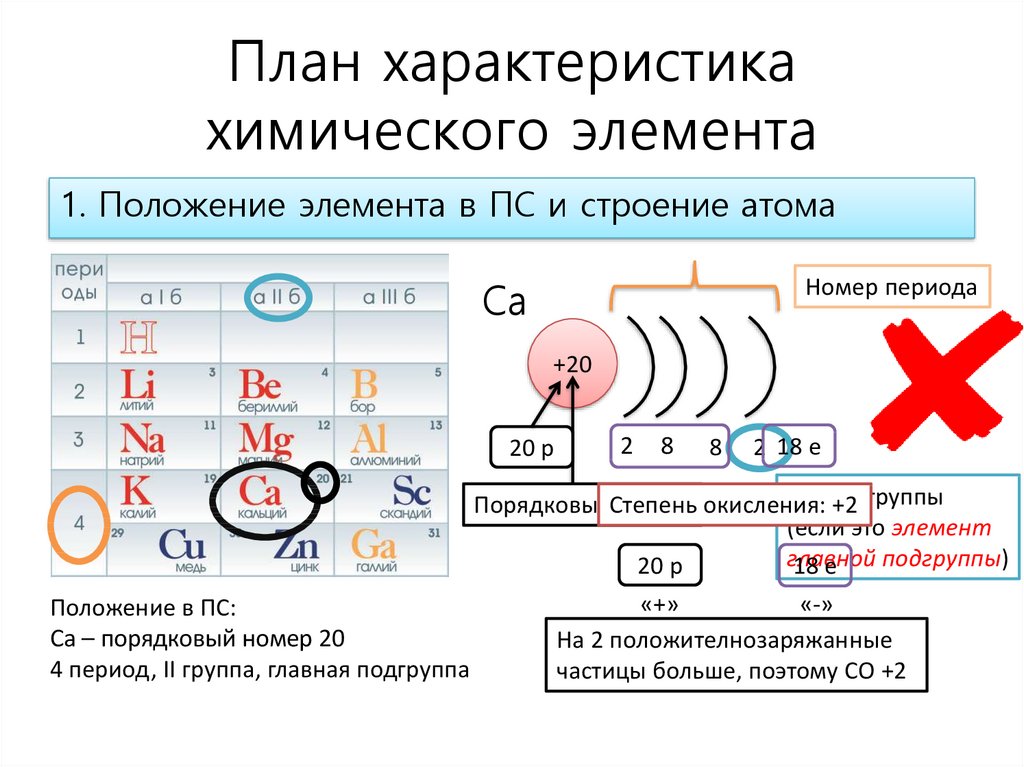
1. Положение элемента в ПС и строение атома
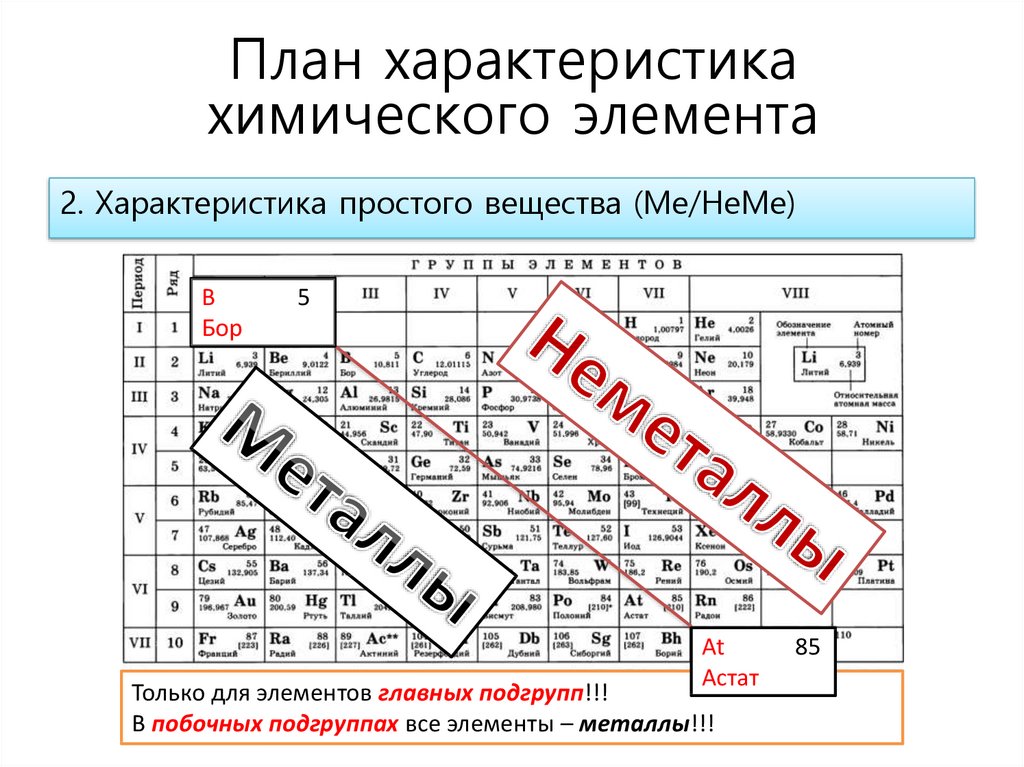
2. Характеристика простого вещества (Ме/НеМе)
3. Сравнение свойств со свойствами соседей по
подгруппе
4. Сравнение свойств со свойствами соседей по периоду
5. Состав высшего оксида, его характер (основный,
кислотный, амфотерный)
6. Состав высшего гидроксида, его характер
(кислородсодержащая кислота, основание,
амфотерный гидроксид)
7. Состав летучего водородного соединения (НеМе)
6. План характеристика химического элемента
1. Положение элемента в ПС и строение атомаСа
Номер периода
+20
20 р
2
8
8
2 18 е
Номер
ПорядковыйСтепень
номер окисления:
+2 группы
(если это элемент
главной
подгруппы)
20 р
18 е
«-»
«+»
Положение в ПС:
Са – порядковый номер 20
На 2 положителнозаряжанные
4 период, II группа, главная подгруппа
частицы больше, поэтому СО +2
7.
План характеристикахимического элемента
2. Характеристика простого вещества (Ме/НеМе)
В
Бор
5
At
Астат
Только для элементов главных подгрупп!!!
В побочных подгруппах все элементы – металлы!!!
85
8.
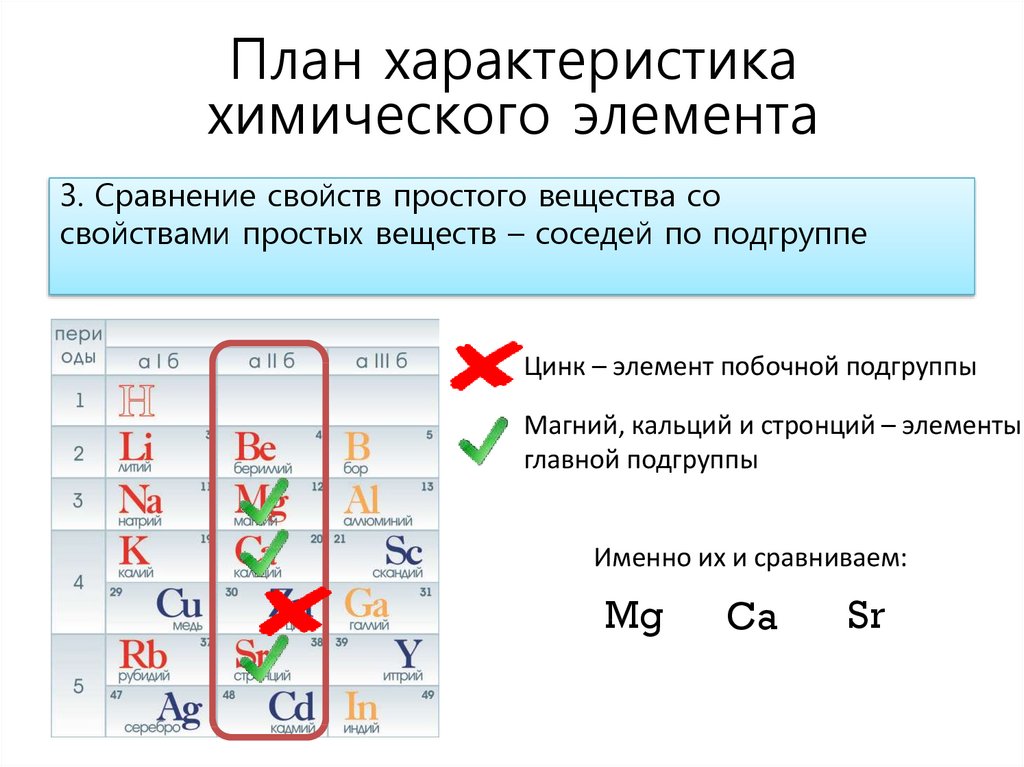
План характеристикахимического элемента
3. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по подгруппе
Цинк – элемент побочной подгруппы
Магний, кальций и стронций – элементы
главной подгруппы
Именно их и сравниваем:
Mg
Ca
Sr
9.
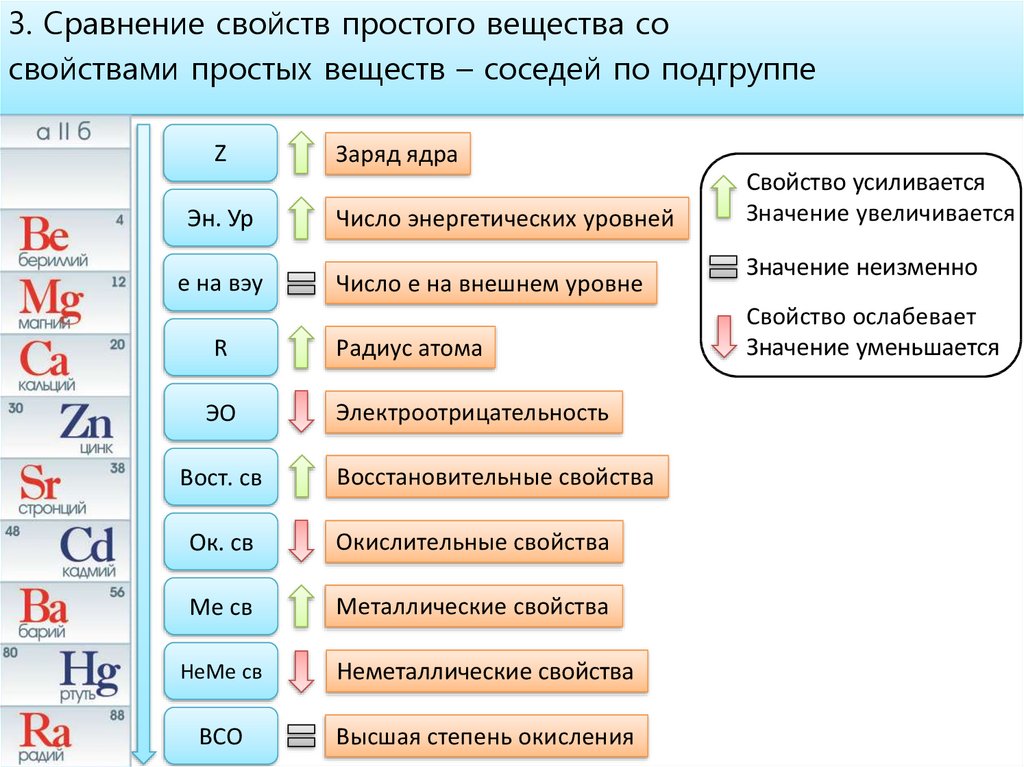
3. Сравнение свойств простого вещества сосвойствами простых веществ – соседей по подгруппе
Z
Эн. Ур
e на вэу
R
ЭО
Вост. св
Заряд ядра
Число энергетических уровней
Число е на внешнем уровне
Радиус атома
Электроотрицательность
Восстановительные свойства
Ок. св
Окислительные свойства
Ме св
Металлические свойства
НеМе св
Неметаллические свойства
ВСО
Высшая степень окисления
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
10.
3. Сравнение свойств простого вещества сосвойствами простых веществ – соседей по подгруппе
Z
Эн. Ур
Mg
Mg
Ca
Ca
Sr
Sr
Mg
Ca
Sr
R
Mg
Ca
Sr
ЭО
Mg
Ca
Sr
Вост. св
Mg
Ca
Sr
Ок. св
Mg
Ca
Sr
Ме св
Mg
Ca
Sr
НеМе св
Mg
Ca
Sr
ВСО
Mg
Ca
Sr
e на вэу
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
11.
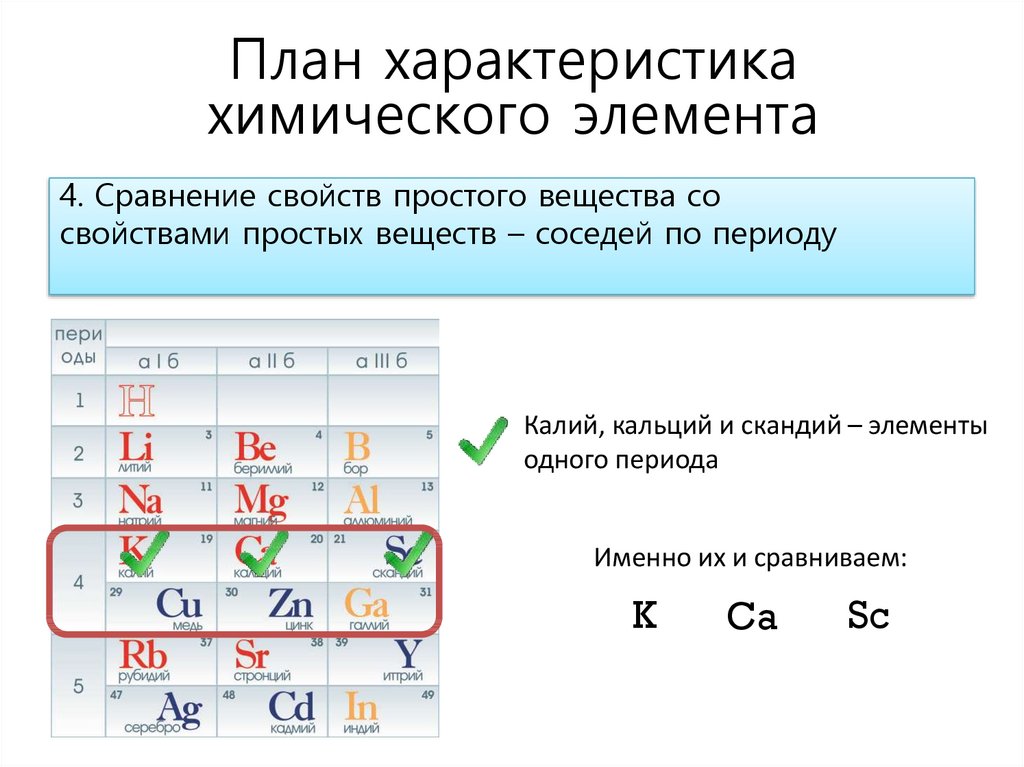
План характеристикахимического элемента
4. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по периоду
Калий, кальций и скандий – элементы
одного периода
Именно их и сравниваем:
K
Ca
Sc
12.
Вост. свОк. св
Ме св
НеМе св
Высшая степень окисления
Неметаллические свойства
Окислительные свойства
Металлические свойства
ЭО
Восстановительные свойства
R
Электроотрицательность
e на вэу
Радиус атома
Эн. Ур
Число е на внешнем уровне
Z
Число энергетических уровней
Заряд ядра
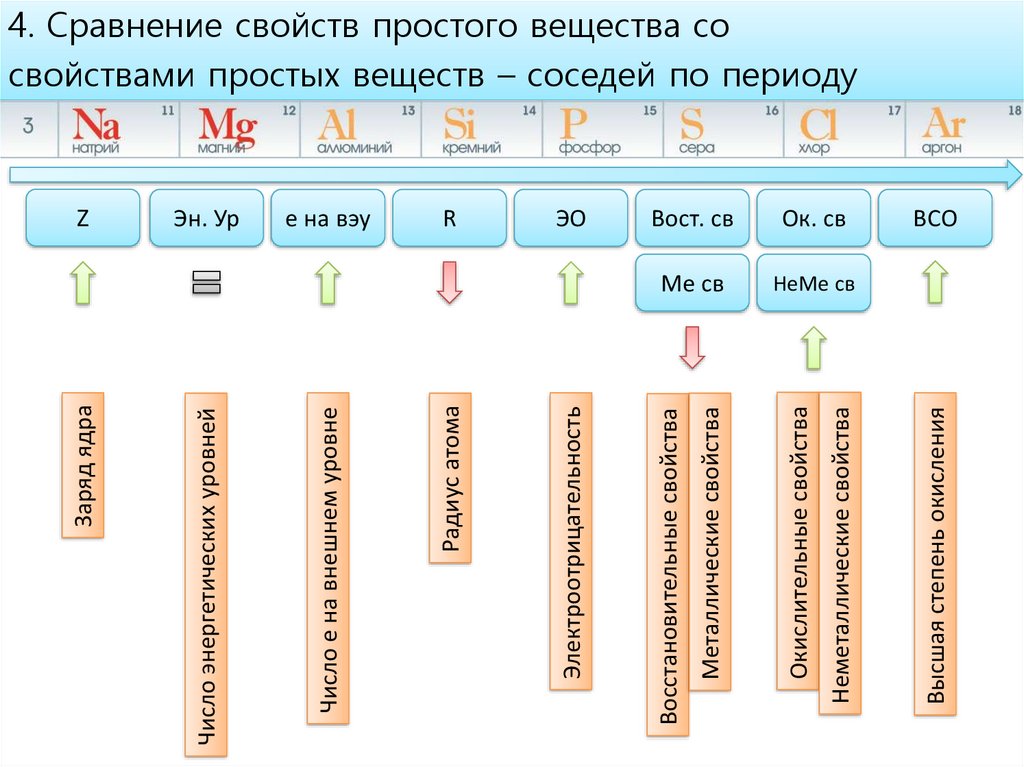
4. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по периоду
ВСО
13.
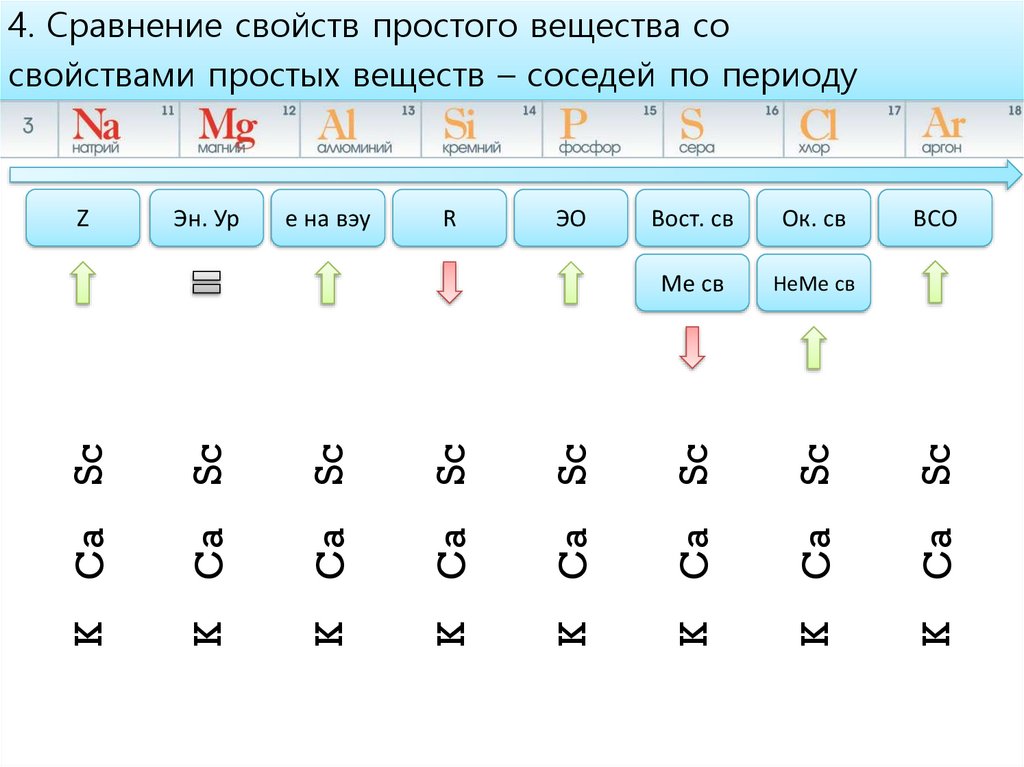
4. Сравнение свойств простого вещества сосвойствами простых веществ – соседей по периоду
НеМе св
ВСО
Ca
Ca
Ca
Ca
Ca
Ca
K
K
K
K
K
Sc
Ме св
Sc
Ок. св
Sc
Вост. св
K
Sc
ЭО
Ca
Sc
R
K
Sc
e на вэу
Ca
Sc
Эн. Ур
K
Sc
Z
14.
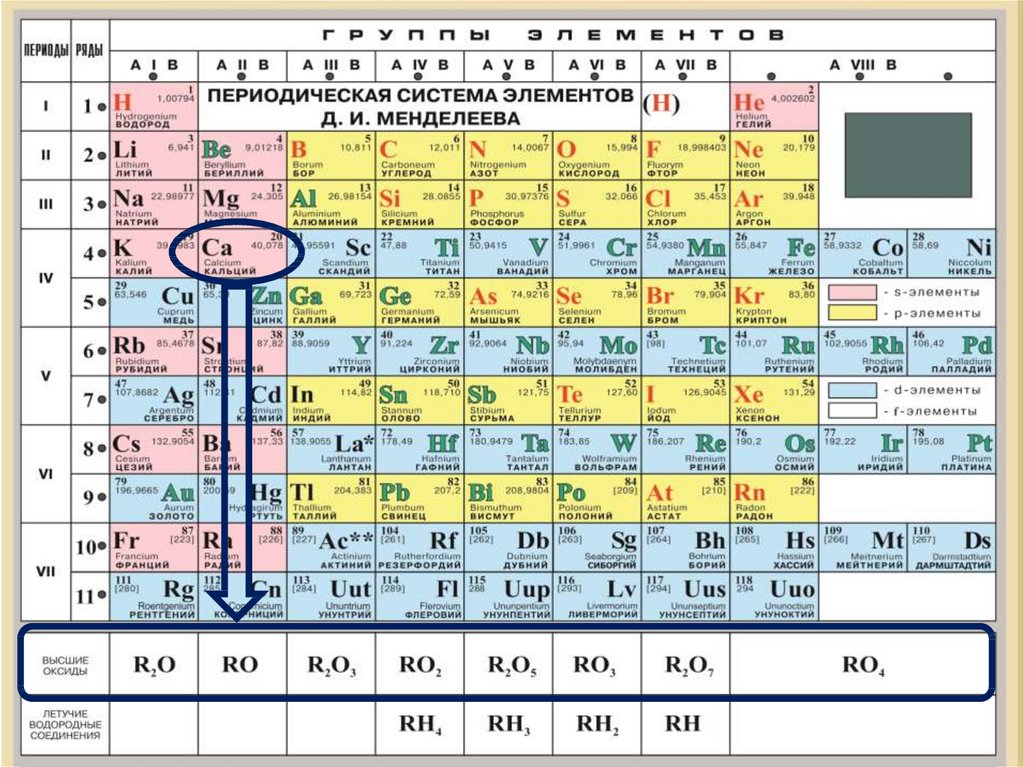
План характеристикахимического элемента
5. Состав высшего оксида, его характер (основный,
кислотный, амфотерный)
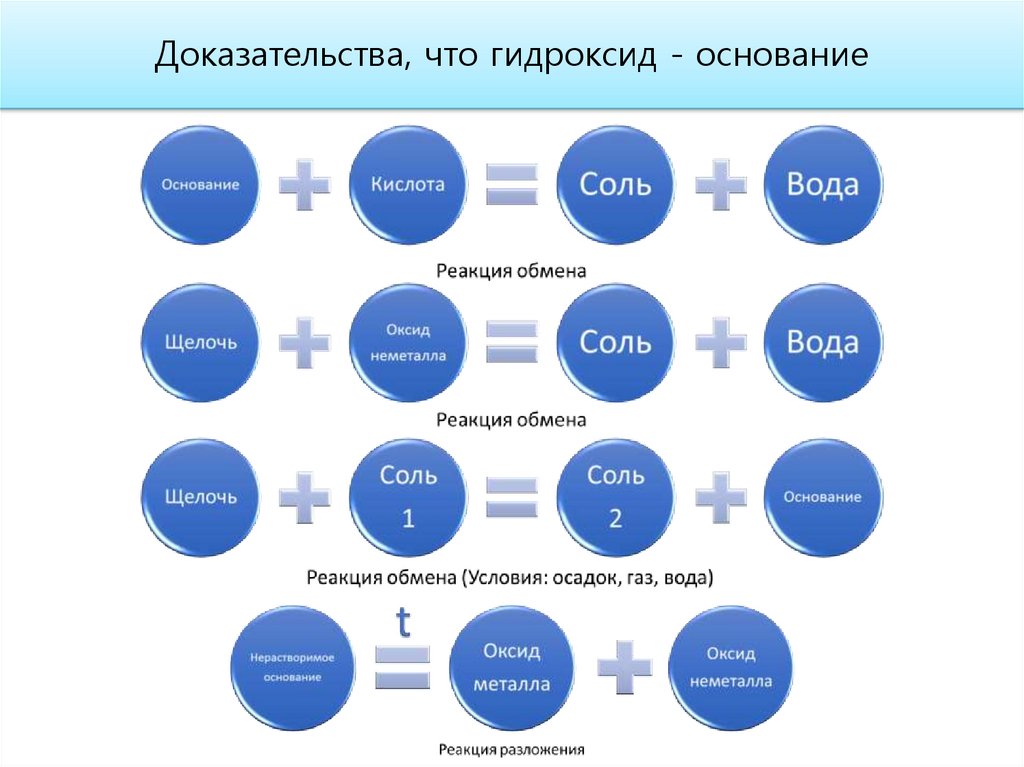
15.
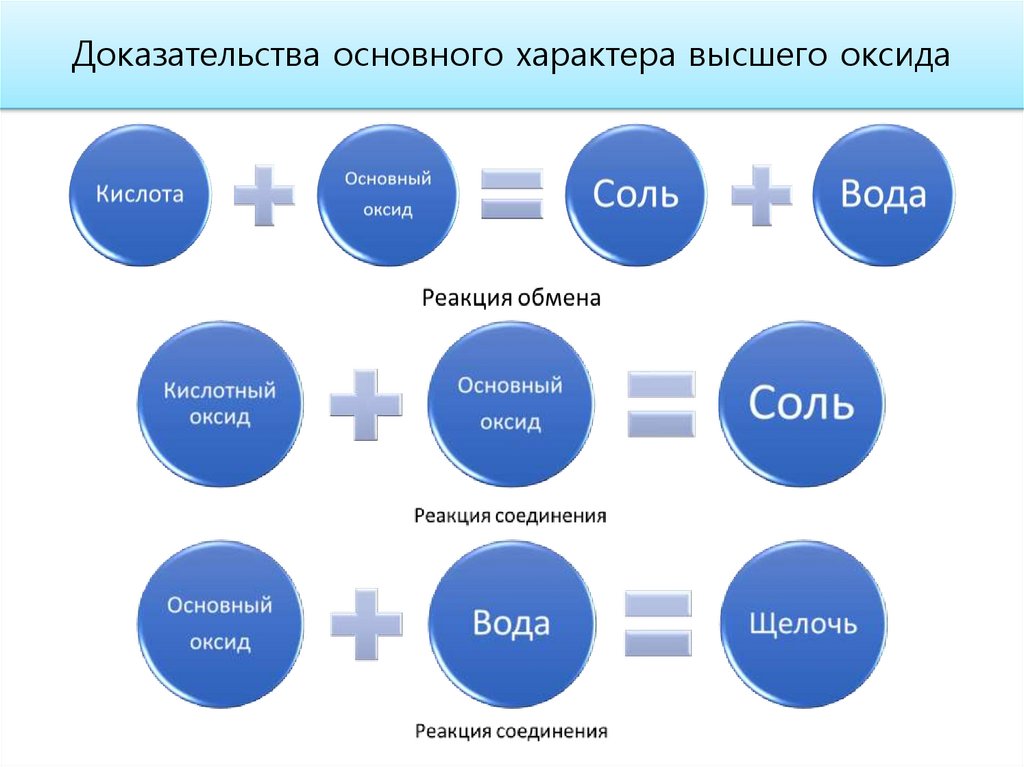
Доказательства основного характера высшего оксида16.
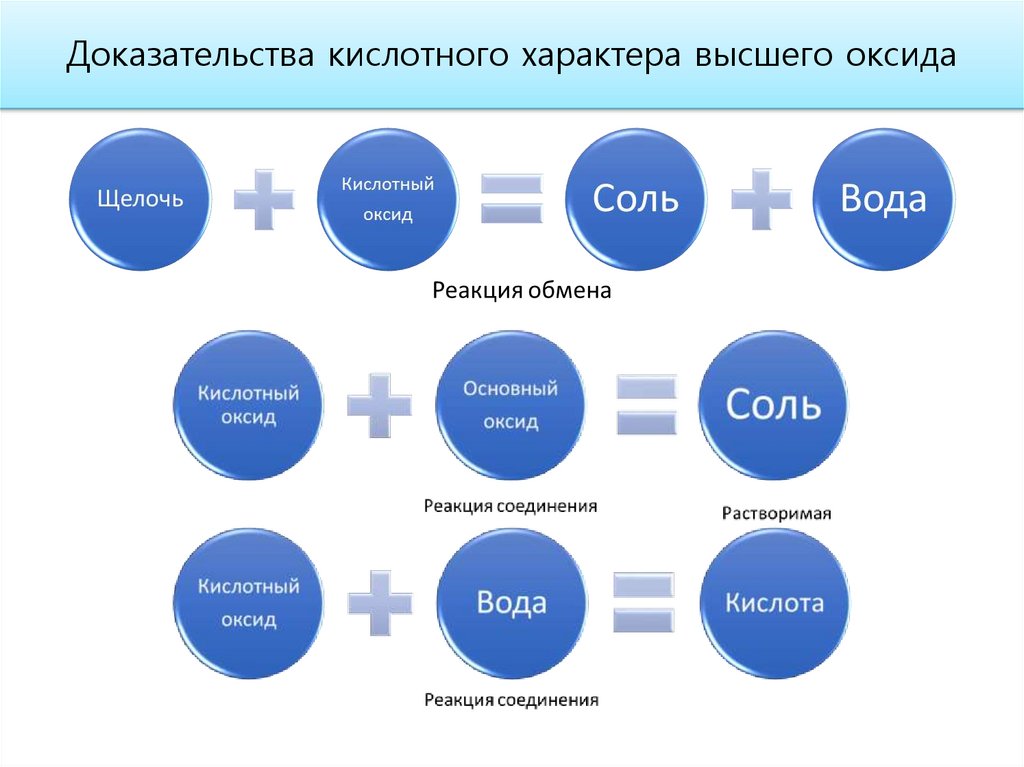
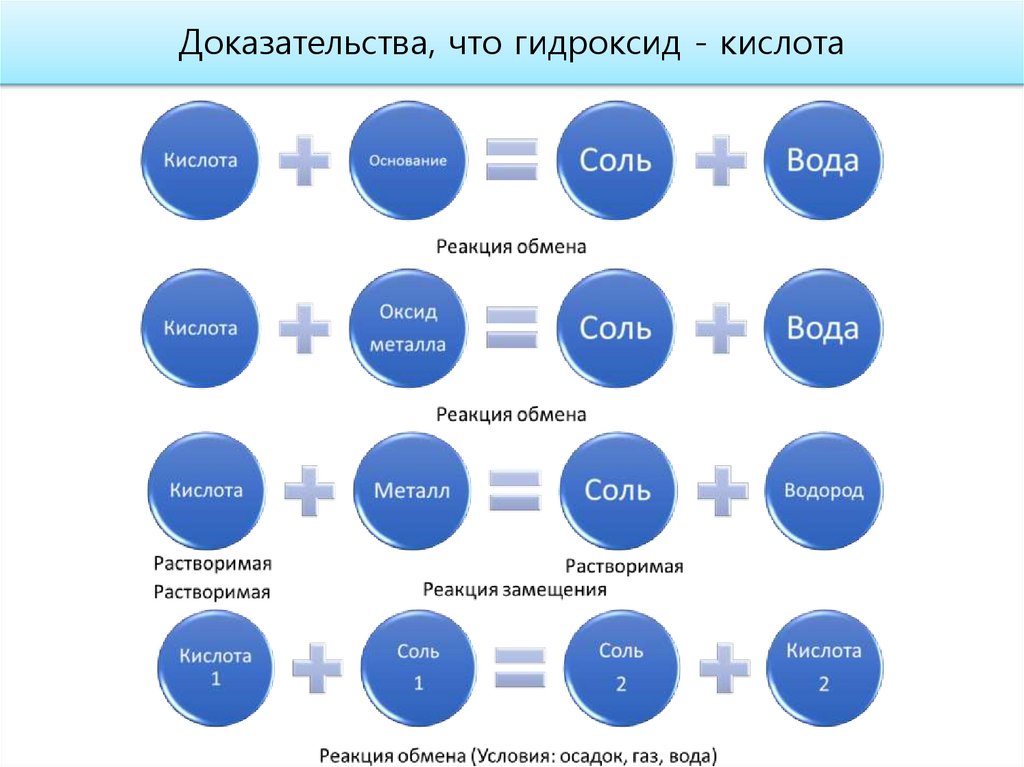
Доказательства кислотного характера высшего оксида17.
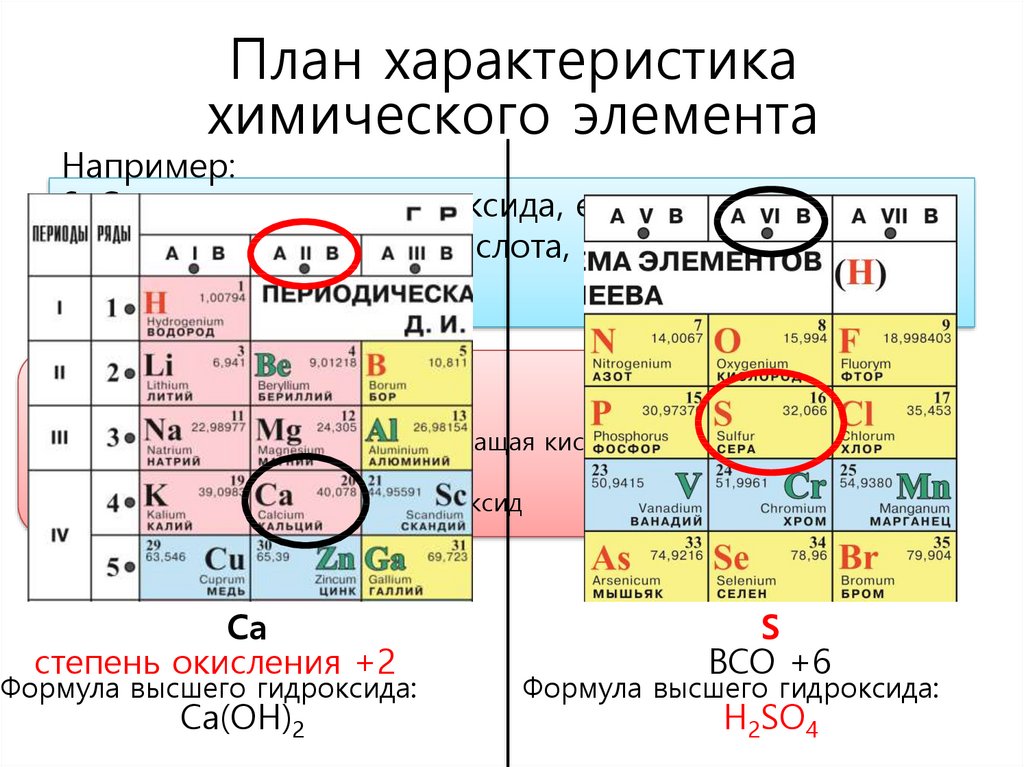
План характеристикахимического элемента
Например:
6. Состав высшего гидроксида, его характер
(кислородсодержащая кислота, основание,
амфотерный гидроксид)
Гидроксид Ме - основание
Гидроксид НеМе – кислородсодержащая кислота
Гидроксид Ме – амфотерный гидроксид
Са
степень окисления +2
Формула высшего гидроксида:
Са(ОН)2
S
ВСО +6
Формула высшего гидроксида:
H2SO4
18.
Доказательства, что гидроксид - основание19.
Доказательства, что гидроксид - кислота20.
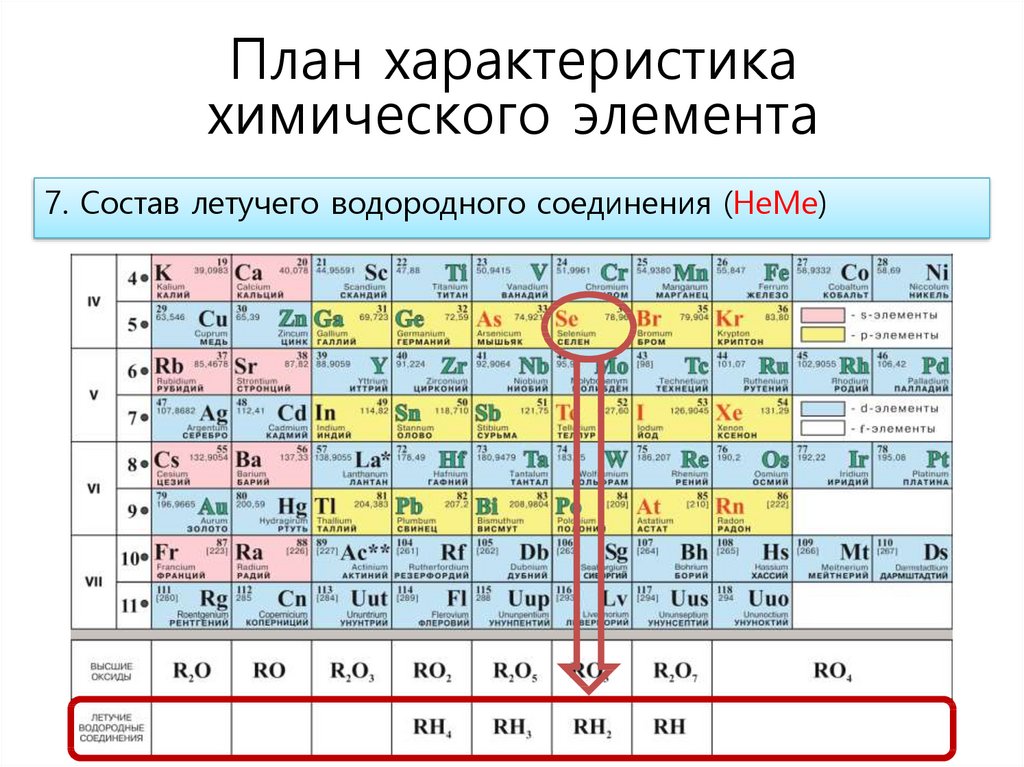
План характеристикахимического элемента
7. Состав летучего водородного соединения (НеМе)
21.
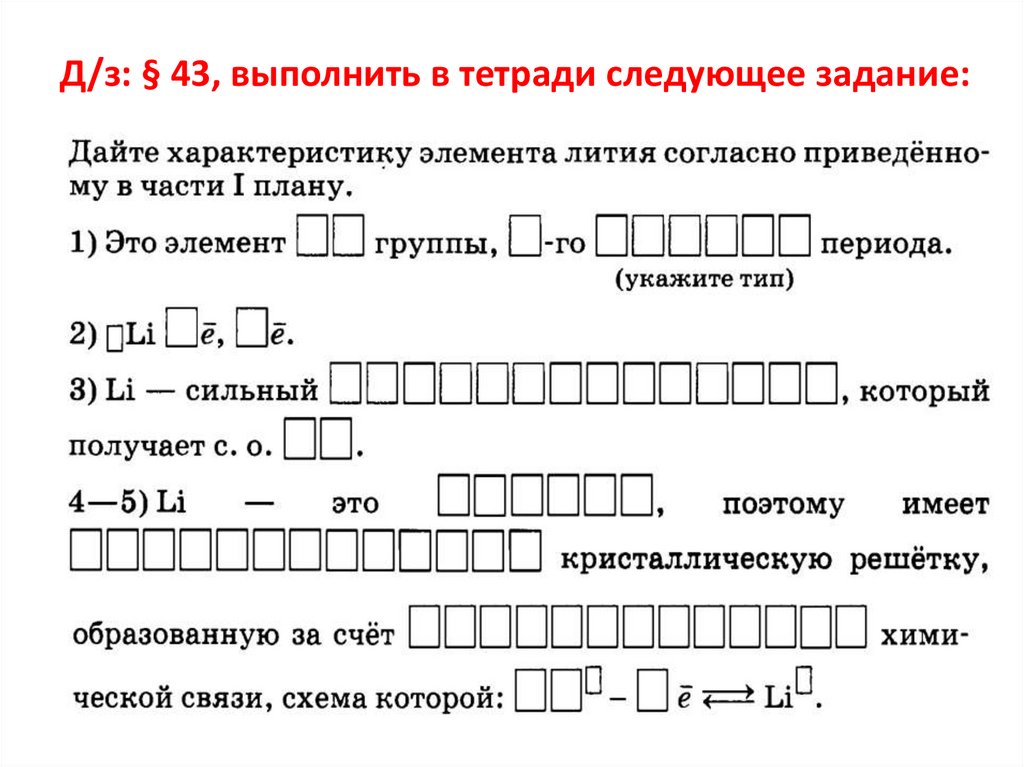
Д/з: § 43, выполнить в тетради следующее задание:22.
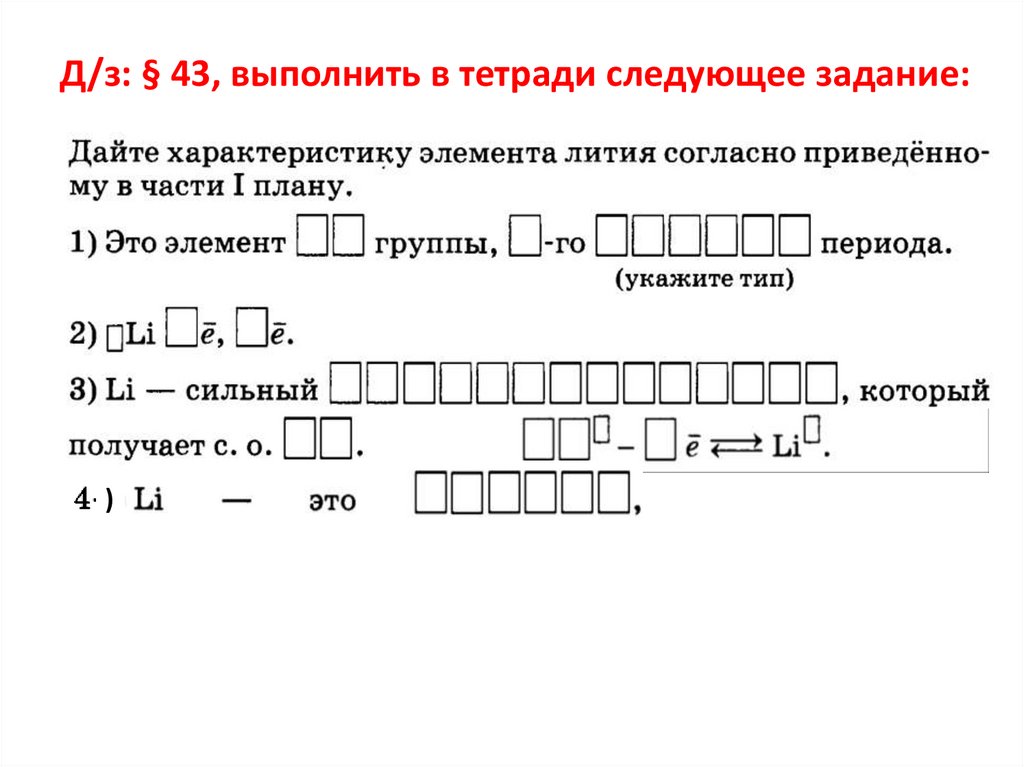
Д/з: § 43, выполнить в тетради следующее задание:)
23.
5)6)
7)
8)






 Химия
Химия








