Похожие презентации:
Статистическое описание равновесных состояний. Функция распределения. Принцип детального равновесия. Распределение Максвелла
1. Лекция 15-2020 г.
1. Статистическое описание равновесных состоянийФункция распределения.
2. Принцип детального равновесия. Распределение
Максвелла. Экспериментальная проверка
распределения Максвелла.
3. Барометрическая формула. Распределение
Больцмана.
4. Фазовое пространство. Распределение МаксвеллаБольцмана.
5. Равновесные флуктуации. Статистическое
обоснование второго начала термодинамики.
Формула Больцмана для статистической энтропии.
2.
Статистическое описание равновесныхсостояний
Статистический метод — это вероятностный метод
исследования систем из большого числа частиц. Данный
метод оперирует статистическими закономерностями
и средними (усредненными) значениями физических величин,
которые характеризуют всю систему.
Этот метод лежит в основе молекулярной физики — раздела
физики, изучающего строение и свойства вещества исходя из
молекулярно-кинетических представлений, основывающихся
на том, что все тела состоят из атомов, молекул или ионов
находящихся в непрерывном хаотическом движении.
А.С. Чуев, 2020
2
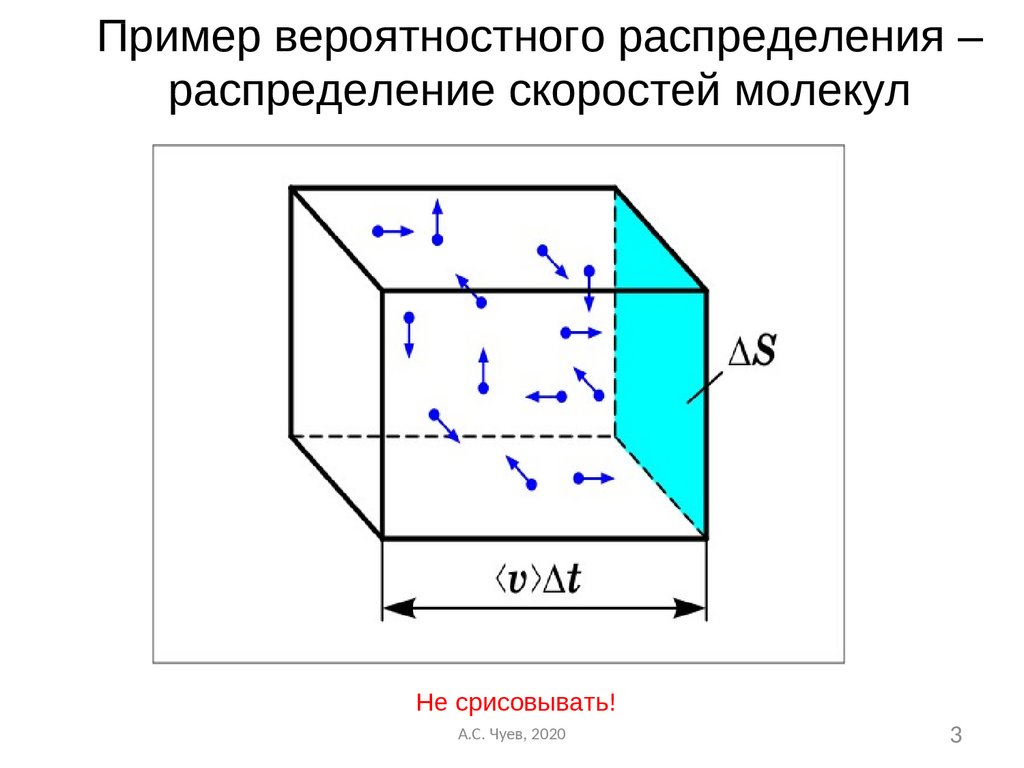
3.
Пример вероятностного распределения –распределение скоростей молекул
Не срисовывать!
А.С. Чуев, 2020
3
4. Математическое определение вероятности: вероятность какого-либо события – это предел, к которому стремится отношение числа
случаев,приводящих к осуществлению события, к общему
числу случаев, при бесконечном увеличении
последних:
n
P lim
n n
Здесь n число раз, когда событие произошло, а
n общее число опытов. Отсюда следует, что Р
может принимать значения от нуля до единицы.
А.С. Чуев, 2020
4
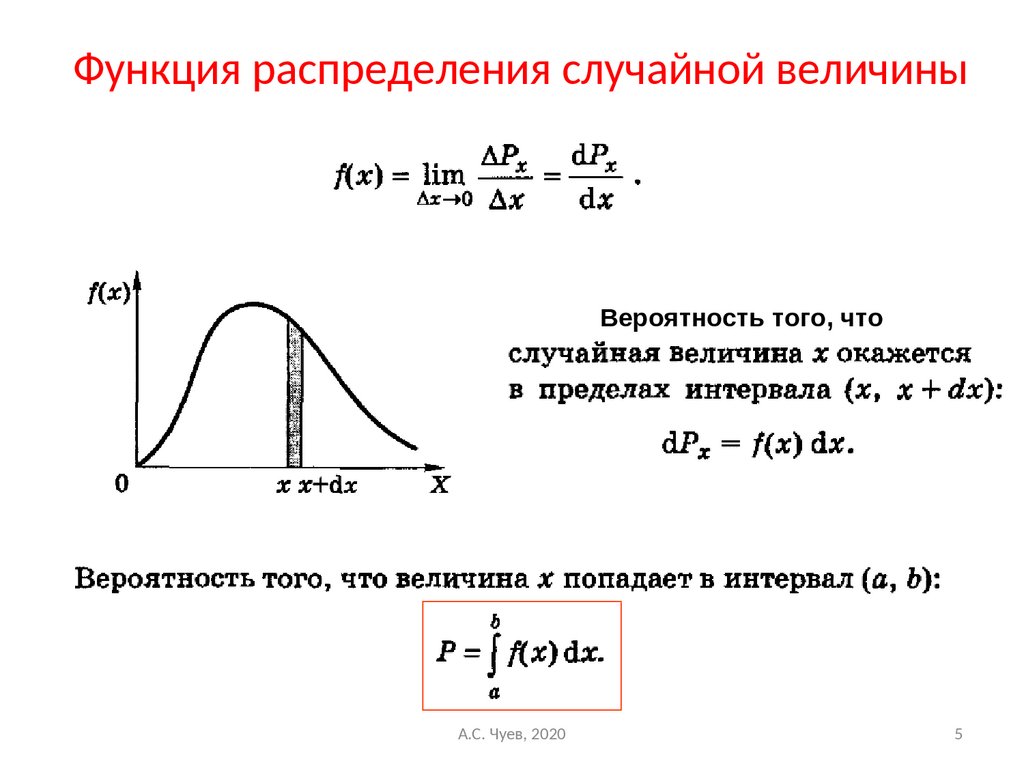
5. Функция распределения случайной величины
Вероятность того, чтоА.С. Чуев, 2020
5
6.
Для распределения молекул газа по скоростям:А.С. Чуев, 2020
6
7.
Плотность распределения молекул по скоростям поодной координате
Условие нормировки:
В среднем значения скорости нулевые из-за равновероятности их
направлений
Общая плотность распределения
А.С. Чуев, 2020
7
8.
Общая формула функции распределения скоростей по одной осиα x2
х А exp
2
Вид функции после
нормировки:
С учетом:
А.С. Чуев, 2020
8
9. Функция распределения Максвелла по модулю скорости
А.С. Чуев, 20209
10.
А.С. Чуев, 202010
11.
А.С. Чуев, 202011
12.
ИзС учетом
Получаем закон распределения Максвелла по модулю
скорости
А.С. Чуев, 2020
12
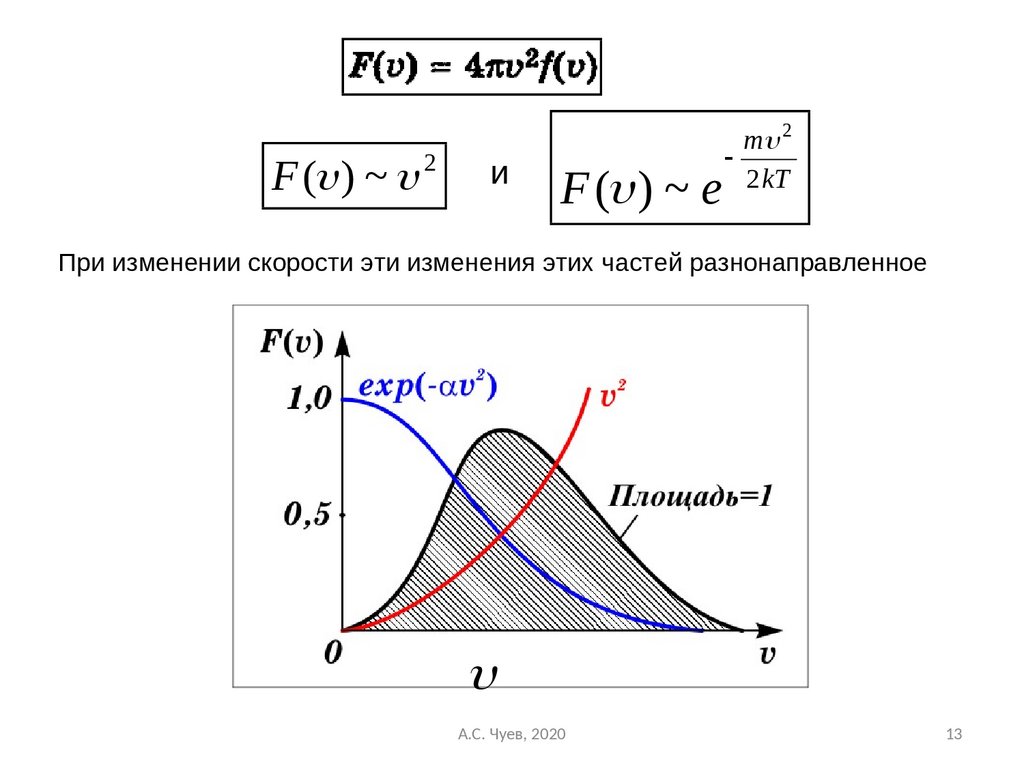
13.
F ( ) ~ 2и
F ( ) ~ e
m 2
2 kT
При изменении скорости эти изменения этих частей разнонаправленное
А.С. Чуев, 2020
13
14.
Данную функцию можно представить в виде:2
F (υ) Aυ e
А.С. Чуев, 2020
mυ 2
2 kT
.
14
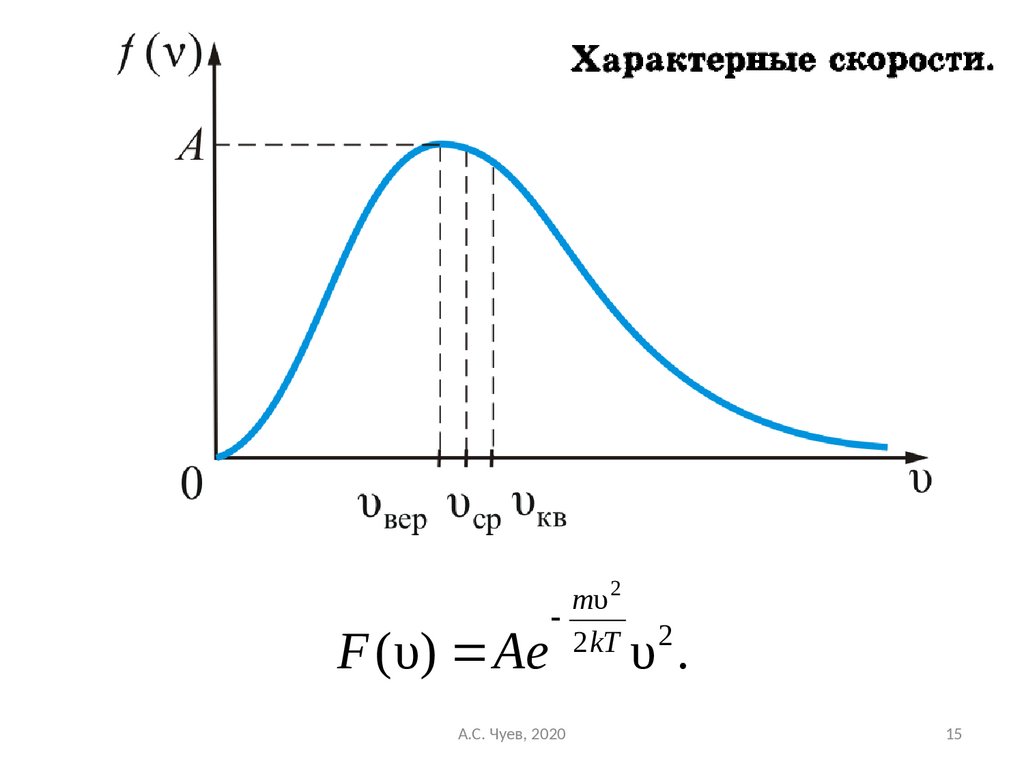
15.
F ( υ) Aemυ 2
2 kT
А.С. Чуев, 2020
2
υ.
15
16.
Факультативно(Из Савельева)
Определение средних
значений через
плотности
распределения
А.С. Чуев, 2020
16
17.
А.С. Чуев, 202017
18. Выводы из формулы: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа (m) и от температуры
Выводы из формулы:F ( υ) Ae
mυ 2
2 kT
2
υ.
- Вид распределения молекул газа по скоростям,
для каждого газа зависит от рода газа (m) и от
температуры (Т). Давление P и объём газа V на
распределение молекул не влияют.
- В показателе степени стоит отношение,
кинетической энергии, соответствующей данной
скорости υ к средней энергии теплового движения
молекул при данной температуре: mυ 2
2kT
А.С. Чуев, 2020
18
19. Доска Гальтона
А.С. Чуев, 202019
20. Формула Максвелла для относительных скоростей
Для решения многих задач удобноиспользовать формулу Максвелла, где скорость
выражена в относительных единицах.
Относительную скорость обозначим через u:
υ где
u
,
υвер
υ вер
А.С. Чуев, 2020
2kT
m
20
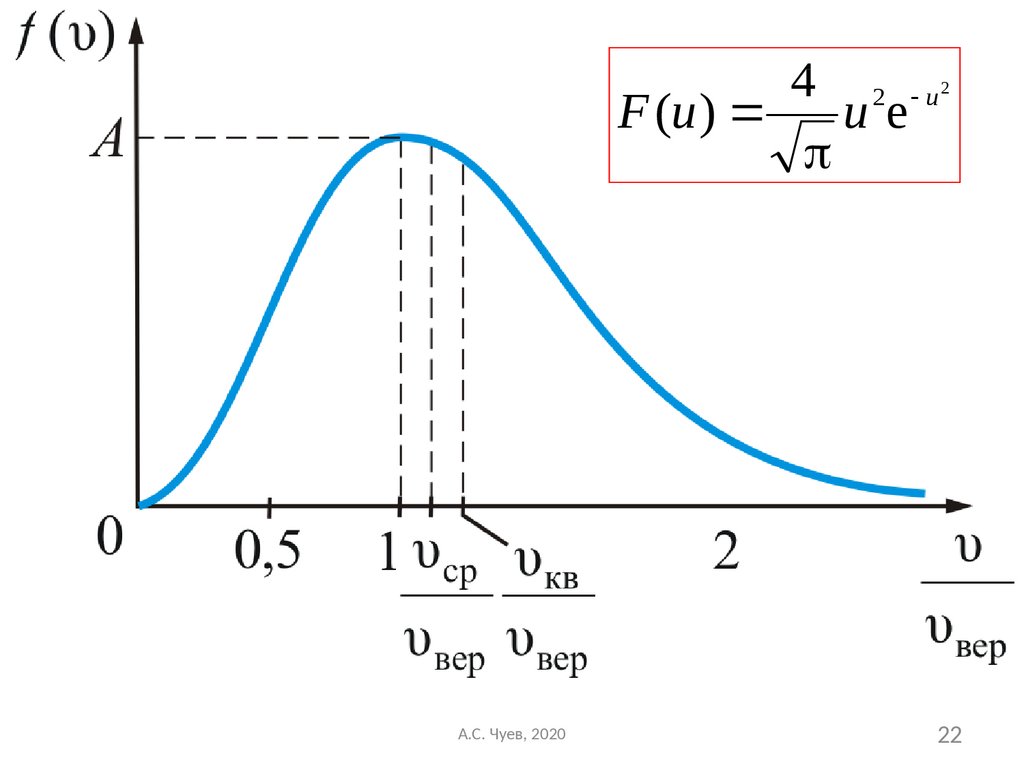
21. В таком виде функция распределения не зависит ни от рода газа, ни от температуры
4 2 uF (u ) u e
2
Формула Максвелла для относительных скоростей
В таком виде функция распределения не
зависит ни от рода газа, ни от температуры
А.С. Чуев, 2020
21
22.
4 2 uF (u ) u e
А.С. Чуев, 2020
2
22
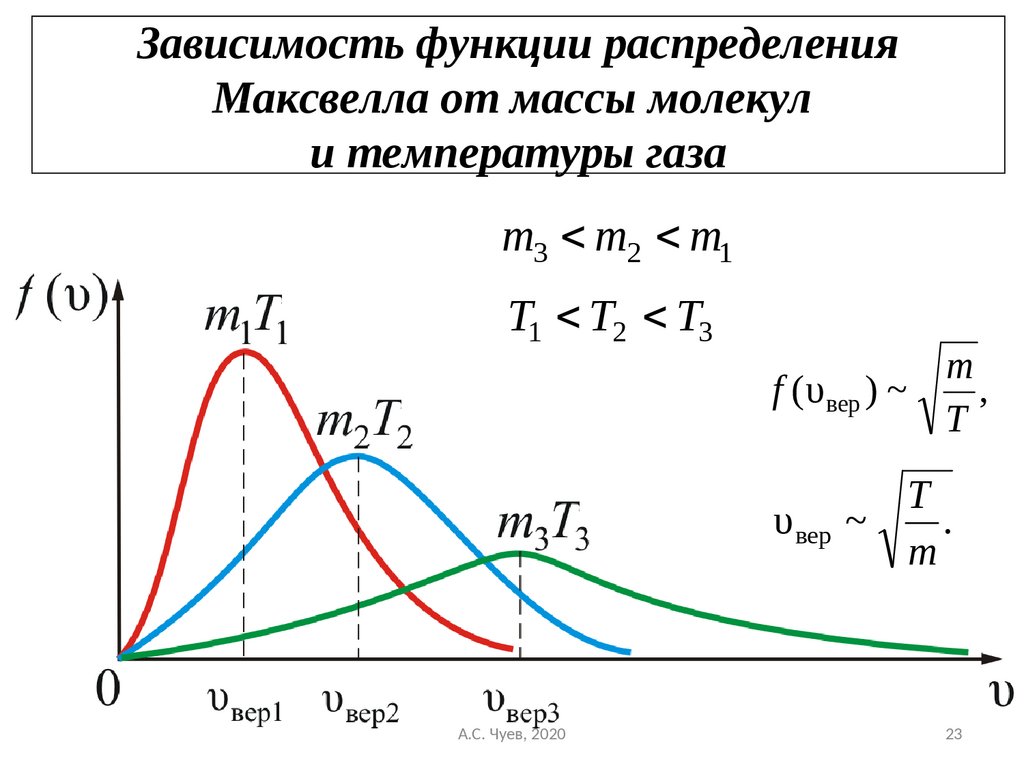
23. Зависимость функции распределения Максвелла от массы молекул и температуры газа
m3 m2 m1T1 T2 T3
m
f ( υ вер ) ~
,
T
υ вер ~
А.С. Чуев, 2020
T
.
m
23
24. Распределение Больцмана для идеального газа во внешнем потенциальном поле. Барометрическая формула
А.С. Чуев, 202024
25. Барометрическая формула
Рассмотрим ещё один, очень важный закон.Атмосферное давление на какой-либо
высоте h обусловлено весом выше
лежащих слоёв газа.
Пусть P – давление на высоте h, а
P ΔP – на высоте h Δh
А.С. Чуев, 2020
25
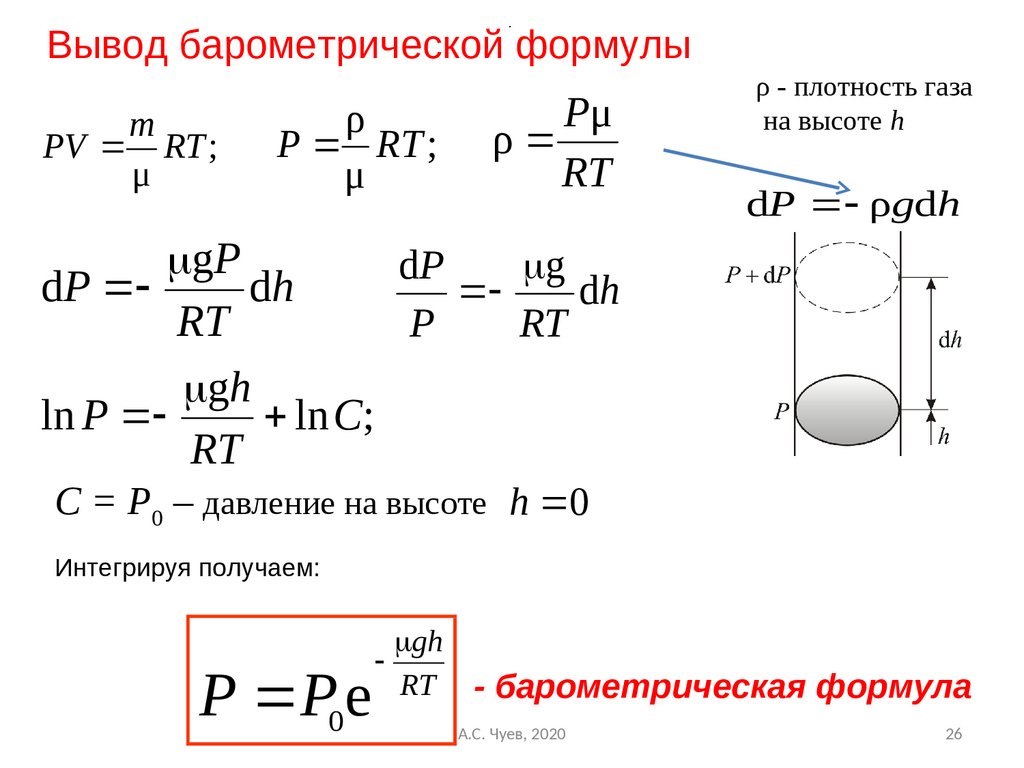
26.
.Вывод барометрической формулы
m
PV RT ;
μ
ρ
P RT ;
μ
Pμ
ρ
RT
ρ - плотность газа
на высоте h
dP ρgdh
gP
dP
g
dP
dh
dh
RT
P
RT
gh
ln P
ln C;
RT
С = Р0 – давление на высоте h 0
Интегрируя получаем:
P P0e
gh
RT - барометрическая формула
А.С. Чуев, 2020
26
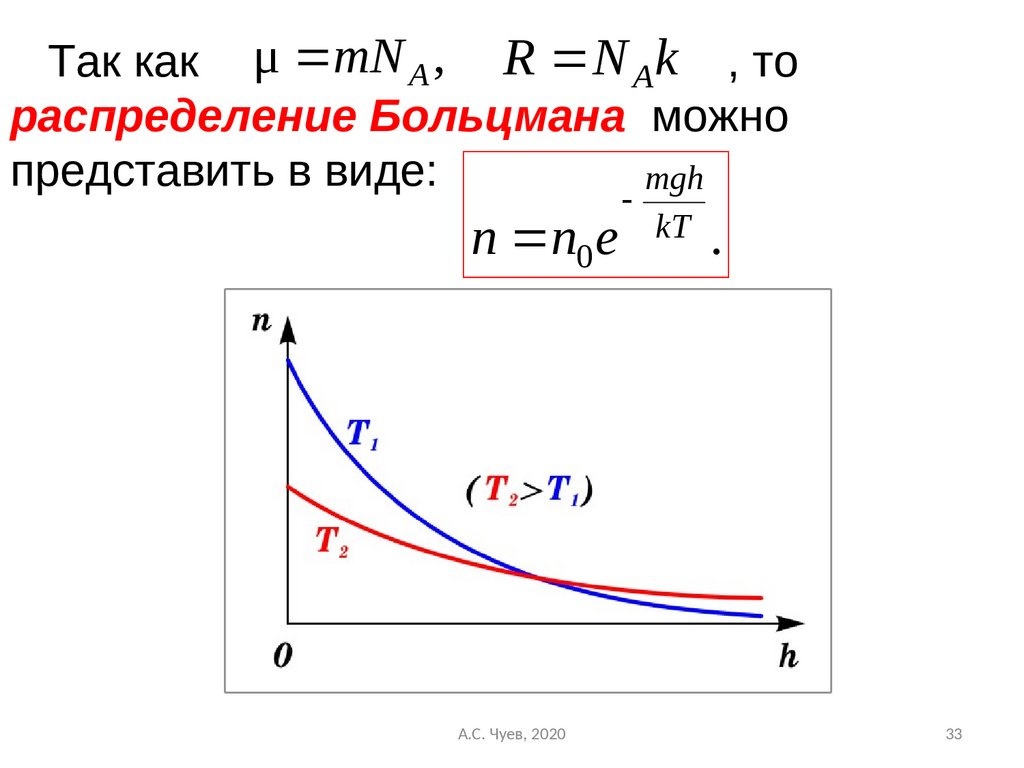
27. Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура
(например, на больших высотах концентрациялегких газов Не и Н2 гораздо больше чем у
поверхности Земли).
На след. Рисунке изображены две кривые,
которые можно трактовать, либо как
соответствующие разным μ (при одинаковой Т),
либо как отвечающие разным Т, при одинаковых
μ.
А.С. Чуев, 2020
27
28.
Таким образом, чем тяжелее газ (> μ) и чем нижетемпература, тем быстрее убывает давление.
А.С. Чуев, 2020
28
29. Распределение Больцмана
Распределение Больцмана определяетраспределение частиц в силовом поле в
условиях теплового равновесия.
А.С. Чуев, 2020
29
30. Пусть идеальный газ находится в поле консервативных сил, в условиях теплового равновесия. При этом, концентрация газа будет
различной в точках с различной потенциальнойэнергией, что необходимо для соблюдения
условий механического равновесия.
Число молекул в единичном объеме n убывает с
удалением от поверхности Земли, и давление, в
силу соотношения P nkT
тоже убывает.
А.С. Чуев, 2020
30
31. Исходя из основного уравнения молекулярно-кинетической теории: , заменим P и P0 в барометрической формуле на n и n0 и получим
Исходя из основного уравнениямолекулярно-кинетической теории: P nkT ,
заменим P и P0 в барометрической формуле
на n и n0 и получим распределение
Больцмана для молярной массы газа:
n n0
μgh
RT
e
,
где n0 и n число молекул в единичном
объёме на высоте h = 0 и h, соответственно.
А.С. Чуев, 2020
31
32.
А.С. Чуев, 202032
33.
Так как μ mN A , R N Ak , тораспределение Больцмана можно
представить в виде:
mgh
n n0 e
А.С. Чуев, 2020
kT
.
33
34. Так как –потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям
Так как U mgh –потенциальная энергия,следовательно, распределение Больцмана
характеризует распределение частиц по
значениям потенциальной энергии:
n n0
U
kT
e
– это закон распределения частиц по
потенциальным энергиям – распределение
Больцмана.
Здесь n0 – число молекул в
единице объёма. Там, где U 0.
А.С. Чуев, 2020
34
35. Больцман доказал, что это соотношение справедливо не только в потенциальном поле сил гравитации, но и в любом потенциальном
Еще одна запись распределения Больцмана:n1
e
n2
U1 U 2
kТ
Больцман доказал, что это соотношение справедливо
не только в потенциальном поле сил гравитации, но и в
любом потенциальном поле, для совокупности любых
одинаковых частиц, находящихся в состоянии
хаотического теплового движения.
А.С. Чуев, 2020
35
36. Закон распределения Максвелла-Больцмана
Закон распределения МаксвеллаБольцманаА.С. Чуев, 2020
36
37.
А.С. Чуев, 202037
38.
А.С. Чуев, 202038
39. Закон Максвелла-Больцмана в представлении через потенциальную и кинетическую энергии, имеет вид:
dnU , K n 04
3/2
U K
m
2
kT
e
d .
2kT
А.С. Чуев, 2020
39
40. Закон распределения Максвелла-Больцмана в иной форме записи Здесь n0 – число молекул в единице объёма в той точке, где ; .
Закон распределения Максвелла-Больцмана виной форме записи
2
E
kT
dn n0 A e d .
Здесь E U K
n0 – число молекул в единице объёма в той точке,
где U 0 ;
m
A
2 kT
А.С. Чуев, 2020
3/2
.
40
41.
Понятие о фазовом пространствеА.С. Чуев, 2020
41
42.
Двумерное фазовое пространствоКвантом двумерного фазового пространства является постоянная Планка.
А.С. Чуев, 2020
42
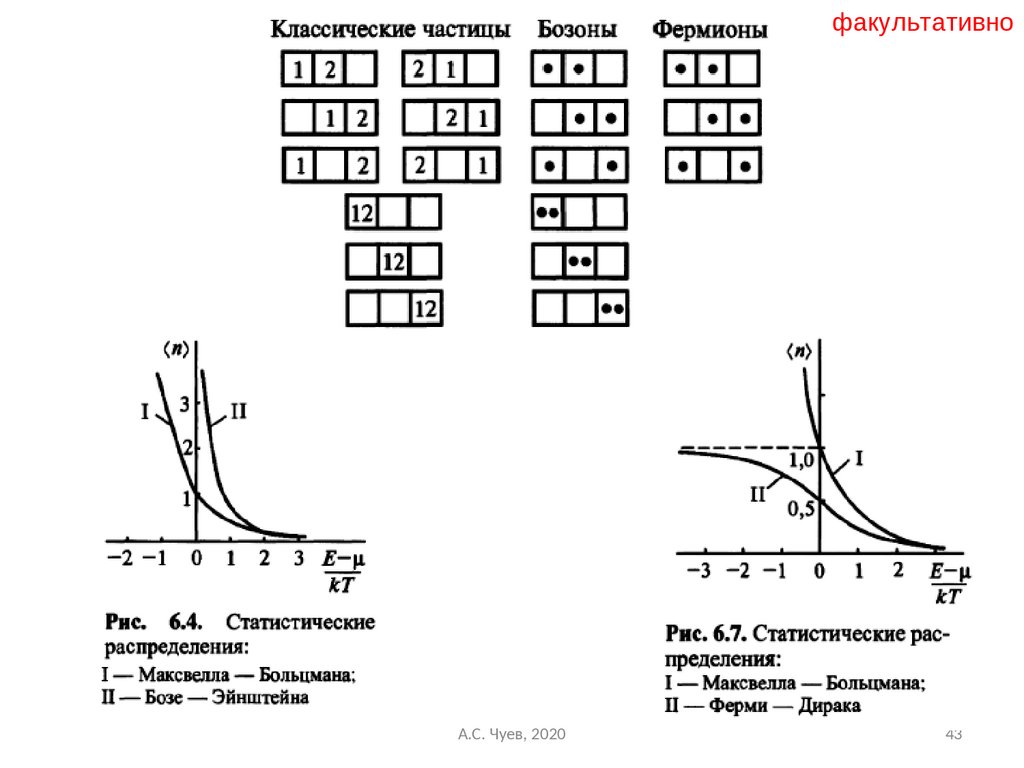
43.
факультативноА.С. Чуев, 2020
43
44.
Понятие о фазовом пространстве,распределения бозонов и фермионов
А.С. Чуев, 2020
факультативно
44
45. Статистический смысл энтропии
Различают понятия микро- и макросостояниетермодинамической системы
А.С. Чуев, 2020
45
46. Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами. Состояние системы, характеризуемое
состоянием каждой входящей в системумолекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то
имеется много микросостояний, соответствующих
одному макросостоянию.
Обозначим W число микросостояний
соответствующее данному макросостоянию
(как правило W >> 1).
А.С. Чуев, 2020
46
47. Термодинамической вероятностью или статистическим весом макросостояния W называется число микросостояний, осуществляющих
Термодинамической вероятностью илистатистическим весом макросостояния W
называется
число
микросостояний,
осуществляющих данное макросостояние (или
число перестановок одноименных элементов, при
которых сохраняется данное макросостояние).
Термодинамическая вероятность W
максимальна, когда система находится в
равновесном состоянии.
А.С. Чуев, 2020
47
48. В состоянии равновесия в термодинамике и вероятность максимальна и энтропия максимальна. Из этого можно сделать вывод, что
междуними существует связь.
Но! Энтропия S – аддитивная величина:
т.е. она равна сумме энтропий тел, входящих в
систему.
n
S Si
i 1
А.С. Чуев, 2020
48
49. Вероятность сложного события, есть произведение вероятностей где W1 – первое состояние; W2 – второе состояние. Аддитивной
Вероятность сложного события, естьпроизведение вероятностей
W W1W2
где W1 – первое состояние; W2 – второе
состояние.
Аддитивной величиной является
логарифм W:
n
ln W ln W1 ln W2 ... ln Wi
i 1
А.С. Чуев, 2020
49
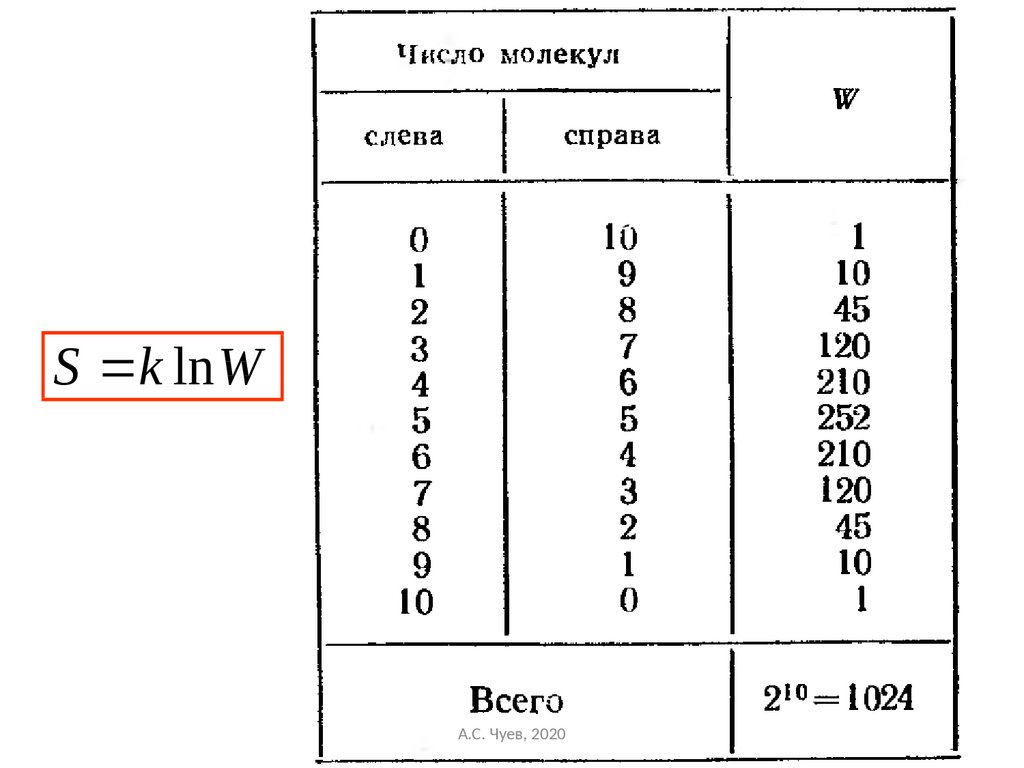
50. Больцман предложил, что энтропия где k – коэффициент (постоянная) Больцмана. С этой точки зрения энтропия выступает, как мера
Формула Больцмана для статистическойэнтропии
Больцман предложил, что энтропия
S k ln W
где k – коэффициент (постоянная) Больцмана.
С этой точки зрения энтропия выступает,
как мера беспорядочности, хаотичности
состояния.
А.С. Чуев, 2020
50
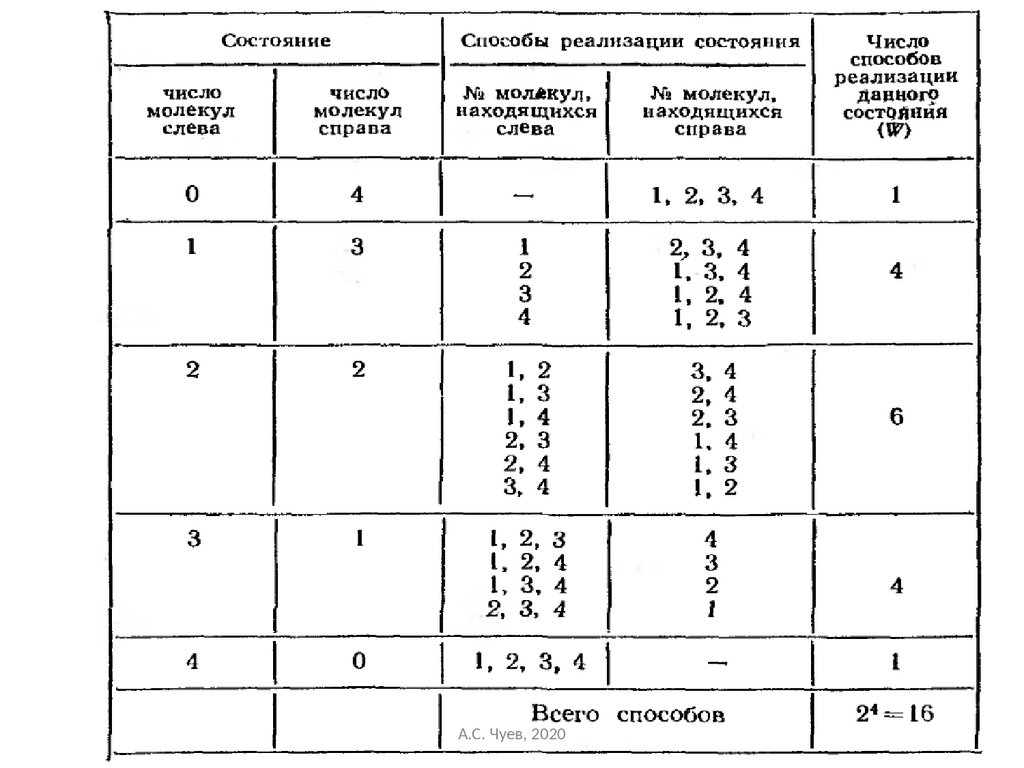
51.
Статистический вес итермодинамическая вероятность
Число состояний
W
n – число частиц слева
(N - n ) – число частиц справа
Максимум числа состоянийА.С.
при
равномерном распределении
Чуев, 2020
51
52.
А.С. Чуев, 202052
53.
S k ln WА.С. Чуев, 2020
53
54.
Конец лекции 15А.С. Чуев, 2020
54











































 Физика
Физика








