Похожие презентации:
Карбоновые кислоты
1. Карбоновые кислоты
2.
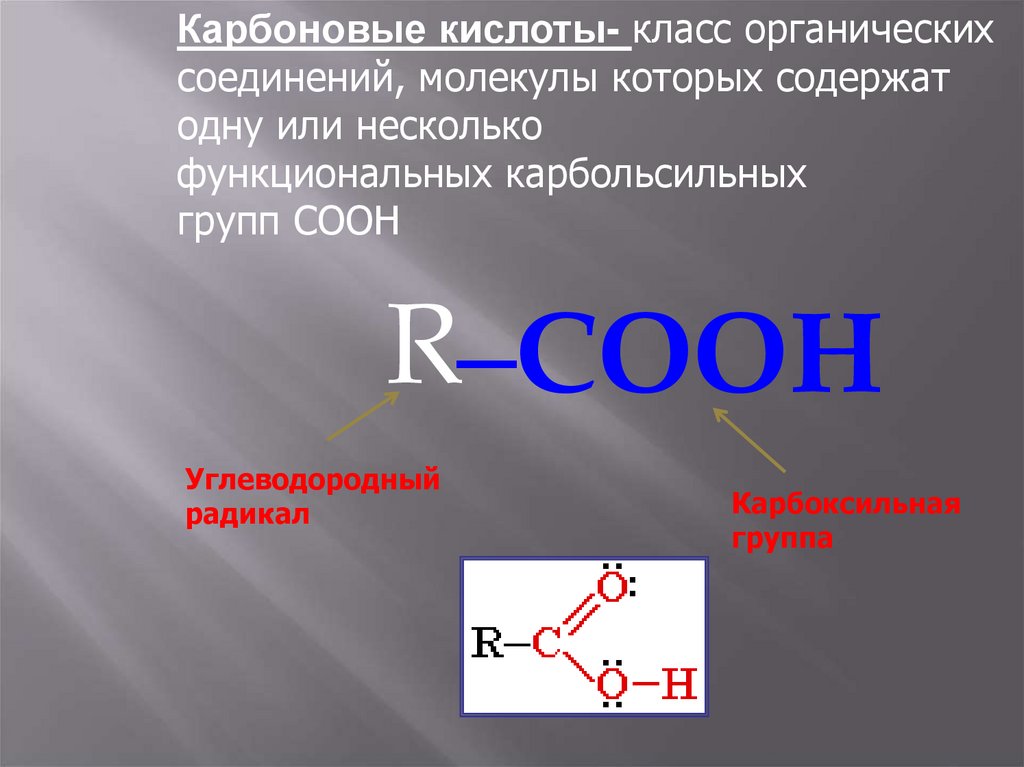
Карбоновые кислоты- класс органическихсоединений, молекулы которых содержат
одну или несколько
функциональных карбольсильных
групп COOH
R–COOH
Углеводородный
радикал
Карбоксильная
группа
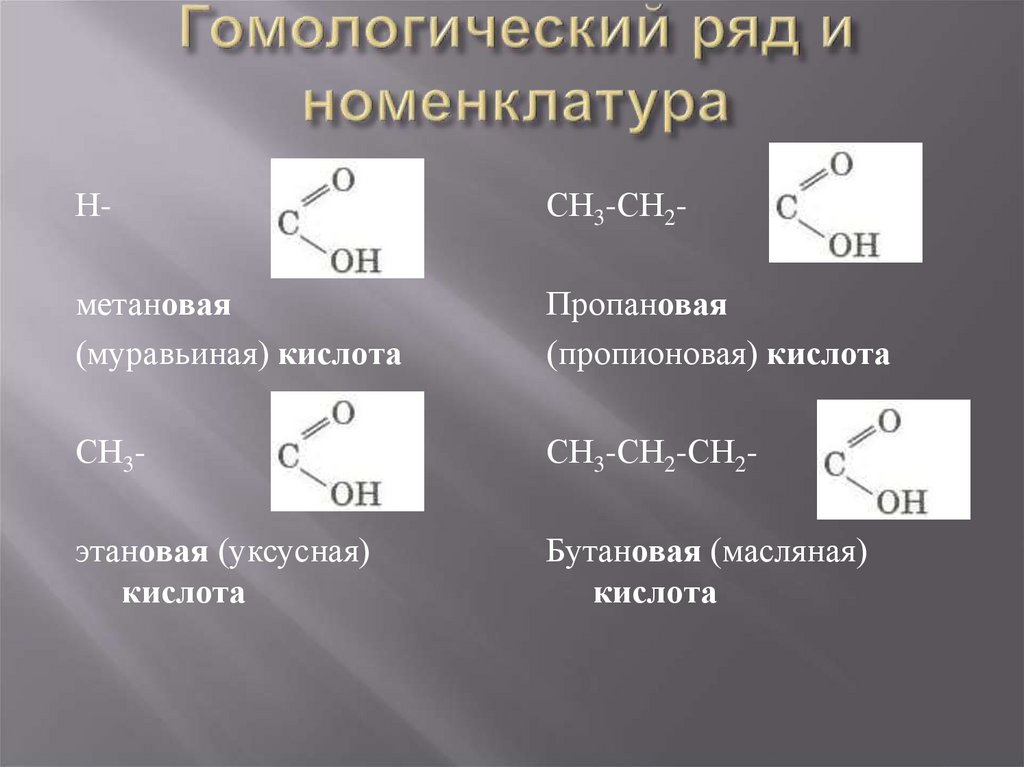
3. Гомологический ряд и номенклатура
Н-СН3-СН2-
метановая
(муравьиная) кислота
Пропановая
(пропионовая) кислота
СН3-
СН3-СН2-СН2-
этановая (уксусная)
кислота
Бутановая (масляная)
кислота
4.
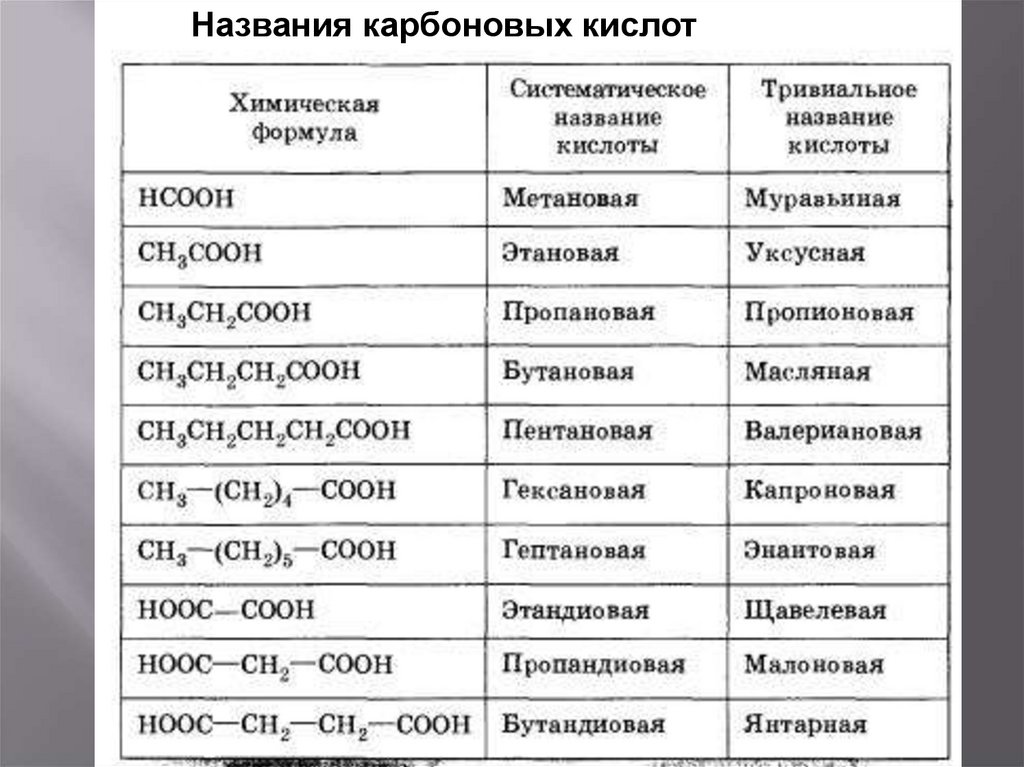
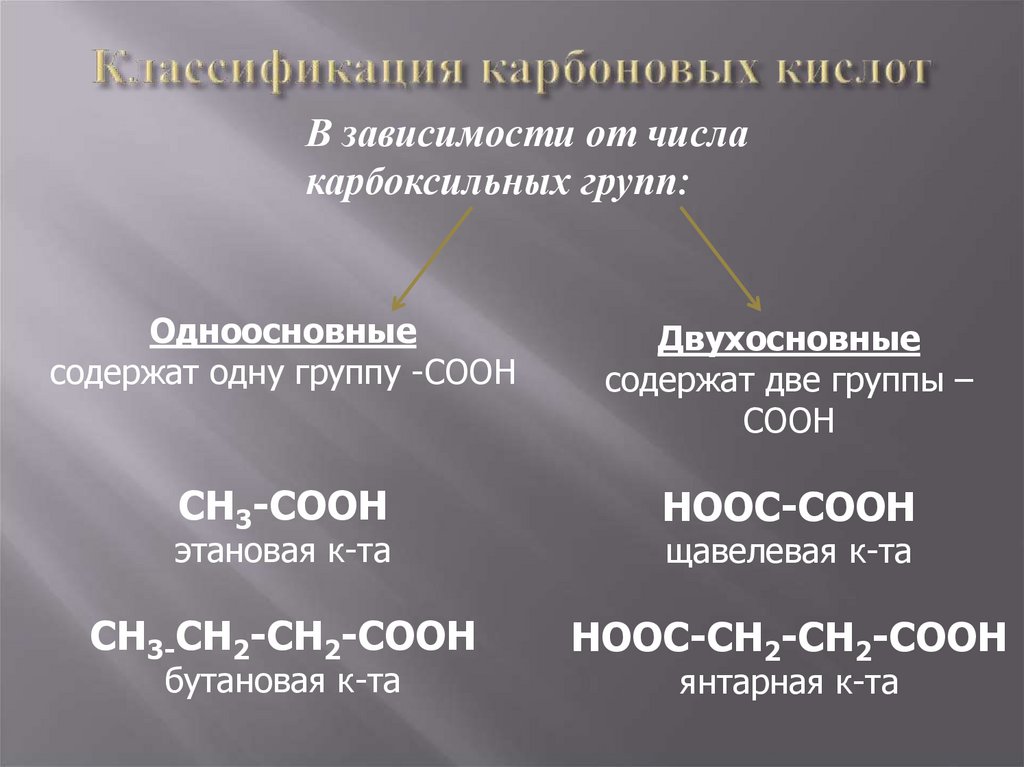
Названия карбоновых кислот5. Классификация карбоновых кислот
В зависимости от числакарбоксильных групп:
Одноосновные
содержат одну группу -COOH
Двухосновные
содержат две группы –
COOH
CH3-COOH
HOOC-COOH
CH3-CH2-CH2-COOH
HOOC-CH2-CH2-COOH
этановая к-та
бутановая к-та
щавелевая к-та
янтарная к-та
6. В зависимости от строения радикала:
Предельные –(производные
алканов)
Непредельные –
(производные
алкенов и других
ненасыщенных
углеводородов)
Ароматические –
(производные бензола,
содержащие одну или
несколько
карбоксильных групп)
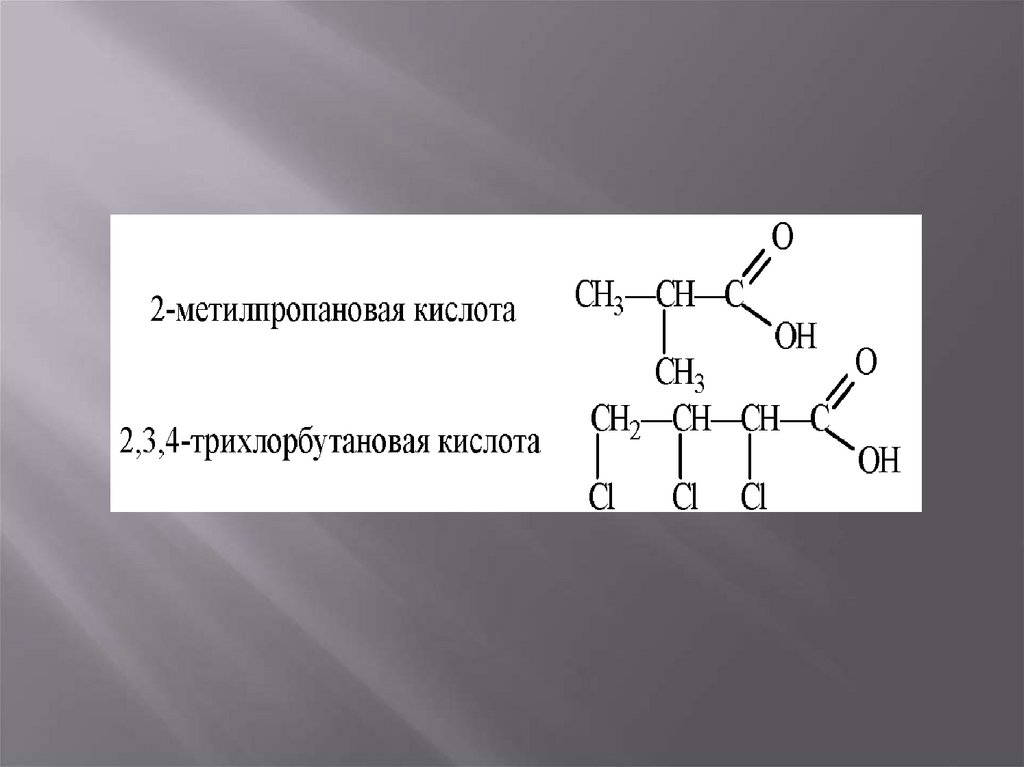
7. Номенклатура
В систематической номенклатуре кислот действуютследующие правила:
1. Главная цепь должна начинаться и нумероваться с
карбоксильной группы.
2. В префиксе указываются положение и названия
заместителей.
3. После корня указывающего число атомов в цепи
идет суффикс, показывающий наличие или отсутствие
двойных, тройных связей, их положение.
4. После этого добавляется «– овая кислота». Если
карбоксильных групп несколько, то перед – овая
ставится числительное (ди –, три –… ).
8.
9. Строение
Поляризациямолекул
Возможность
образования
водородных связей
Высокие
температуры
кипения
10.
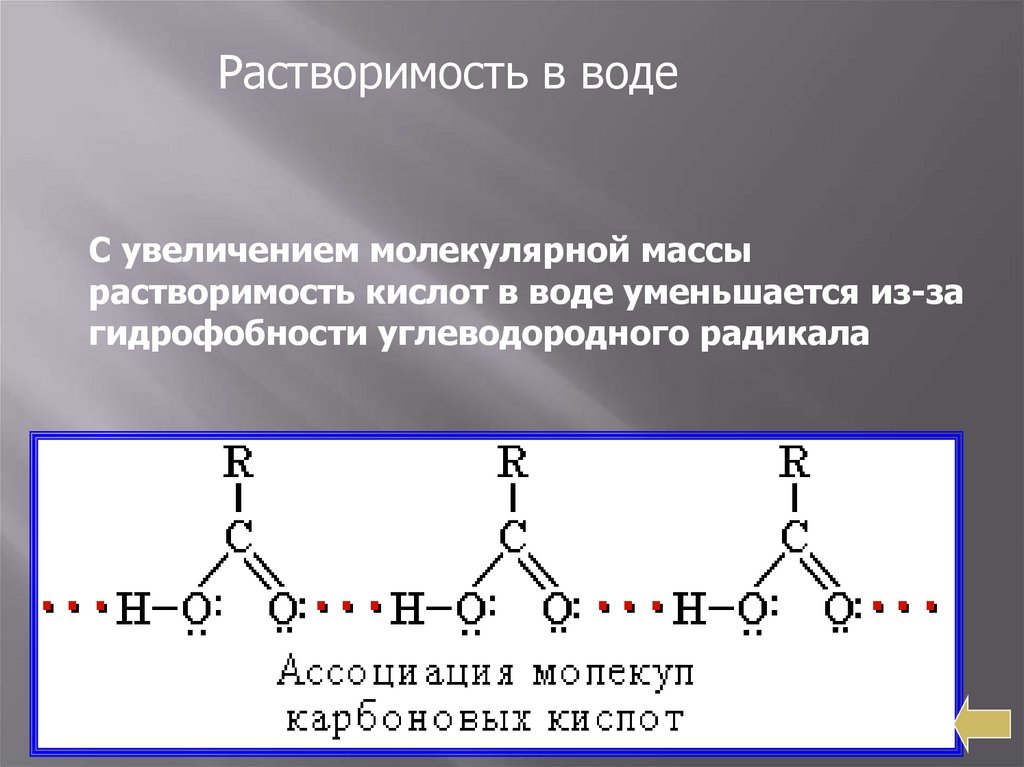
Растворимость в водеС увеличением молекулярной массы
растворимость кислот в воде уменьшается из-за
гидрофобности углеводородного радикала
11. Физические свойства
1.2.
3.
легкоподвижные бесцветные жидкости,
неограниченно смешиваются с водой, с
характерным острым запахом .
вязкие маслянистые жидкости с неприятным
запахом, растворимость падает с ростом С.
твердые вещества, не растворимы в воде.
12. Химические свойства
Карбоновые кислоты обладаютсвойствами, характерными для минеральных
кислот.
Из-за смещения электронной плотности от
гидроксильной группы O–H к сильно
поляризованной карбонильной группе C=O
молекулы карбоновых кислот способны к
электролитической диссоциации:
R–COOH → R–COO- + H+
Все карбоновые кислоты - слабые электролиты.
Карбоновые кислоты слабее многих
сильных минеральных кислот (HCl, H2SO4 и
т.д.) и поэтому вытесняются ими из солей:
СH3COONa + H2SO4 → CH3COOH + Na2SO4
конц.
tº
13. Химические свойства
1) Взаимодействуют с активными металламиMg + 2CH3COOH (CH3COO)2Mg + H2
2) Взаимодействуют с основными оксидами
CaO+2CH3COOH (CH3COO)2Ca+H2O
3) Взаимодействуют с основаниями
CH3COOH+NaOH CH3COONa+H2O
3CH3COOH + Fe(OH)3 → (CH3COO)3Fe + 3H2O
4) Взаимодействуют с солями слабых кислот
2CH3COOH+CaCO3 (CH3COO)2Ca+CO2+H2O
5) Реагируют с аммиаком (как основанием)
СH3COOH + NH3 → СH3COONH4
14. Сила карбоновых кислот
С увеличением числа атомов углерода сила кислотубывает (из-за снижения полярности связи O-H). Так,
в ряду
HCOOH CH3COOH C2H5COOH
15. Спасибо за внимание!
16. Источники:
wikipedia.orgcalc.ru
foxford.ru
himija-online.ru










 Химия
Химия








