Похожие презентации:
Виды ВЭЖХ по технике исполнения
1.
Виды ВЭЖХ по технике исполненияХроматография
Жидкостная
Колоночная
Бумажная
Планарная
Тонкослойная
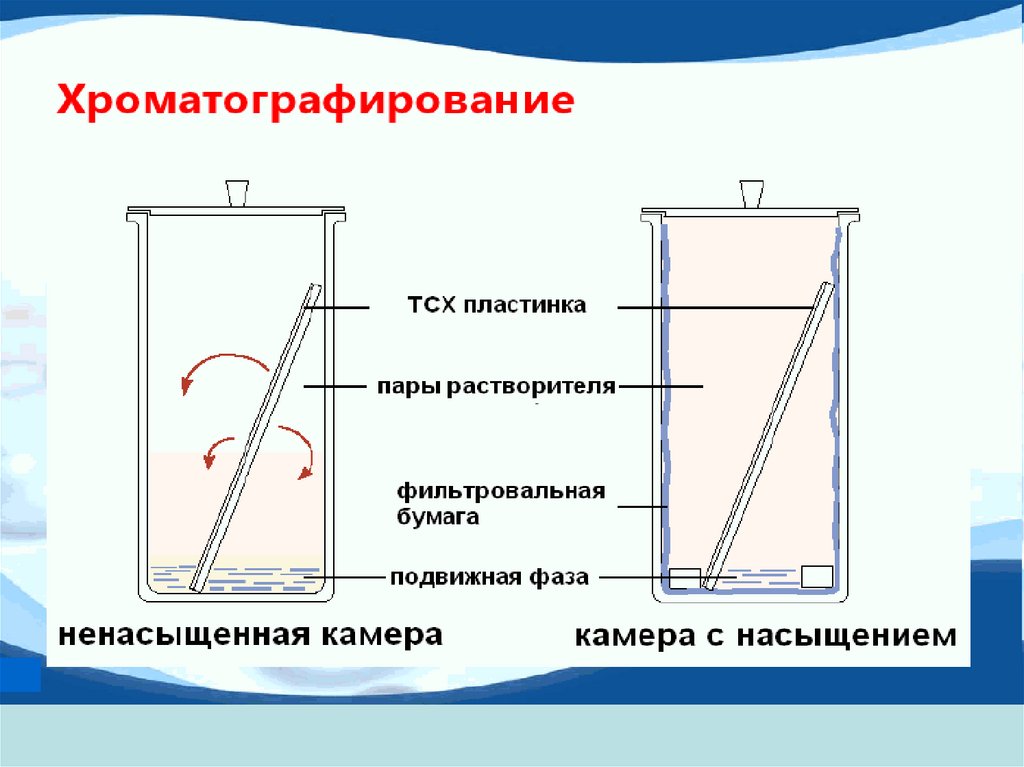
2. Планарная (тонкослойная) хроматография
3.
Разделение веществ происходит на открытомслое сорбента
Хроматографический процесс обеспечивается
передвижением подвижной фазы (элюента)
посредством капиллярных сил
4.
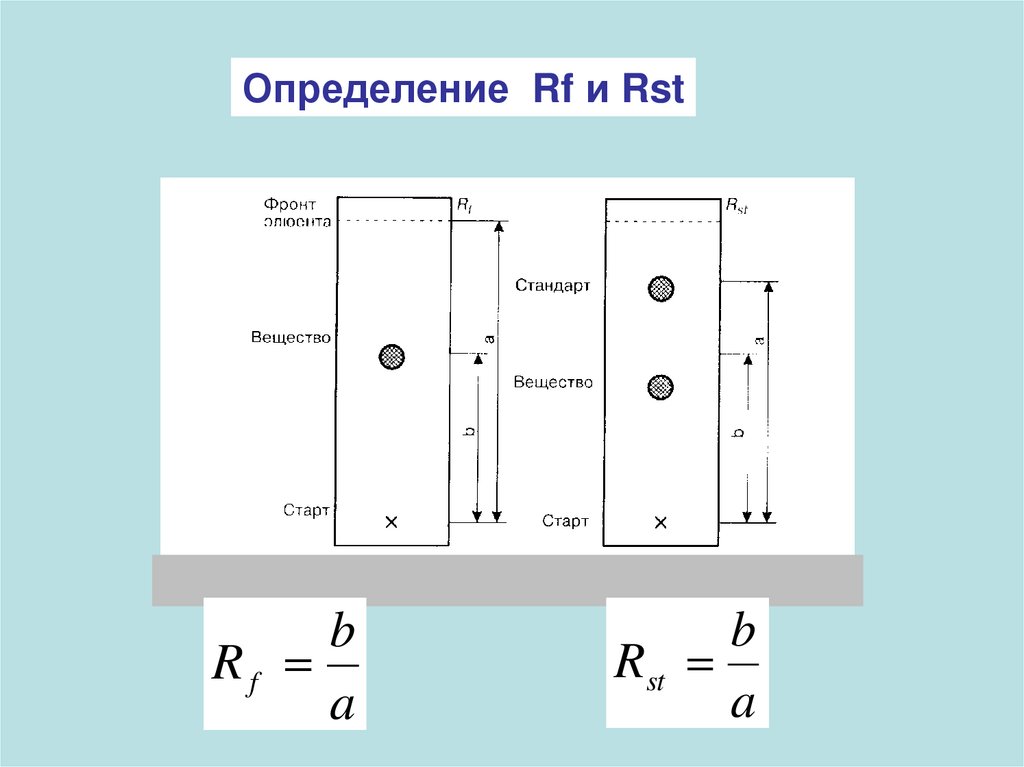
Определение Rf и Rstb
Rf
a
b
Rst
a
5.
Rf зависит от:«Активности» и качества сорбента
Природы и качества растворителей
Толщины слоя сорбента
Количества нанесенного вещества
Способа работы
Коэффициент разделения 2-х соединений
K2/1 = D2/D1 = (1/Rf – 1)2 / (1/Rf – 1)1
6. Достоинства планарной хроматографии
7.
- единственный хроматографический метод,который позволяет проводить полный анализ
неизвестной смеси, т.к можно проверить, не осталось
ли на старте неэлюированных компонентов;
- по производительности, по крайней мере, на
порядок, превосходит газовую и высокоэффективную
жидкостную хроматографию;
- используется более простое и дешевое
оборудование;
8.
-обладает высокой селективностью, которую легковарьировать, подбирая состав подвижной фазы;
- нет ограничений как в ВЭЖХ на выбор
растворителей;
- дает возможность одновременного разделения
нескольких образцов в условиях однократного или
многократного элюирования (при различных
условиях);
- возможность детектировать соединения с высокой
чувствительностью и селективностью, которые легко
варьировать, подбором проявляющего реагента;
9.
Недостатки планарнойхроматографии
10.
-ограниченная разделяющая способность из-засравнительно небольшой длины разделяющей зоны (310 см);
-чувствительность ниже, чем в случае ВЭЖХ;
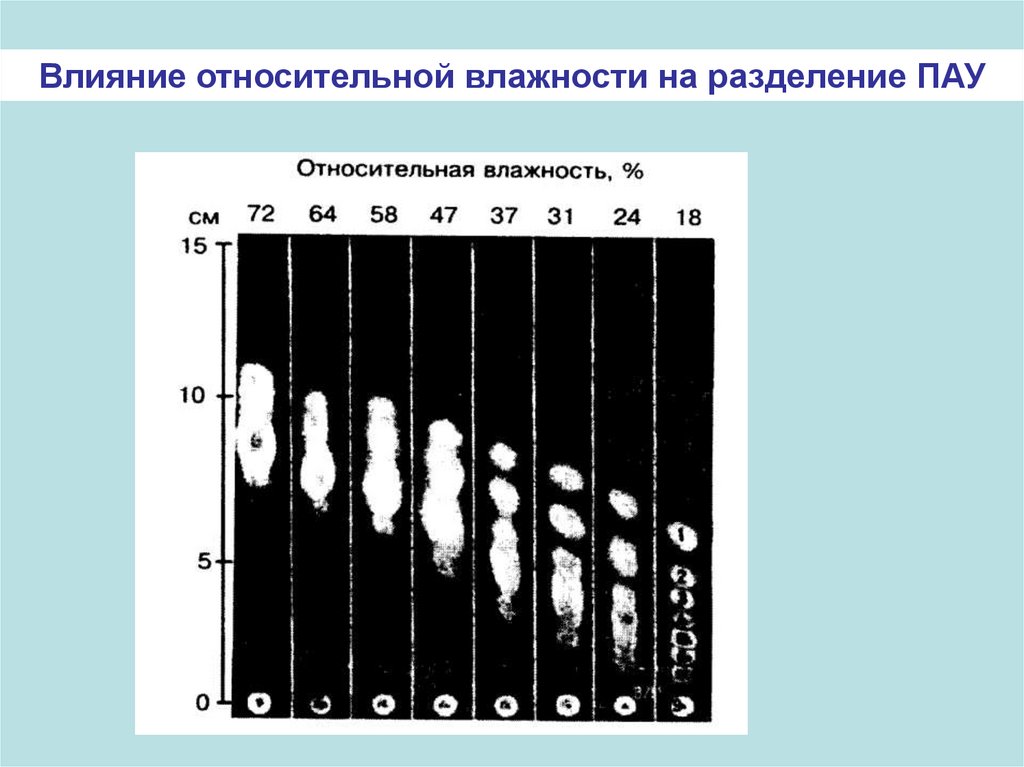
-зависимость от окружающей среды: относительная
влажность, температура, а также наличие
загрязняющих веществ в воздухе;
- трудности в работе с образцами, имеющими высокую
летучесть, а также с веществами, чувствительными к
кислороду воздуха или свету.
11.
Области применения плоскостнойхроматографии
12.
Методы элюирования в планарнойхроматографии
13.
14.
15.
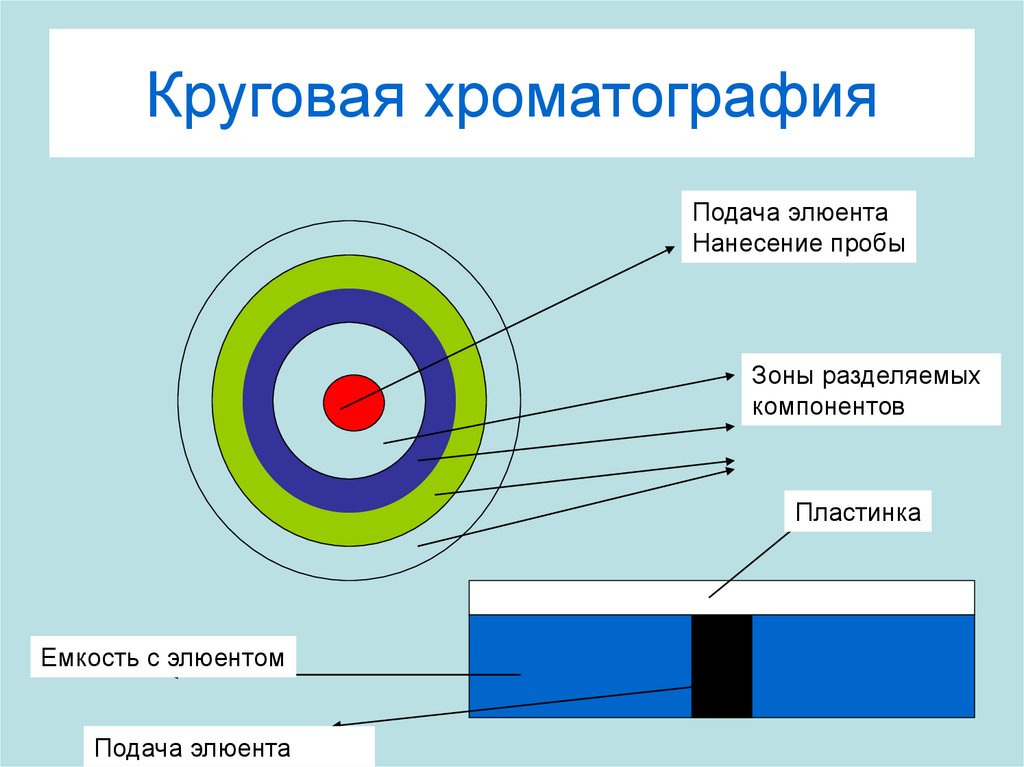
16. Круговая хроматография
Подача элюентаНанесение пробы
Зоны разделяемых
компонентов
Пластинка
Емкость с элюентом
Подача элюента
17.
При нанесении пробы необходимо:- легкое удаление растворителя со стартовой зоны;
- растворимость анализируемых веществ должна быть
не менее 0,01 г/мл;
- растворитель не должен иметь высокую полярность,
иначе зона на старте может быть размыта.
18.
19.
20.
21.
22.
23.
Подложки: стекло, алюминевая фольга,полимерные пленки
Связующие вещества : гипс (5-10%),
силиказоль, силикаты щелочных металлов,
полиакриламид, полиакриловый эфир, крахмал
Флуоресцентный индикатор: смесь
силикатов цинка и магния и смесь сульфидов
цинка и кадмия; вольфраматы
щелочноземельных элементов
24.
Требования к сорбентам в ТСХ- образуют химически и физически стабильные слои;
- не образуют ковалентных связей с разделяемыми
веществами;
- не растворяются в подвижной фазе или
перемещаются вместе с ней по пластинке;
- не содержат компонентов, мешающих разделению
или детектированию
- не имеют собственной окраски;
- не набухают и не сжимаются под действием
подвижной фазы.
25.
Предварительная подготовка слоя сорбента- промыть пластинку
- активировать пластинку
- активироавнную пластинку хранить в
эксикаторе
вакуум-
- при нанесении пробы рабочую область
платинки предохранять покровной стеклянной
пластинкой
26.
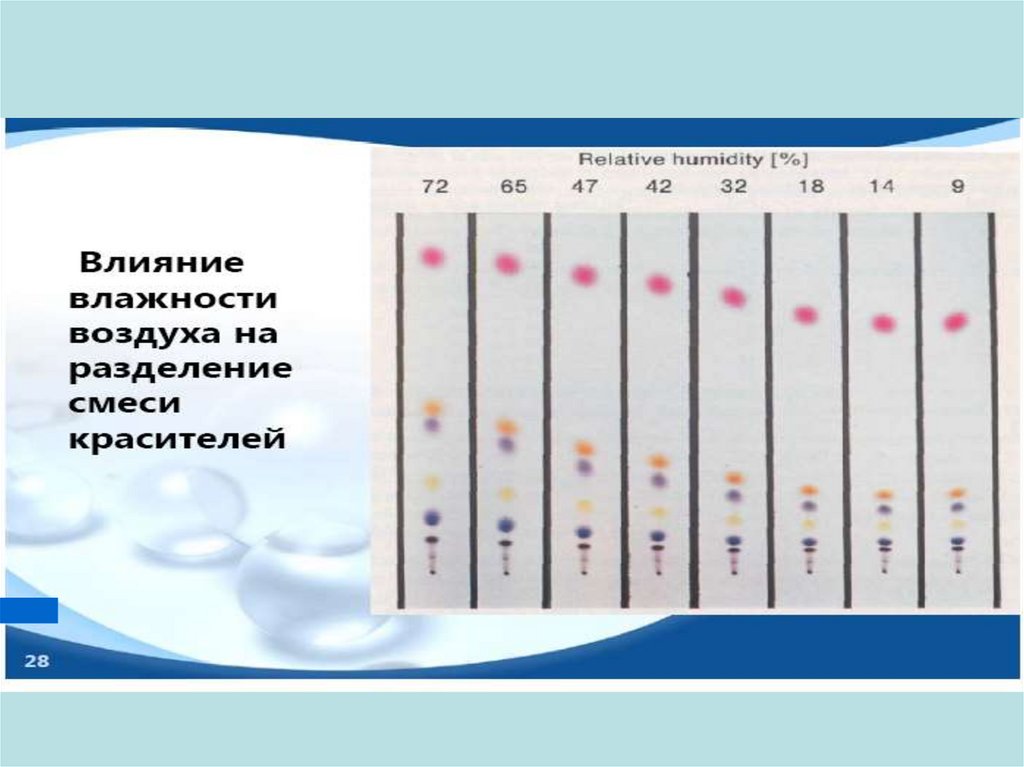
Влияние относительной влажности на разделение ПАУ27.
28.
Основные типы сорбентов в ТСХ29.
Силикагель - полярный адсорбент, содержитактивные силанольные и силоксановые группы.
Применяют для разделения соединений различной
полярности.
Оксид алюминия
- полярный адсорбент с
гетерогенной поверхностью, содержит активные ОНгруппы, заметно выражены протоноакцепторные
свойства. Применяют для разделения ароматических
углеводородов, алкалоидов, хлоруглеводородов,
стероидов
30.
31.
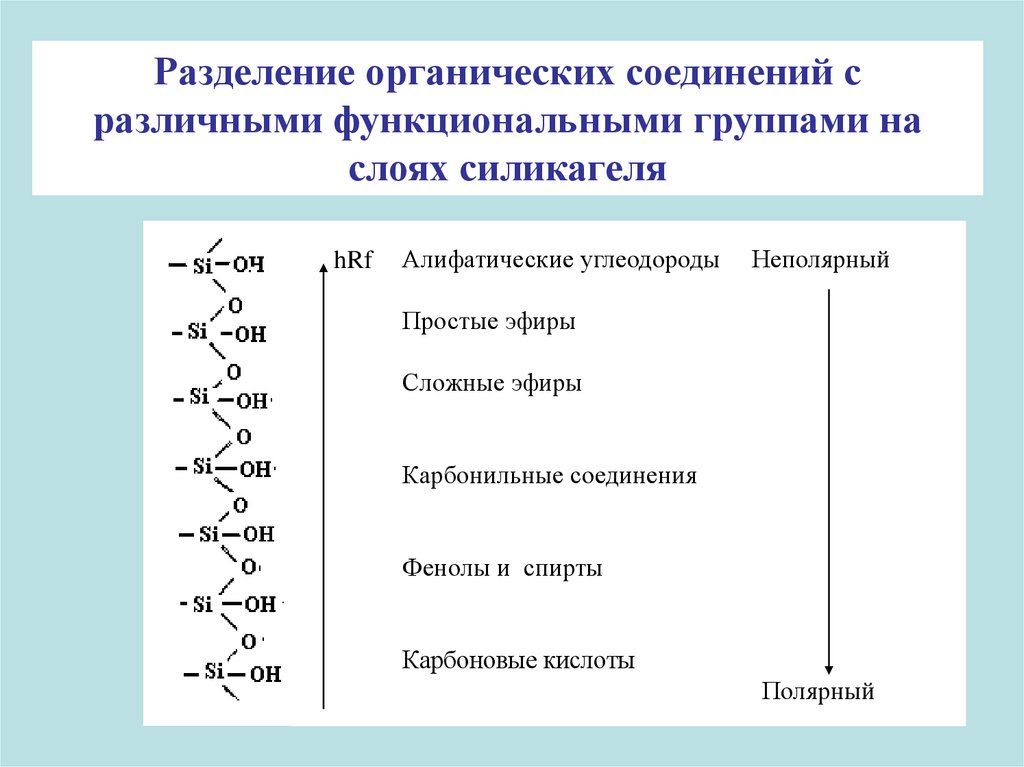
Разделение органических соединений сразличными функциональными группами на
слоях силикагеля
hRf
Алифатические углеодороды
Неполярный
Простые эфиры
Сложные эфиры
Карбонильные соединения
Фенолы и спирты
Карбоновые кислоты
Полярный
32.
Хроматограмма разделения L-аминокислот1- лейцин, 2- метионин, 3-фенилаланин, 4- валин, 5 – смесь кислот
ПФ – хлороформ:этанол:CH3COOH:H2O
А- пластинки «Сорбфил», высокоэффективный вариант,
Б – пластинки «Сорбфил», аналитический вариант
33.
Некоторые характеристикиТСХ- и ВЭТСХ пластинок
34.
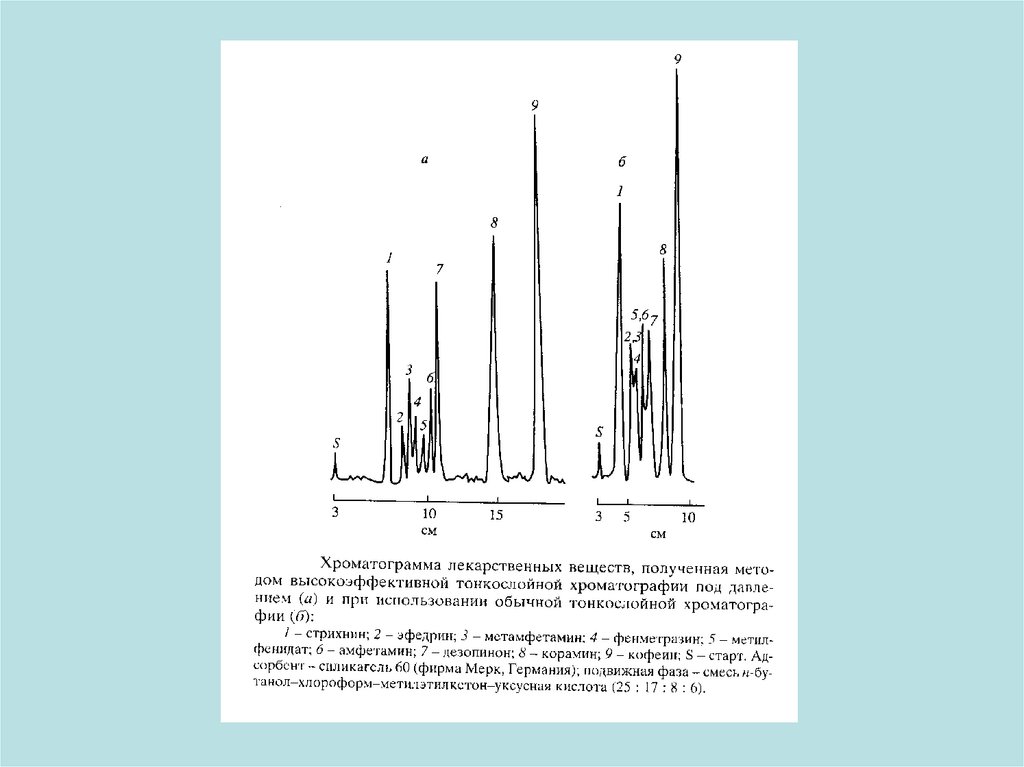
Устройство для высокоэффективной тонкослойнойхроматографии под давлением
35.
36.
Выбор подвижной фазы37.
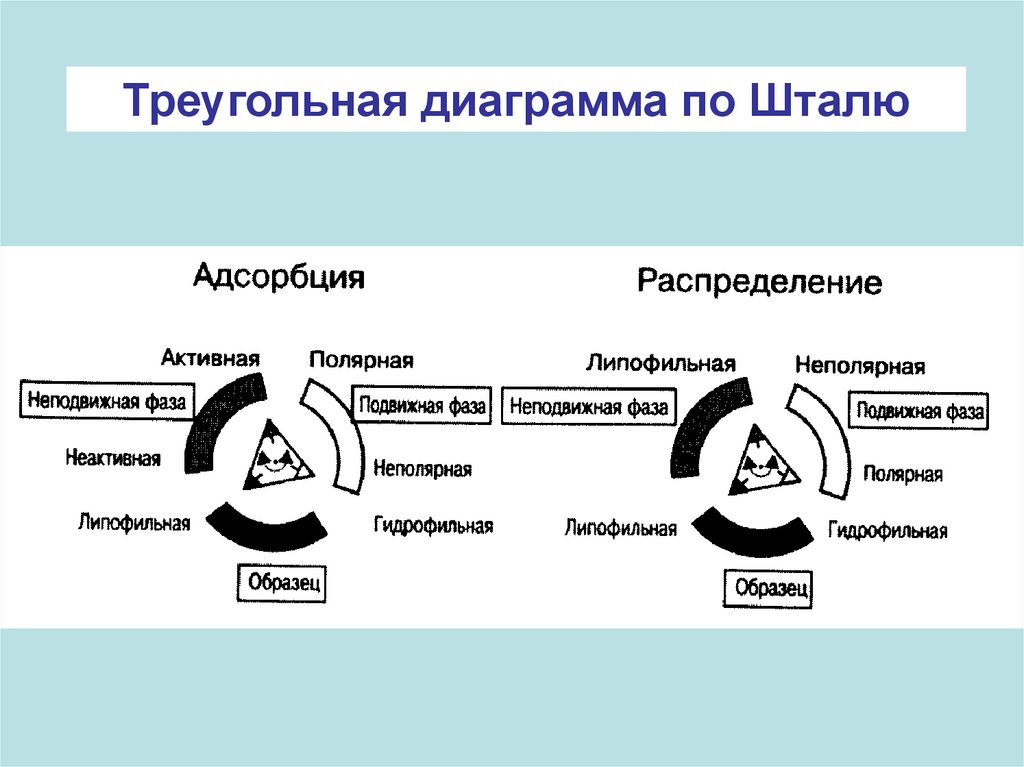
Треугольная диаграмма по Шталю38.
Методы подбора и оптимизациисостава подвижной фазы
39.
Стандартные системы дляадсорбционной ПХ:
Хлороформ – метанол
Хлороформ – ацетон
Диэтиловый эфир – толуол
Диэтиловый эфир – гексан – уксусная кислота
Этилацетат – метанол
Этилацетат - толуол
40.
Стандартные системы дляраспределительной ПХ:
Хлороформ – метанол – вода
Хлороформ – метанол – вода – уксусная кислота
Хлороформ – метанол – вода – водный аммиак
Бутанол-1 – уксусная кислота – вода
Бутанол-1 – пиридин – вода
Этилацетат – муравьиная кислота – вода
41.
Метод «элюирования» пятна42.
Схема подбора ПФ фирмы «Camag»43.
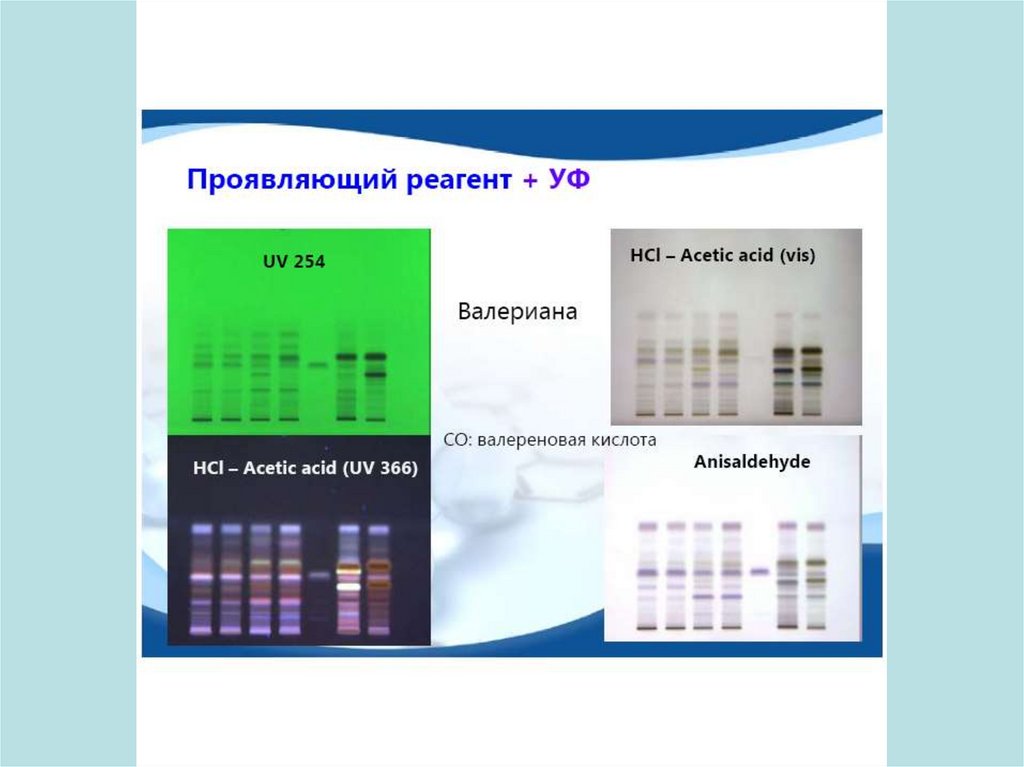
Идентификация компонентов- физическими методами, основанными на поглощении
света и флуоресценции
- химическими методами
- с «универсальными реагентами»
- с реагентами, которые избирательно реагируют с
определенными функциональными группами
исследуемых соединений.
44.
45.
46. Количественный анализ в тонкослойной хроматографии
47.
Определение с удалением хроматографической зоны спластинки
Проводят двояко:
переносом хроматографической зоны вместе с сорбентом
экстрагированием хроматографической зоны со слоя
сорбента
Определение определяемых соединений
непосредственно на пластинке
Метод визуального сравнения размеров площадей пятен и их
окраски с соответствующими параметрами пятен стандартных
образцов
48.
49.
50.
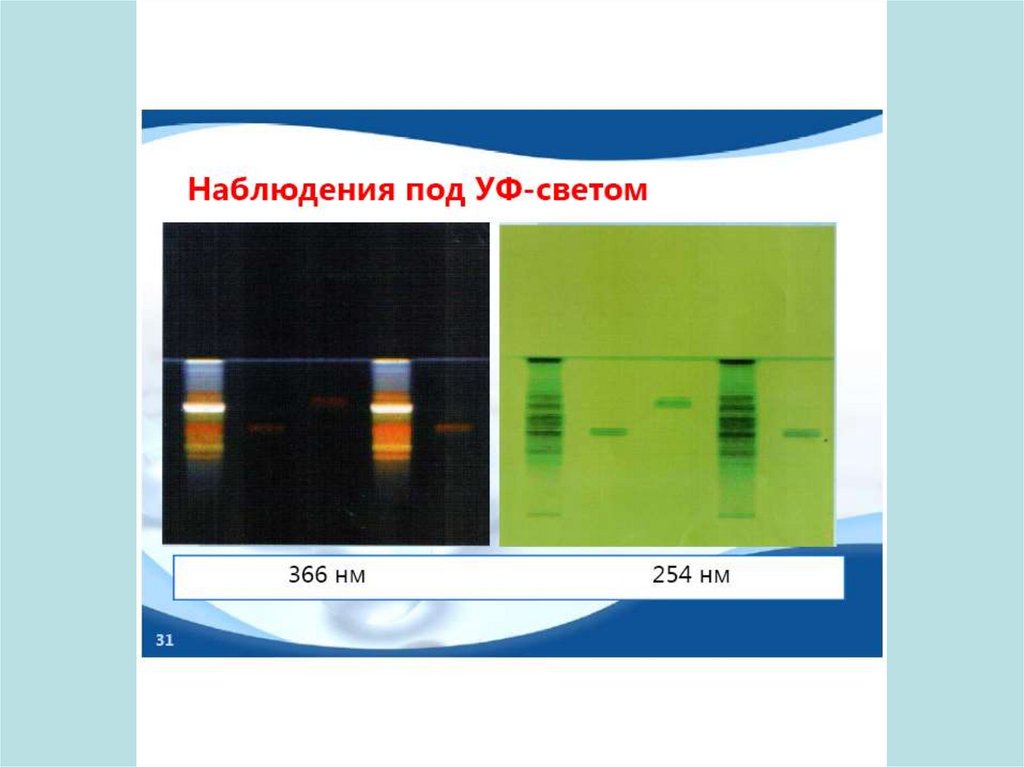
Использование метода денситометрииСканирование хроматограмм в видимом и УФ-свете с
помощью «хроматографических спектрофотометров» –
денситометров.
Измеряется:
поглощение света веществом на хроматограмме в режиме
пропускания или отражения;
флуоресценция и ее гашение.
51. Денситометрические измерения
52. Денситометрические измерения
53. Денситометрические измерения
54.
Использование метода видеоденситометрииВведение изображения хроматограммы в компьютер с
помощью видеокамеры или цифровой камеры;
сравнением интенсивностей пятен стандартных
соединений и исследуемых образцов.
Использование денситометрии с планшетным
сканером.
55.
56.
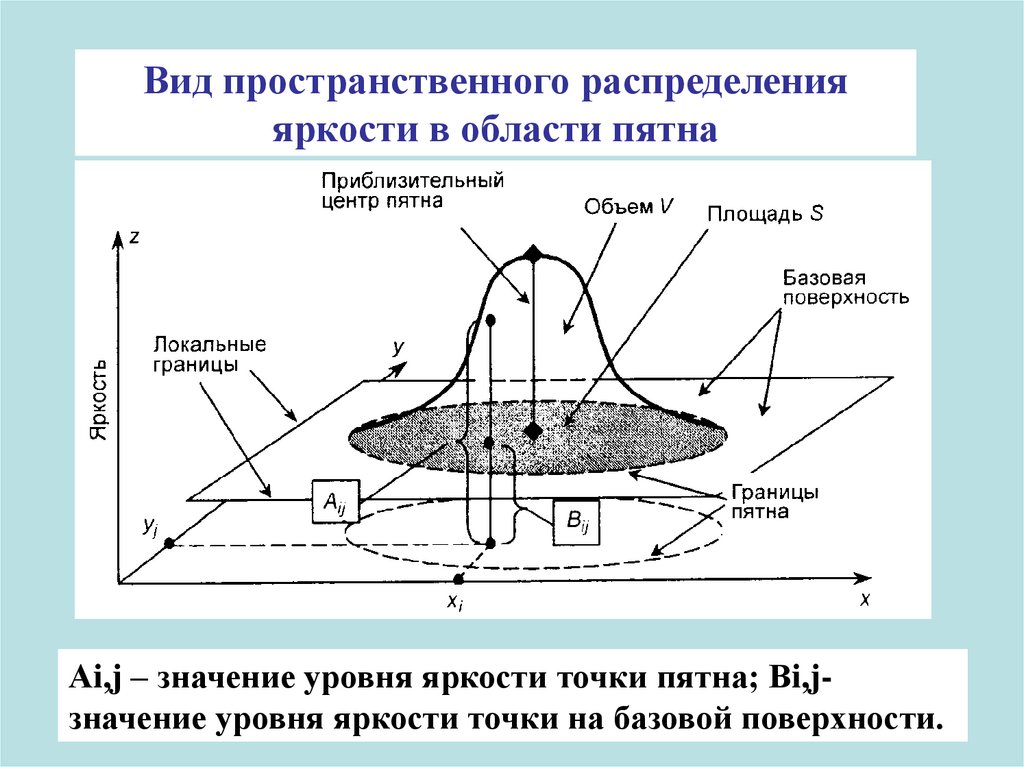
Вид пространственного распределенияяркости в области пятна
Аi,j – значение уровня яркости точки пятна; Вi,jзначение уровня яркости точки на базовой поверхности.
57.
обработку пятна в видеоденситометриипроводят по двум характеристикам:
площади пятна;
его «объему» в пространстве;
в качестве третьей координаты используют
яркость (интенсивность окраски пятна)
58.
59.
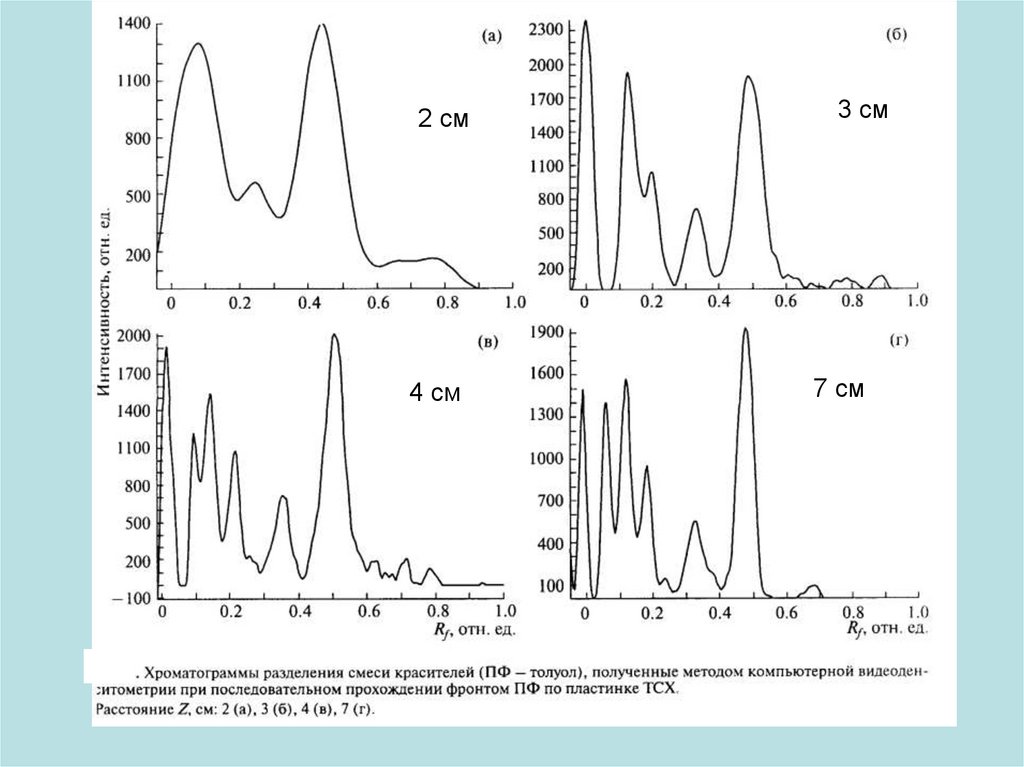
2 см4 см
3 см
7 см
60. Примеры определений
61.
Денситограмма ТСХ-хроматограммы питьевой воды сдобавкой гербицидов (20 нг в пробе)
1 – метоксурон; 2 – монурон; 3 – хлортолурон; 4 – небурон; 5 – линурон
при различных длинах волн (200; 220; 240; 260; 280; 300 нм).
62.
Разделение тетрациклиновых антибиотиков1 – хлортетрациклин;
2 – тетрациклин;
3 – окситетрациклин.
Сорбент – силикагель RP-18W;
ПФ: 0,5 М водный раствор щавелевой кислоты – метанол – ацетонитрил
(6:2:2)
63.
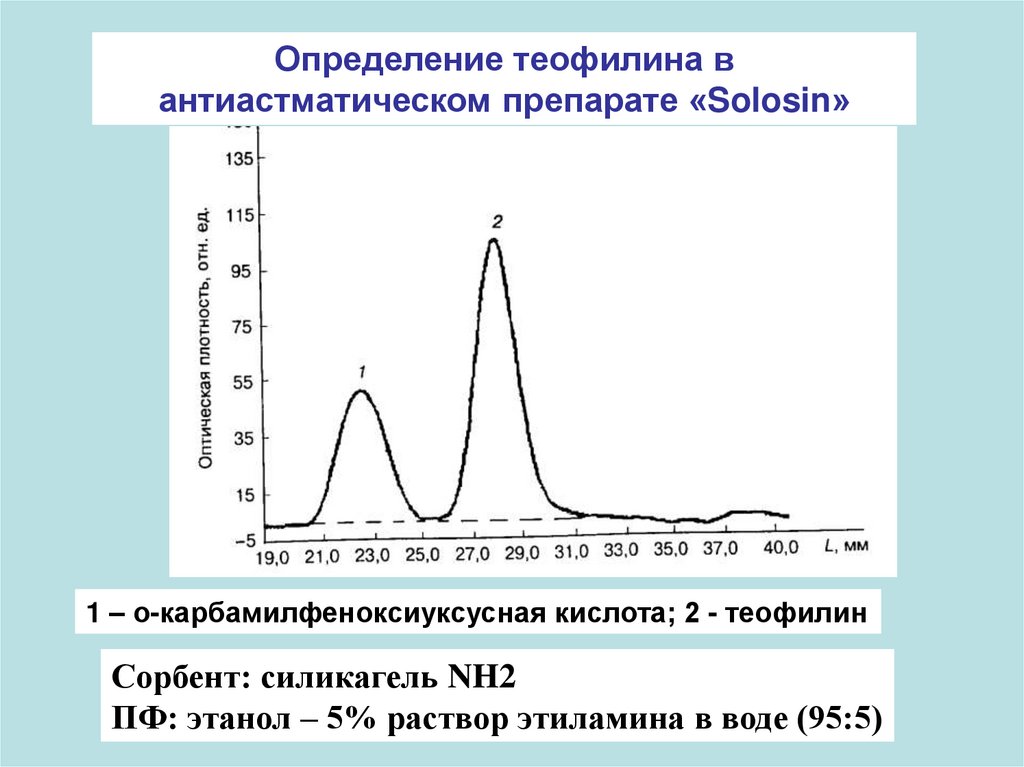
Определение теофилина вантиастматическом препарате «Solosin»
1 – о-карбамилфеноксиуксусная кислота; 2 - теофилин
Сорбент: силикагель NH2
ПФ: этанол – 5% раствор этиламина в воде (95:5)
64.
Разделение аминокислотПластинки – «Сорбфил» ПТСХ-П-В;
ПФ: пропанол-2 – этилацетат – 25% аммиак – вода (30:10:3,5:10)
65.
66.
alliinаланин
NH2 —CH2 —CH2 —COOH
67.
Хроматограммы красящих композицийнекоторых популярных тонов коммерческих
оттеночных шампуней: a – «бургунский», b –
«серебристый» или «платиновый», c –
«вишневый» или «вишня», d: 1 – «шоколад», 2 –
«коньяк», 3 – «красное дерево».
68.
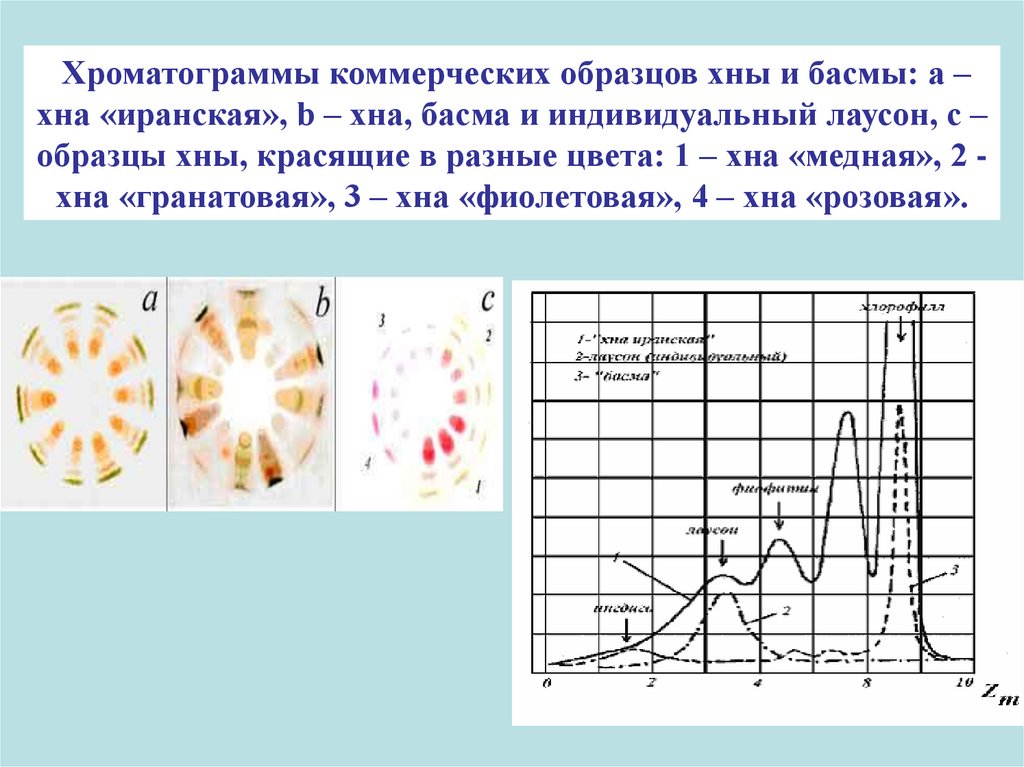
Хроматограммы коммерческих образцов хны и басмы: a –хна «иранская», b – хна, басма и индивидуальный лаусон, c –
образцы хны, красящие в разные цвета: 1 – хна «медная», 2 хна «гранатовая», 3 – хна «фиолетовая», 4 – хна «розовая».























































 Химия
Химия








