Похожие презентации:
Оптимизация хроматографического процесса
1. Оптимизация хроматографического процесса
2.
Хроматографические параметрыЦели разделения и анализа веществ пробы:
3.
ХРОМАТОГРАФИЧЕСКИЙ ПИК – отражаетдвижение молекул вещества в колонке
4.
Формирование хроматографического пикаПеремещение молекул веществ
между подвижной и неподвижной фазами
Неподви жная фаза
Подви жная фаза
Неподви жная фаза
вещество 1
вещество 2
время пребывания в подвижной фазе
=
время пребывания в неподвижной фазе
>
5.
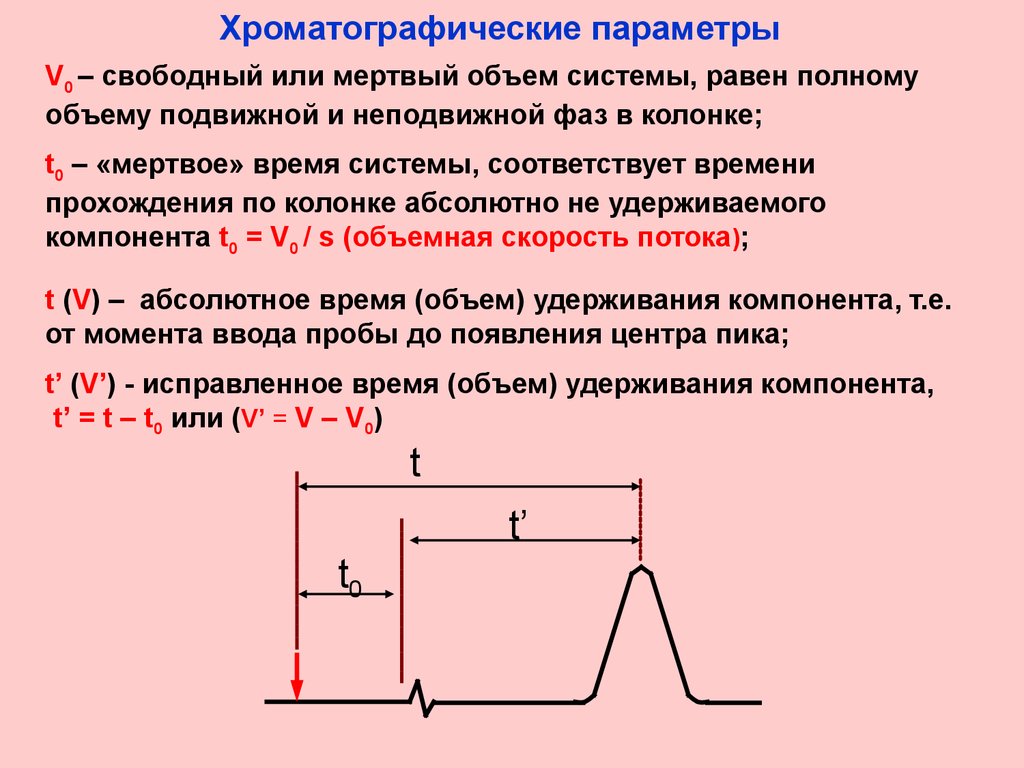
Хроматографические параметрыV0 – свободный или мертвый объем системы, равен полному
объему подвижной и неподвижной фаз в колонке;
t0 – «мертвое» время системы, соответствует времени
прохождения по колонке абсолютно не удерживаемого
компонента t0 = V0 / s (объемная скорость потока);
t (V) – абсолютное время (объем) удерживания компонента, т.е.
от момента ввода пробы до появления центра пика;
t’ (V’) - исправленное время (объем) удерживания компонента,
t’ = t – t0 или (V’ = V – V0)
t
t’
t0
6.
Хроматографические параметрыУдерживание вещества
t
t - t0
t0
k’ =
t - t0
t0
коэффициент емкости вещества;
должен быть > 0;
применим при данной колонке,
температуре, составе элюентов.
7.
Хроматографические параметрыРазделение вещества
t2
t1
k’1
k’2
α=
k’2
k’1
=
t 2 - t0 t1 - t 0
:
=
t0
t0
t’2
t’1
Коэффициент селективности,
определяется соотношением
исправленных времен удерживания,
должен быть ≠ 1.
8.
Хроматографические параметрыРазделение вещества
t2
t1
Коэффициент разрешения
R= 2 ·
W1
W2
R=0.4
R=0.5
R=0.8
R=0.6
R=1.0
R=0.7
R=1.25
t2 - t 1
W 1 + W2
9.
Хроматографические параметрыЭФФЕКТИВНОСТЬ
Число теоретических тарелок (N) – физический смысл:
- число элементарных актов сорбции-десорбции, произошедших с
веществом при его движении по колонке;
Высота, эквивалентная теоретической тарелке (H) –
физический смысл:
- высота слоя сорбента в колонке, на котором происходит единичный
акт сорбции-десорбции.
H=
L
N
эффективность прямо пропорциональна длине колонки,
где L - длина колонки.
10.
ЭФФЕКТИВНОСТЬРасчет числа т.т.
Чем эффективнее колонка,
тем уже пик, тем большее число
компонентов можно разделить за
более короткое время.
N = 5.545 ( t / W0.5)2
h x 0.5
Количественно эффективность
колонки выражают числом
теоретических тарелок N.
W0.5
1
11.
Ассиметрия пиковh x 0.05
f
h
W0.05
S – фактор симметрии
S=
W0.05
2f
S = 1 : Пик симметричен
S > 1 : Наличие хвоста
S < 1 : Наличие «бороды»
12.
ОСНОВНАЯ ЗАДАЧА ОПТИМИЗАЦИИХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА
Получить хорошее разрешение (разделение) интересующих
хроматографических пиков в разумно короткое время без потери
эффективности (т.е., составить оптимальную хроматографическую
систему, используя:
доступные адсорбенты,
набор растворителей,
и эксплуатационные возможности прибора (температура,
скорость потока).
13.
ОПТИМИЗАЦИЯХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА
Выбор вида хроматографии
Определяется: а) задачей исследования,
б) свойствами, типом разделяемых веществ.
Определение (выделение)
крупного класса органических
соединений, загрязнителей,
пищевых компонентов и т.п.
- Экстракция
- Тонкослойная хроматография
- Бумажная хроматография
- Колоночная хроматография
низкого давления
- Электрофорез
Определение (выделение)
индивидуальных (или небольшой группы)
органических соединений, загрязнителей,
пищевых компонентов и т.п.
- Газовая хроматография
- Высокоэффективная
жидкостная хроматография
14.
Выбор вида хроматографии для индивидуальныхкомпонентов: газовая или высокоэффективная жидкостная?
п о л я р н о ст ь
гидрофильные
гидрофобные
ВЭЖХ
летучие
глифосат
органические
альдегиды
кислоты
кетоны
гликоли
сульфонил
-амиды
нитрилы
антиоксиданты
нитрозамины
производные
сахаров
эпоксиды
алифатические
углеводороды
ГХ
летучие
аминокислоты
синтетические
красители
сахарные
спирты
ферменты
фенолы
афлатоксины
жирные
кислоты
водорастворимые
витамины
флавоноиды
полиароматические
анаболики
углеводороды
ароматические
амины
мономеры
жирорастворимые
полимеров
витамины
эфиры
жирных
кислот
углеводы
антибиотики
спирты
фосфорсодержащие
пестициды
неорганические
ионы
синтетические
красители
фосфолипиды
триглицериды
ароматические
эфиры
л е т у ч е ст ь
нелетучие
15.
Примеры использования различных видовхроматографии для разделения биоорганических
соединений и органических загрязнителей:
1. Классы липидов – ТСХ
2. Органические кислоты (цикл Кребса) – ТСХ, бумажная
хроматография
3. Пигменты растений, животных – ТСХ, ВЭЖХ
4. Белки, пептиды – электрофорез, ВЭЖХ
5. Аминокислоты - ВЭЖХ, на ионообменных смолах
6. Углеводы, мономеры - ВЭЖК, ТСХ
7. Витамины, кофакторы – ВЭЖХ
8. Эфирные масла, жирные кислоты, стерины – ГХ
9. Углеводороды, фенолы, их производные – ГХ, ВЭЖХ
10. Полимеры, олигомеры – ВЭЖХ, гель-проникающая
11. Синтетические орг. соединения - ГХ, ВЭЖХ
16.
ВЭЖХ хроматограмма воды с добавкой пестицидов (0,2 мг/л) послесорбционного концентрирования: 1 – дис-изопропилатразин; 2 – метамитрон; 3 –
хлордиазон; 4 – дис-этилатразин;5 – кримидин; 6 – карбетамид; 7 – бромацил; 8 –
симазин; 9 – цианазин;10 – дис-этилтербутилазин; 11 – карбутилат; 12 –
метабензтиазурон; 13 –хлортолурон; 14 - атразин; 15 – монолинурон; 16 – изопротурон;
17 –метазахлор; 18 – метапротрин; 19 – димефурон; 20 – себутилазин; 21 – пропазин;
22 – тетбутилазин; 23 – линурон; 24 – хлорхурон; 25 –прометрин; 26 – хлорпрофарм;
27 – тербутрин; 28 – метолахлор; 29 –пенцицурон; 30 – бифенокс; 31 – пердиметалин.
17.
ОПТИМИЗАЦИЯХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА
Выбор адсорбента (неподвижной фазы) в ВЭЖХ или ГХ
определяется характером разделяемых веществ:
ВЭЖХ: Силикагели, привитые неполярные фазы, ионообменные смолы
ГХ: Кремнийорганические неполярные и малополярные фазы,
органические полярные фазы
Выбор состава элюента: может включать несколько
растворителей с разными пропорциями
Элюирующая сила – способность элюента вытеснять
адсобированные анализируемые вещества в поверхности
адсорбента
Элюотропный ряд - повышение силы элюента в ВЭЖХ,
18.
ОПТИМИЗАЦИЯХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА
Элюотропные ряды зависят от типа используемого адсобента
и фактически отражают полярность растворителей
Элюотропный ряд - для нормально-фазовой ВЭЖХ
гексан < бензол < хлороформ < ацетон< ацетонитрил < пропанол < метанол
воды >1, т.е. растворитель необратимо
адсорбируется на поверхности адсорбента
Элюотропный ряд - для обращенно-фазовой ВЭЖХ
вода < метанол < ацетонитрил < этанол < тетрагидрофуран < диоксан
Н 20
СН3-0Н
СН3-C N
СН3-CH2-0Н
19.
Классификация селективностирастворителей по Снайдеру
спирты
эфиры
формамид
ацетонитрил
Н2О
дихлорметан
бензол
Xd - протонакцепторные взаимодействия
Xe – протондонорные взаимодействия
Xn – диполь-дипольные взаимодействия
20.
Разделение экстракта ягод тиса,терпеновые компоненты,
Обращенно-фазовая ВЭЖХ
Подвижная фаза:
Вода-ацетонитрил 40:60
Подвижная фаза:
Вода-ацетонитрил-метанол 40:30:30
21.
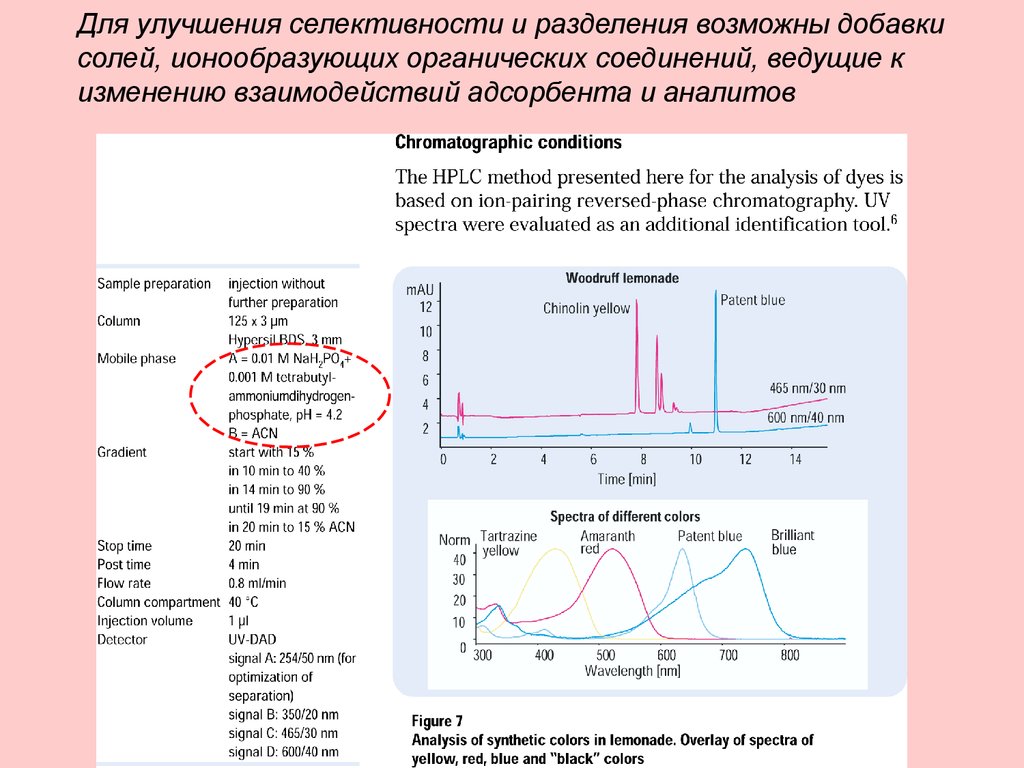
Для улучшения селективности и разделения возможны добавкисолей, ионообразующих органических соединений, ведущие к
изменению взаимодействий адсорбента и аналитов
22.
Режимы элюированияИзократический - постоянная элюирующая сила в ходе всего
хроматографического процесса;
Градиентный – состав элюентов, т.е..элюирующая сила
меняется в ходе анализа по заданной программе, что
позволяет подобрать оптимальные условия разделения
смесей вещества, ускоряет прохождение анализа.
В – концентрация сильного компонента в подвижной фазе
23.
Градиентный режим - состав элюента в процессеразделения компонентов изменяется по заданному режиму.
24.
Температурные режимы в газовой хроматографииподобны режимам элюирования в ВЭЖХ
Изотермальный (ГХ) ~ Изократический (ВЭЖХ)
240
240
200
200
Temp (deg C)
Temp (deg C)
Програмирование температуры (ГХ) ~ Градиентный (ВЭЖХ)
160
120
80
160
120
80
40
40
0
0
0
10
20
30
Time (min)
40
50
60
0
10
20
30
Time (min)
40
50
60
25.
ОПТИМИЗАЦИЯ: ВЛИЯНИЕТЕМПЕРАТУРЫ
VR = V0+V0*k'
lgk' = a/T + b
где Т – абсолютная температура в (°К);
a и b – константы (обычно а > 0).
Понижение температуры замедляет массообмен между
сорбентом и элюентом и, следовательно, способствует
размыванию пиков.
Повышение температуры может вызывать изменение
конформации макромолекул (белки, нуклеиновые
кислоты, полисахариды)
26.
ВЛИЯНИЕ СКОРОСТИ ПОТОКА НАЭФФЕКТИВНОСТЬ
Основные причины размывания пиков
1. Неоднородность потока по сечению колонки
Влияние этого фактора – константа; минимизуется равномерностью
заполнения колонки и малой вариабельностью размеров частиц.
2. Продольная и поперечная молекулярная диффузия
Чем больше скорость потока, тем меньше размывание по этой причине;
3. Сопротивление массопередаче молекул, перемещающихся из одной
фазы в другую.
Чем больше скорость потока, тем больше размывание по этой причине.
где Н – высота, эквивалентная
теоретической тарелке, U –
линейная скорость потока,
А, В, С - коэффициенты
27.
ВЛИЯНИЕ СКОРОСТИ ПОТОКА НАЭФФЕКТИВНОСТЬ
д
B/U – вкла
Н = А + СU + B/U
уравнение Ван-Деемптера
диффузии
–
СU
НМИН
в
са
о
н
ере
п
о
асс
м
д
кл а
А – вклад неоднодности упаковки
Uоптим
Линейная скорость потока (U)
28.
ВЛИЯНИЕ ОБЪЕМА ПРОБЫ НАЭФФЕКТИВНОСТЬ КОЛОНКИ
увеличение объема пробы
перегрузка колонки
уменьшение эффективности
29.
Шаги оптимизациихроматографического процесса
начальная
емкость
изменение k’
эффективность
изменение N
селективность
изменение α
Варьируем состав
подвижной фазы (градиент)
Оптимизируем скорость
потока, увеличиваем
длину колонки,
уменьшаем размер частиц
Меняем тип растворителя,
тип или марку
неподвижной фазы
30.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗКоличественный анализ проводят после идентификации
компонента, при которой с достаточной степенью
уверенности соотносят пик на хроматограмме с конкретным
веществом.
Задача: определение содержания одного или нескольких компонентов в пробе
Мера количества вещества в хроматографии: площадь
соответствующего ему пика на хроматограмме.
Для отнесения площади пика компонента к его
концентрации в пробе необходимо выполнить калибровку –
установление количественной зависимости концентрации от
площади пика.
31.
Методы количественного анализа1. нормализация;
2. абсолютная калибровка по внешнему
стандарту;
3. метод добавок;
4. калибровка по внутреннему стандарту.
32.
Количество вещества во введенной пробе равноколичеству вещества в соответствующем ему
хроматографическом пике
S=w·h
s
нулевая (базовая) линия
Vr - объем элюента, вытекающий за время удерживания;
h - высота пика в единицах детектирования
w - ширина пика на половине его высоте;
S - площадь хроматограммы, заключенная между пиком и его
основанием (нулевой линией).
Нулевая (базовая) линия - соответствует нулевой концентрации анализируемых
веществ
33.
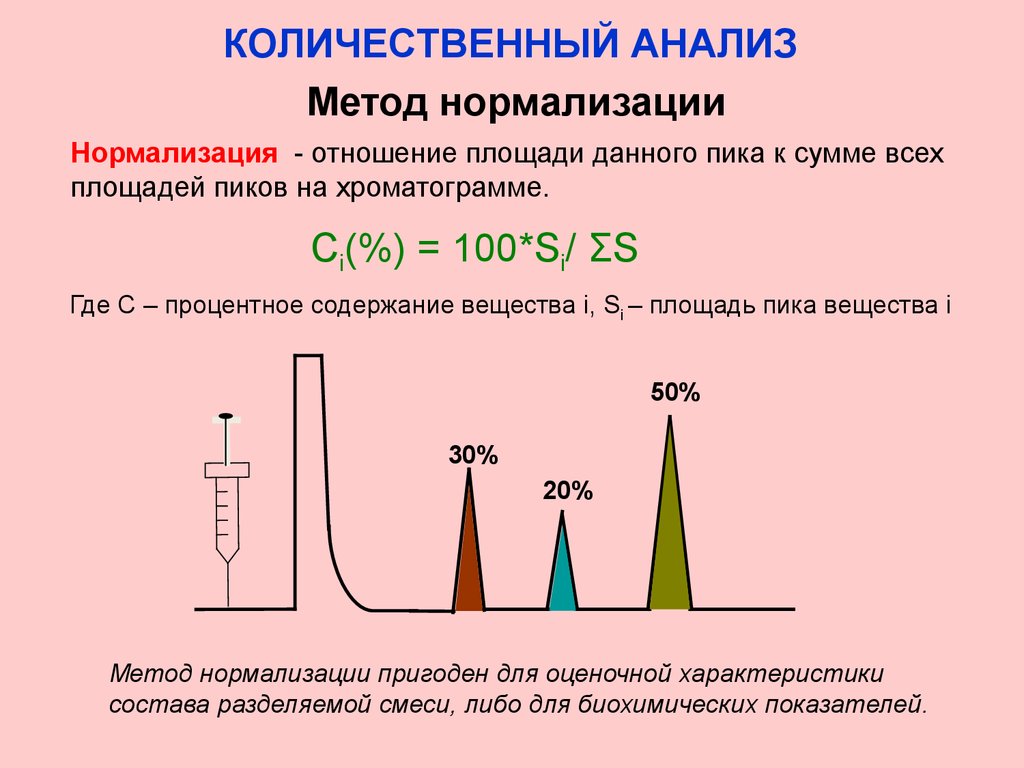
КОЛИЧЕСТВЕННЫЙ АНАЛИЗМетод нормализации
Нормализация - отношение площади данного пика к сумме всех
площадей пиков на хроматограмме.
Сi(%) = 100*Si/ ƩS
Где С – процентное содержание вещества i, Si – площадь пика вещества i
50%
30%
20%
Метод нормализации пригоден для оценочной характеристики
состава разделяемой смеси, либо для биохимических показателей.
34.
Метод нормализацииПример расчета процентного
содержания токоферолов,
разделяемых ВЭЖХ,
флуорометрический детектор
35.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗМетод абсолютной калибровки
Для реализации метода необходимо анализируемое вещество в чистом
виде - стандарт
Суть метода:
готовят ряд растворов с известными концентрациями стандарта,
перекрывающими
ожидаемый диапазон содержания анализируемого компонента в пробе;
растворы последовательно хроматографируют в одинаковых условиях и
получают ряд площадей пиков, соответствующих концентрационному ряду
калибровочных растворов;
На основании полученных данных строят калибровочный график, по
которому определяют концентрацию данного компонента в пробе, находя
соответствие площади пика количеству компонента.
Недостатки метода:
необходимость использования стандарта (может быть недоступен в чистом виде,
химически лабилен, летуч, токсичен)
36.
Метод абсолютной калибровки100
Хроматографирование
вещества-стандарта
10 мкг
5
t, мин
100
30 мкг
Q, мкг
5
t, мин
100
50 мкг
5
t, мин
Построение зависимости
площади пика от количества
введенного вещества
Аппроксимация: S = a·Q + b
37.
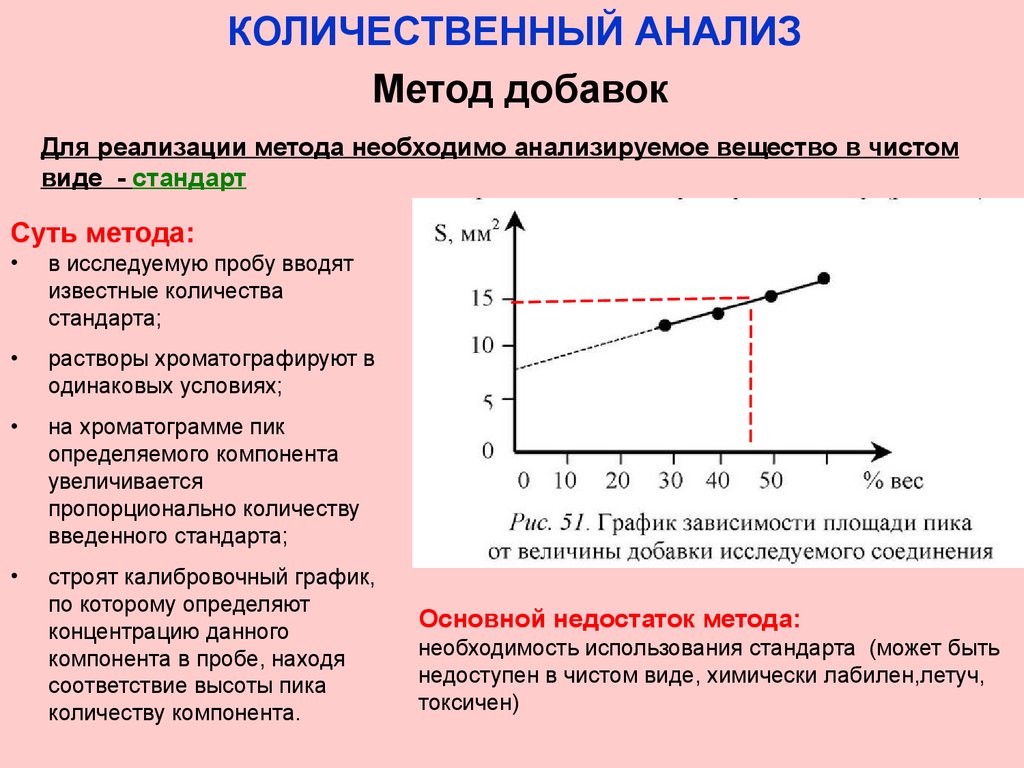
КОЛИЧЕСТВЕННЫЙ АНАЛИЗМетод добавок
Для реализации метода необходимо анализируемое вещество в чистом
виде - стандарт
Суть метода:
в исследуемую пробу вводят
известные количества
стандарта;
растворы хроматографируют в
одинаковых условиях;
на хроматограмме пик
определяемого компонента
увеличивается
пропорционально количеству
введенного стандарта;
строят калибровочный график,
по которому определяют
концентрацию данного
компонента в пробе, находя
соответствие высоты пика
количеству компонента.
Основной недостаток метода:
необходимость использования стандарта (может быть
недоступен в чистом виде, химически лабилен,летуч,
токсичен)
38.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗМетод внутреннего стандарта
Для реализации метода необходимо вещество в чистом виде, по
свойствам близкое к определяемому, – внутренний стандарт.
Суть метода:
внутренний стандарт добавляется в анализируемую пробу в известной
концентрации;
раствор хроматографируют (необходимо, чтобы при данных условиях
разделения внутренний стандарт выходил на хроматограмме в области,
свободной от других компонентов пробы);
вычисление концентрации определяемого компонента в пробе проводят по
соотношению:
Сi = (Si*Cst)/Sst
При использовании метода внутреннего стандарта линейность
детектирования необходимо проверять по отношению ко всем веществам.
39.
Хроматограмма экстракта ферментированной капустыВведение в пробу вещества –
внутреннего стандарта,
известной концентрации



































 Биология
Биология Физика
Физика Химия
Химия








