Похожие презентации:
Гетерогенные и лигандообменные равновесия и процессы
1. Лекция 2. Гетерогенные реакции в растворах электролитов
2.
Растворимость – свойство вещества растворяться в водеили другом растворителе.
Выражается константой растворимости (Ks), который
показывает, какая масса вещества может раствориться в
100 г растворителя при данной температуре. Мерой
растворимости (S) вещества при данных условиях
является его содержание в насыщенном растворе.
Вещества
Хорошо растворимые
в воде (Р)
Малорастворимые
в воде (М)
Практически
нерастворимые
в воде (Н)
Ks >10г/100г воды
Ks < 1г /100г воды
Ks< 0,01г /100г воды
3.
Константа растворимости (Кs)растворение
СаСО3
Са2+ + СО32-
осаждение
жидкая фаза
тв. фаза
При равновесии:
Vраств. = Vосажд.
4.
22
) а (СО3 )
а (Са
K х.р.
а (СаСО3 )
где
а = f а∙ С
Кх.р. а (CaСО3) = а (Са2+) а (СО32-)
соnst
const
при данных для твердого
условиях
вещества
Ks
5.
Ks - константа растворимостиKs = а (Са2+) ∙ а (СО32-)
Ks или ПР (произведение растворимости),
справочные величины
для разбавленных растворов
fa→1 и а → С
Ks = С(Са2+) ∙ С(СО32-)
Ks = [Са2+] ∙ [СО32-]
или
6.
Для электролитов состава МхАyKs = Cх(М+) ∙ Cy(А‾)
Например,
Ca3(PO4)2
3Ca2+ + 2PO43-
Ks = C3 (Ca2+) ∙ C2 (PO43-)
7.
Зная Ks можно рассчитать равновесную концентрациювещества в насыщенном растворе, т.е. растворимость (S)
общий вид для электролита типа
A m Bn
mA n+ + nB m‾
S m n
Пример: Ca3(PO4)2
Ks
m
n
m n
3Са 2+ + 2РО43-
K
K
s
S 3 2 3 2 5 s
108
3 2
8.
Условия образования ирастворения
осадков
9.
CaSO4растворение
Ca2+ + SO42‾
осаждение
1) В равновесии Vраств.=Vосажд
С (Ca2+) ∙ С (SO42-) = Ks
2) Увеличение [С] ионов => равновесие, т.е. выпадает
осадок.
С (Ca2+) ∙ С (SO 2-) > K
4
s
- условие образования осадка ↓
3) С (Ca2+) ∙ С (SO42-) < Ks
- условие растворения осадка
10.
Конкурирующиегетерогенные
равновесия
11.
I) Конкуренция за общий анионCaSO4 ↓
Твердая фаза
Ks1
Ca2++ SO42-
Смещение равновесия
Ks (CaSO4) = 2,5 ∙ 10-5
Ks (SrSO4) = 3,2 ∙ 10-7
Жидкая фаза
+
Sr2+ SrCl2
Ks2
SrSO4↓
Твердая фаза
CaSO4 + SrCl2 → CaCl2 + SrSO4↓
12.
II) Конкуренция за общий катионKs1
CaSO4 ↓
Твердая фаза
SO42- + Ca2+
Жидкая фаза
Смещение равновесия
Ks (CaSO4) = 2,5 ∙ 10-5
Ks (CaCO3) = 3,8 ∙ 10-9
+
CО32-
К2CO3
Ks2
CaCO3↓
Твердая фаза
CaSO4 + K2CO3 → CaCl2 + CaCO3↓
13.
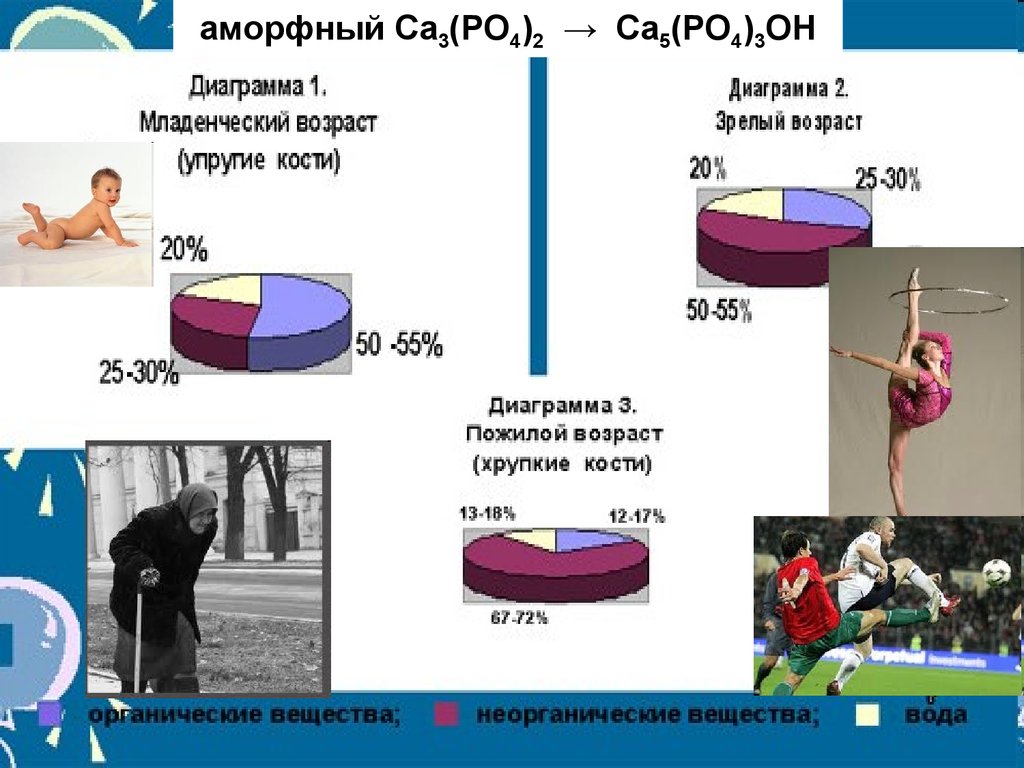
Гетерогенные процессы в живых организмахЖидкая фаза – кровь
Са2+, НРО42-, Н2РО4-, ОН- ,
НСО3-, лактаты, белки
Ks (Ca(Н2РO4)2 = 1,0 ∙ 10-3
Са2+ + НРО42- → СаНРО4
Ks (CaНРO4) = 2,7 ∙ 10-7
Далее происходит депротонирование
2Са2++ 3СаНРО4 + 4ОН-
рН крови (7,4)
Ca5(PO4)3ОН + 3H2O
гидроксиапатит
Кs = 1,6 ∙ 10-58
14.
аморфный Ca3(PO4)2 → Ca5(PO4)3OH15.
2Са2++ 3СаНРО4 + 4ОН- ↔ Ca5(PO4)3ОН + 3H2OЭмаль
Налет
(с кариесным
поражением)
Бактериальные
кислоты
Слюна
Са2+
Ca5(PO4)3ОН+7Н+→5Са2++3Н2РО4¯+H2O
Ca5(PO4)3F
Факторы, защищающие эмаль от растворения
16.
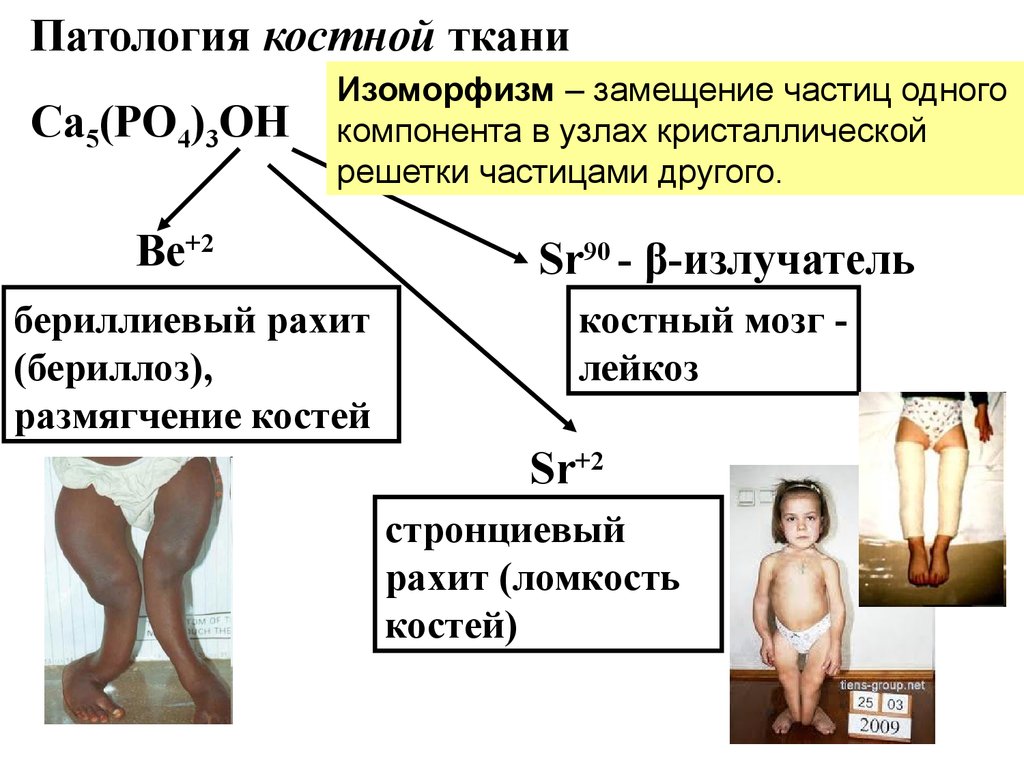
Патология костной тканиСа5(РО4)3ОН
Изоморфизм – замещение частиц одного
компонента в узлах кристаллической
решетки частицами другого.
Ве+2
бериллиевый рахит
(бериллоз),
размягчение костей
Sr90 - β-излучатель
костный мозг лейкоз
Sr+2
стронциевый
рахит (ломкость
костей)
17. Камнеобразование-болезнь обмена веществ
Кальциноз —отложений солейкальция в мягких тканях или
органах, в которых соли в
нерастворённом состоянии
содержаться не должны.
Известно также как
мочекислые (уратные),
оксалатные, фосфатные, обызвествление.
цистиновые камни
ПАДАГРА. Соли мочевой кислоты (ураты)
откладываются в суставах.
18.
Лигандообменныеравновесия и процессы
19.
Координационная теория,предложенная в 1893 году А. Вернером и
дополненная Л.А.Чугаевым.
Альфред
Вернер
(1866-1919)
Лев Александрович
Чугаев
(1873-1922)
20.
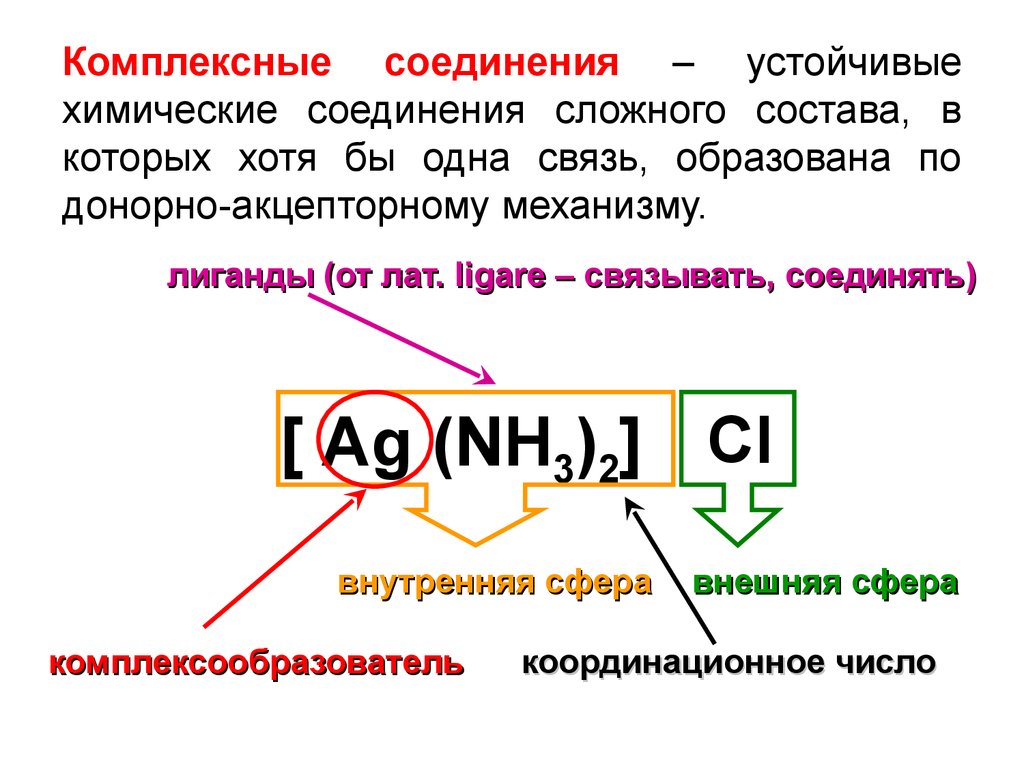
Комплексные соединения – устойчивыехимические соединения сложного состава, в
которых хотя бы одна связь, образована по
донорно-акцепторному механизму.
лиганды (от лат. ligare – связывать, соединять)
[ Ag (NH3)2] Cl
внутренняя сфера
комплексообразователь
внешняя сфера
координационное число
21.
22.
Комплексообразователь (центральный атом (М)) –атом или ион, который является акцептором
электронных пар, предоставляя свободные атомные
орбитали, и занимает центральное положение в КС.
Являются d- и f – металлы.
2
2
6
2
6
10
2
6
10
1
Ag
1S
2S
2p
3S
3p
3d
4S
4p
4d
5S
47
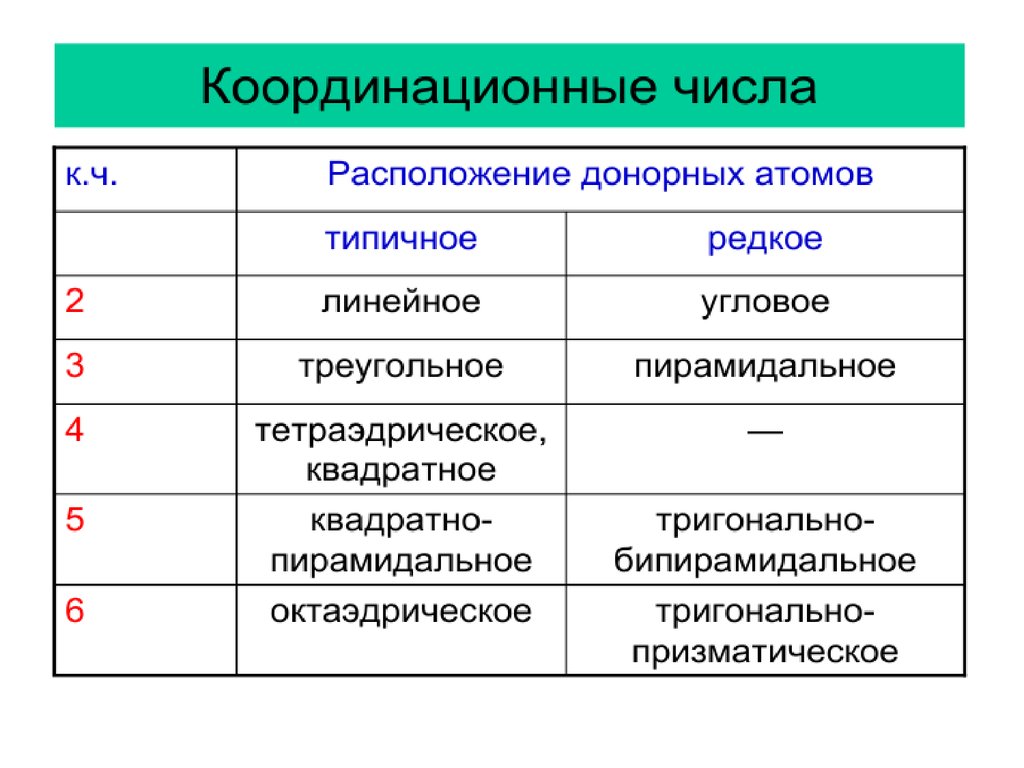
Число свободных орбиталей М, определяет его
координационное число. Обычно оно равно удвоенному
заряду иона комплексообразователя и определяет
структуру внутренней сферы КС.
23.
24.
Лиганды (L) – молекулы или ионы, которыеявляются донорами электронных пар и связаны
непосредственно с комплексообразователем.
донорно-акцепторная связь
По числу связей, образуемых лигандом с
комплексообразователем, лиганды делятся на
моно-, би- и полидентатные.
25.
Если в состав лиганда входит атом имеющийодну неподеленную пару электронов –
монодентатный L:
•
Cl ,
-
•
OH ,
-
•
CN ,
-
•
H2O,
•
R-OH,
•
NH3
две пары – бидентатный L:
NH2
CH2 CH2
NH2
и более – полидентатные L:
-
OOC
- OOC
CH2
CH2
N
CH2 CH2
N
-
CH2
COO
CH2
COO
26.
Би- и полидентатные лиганды часто образуютхелаты (от греч. «клешня») – комплексы, в
которых лиганд и центральный атом образуют
цикл.
Увеличение прочности комплексов с
полидентатными лигандами по сравнению с
монодентатными, называется хелатным
эффектом.
27.
Эффективность донорно-акцепторного взаимодействия L иM (прочность связи) определяется их поляризуемостью.
Чем меньше радиус и число электронов у частицы, тем
менее поляризуема («жесткие»), наоборот – «мягкие».
28.
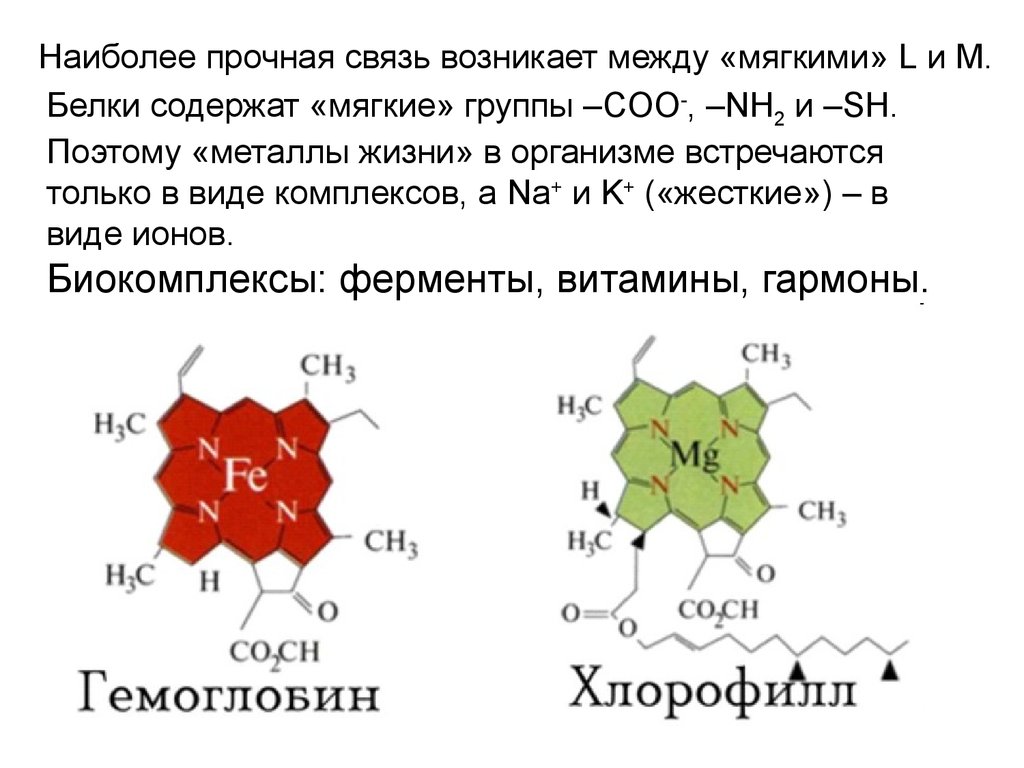
Наиболее прочная связь возникает между «мягкими» L и M.Белки содержат «мягкие» группы –COO-, –NH2 и –SH.
Поэтому «металлы жизни» в организме встречаются
только в виде комплексов, а Na+ и K+ («жесткие») – в
виде ионов.
Биокомплексы: ферменты, витамины, гармоны.
29.
Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны,т.к. образуют прочные комплексы с белком
(особенно содержащие группу – SH), нарушая
обмен веществ, вызывая появление опухолей,
мутагенез.
Тиоловые яды
30.
Детоксикацию организма от металлов токсикантовпроводят при помощи лиганд-препаратов на основе
полидентатных L – хелатотератия.
Принципы хелатотерапии:
1) детоксикант (антидот) должен эффективно связывать
ионы-токсиканты; образующееся соединение должно быть
прочнее, чем те, которые существовали в организме;
2) антидот не должен разрушать жизненно необходимые
КС; соединение детоксиканта с биометаллами должно
быть менее прочным, чем существующее в организме.
31. Диссоциация комплексных соединений
Первичная диссоциация комплексных соединений это распад КС в растворе на ионы внешней и внутреннейсфер подобно cильным электролитам, так как эти ионы
связаны ионными (электростатическими) силами.
Вторичная диссоциация комплексного соединения –
это распад внутренней сферы на составляющие ее
компоненты. Этот процесс протекает по типу слабых
электролитов, так как частицы внутренней сферы
связаны ковалентной связью.
32. Устойчивость комплексных соединений
Для качественной характеристики устойчивости КСиспользуют:
1) константу нестойкости комплекса (Кнест).
Чем меньше значение Кн, тем более устойчивым является КС.
константу устойчивости (Kуст) - величина, обратная
Кн.
2)
.
Чем больше значение Куст, тем более устойчивый комплекс.
33.
Эффективными препаратами для хелатотерапииявляются:
этилендиаминтетрауксусная
кислота
сукцимер
БАЛ
H2 C - S - H
H2 C - S
Hg
H C - S - H + HgCl2 H C - S
H2 C - SO3Na
H2 C - SO3Na
+ 2HCl
34. тетацин (кальцийдинатриевая соль ЭДТА)
-OOCH2C
CH2COO-
N – CH2 - CH2 – N
-
OOCH2C
CH2COOСa2+
Hg2+
Hg2+ + ЭДТА · Ca2+ Ca2+ + ЭДТА · Hg2+
35.
отравление ртутьюотравление мышьяком
36.
37.
38. Геометрическая изомерия
• Плоскоквадратныекомплексы при наличии
двух разных лигандов L
и L дают 2 изомера
(цис- и транс-).
цис- и транс-изомеры
дихлородиамминплатины(II)
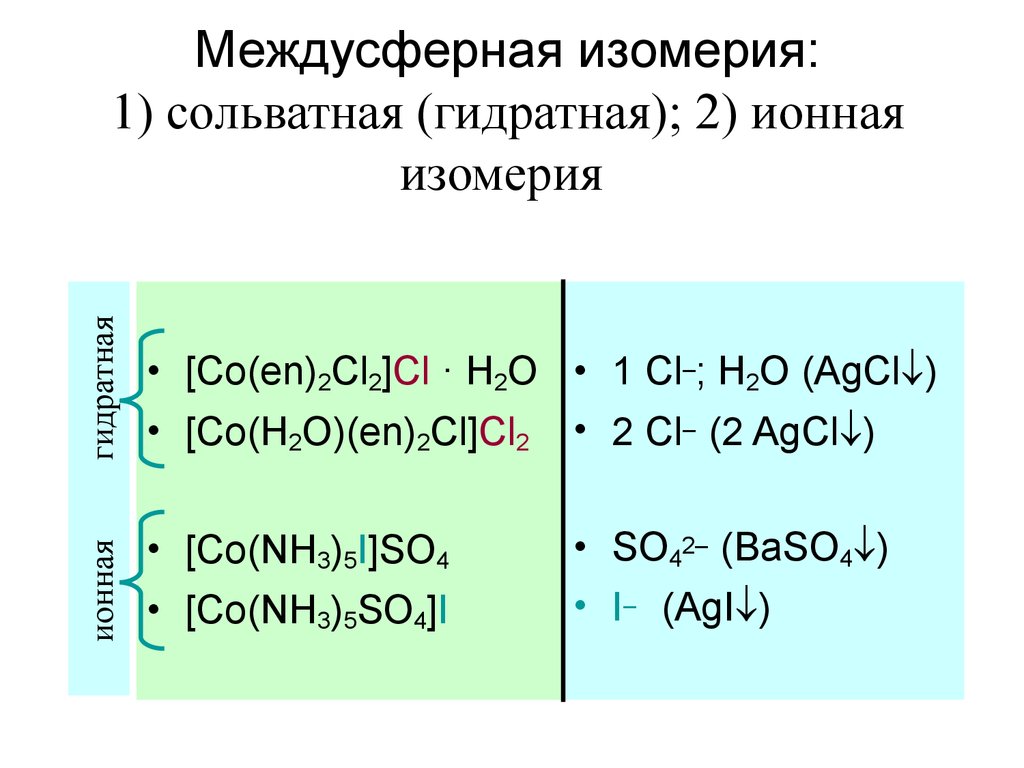
39. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия
гидратная• [Co(en)2Cl2]Cl · H2O • 1 Cl–; H2O (AgCl )
• [Co(H2O)(en)2Cl]Cl2 • 2 Cl– (2 AgCl )
ионная
Междусферная изомерия:
1) сольватная (гидратная); 2) ионная
изомерия
• [Co(NH3)5I]SO4
• [Co(NH3)5SO4]I
• SO42– (BaSO4 )
• I– (AgI )
40. Междусферная изомерия
• Ионные (ионизационные) изомеры• [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
• [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4
pH 7
pH 7
• Координационные изомеры
• [Cr(NH3)4(NCS)2][Cr(NH3)2(NCS)4]
• [Cr(NH3)6][Cr(NCS)6]


































 Химия
Химия