Похожие презентации:
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
1. Лекция «Произведение растворимости (Константа растворимости)» «Строение комплексных (координационных) соединений. Устойчивость
Кафедра общей и медицинской химииЛекция
«Произведение растворимости
(Константа растворимости)»
«Строение комплексных
(координационных)
соединений. Устойчивость в
растворах»
1
2.
Произведение растворимости(ПР или Ks)
2
3.
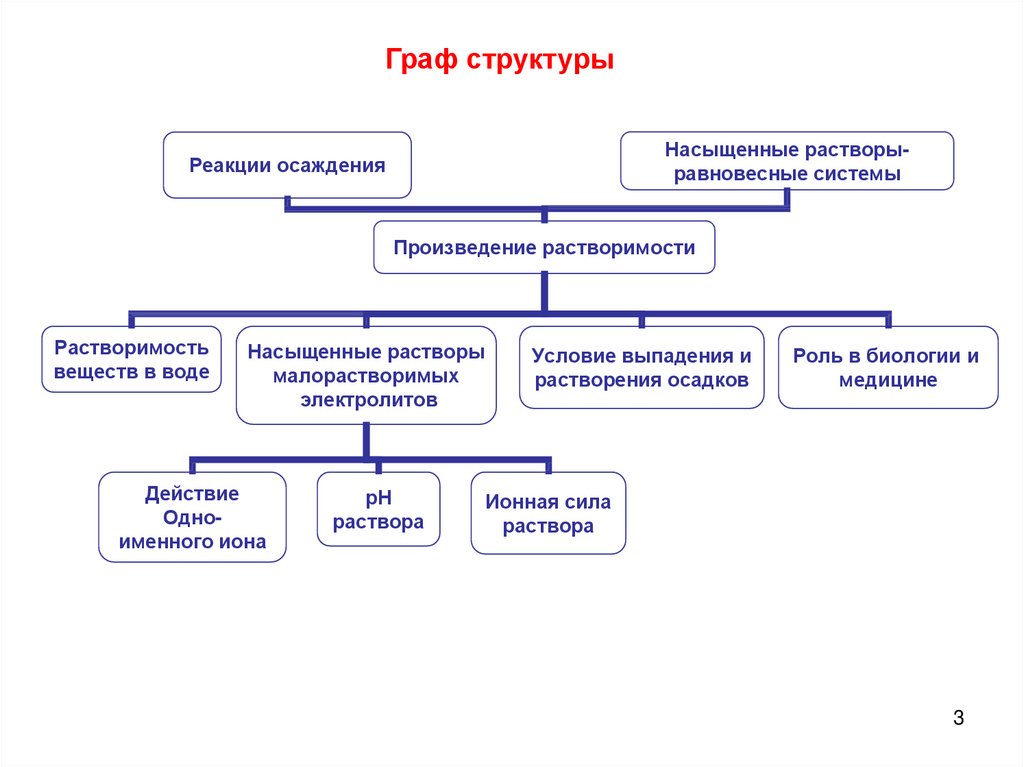
Граф структурыНасыщенные растворыравновесные системы
Реакции осаждения
Произведение растворимости
Растворимость
веществ в воде
Насыщенные растворы
малорастворимых
электролитов
Действие
Одноименного иона
рН
раствора
Условие выпадения и
растворения осадков
Роль в биологии и
медицине
Ионная сила
раствора
3
4.
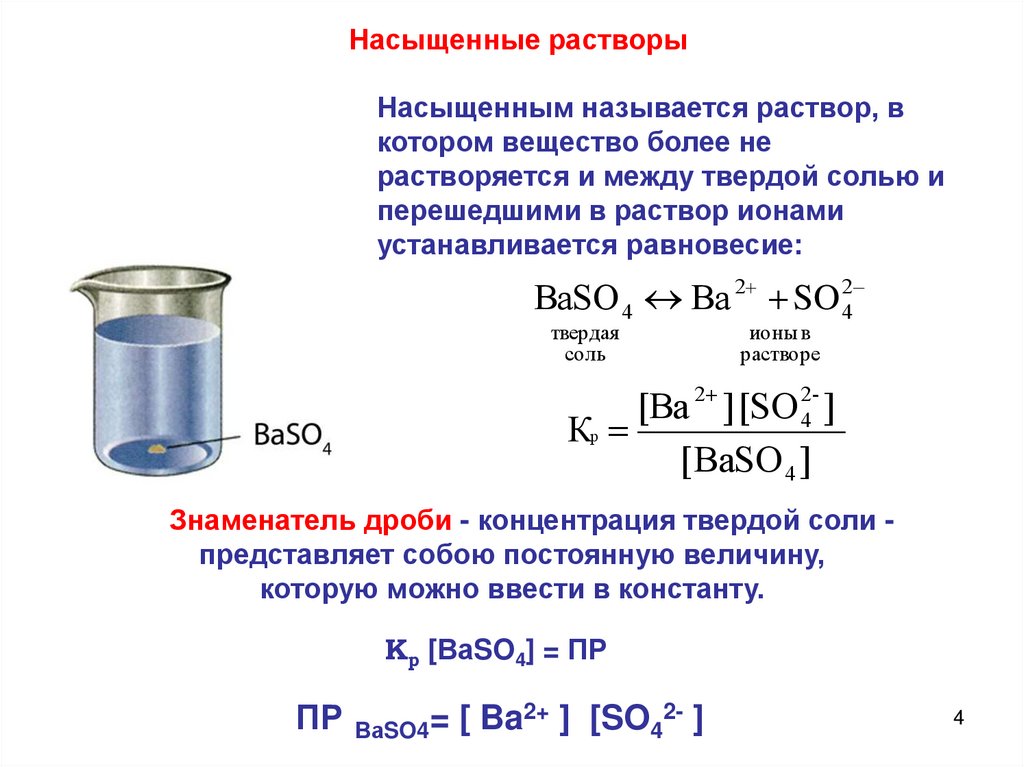
Насыщенные растворыНасыщенным называется раствор, в
котором вещество более не
растворяется и между твердой солью и
перешедшими в раствор ионами
устанавливается равновесие:
ВaSO 4 Вa 2 SO 24
твердая
соль
ионы в
растворе
[Вa 2 ] [SO 24- ]
Кр
[ВaSO 4 ]
Знаменатель дроби - концентрация твердой соли представляет собою постоянную величину,
которую можно ввести в константу.
Кр [ВаSO4] = ПР
ПР
ВаSO4=
[ Ba2+ ] [SO42- ]
4
5.
Произведение растворимости –произведение концентраций ионов трудно растворимого
соединения в насыщенном растворе при данной температуре
Если трудно растворимое вещество содержит два или
несколько одинаковых ионов, концентрации этих ионов
должны быть возведены в соответствующие степени:
PbI2 ↔ Pb2+ + 2I-
ПР PbI2 [Pb2 ]·[I ]2
5
6.
Чем меньше ПР, тем хуже растворимо вещество!6
7.
Использование произведения растворимости (ПР или Ks)1. Для сравнения растворимости веществ (s)
Чем меньше ПР, тем хуже растворимо вещество!
2. Для прогнозирования выпадения осадка:
ПИ < ПР - осадка не будет
ПИ > ПР – осадок выпадает
(ПИ – произведение концентраций ионов,
иногда обозначают - Ks)
Выпадет ли осадок при смешении 0.01н растворов Na2SO4 и CaCl2?
Na 2SO4 CaCl2 CaSO4 2 NaCl
0.01
Na 2SO4 2 Na
5·10 3
0.01
2
SO4
5·10 3
ПИ = [Ca2+]·[SO42-] = 2,5∙10-5
CaCl2 Ca 2 3 2Cl
5·10 3
5·10
ПР (CaSO4) = 1,3∙10–4
7
8.
3. Для установления последовательности выпадения осадка( чем меньше ПР, тем раньше выпадает осадок!!!)
ПР (AgCl) = 1,8∙10-10
ПР (AgBr) = 6 ∙10-13
ПР (AgI) = 1,6∙10 -16
4. Для подбора более эффективного осадителя:
( чем меньше ПР образующегося осадка,
тем эффективней осадитель!!!)
К раствору Na2S для более эффективного удаления ионов
S2– нужно добавить Hg(NO3)2 или Pb(NO3)2?
ПР (HgS) =1,6∙10-52
ПР (PbS) =2,5∙10-27
8
9.
5. Для расчета растворимости солей.Рассчитать растворимость хлорида серебра, если ПР (AgCl) =1,8∙10-10
S
S
S
AgCl ↔ Ag+ + Cl-
ПР (AgCl) = [Ag+]·[Cl-] = S·S = S2 = 1,8∙10-10
S (AgCl) = 1,34∙10-5
( моль/л )
9
10.
Рассчитать растворимость фосфата кальция, еслиПР Ca 3 ( PO4 )2 2,0·10 29
S
3S
2S
Ca 3 (PO 4 ) 2 3Ca 2 2PO34
насыщенный
раствор
твердое
ПР [Ca 2 ]3 ·[PO34 ]2 (3S)3 ·(2S) 2 108·S5
29
ПР
2
,
0
·
10
S 5
5
5 1,85·10 31
108
108
S 7·10 7 моль/л
A x By
S
x y
[A] ·[B]
x
y
10
11.
NB! При добавлении к насыщенному раствору малорастворимогоэлектролита раствора сильного электролита, не имеющего с ним
общих ионов, повышается ионная сила раствора, понижается
коэффициент активности f, следовательно, произведение
активностей ионов становится меньше ПР, т.е. раствор становится
ненасыщенным, происходит растворение осадка. Это явление
называется солевым эффектом.
11
12.
Значение ПР в медицине1. Образование костной ткани:
остеобласты ( рН 8, 3)
минерализация
деминерализация
остеокласты
5Ca 2 3HPO 24 4OH Ca 5 (PO 4 )3 OH 3H 2 O
ПР Ca 5 ( PO4 )3 OH 1,6·10 58
В поверхностных слоях кости образуется некоторое
количество аморфного фосфата кальция Ca3(PO4)2 - более
растворимой
соли
(ПР=2,0·10-29),
которая
постепенно
превращается в гидроксиапатит.
Аморфный фосфат кальция является лабильным резервом
ионов кальция и фосфатов в организме. С возрастом
содержание аморфного фосфата кальция в костной ткани
12
уменьшается.
13.
При небольшом повышении содержания Н+ кость начинаетрастворяться, отдавая вначале катионы кальция:
Ca 5 (PO 4 )3 OH 2H Ca 4 H(PO 4 )3 Ca
2
H 2O
При большей кислотности среды происходит ее полный распад:
2
Ca5 (PO4 )3 OH 7H 3H2PO4 5Ca H2O
13
14.
2. Защита от кариеса:В полости рта в результате жизнедеятельности микробов
образуются достаточно сильные кислоты: пировиноградная,
молочная, янтарная, которые разрушают зубы не только
вследствие повышения кислотности среды, но и в результате
связывания катионов кальция в устойчивые комплексные
соединения.
Физико-химическим фактором, защищающим зубы от
разрушения, является повышенная концентрация ионов
кальция в слюне.
14
15.
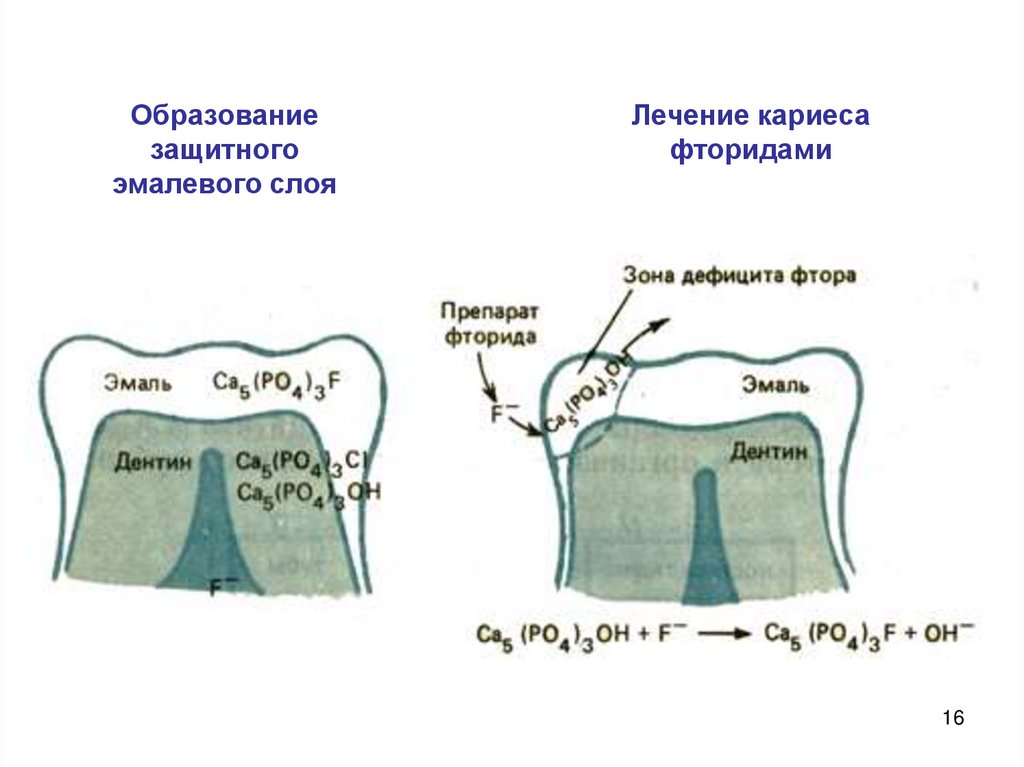
Замена гидроксид-аниона на фторид-анион значительноповышает твердость и устойчивость зубной эмали к
растворению.
ПР Ca 5 ( PO4 )3 F 2·10
72
15
16.
Образованиезащитного
эмалевого слоя
Лечение кариеса
фторидами
16
17.
3. Рахиты различной этиологии:Бериллиевый рахит (бериллиоз) - вытеснение
ионов Са2+ ионами Ве2+ из костей и их размягчение
вследствие меньшего радиуса иона Ве2+.
Стронциевый рахит - замещение ионов Са2
ионами стронция в костях. Вследствие большего
радиуса иона Sr2+ происходит ломкость костей
Заболевание
характерно
для
регионов
с
повышенным содержанием стронция в почве.
Особую
опасность
представляет
радиоактивный изотоп стронций-90, который,
оседая в костях, облучает костный мозг и
нарушает костномозговое кроветворение.
17
18.
4. Детоксикация при отравлениях:Отравление тяжелыми металлами (Pb, Hg, Cd) приводит к
блокаде
–SH-групп
белковых
фрагментов.
Вводятся
растворимые сульфиды (Na2S, K2S) для образования
труднорастворимых осадков PbS, HgS, CdS с последующим
выведением из организма.
18
19. «Строение комплексных (координационных) соединений. Устойчивость в растворах»
1920.
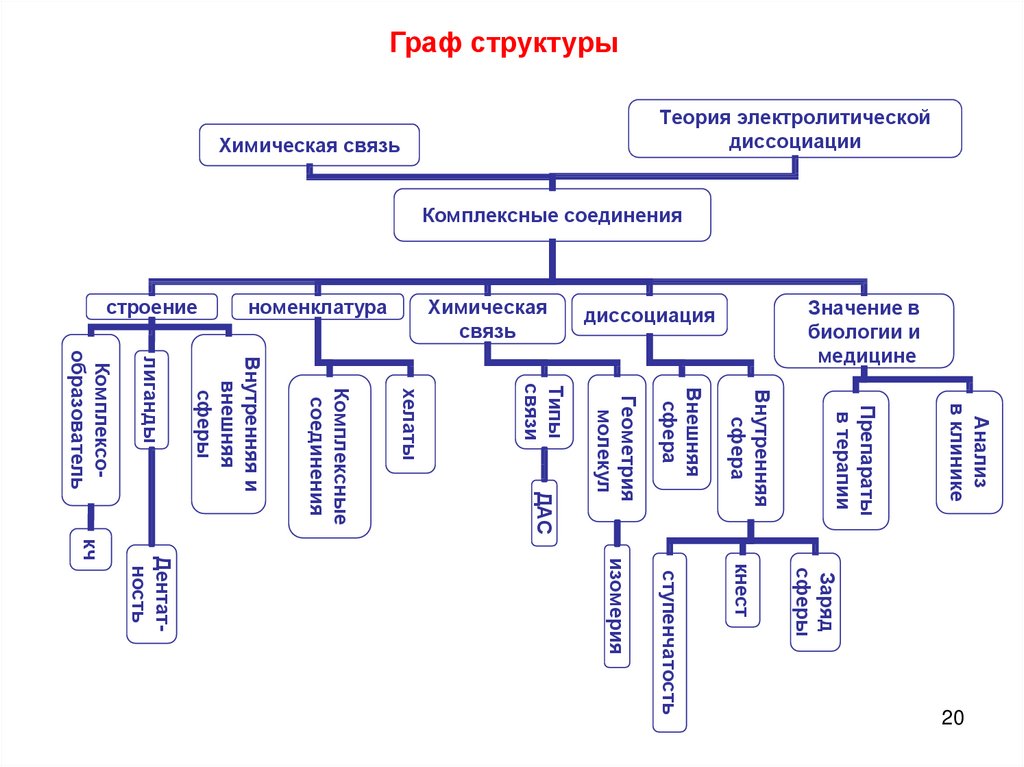
Граф структурыХимическая связь
Анализ
в клинике
Препараты
в терапии
кнест
Заряд
сферы
Внутренняя
сфера
кч
Дентатность
изомерия
ступенчатость
20
Внешняя
сфера
ДАС
Геометрия
молекул
Типы
связи
хелаты
Комплексные
соединения
Комплексообразователь
лиганды
Внутренняя и
внешняя
сферы
Значение в
биологии и
медицине
диссоциация
Химическая
связь
номенклатура
строение
Теория электролитической
диссоциации
Комплексные соединения
21.
Комплексные соединения- устойчивые химические соединения сложного состава, в
которых имеется хотя бы одна связь, образованная по
донорно-акцепторному механизму.
Нобелевская премия (1913 г.) «в знак
признания его работ о природе
связей атомов, которые позволили
по-новому взглянуть на результаты
ранее проведенных исследований и
открыли новые возможности в
области неорганической химии».
Альфред Вернер
(12.12.1866-15.11.1919)
21
22.
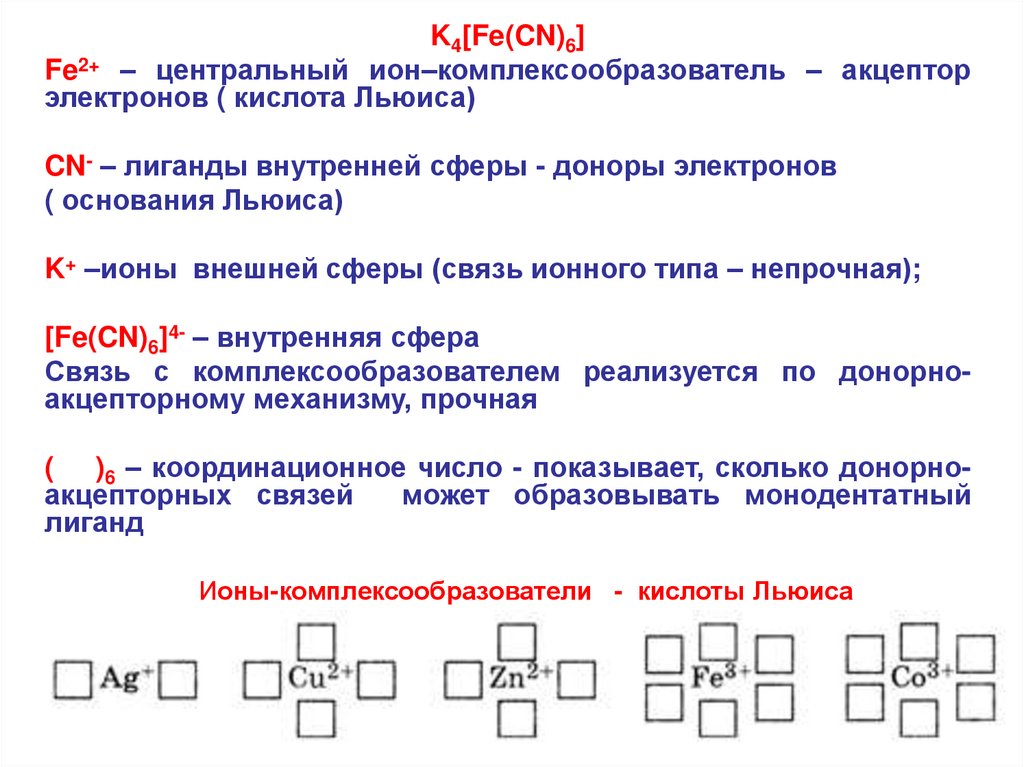
K4[Fe(CN)6]Fe2+ – центральный ион–комплексообразователь – акцептор
электронов ( кислота Льюиса)
CN- – лиганды внутренней сферы - доноры электронов
( основания Льюиса)
K+ –ионы внешней сферы (связь ионного типа – непрочная);
[Fe(CN)6]4- – внутренняя сфера
Связь с комплексообразователем реализуется по донорноакцепторному механизму, прочная
( )6 – координационное число - показывает, сколько донорноакцепторных связей
может образовывать монодентатный
лиганд
Ионы-комплексообразователи - кислоты Льюиса
22
23.
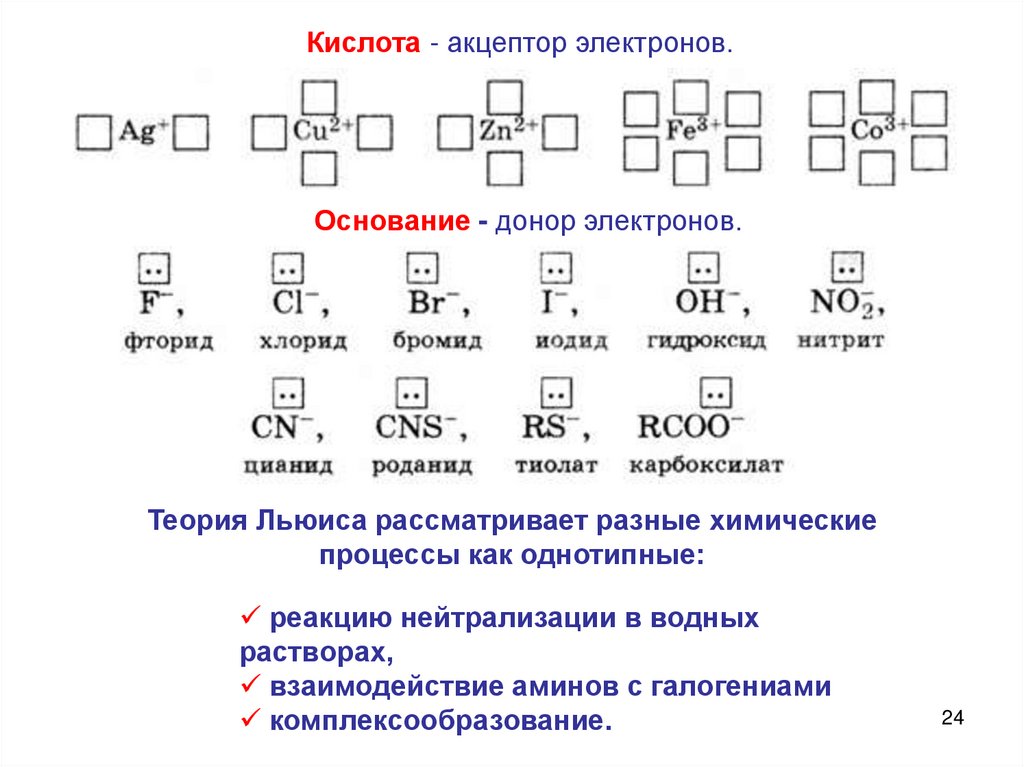
3. По ЛьюисуКислота - вещество, принимающее
электронные
пары
–
акцептор
электронов;
Основание
вещество,
поставляющее
электроны
для
образования химической связи – донор
электронов.
ЛЬЮИС Гилберт Ньютон
(23.10 1875–23.03 1946)
Во время первой мировой
войны – полковник Военнохимической службы США
(разрабатывал
способы
защиты
от
отравляющих
газов).
23
24.
Кислота - акцептор электронов.Основание - донор электронов.
Теория Льюиса рассматривает разные химические
процессы как однотипные:
реакцию нейтрализации в водных
растворах,
взаимодействие аминов с галогениами
комплексообразование.
24
25.
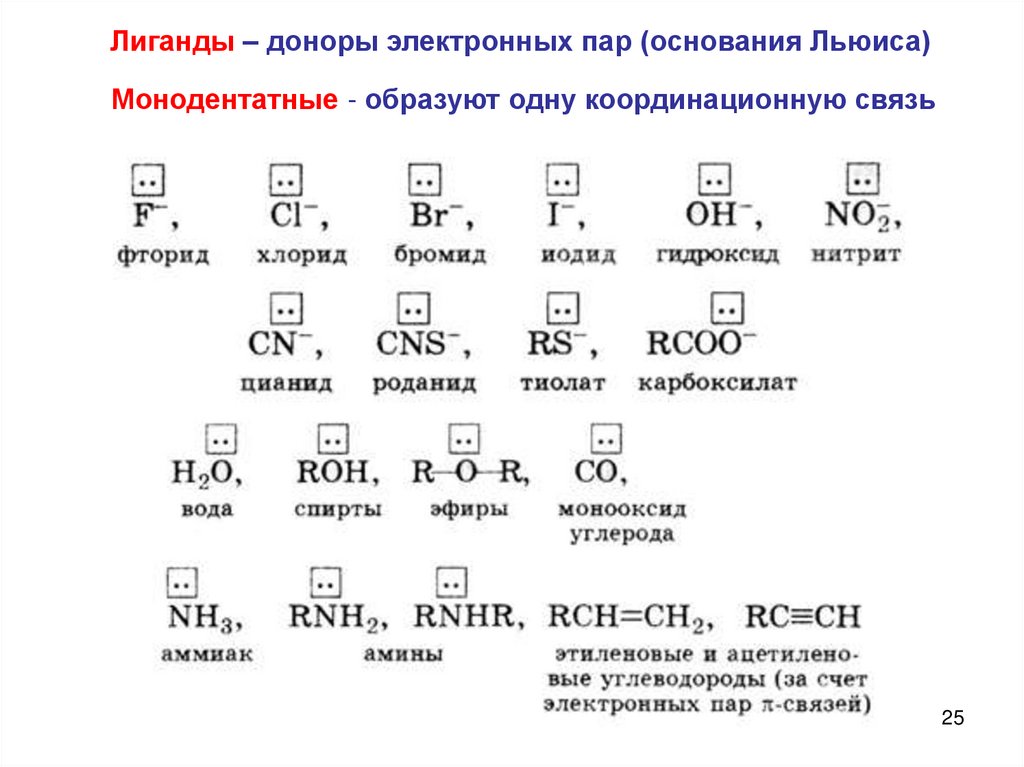
Лиганды – доноры электронных пар (основания Льюиса)Монодентатные - образуют одну координационную связь
25
26.
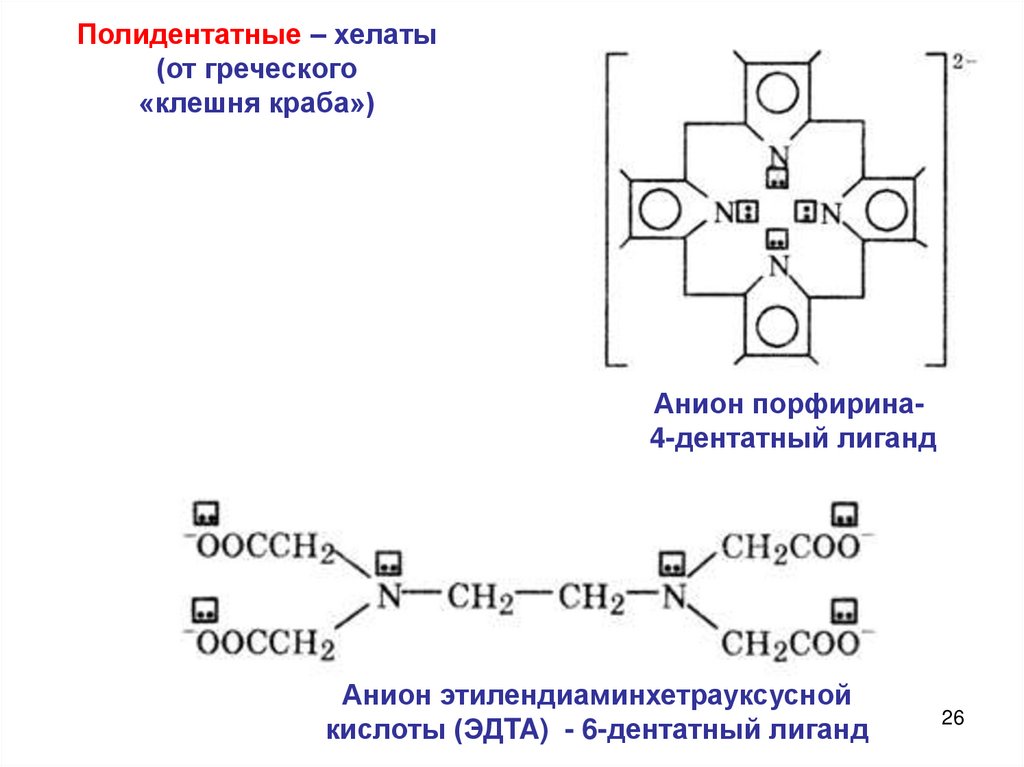
Полидентатные – хелаты(от греческого
«клешня краба»)
Анион порфирина4-дентатный лиганд
Анион этилендиаминхетрауксусной
кислоты (ЭДTA) - 6-дентатный лиганд
26
27.
Большинство комплексных соединений,как и сами ионы металлов, имеют окраску
27
28.
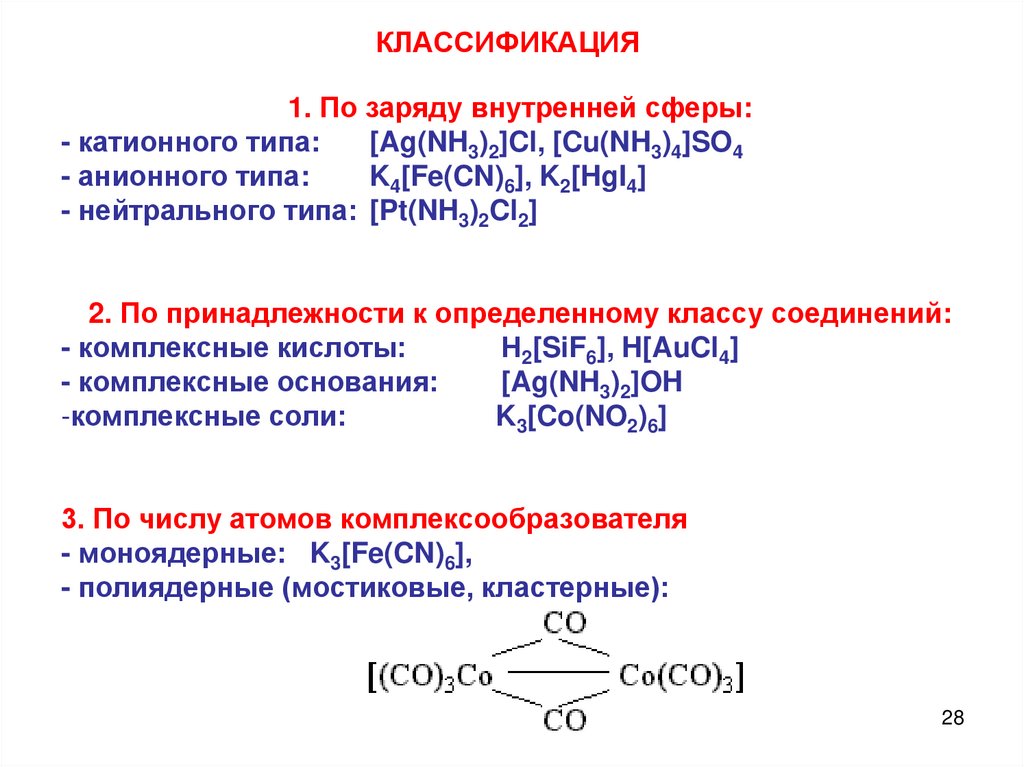
КЛАССИФИКАЦИЯ1. По заряду внутренней сферы:
- катионного типа:
[Ag(NH3)2]Cl, [Cu(NH3)4]SO4
- анионного типа:
K4[Fe(CN)6], K2[HgI4]
- нейтрального типа: [Pt(NH3)2Cl2]
2. По принадлежности к определенному классу соединений:
- комплексные кислоты:
Н2[SiF6], H[AuCl4]
- комплексные основания:
[Ag(NH3)2]OH
-комплексные соли:
K3[Co(NO2)6]
3. По числу атомов комплексообразователя
- моноядерные: K3[Fe(CN)6],
- полиядерные (мостиковые, кластерные):
28
29.
4. По природе лигандов внутренней сферы:-ацидокомплексы (анионы кислотных остатков):
K3[Fe(CN)6], K2[HgI4]
-аквакомплексы:
[Al(H2O)6]Cl3
-аммиакаты: (разлагаются при нагревании):
[Ag(NH3)2]OH,
[Pt(NH3)2Cl2]
-гидроксокомплексы:
K3[Cr(OH)6]
- гидридные (получают только в неводных средах):
Li[AlH4], Na[BH4]
- оксалатные (С2O42-), карбонатные (СO32-), цианидные (CN-),
галогенидные (F-, Cl-, Br-, I-), роданидные (CNS-),- карбонилы
(CO)
29
30.
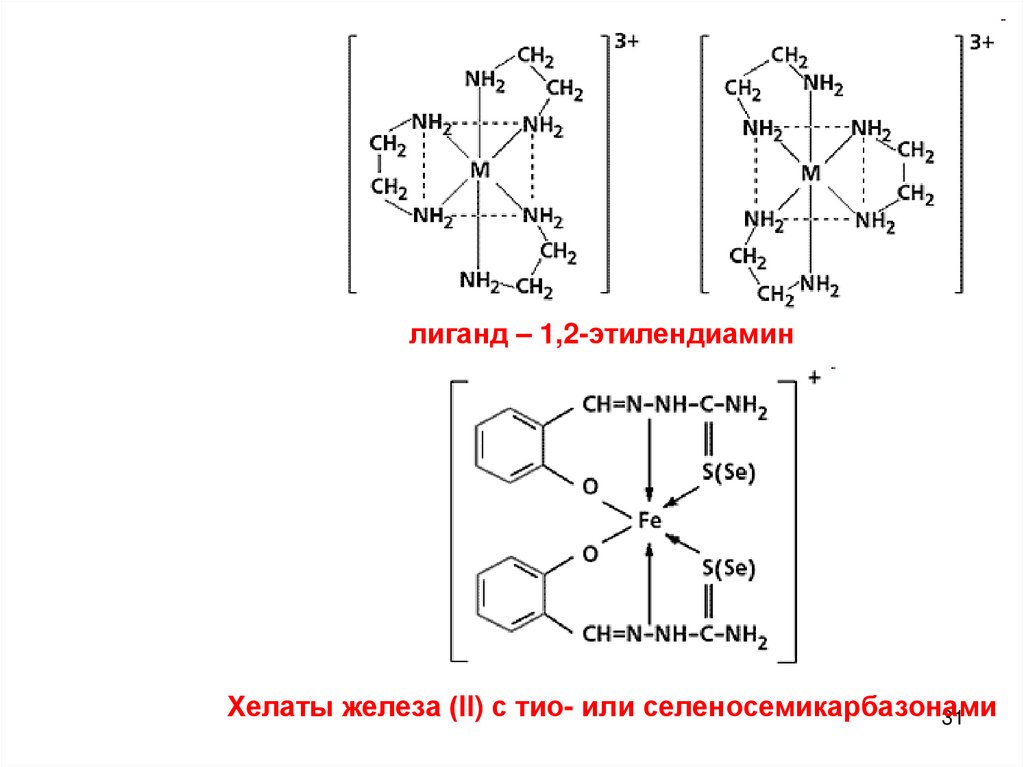
5. Хелатные соединения - в их состав входят полидентатныелиганды:
30
31.
лиганд – 1,2-этилендиаминХелаты железа (ll) с тио- или селеносемикарбазонами
31
32.
Изомерия комплексных соединений1. Ионизационная изомерия - различное распределение
ионов между внутренней и внешней сферами комплекса:
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
2. Координационная изомерия - различное распределение
комплексообразователей или лигандов между комплексными
катионами и анионами:
[Co(NH3)6][Cr(CN)6]
[Cr(NH3)6][Co(CN)6]
32
33.
3. Гидратная изомерия определяется характером связеймолекул воды, входящих в состав комплекса
[Сr(Н2О)6]Сl3
сине-серая
[Сr(Н2О)4Сl2]Сl·2Н2О
темно-зеленая
33
34.
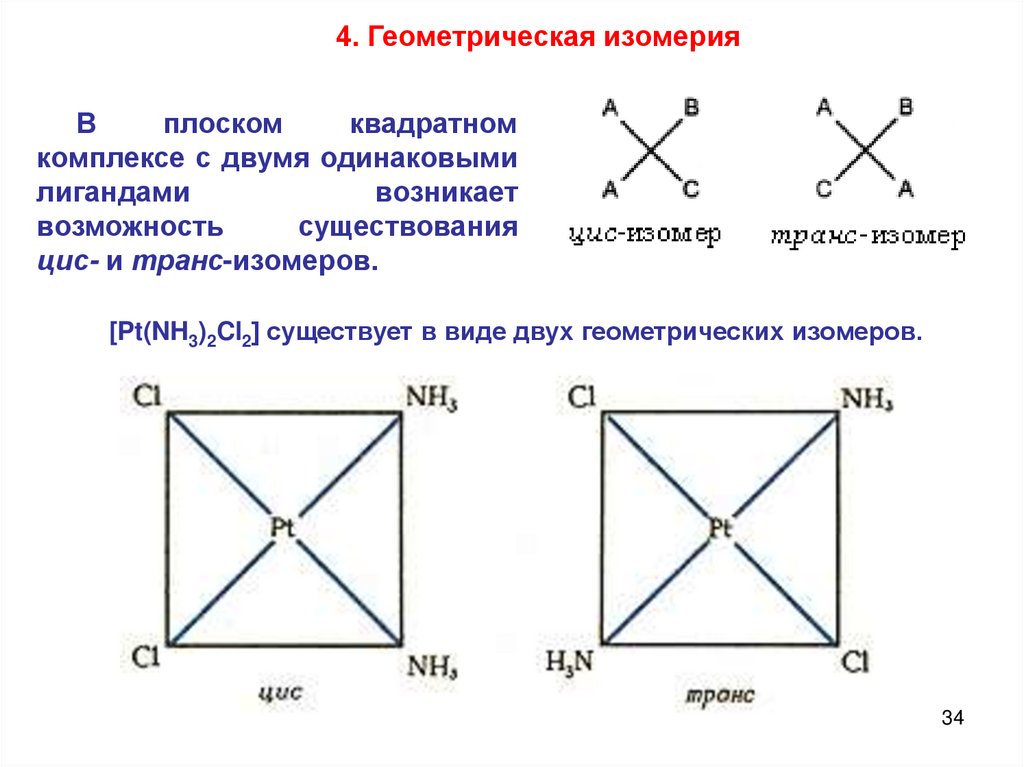
4. Геометрическая изомерияВ
плоском
квадратном
комплексе с двумя одинаковыми
лигандами
возникает
возможность
существования
цис- и транс-изомеров.
[Pt(NH3)2Cl2] существует в виде двух геометрических изомеров.
34
35.
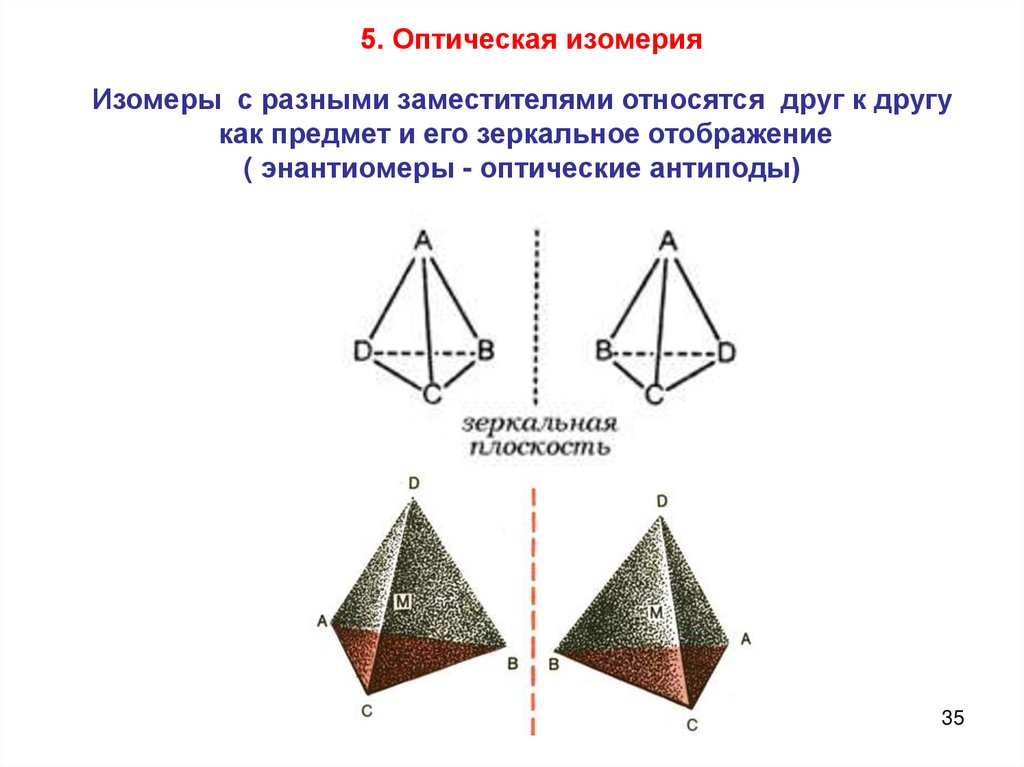
5. Оптическая изомерияИзомеры с разными заместителями относятся друг к другу
как предмет и его зеркальное отображение
( энантиомеры - оптические антиподы)
35
36.
3637.
Характерная их особенность - способность вращатьплоскость поляризации плоскополяризованного луча.
37
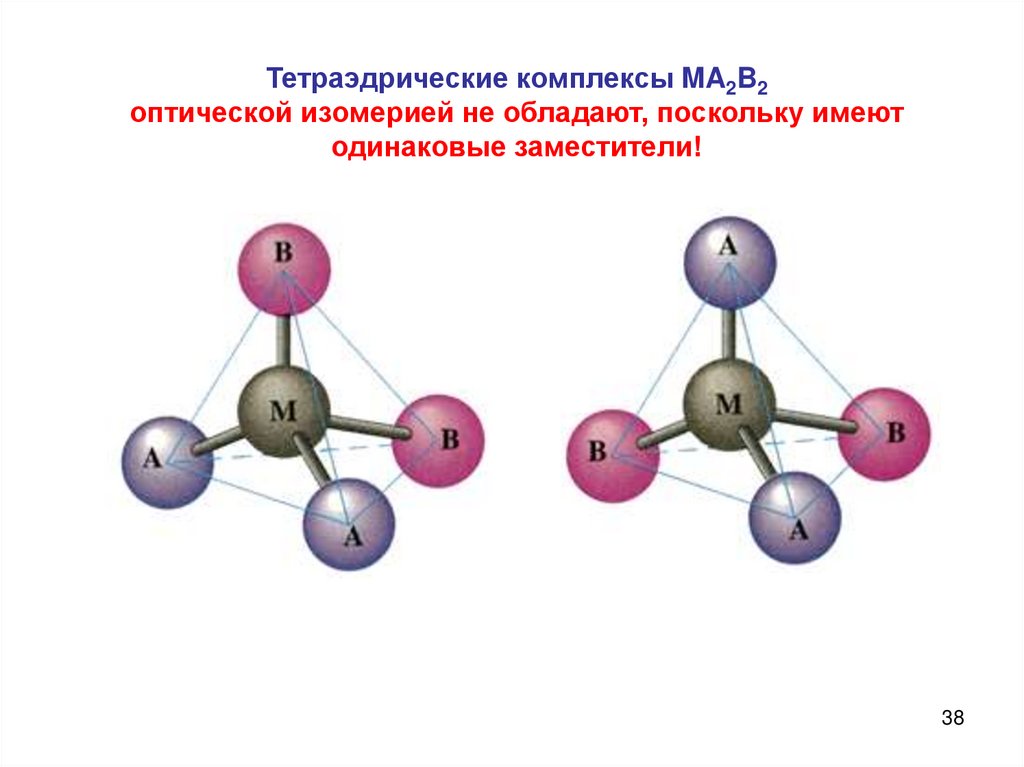
38. Тетраэдрические комплексы MA2B2 оптической изомерией не обладают, поскольку имеют одинаковые заместители!
3839.
Номенклатура[Ag(NH3)2]Cl – хлорид диамминсеребра
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Pt(NH3)2Cl2] – дихлориддиамминплатина (II)
[Pt(NH3)6]Cl4
хлорид гексамминплатины (IV)
[Fe(CO)5]
пентакарбонилжелезо (0)
K4[Fe(CN)6]
гексацианоферрат (II) калия
K3[Fe(CN)6]
гексацианоферрат (III) калия
39
40.
Получение комплексных соединений:CuSO 4 4NH3 [Cu( NH3 ) 4 ]SO4
40
41.
Строение комплексных соединений:1. [Ag(NH3)2]Cl
Ag+ KLM 4s2 4p6 4d10 5s0 5p0
41
42.
1. [Ag(NH3)2]Cl(к.ч = 2)
sp–гибридизация
(прямая линия)
[Ag(NH3)2]+
5s
5p
Ag+ KLM 4s2 4p6 4d10 5s0 5p0
sp-гибридизация
42
43.
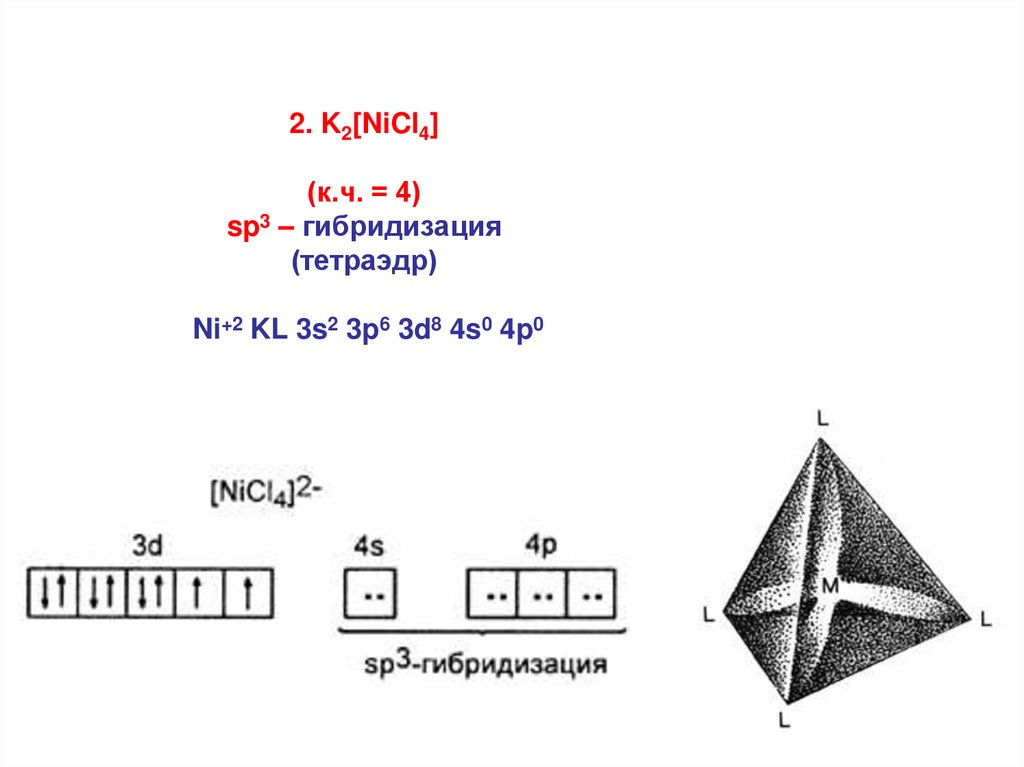
2. K2[NiCl4](к.ч. = 4)
sp3 – гибридизация
(тетраэдр)
Ni+2 KL 3s2 3p6 3d8 4s0 4p0
43
44.
Кристаллическое поле (жесткость) лигандовCO, CN- > этилендиамин > NH3 > SCN- > H2O > OH- > F- > Cl- > Br- > Iсильное поле
среднее поле
слабое поле
При взаимодействии с жесткими лигандами происходит
спаривание d-электронов.
Образуется диамагнитный комплекс
с плоским квадратным строением.
44
45.
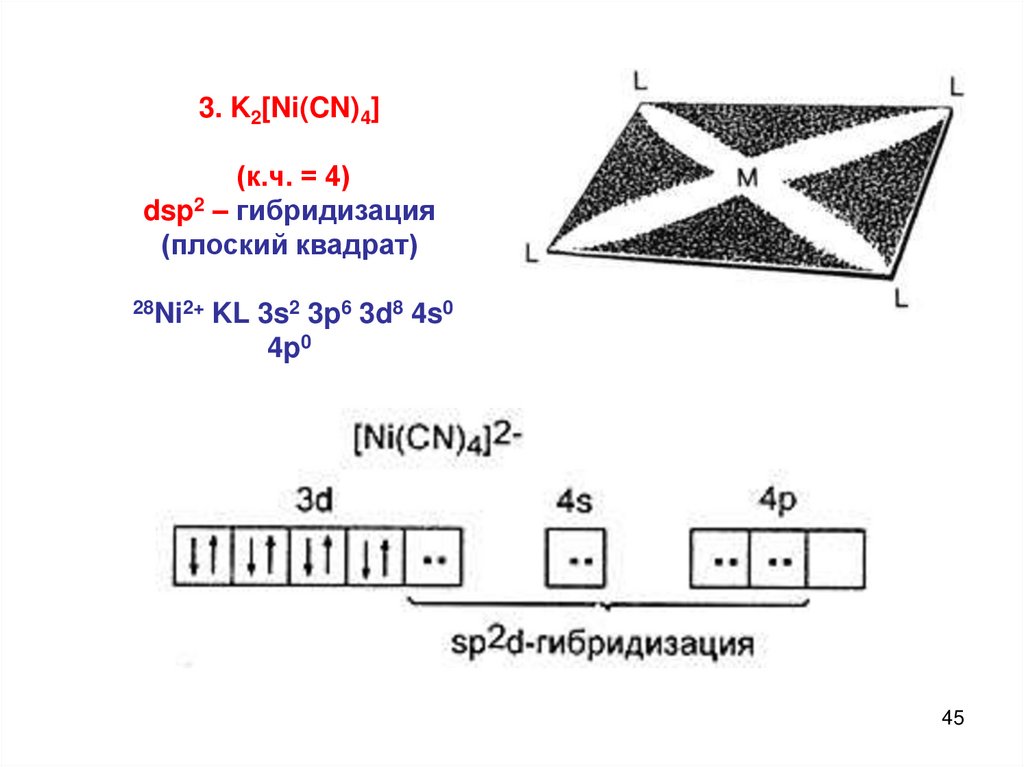
3. K2[Ni(CN)4](к.ч. = 4)
dsp2 – гибридизация
(плоский квадрат)
28Ni2+
KL 3s2 3p6 3d8 4s0
4p0
45
46.
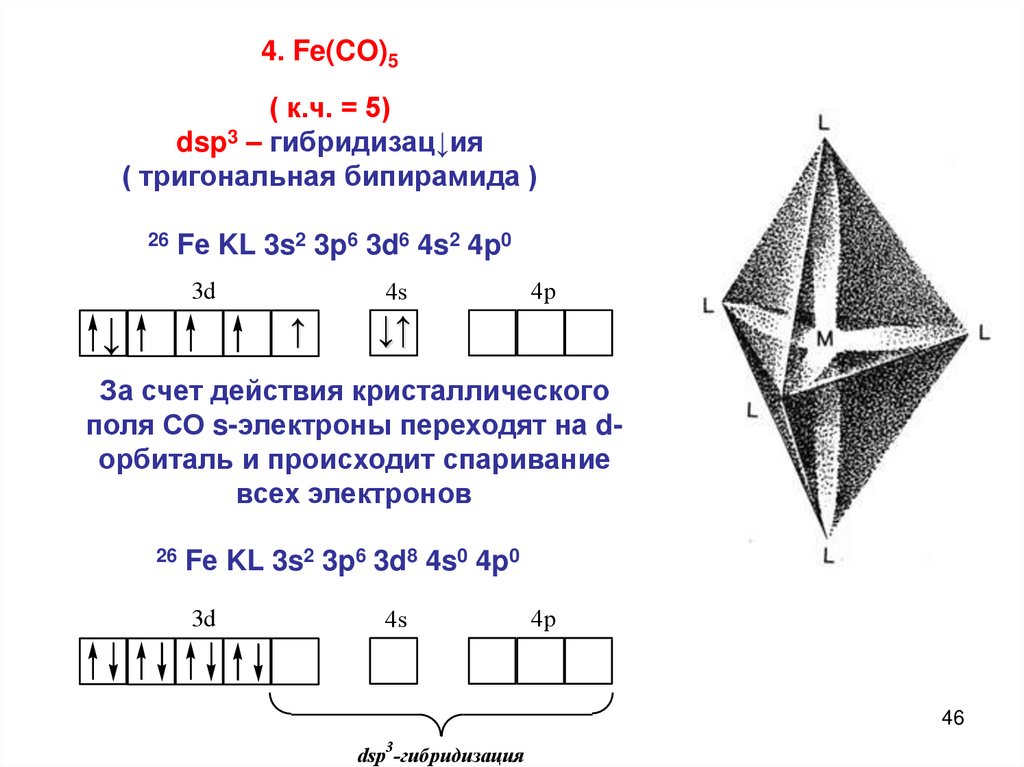
4. Fe(CO)5( к.ч. = 5)
dsp3 – гибридизац↓ия
( тригональная бипирамида )
26
Fе KL 3s2 3p6 3d6 4s2 4p0
3d
↓
4s
↑
4p
↓↑
За счет действия кристаллического
поля СО s-электроны переходят на dорбиталь и происходит спаривание
всех электронов
26
Fе KL 3s2 3p6 3d8 4s0 4p0
3d
4s
4p
46
dsp3-гибридизация
47.
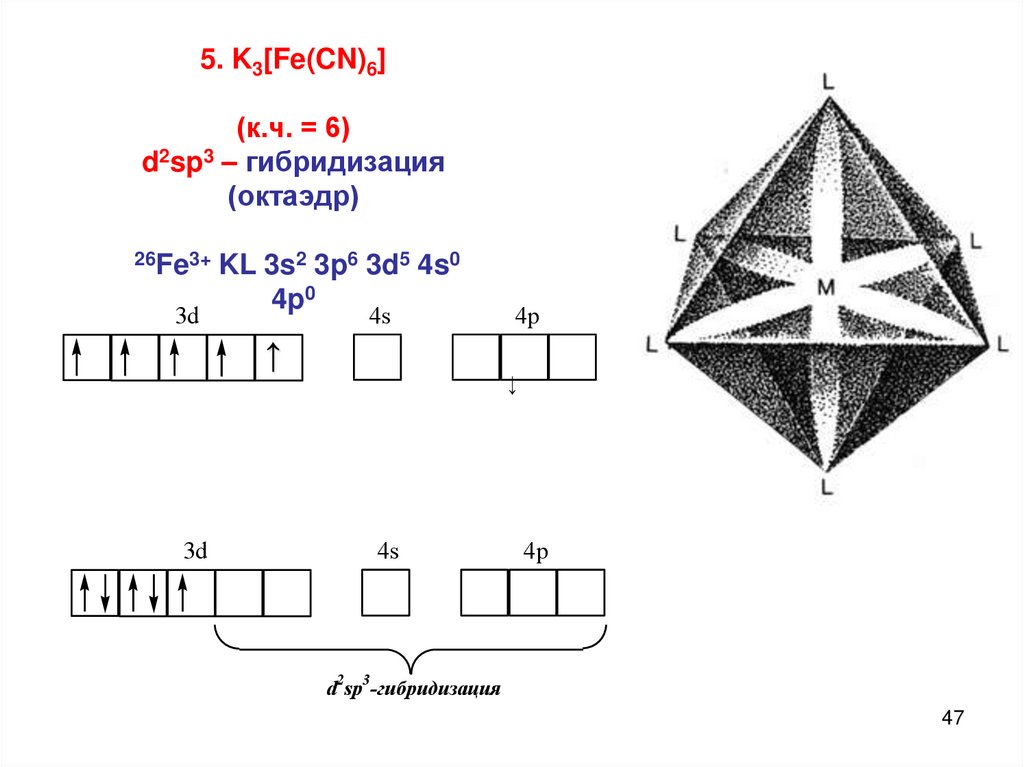
5. K3[Fe(CN)6](к.ч. = 6)
d2sp3 – гибридизация
(октаэдр)
26Fe3+
3d
KL 3s2 3p6 3d5 4s0
4p0
4s
4p
↑
↓
3d
4s
4p
d2sp3-гибридизация
47
48.
Комплексные соединения в растворахЭффективность донорно-акцепторного взаимодействия
лиганда и комплексообразователя, а, следовательно, и
прочность связи между ними определяется их
поляризуемостью - способностью трансформировать свои
электронные оболочки под внешним взаимодействием.
По этому признаку реагенты подразделяются на:
-«жесткие» ( малополяризуемые )
- «мягкие» ( легкополяризуемые )
48
49.
Жесткие и мягкие кислоты и основания ЖМКОКислоты (по Льюису) – акцепторы электронов
Al3+, Fe3+, Pb2+
Основания (по Льюису) – доноры электронов
O2-, S2Для «жестких» частиц характерны высокий заряд при
небольших размерах
Для «мягких» частиц, наоборот, характерно наличие
достаточно большого радиуса и низкого заряда, что
обуславливает их высокую поляризуемость
49
50.
Таким образом, прочность и устойчивость к диссоциацииковалентной связи между комплексообразователем и лигандами
зависит от их природы, и прежде всего от способности
вызывать и проявлять поляризуемость.
Металлы – комплексообразователи
Na+ > K+ > Mg2+> Ca2+> Fe2+> Co2+> Ni2+> Cu2+> Zn2+> Cd2+>Pb2+> Hg2+
жесткие
мягкие
Лиганды
F- > OH- > H2O> CI-> Br-> I-> RCOO-> NR3> R-SH
жесткие
мягкие
50
51.
В соответствии с общим принципом «подобное в подобном»наиболее прочная и устойчивая к диссоциации ковалентная
связь возникает между мягким комплексообразователем и
мягкими лигандами.
С учетом того, что белки, включая ферменты, содержат
мягкие легкополяризуемые группы: —СОО־, —NH2 и —SH,
становится понятным, почему все «металлы жизни»,
относящиеся к d-элементам, в организме встречаются
практически только в виде комплексов с биосубстратами.
С другой стороны, ясно, почему катионы тяжелых металлов
Cd²+, Pb²+, Hg²+ сильно токсичны. Эти катионы очень «мягкие»,
особенно катион Hg2+ , и поэтому активно образуют прочные
комплексы с жизненно важными белоксодержащими
субстратами, нарушая их метаболизм. Особенно легко в
реакцию комплексообразования вступают белки, содержащие
группу —SH
51
52.
Склонностью к комплексообразованиюобъясняется такжн токсичность цианидов, так
как анион СN- ( очень мягкий лиганд) активно
взаимодействует с катионами d-металлов в
комплексах, замещая в них биосубстраты и
тем самым инактивируя эти биокомплексы
Катионы Na+ и К+ вследствие своей жесткости практически не
образуют устойчивых комплексов с биосубстратами и в
физиологических средах находятся, в основном, в виде
гидратированных ионов. Катионы Mg2+ и Ca2+ способны
образовывать достаточно устойчивые комплексы с белками, и
поэтому в физиологических средах они встречаются как в
ионизованном, так и в связанном состоянии (в виде комплексов
с белками, а также нерастворимых солей – фосфатов
оксалатов и уратов).
52
53.
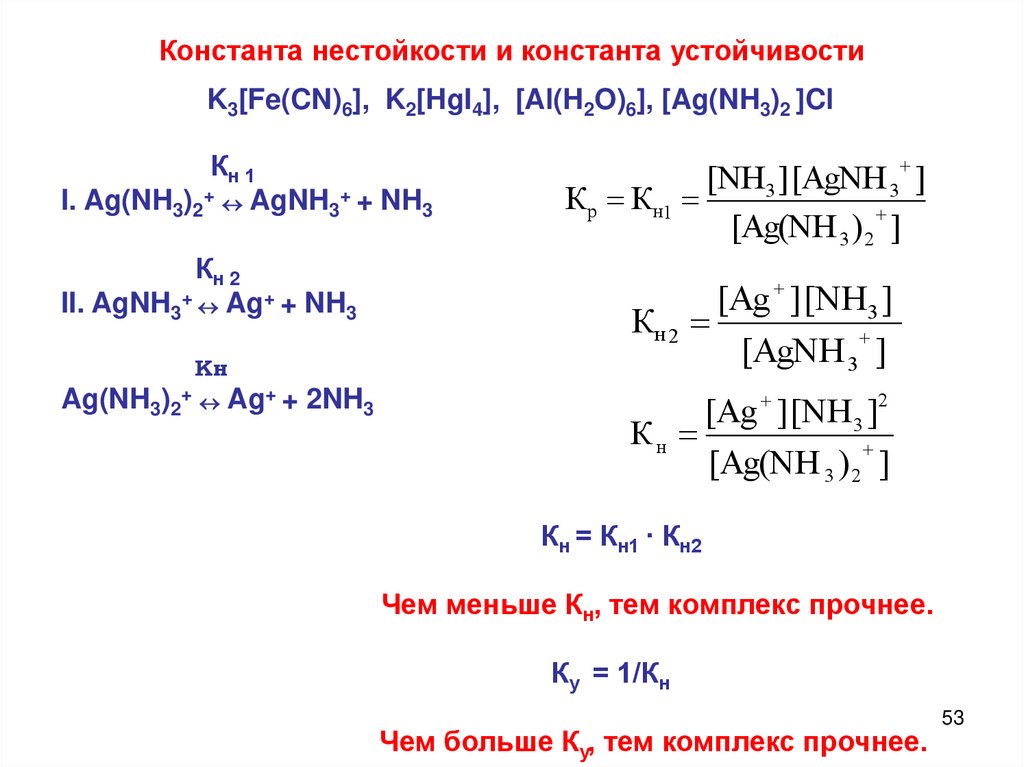
Константа нестойкости и константа устойчивостиK3[Fe(CN)6], K2[HgI4], [Al(H2O)6], [Ag(NH3)2 ]Cl
Кн 1
I. Ag(NH3)2+ AgNH3+ + NH3
Кн 2
II. AgNH3+ Ag+ + NH3
Кн
Ag(NH3)2+ Ag+ + 2NH3
[NH3 ] [AgNH 3 ]
Кр Кн1
[Ag(NH 3 ) 2 ]
[Ag ] [NH3 ]
Кн 2
[AgNH 3 ]
[Ag ] [NH 3 ]2
Кн
[Ag(NH 3 ) 2 ]
Кн = Кн1 · Кн2
Чем меньше Кн, тем комплекс прочнее.
Ку = 1/Кн
Чем больше Ку, тем комплекс прочнее.
53
54.
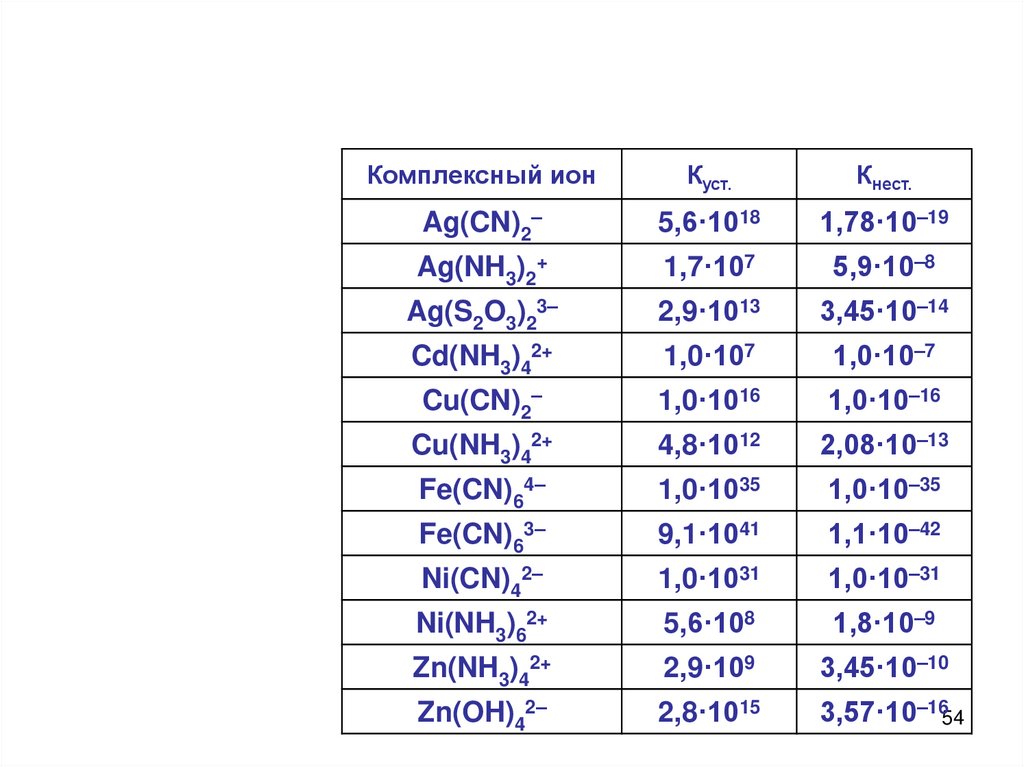
Комплексный ионКуст.
Кнест.
Ag(CN)2–
5,6·1018
1,78·10–19
Ag(NH3)2+
1,7·107
5,9·10–8
Ag(S2O3)23–
2,9·1013
3,45·10–14
Cd(NH3)42+
1,0·107
1,0·10–7
Cu(CN)2–
1,0·1016
1,0·10–16
Cu(NH3)42+
4,8·1012
2,08·10–13
Fe(CN)64–
1,0·1035
1,0·10–35
Fe(CN)63–
9,1·1041
1,1·10–42
Ni(CN)42–
1,0·1031
1,0·10–31
Ni(NH3)62+
5,6·108
1,8·10–9
Zn(NH3)42+
2,9·109
3,45·10–10
Zn(OH)42–
2,8·1015
3,57·10–1654
55.
Смещение равновесияв растворах комплексных
соединений
55
56.
Если на систему, находящуюся в равновесии, оказывается внешнеевоздействие, равновесие смещается в таком направлении, чтобы
56
свести к минимуму влияние этого воздействия (1884г – Ле Шателье)
57.
Разрушение комплексов1. Разрушение по металлу – введение
образующих с металлом более прочный комплекс
3 2
Ag ( NH )
KCN
лигандов,
-8
5,8·10
Ag
CN
2 NH3
1.78·10
Ag (CN)
K
19
2
57
58.
Ag ( NH3 ) 25,9·10-8
Ag
2 NH3
KCN
CN
K
1.78·10 19
Ag (CN) 2
K н 2 Kн1
58
59.
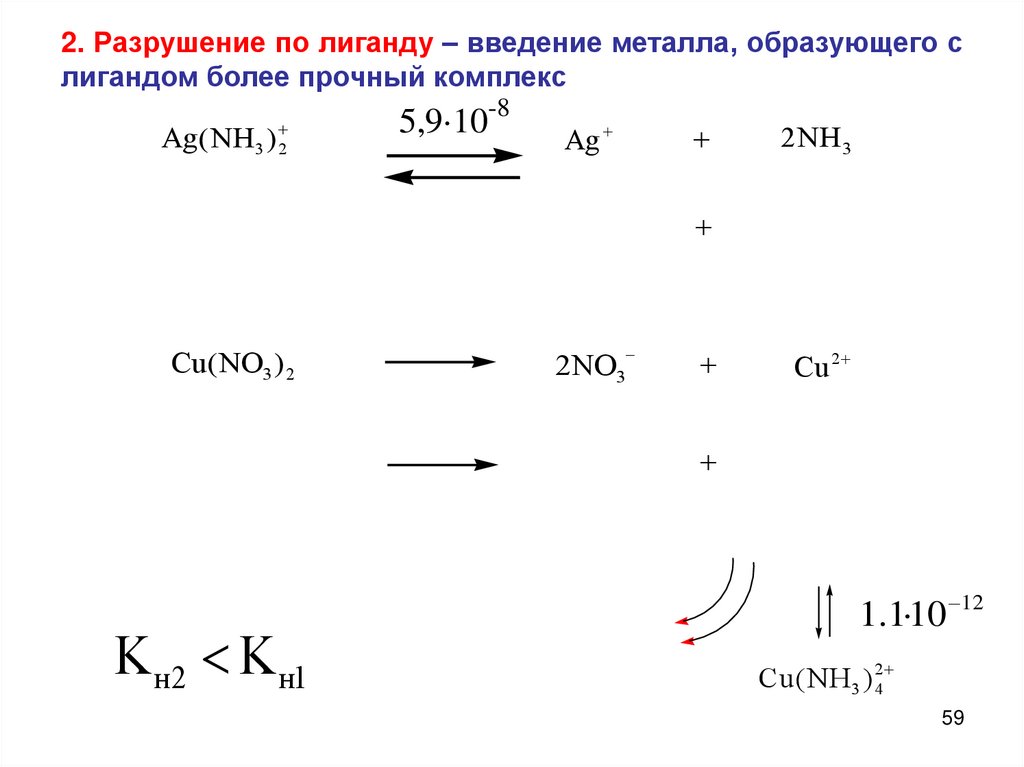
2. Разрушение по лиганду – введение металла, образующего слигандом более прочный комплекс
3 2
Ag ( NH )
5,9·10-8
Ag
2 NH3
Cu( NO3 ) 2
2NO3
Cu 2
Kн2 Kн1
1.1·10 12
Cu( NH3 ) 24
59
60.
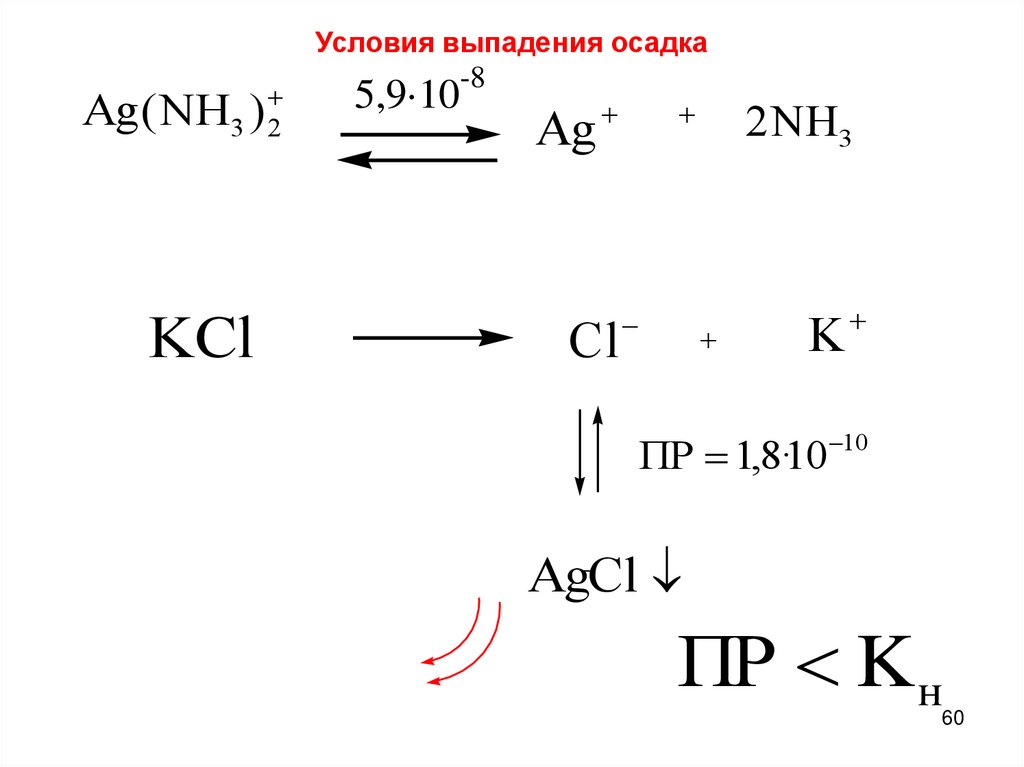
Условия выпадения осадка3 2
Ag ( NH )
KCl
-8
5,9·10
Ag
Cl
2 NH3
K
ПР 1,8·10 10
AgCl
ПР K н
60
61.
Условия растворения осадкаAgCl
KCN
1,8·10-10
Ag
CN
Cl
1.4·10
Ag (CN)
K
20
2
Kн ПР
61
62.
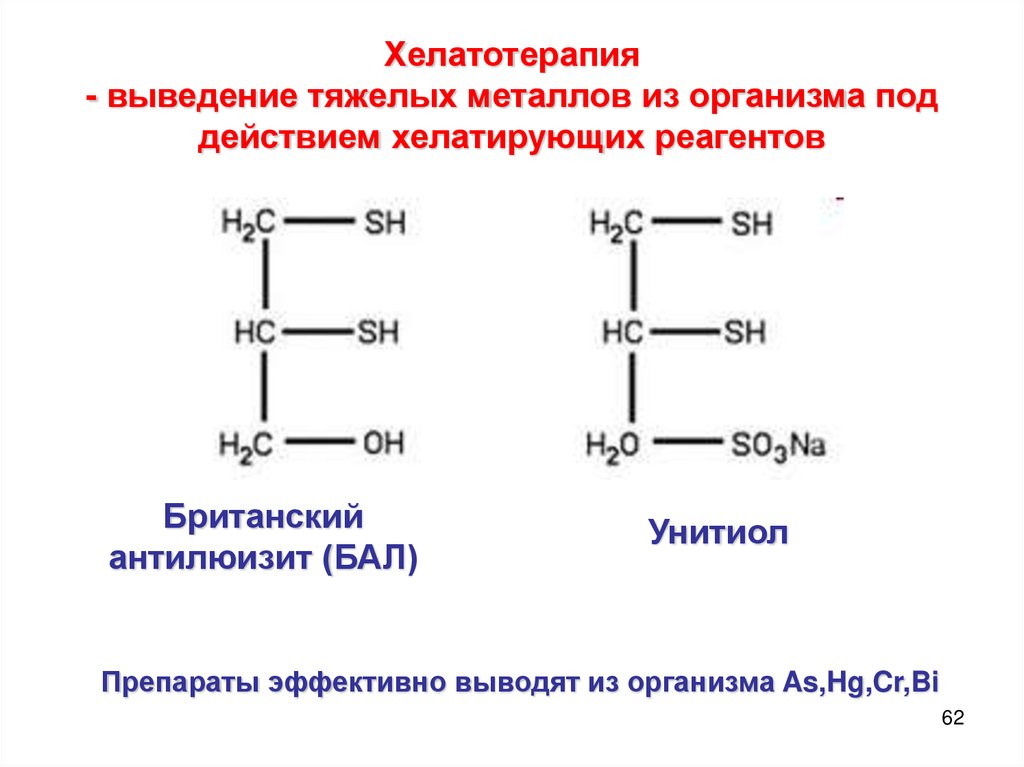
Хелатотерапия- выведение тяжелых металлов из организма под
действием хелатирующих реагентов
Британский
антилюизит (БАЛ)
Унитиол
Препараты эффективно выводят из организма As,Hg,Cr,Bi
62
63.
Два основных принципахелатотерапии
1. Детоксикант (лиганд) должен эффективно связывать ионытоксиканты то есть…!!!!!! - вновь образующиеся соединения
должны быть прочнее, чем те, которые существовали в
организме
2. Детоксиант не должен разрушать жизненно необходимые
соединения то есть…..!!!!! – соединения, которые могут
образовываться при взаимодействии детоксиканта и ионов
биометаллов должны быть менее прочными, чем
существующие в организме
63
64.
Медико-биологическое значение комплексов:1. Ионы d-металлов образуют
ферментами, аминокислотами;
комплексы
с
белками,
2. Комплексы с серосодержащими спиртами используются
при отравлениях тяжелыми металлами (Pb, Cd, Sn, Hg);
R-OH
R-SH
C2H5 S
C2H5 S
Pb
3. Трилон «Б» (ЭДТА) используется при мочекаменной болезни
для разрушения камней и выведения осадков;
4. Сu2+-содержащий комплекс - супероксиддисмутаза (СОД)
препятствует накоплению в организме свободных радикалов.
64
65.
5. Трилонометрия применяется для определения:содержания
ионов кальция, цинка, магния, железа в
фармпрепаратах,
общего кальция в сыворотке крови, костях и хрящах
жесткости воды, обусловленной наличием ионов Са2+ и Mg2+
в виде гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2
65
66.
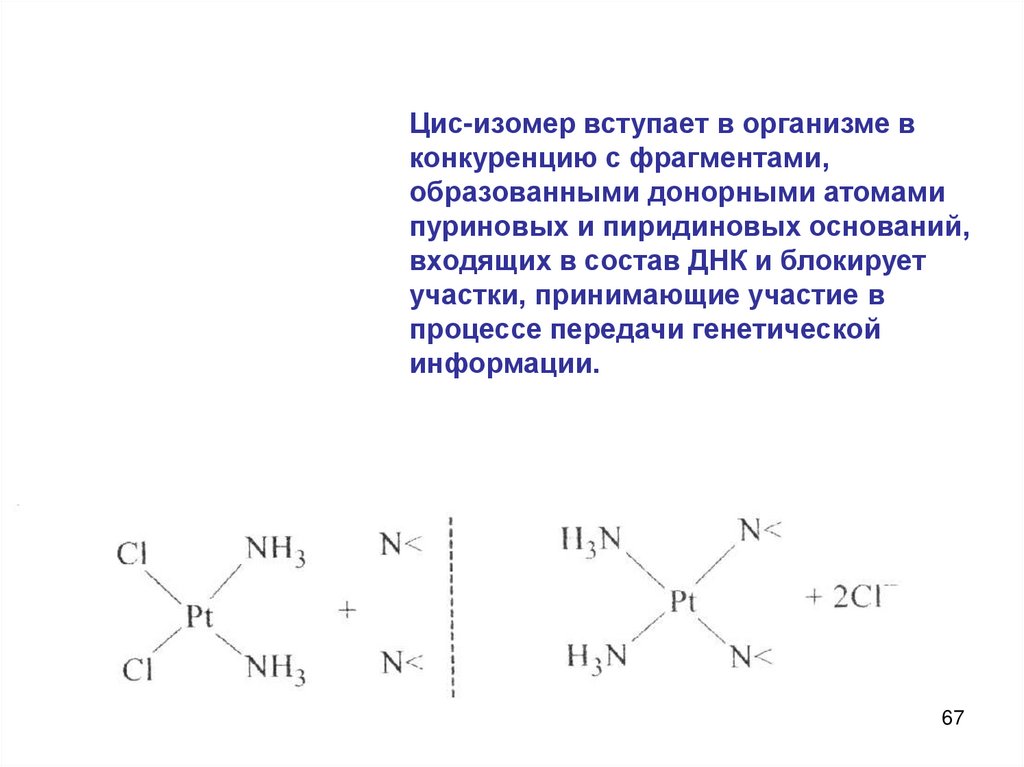
6.Цис-изомер
дихлордиамминплатины
(II)
обладает
противоопухолевой активностью и применяется в качестве
лекарственного средства при онкологических заболеваниях.
66
67.
Цис-изомер вступает в организме вконкуренцию с фрагментами,
образованными донорными атомами
пуриновых и пиридиновых оснований,
входящих в состав ДНК и блокирует
участки, принимающие участие в
процессе передачи генетической
информации.
67
68.
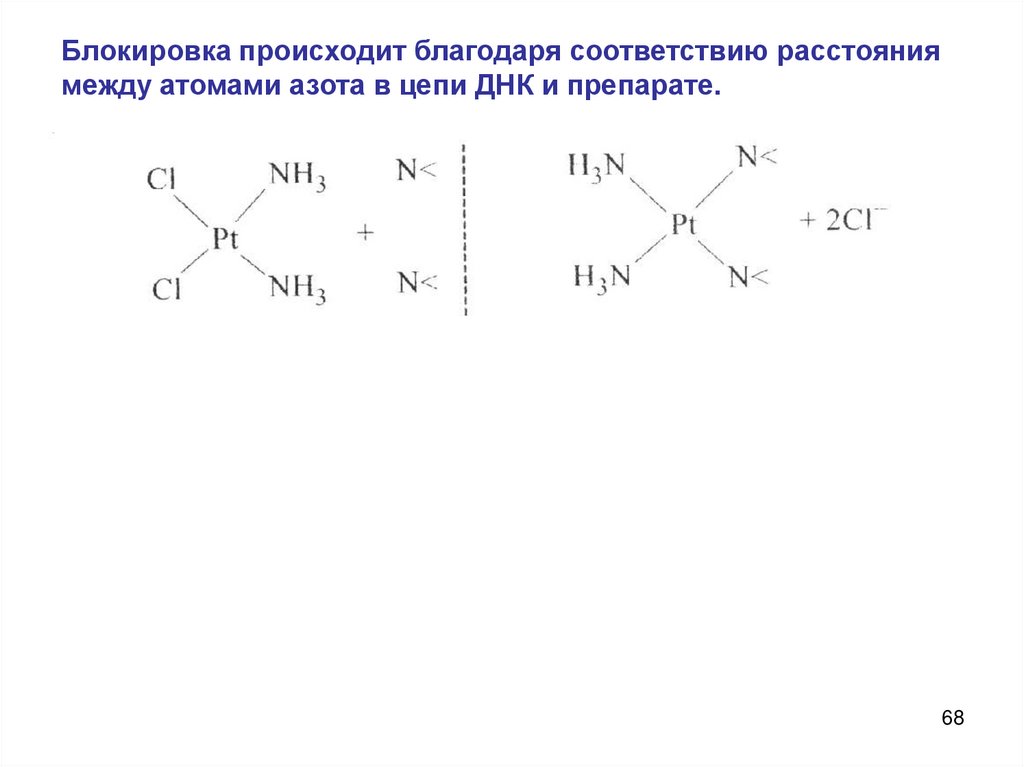
Блокировка происходит благодаря соответствию расстояниямежду атомами азота в цепи ДНК и препарате.
68
69.
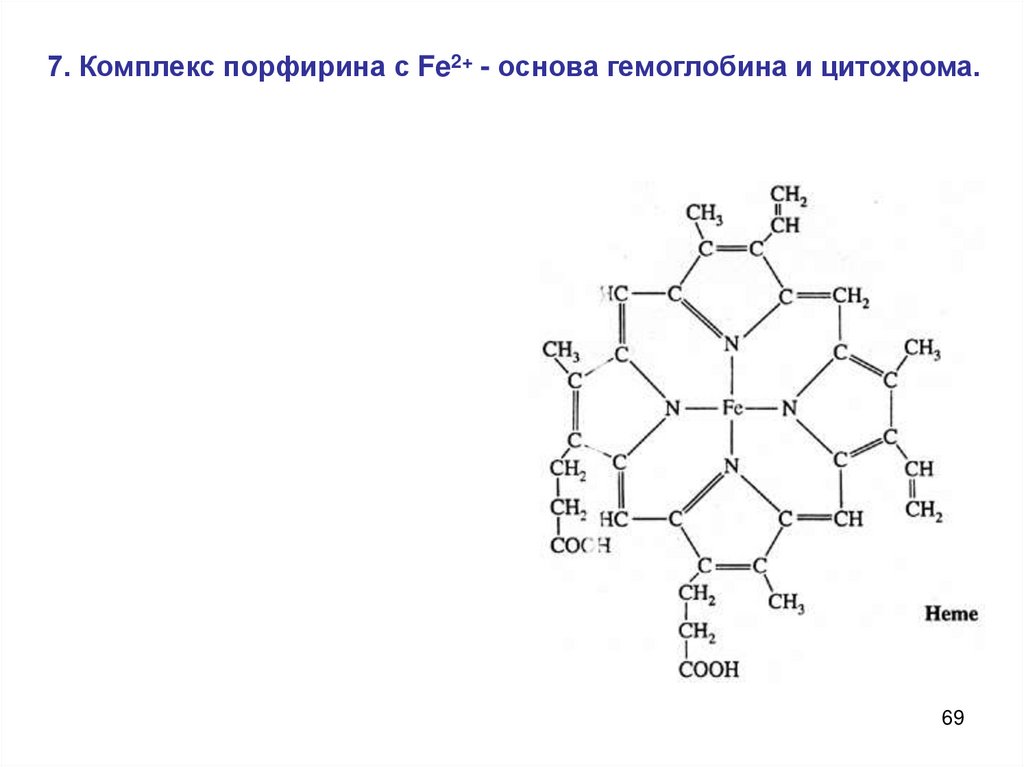
7. Комплекс порфирина с Fe2+ - основа гемоглобина и цитохрома.69
70.
Среднее содержание гемоглобина в эритроцитах крови –15 г / 100 мл.
1 г гемоглобина связывает
1.33 мл кислорода
70
71.
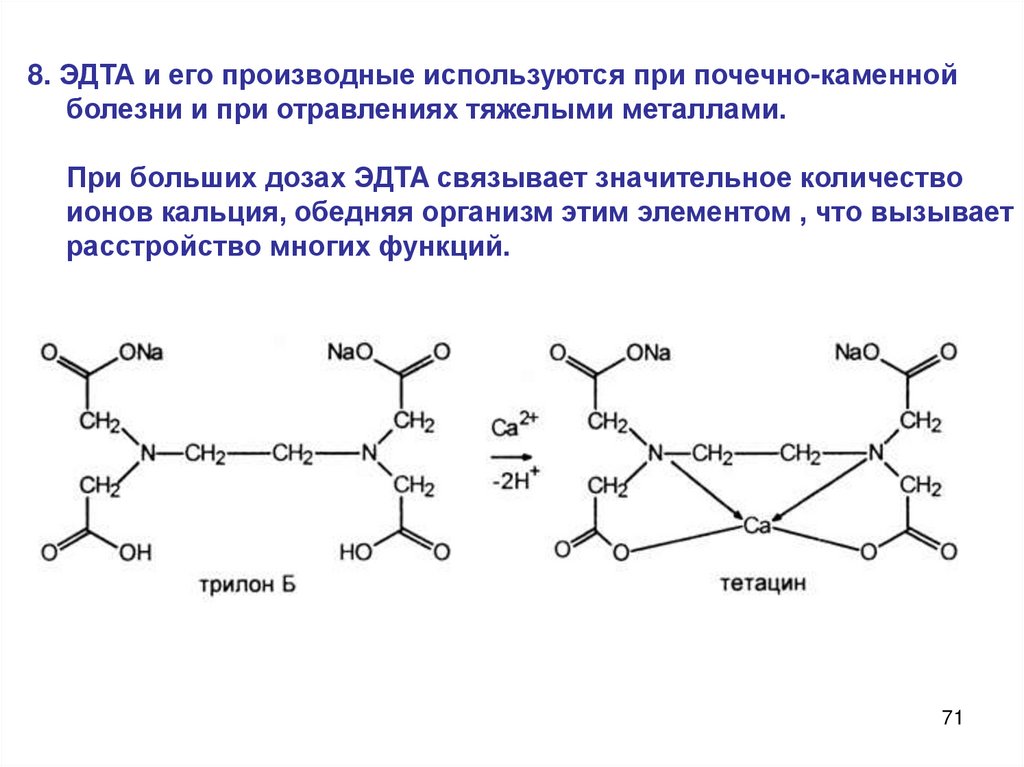
8. ЭДТА и его производные используются при почечно-каменнойболезни и при отравлениях тяжелыми металлами.
При больших дозах ЭДTA связывает значительное количество
ионов кальция, обедняя организм этим элементом , что вызывает
расстройство многих функций.
71
72.
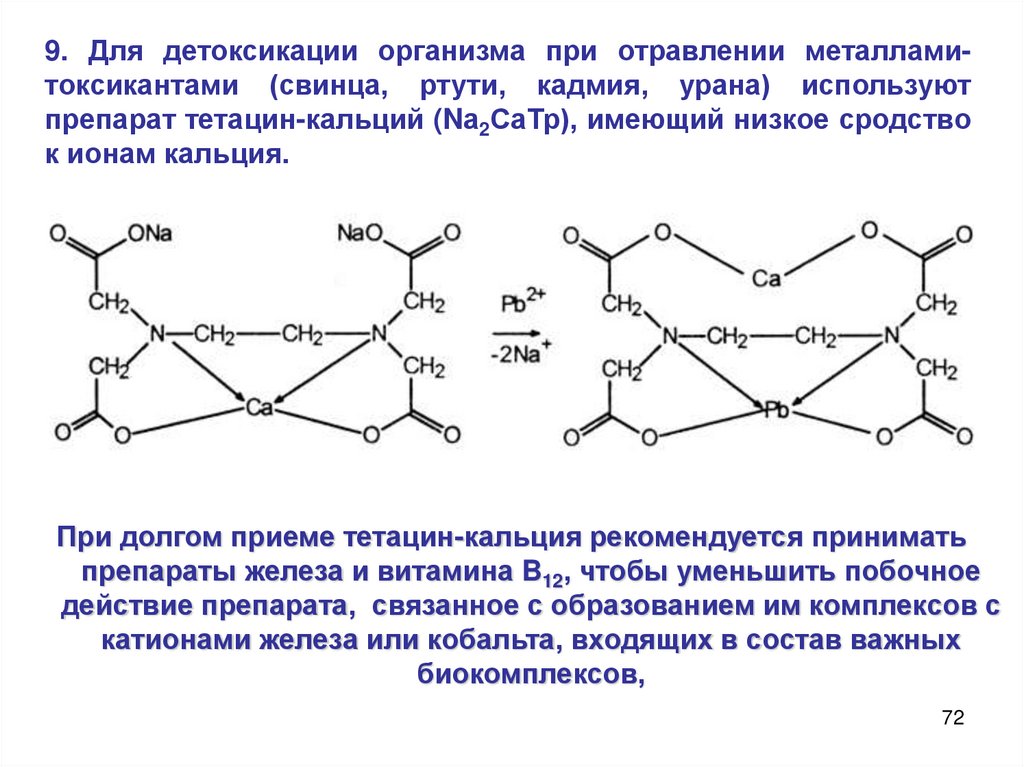
9. Для детоксикации организма при отравлении металламитоксикантами (свинца, ртути, кадмия, урана) используютпрепарат тетацин-кальций (Nа2СаТр), имеющий низкое сродство
к ионам кальция.
При долгом приеме тетацин-кальция рекомендуется принимать
препараты железа и витамина B12, чтобы уменьшить побочное
действие препарата, связанное с образованием им комплексов с
катионами железа или кобальта, входящих в состав важных
биокомплексов,
72
73.
10. Пентацин - производное диэтилентриамин пентауксуснойкислоты
СаNа3ДТПА
применяют
при
отравлениях
радиоактивными элементами.
73
74.
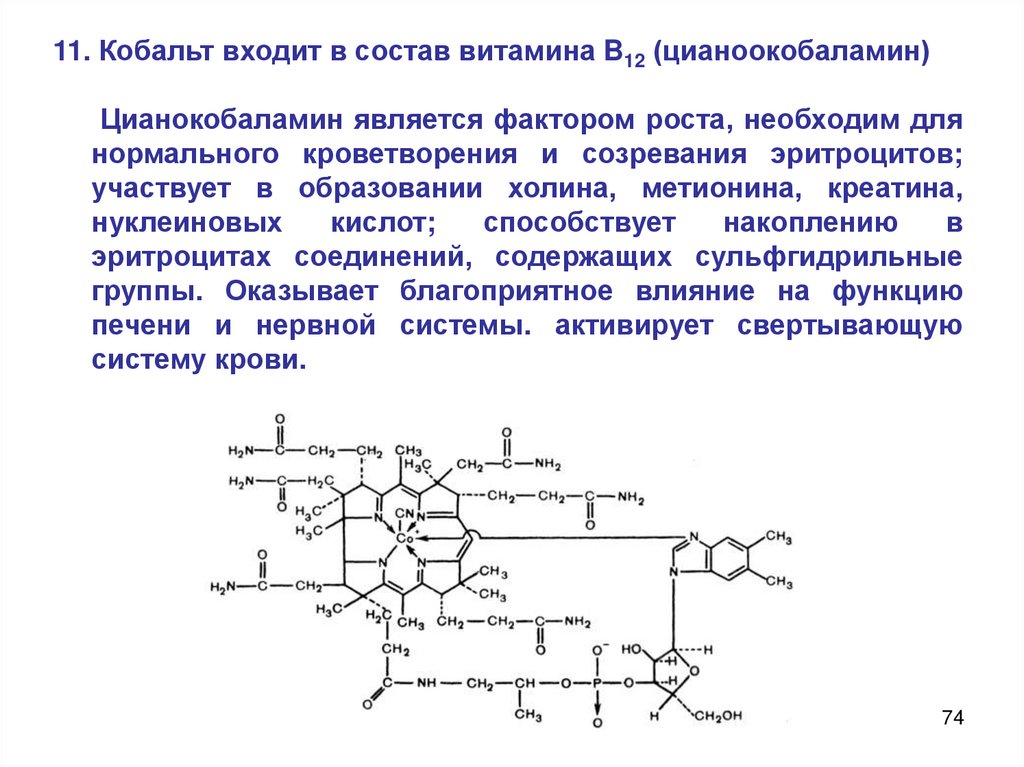
11. Кобальт входит в состав витамина B12 (цианоокобаламин)Цианокобаламин является фактором роста, необходим для
нормального кроветворения и созревания эритроцитов;
участвует в образовании холина, метионина, креатина,
нуклеиновых
кислот;
способствует
накоплению
в
эритроцитах соединений, содержащих сульфгидрильные
группы. Оказывает благоприятное влияние на функцию
печени и нервной системы. активирует свертывающую
систему крови.
74
75.
12. Для связывания токсичного катиона бериллия применяетсяалюминон, получивший такое название из-за способности
координироваться с катионом алюминия.
Его эффективность по отношению к бериллию - проявление
диагонального сходства пары бериллий-алюминий.
алюминон
75
76.
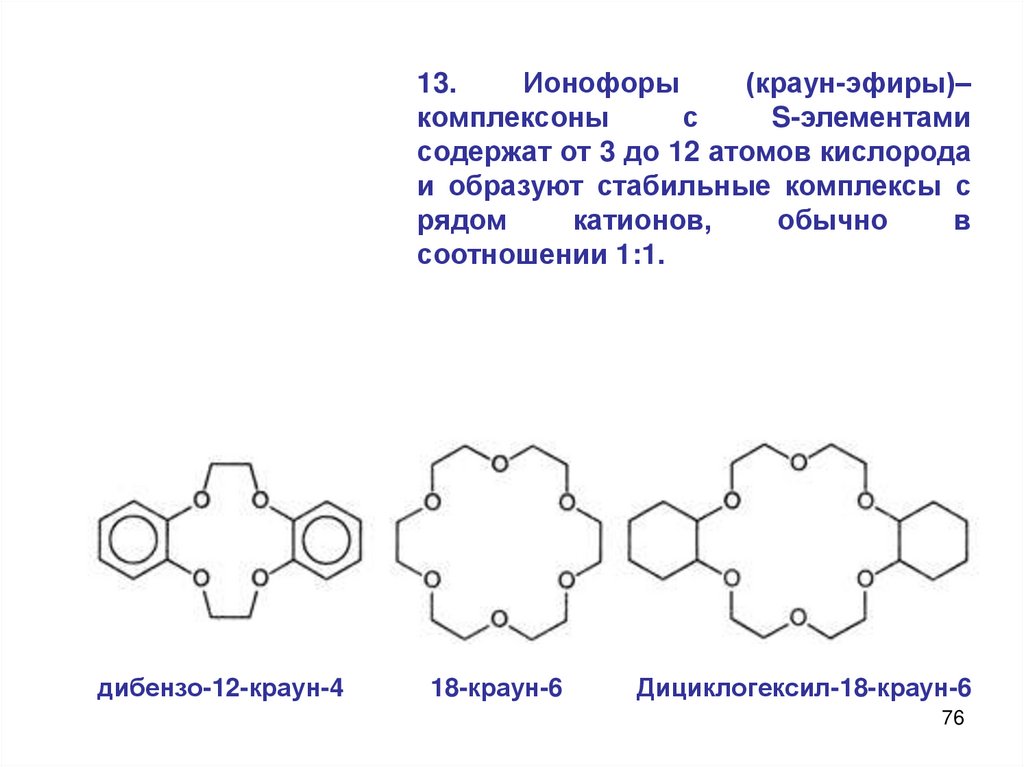
13.Ионофоры
(краун-эфиры)–
комплексоны
с
S-элементами
содержат от 3 до 12 атомов кислорода
и образуют стабильные комплексы с
рядом
катионов,
обычно
в
соотношении 1:1.
дибензо-12-краун-4
18-краун-6
Дициклогексил-18-краун-6
76
77.
Ионофоры, перенося катионыкалия через мембрану, как это
показано
на
примере
валиномицина,
уменьшают
мембранный потенциал и тем
самым осуществляют разобщение
жизненно необходимых процессов
клеточного дыхания. В результате
валиномицин
и
обладает
свойствами антибиотика.
77
78.
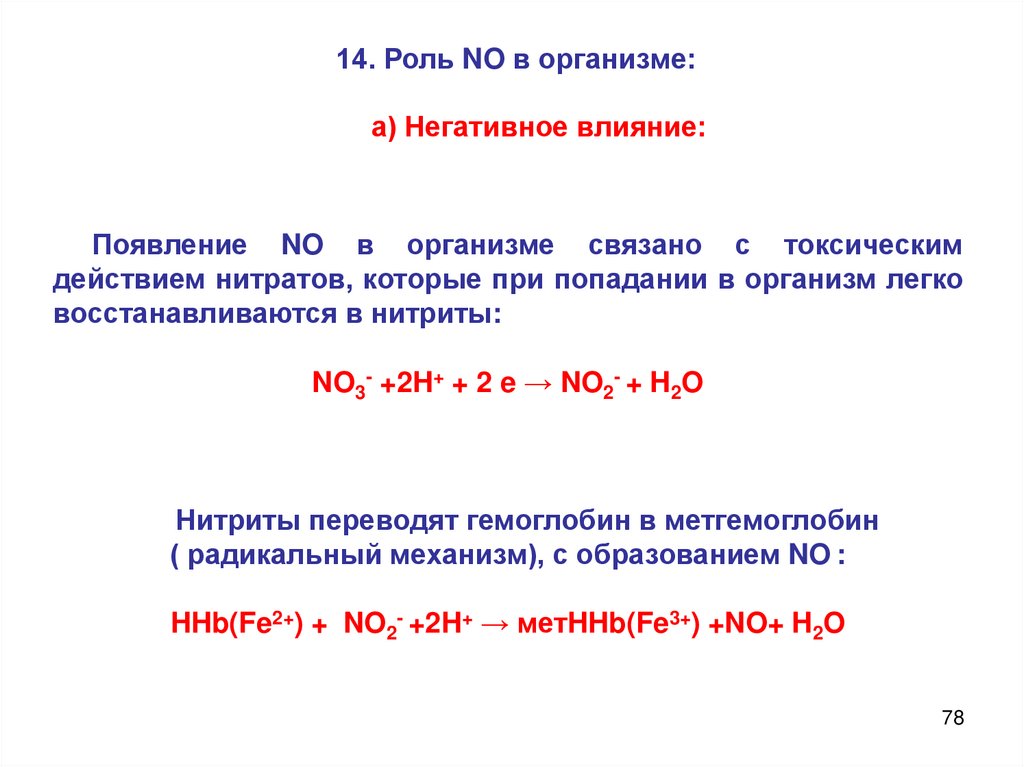
14. Роль NO в организме:а) Негативное влияние:
Появление NO в организме связано с токсическим
действием нитратов, которые при попадании в организм легко
восстанавливаются в нитриты:
NO3- +2H+ + 2 e → NO2- + H2O
Нитриты переводят гемоглобин в метгемоглобин
( радикальный механизм), с образованием NO :
HHb(Fe2+) + NO2- +2H+ → метHHb(Fe3+) +NO+ H2O
78
79.
NO является лигандом, который, подобно кислороду, образуеткомплекс с гемоглобином, устойчивость которого в 60 раз
больше, чем оксигемоглобина. Возникает острое кислородное
голодание
тканей
из-за
перехода
гемоглобина
в
нитрозогемоглобин:
HHb O2 HHbO 2
HHb NO HHbNO
Диагностический признак токсического действия нитратнитритов – изменение уровня метгемоглобина в крови, норма
которого определена для человека на уровне до 2 %.
79
80.
б) Физиологическое значение:Вместе с тем, NO обязательно синтезируется в организме
человека из аргинина. Время жизни NO в клетках организма
составляет порядка 1 секунды, но, благодаря высокой
химической активности, это соединение обеспечивает
расслабление гладких мышц сосудов, регуляцию работы
сердца, эффективную работу иммунной системы, передачу
нервных импульсов, сексуальное возбуждение и играет
важную роль в обучении и запоминании.
80
81.
За открытие синтеза NO в организме и исследование егофизиологической роли Р.Фурчготт, Л.Игнарро и Ф.Мурад были
удостоены Нобелевской премии в 1988 году.
Luis J. Ignarro
R.F Furchgott
Ferid Murad
81
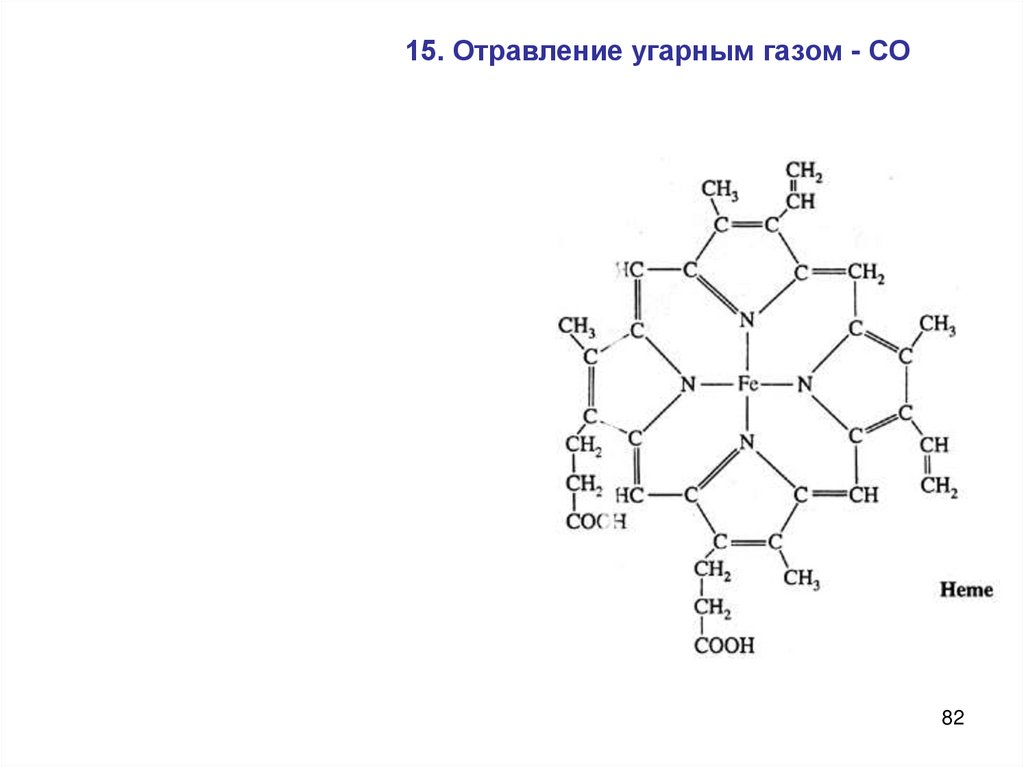
82.
15. Отравление угарным газом - СО82
83.
Механизм отравленияДлина связи (Å)
1 Å=10-8см=10-10 м
CO NO O 2
1.13
1.15
1.21
Равновесие смещено в сторону образования карбоксигемоглобина,
устойчивость которого в 210 раз больше, чем оксигемоглобина, что
приводит к накоплению карбоксигемоглобина в крови.. 83
84.
Причины отравления1. Курение
84
85.
2. Вдыхание выхлопных газов автомобиля.85
86.
3. Преждевременноезакрытие вытяжной заслонки
протопленной печи.
86
87.
Последствия отравленияЛегкое отравление - содержание метгемоглобина 30% :
наблюдается головная боль, слабость, тошнота.
Отравление средней степени - содержание метгемоглобина
40-50% : нарушается координация движений, происходит
посинение кожи лица (иногда с четкими красными пятнами) и
помутнение сознания.
Тяжелое отравление - содержание метгемоглобина до 60%:
происходит потеря сознания, судороги.
Содержание метгемоглобина – 70% и выше:
смерть наступает от остановки дыхания.
Смертельные концентрации СО
- 2 мг/л при 60-минутной экспозиции
- 5 мг/л при 5 - минутной экспозиции
87
88.
Помощь при отравленияхПострадавшим необходимо тепло, сердечные средства и
вдыхание чистого кислорода, так как содержание кислорода в
воздухе недостаточно для быстрого вытеснения СО из
88
карбоксигемоглобина.


























































 Химия
Химия








