Похожие презентации:
Окислительно-восстановительные реакции. Электролиз
1.
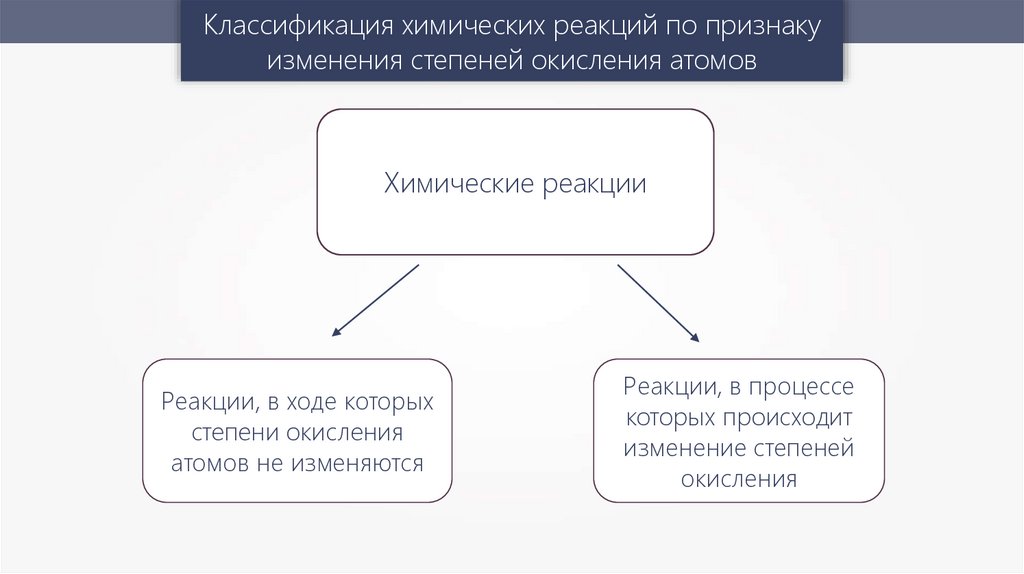
Классификация химических реакций по признакуизменения степеней окисления атомов
Химические реакции
Реакции, в ходе которых
степени окисления
атомов не изменяются
Реакции, в процессе
которых происходит
изменение степеней
окисления
2.
-30
+1
+2
+3
+4
+5
NH3 N2 N2O NO HNO2 NO2 HNO3
Степень окисления — это условный заряд
атомов химического элемента в соединении,
если предположить, что вещество состоит
только из простых ионов.
3.
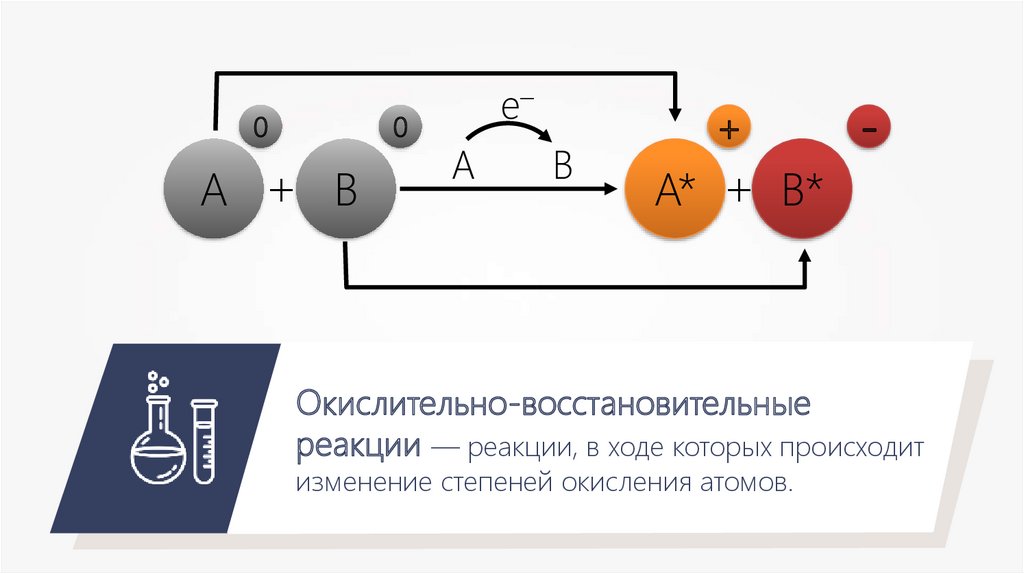
00
A + B
e–
A
B
+
A* + B*
-
Окислительно-восстановительные
реакции — реакции, в ходе которых происходит
изменение степеней окисления атомов.
4.
Правила расчёта степеней окисленияСтепень окисления кислорода в соединениях равна -2
+2
(исключения: OF2, а также пероксиды, в которых степень окисления кислорода -1).
Степень окисления водорода в соединениях равна +1
(исключения: гидриды, в которых степень окисления водорода -1).
Металлы в соединениях всегда имеют положительную степень окисления, причём
максимальная, как правило, равна номеру группы.
Степень окисления в простых веществах и свободных атомах всегда равна нолю.
В соединении сумма всех степеней окисления атомов элементов равна нолю.
5.
Лабораторный способ получения водорода0
+1
-1
+2
0
-1
Zn + 2HCl = Zn + 2Cl2 + H2
0
Восстановитель
+1
Окислитель
+2
0
6.
Реакции горенияуглеводородов протекают
с изменением степеней
окисления атомов элементов.
7.
Горение этана-4
+1
0
+4 -2
+1
-2
2С2Н6 + 7О2 → 4СО2 + 6Н2О
-4
Восстановитель
0
Окислитель
+4
-2
8.
Сильные восстановителиСильные окислители
– водород
– углерод
– сероводород
– аммиак
– металлы
– кислород
– озон
– фтор
– галогены
– серная кислота
– азотная кислота
9.
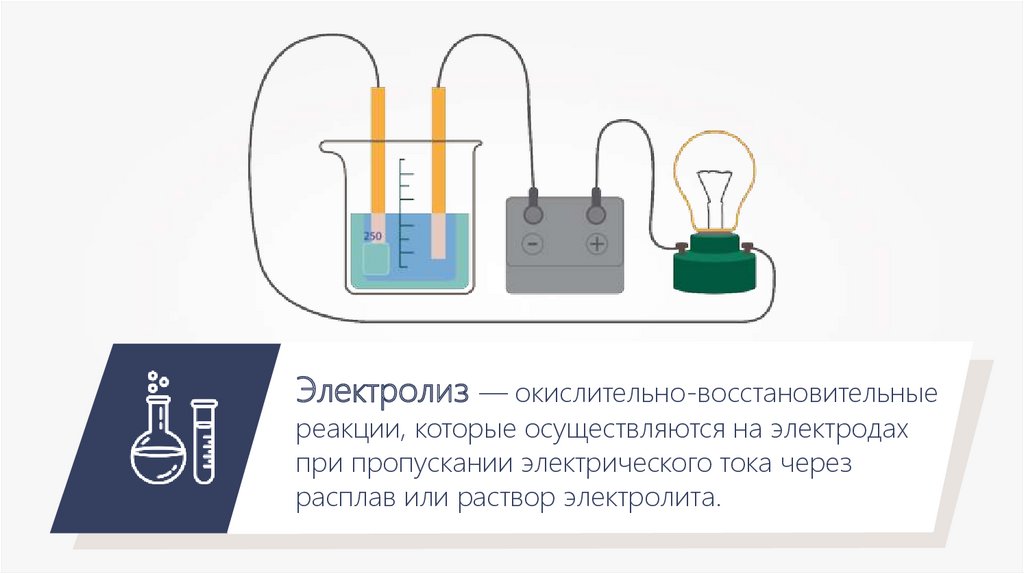
Электролиз — окислительно-восстановительныереакции, которые осуществляются на электродах
при пропускании электрического тока через
расплав или раствор электролита.
10.
Электролиз расплава хлорида натрия–
+
+
–
Катод
Анод
Cl2↑
Na
электроны
+
Cl
–
+
Cl
–
Na
Na
NaCl = Na + Cl
+
–
11.
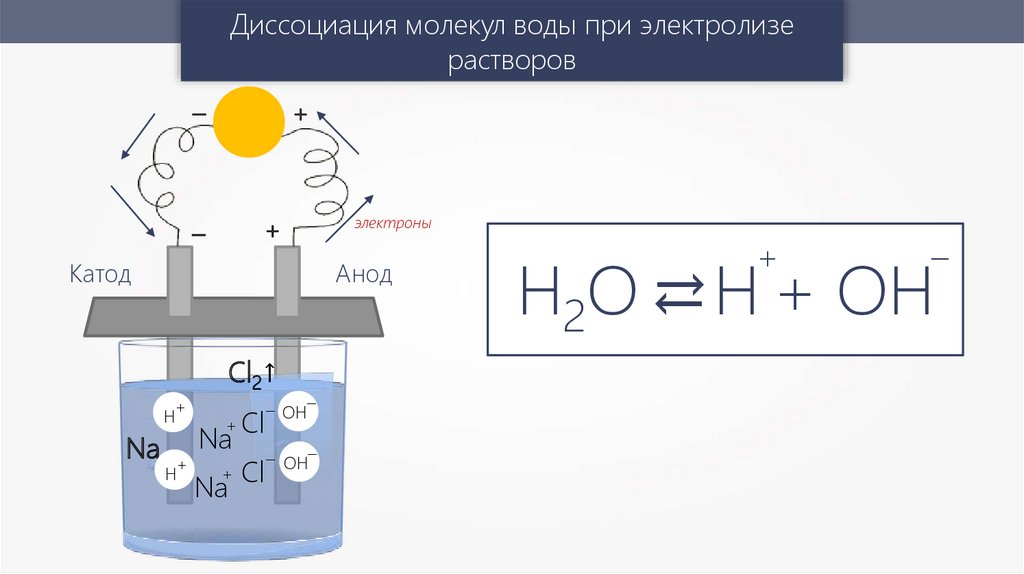
Диссоциация молекул воды при электролизерастворов
+
+
–
Катод
Анод
Cl2↑
+
H
Na
электроны
+
H
+
Na
+
Na
Cl
Cl
– OH–
– OH–
Н2О → Н + ОH
→
–
+
–
12.
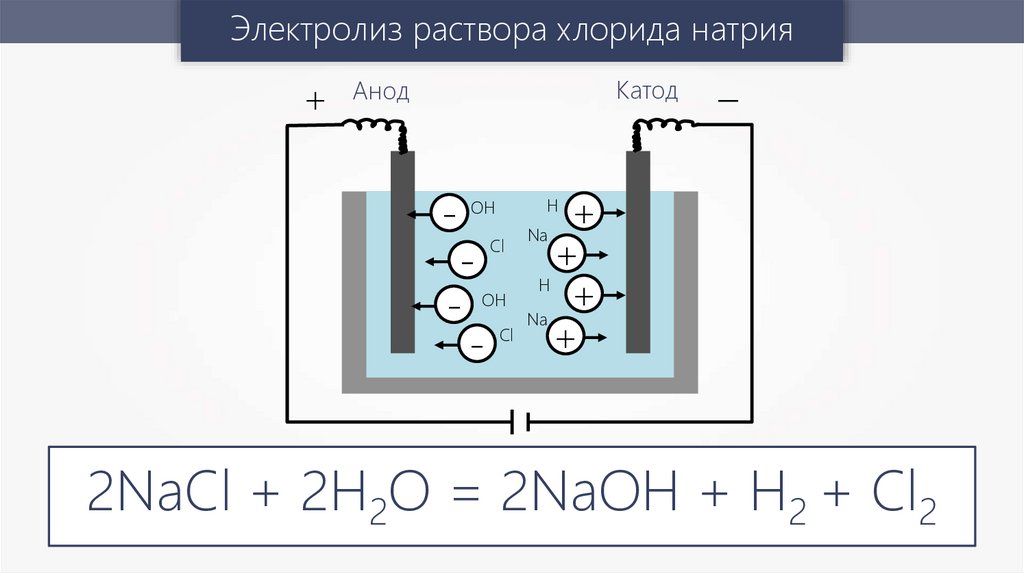
Электролиз раствора хлорида натрия+
Катод
Анод
-
OH
- OH
- Cl
Cl
–
+
+
H
+
Na
+
H
Na
2NaCl + 2H2O = 2NaOH + H2 + Cl2
13.
Практическое промышленноеприменение электролиза
14.
Практическое промышленноеприменение электролиза
15.
Практическое промышленноеприменение электролиза









 Химия
Химия








