Похожие презентации:
Окислительно-восстановительные реакции в органической химии
1.
Окислительновосстановительныереакции в
органической химии
Алехина Е.А.
2. План презентации:
1. Определение понятия «окислительновосстановительные реакции»2. Определение степени окисления атомов углерода в
органических веществах
3. Реакции окисления органических соединений
3.1. Окислители органических соединений
3.2. Классификация реакций окисления
3.3. Механизмы реакций окисления органических соединений
4. Реакции восстановления органических соединений
4.1. Классификация реакций восстановления
4.2. Восстановители органических соединений
4.3. Механизмы реакций восстановления органических соединений
5. Литература
Алехина Е.А.
3.
Окислительно-восстановительныереакции
(реакции окисления-восстановления)
– реакции, сопровождающиеся изменением
степени окисления атомов, входящих в состав
реагирующих веществ, в результате
перемещения электронов от атома одного из
реагентов (восстановителя) к атому другого
(окислителя)
Алехина Е.А.
4.
Генетическая связьорганических веществ
Алехина Е.А.
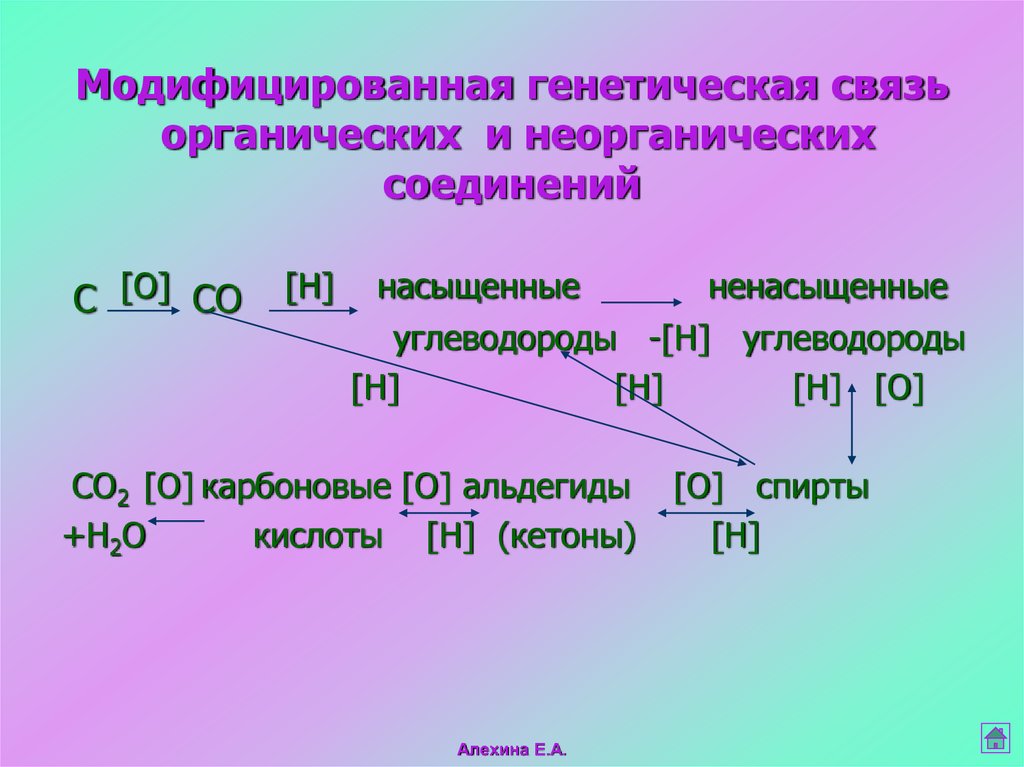
5. Модифицированная генетическая связь органических и неорганических соединений
C [O] CO[H]
насыщенные
ненасыщенные
углеводороды -[H] углеводороды
[H]
[H]
[H] [O]
CO2 [O] карбоновые [O] альдегиды
+H2O
кислоты [H] (кетоны)
Алехина Е.А.
[O] спирты
[H]
6.
Определение степениокисления атомов в
органических веществах
Например:
+1 -3
-2 +1
-3 +1
-3 +1
Н3С – СН2 – СН3
-1+1
-2 +1
СН3 – СН2 – ОН
Алехина Е.А.
7.
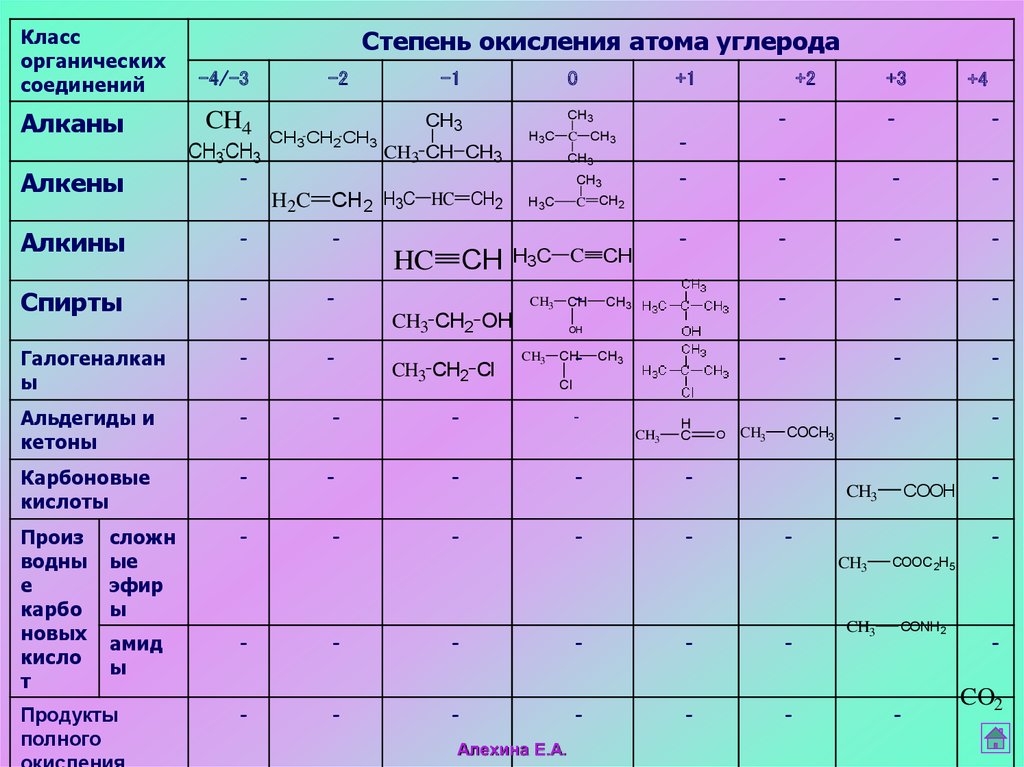
8.
Классорганических
соединений
Алканы
Алкены
Степень окисления атома углерода
-4/-3
CH4
CH3 CH3
-2
CH3 CH2 CH3
-
-1
CH3
CH3 CH CH3
0
+1
C
CH3
Алкины
-
-
Спирты
-
-
HC CH
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
C CH2
H3C
H3C C CH
CH
CH3
CH3 CH2 OH
CH3
OH
Галогеналкан
ы
-
Альдегиды и
кетоны
-
Карбоновые
кислоты
-
-
-
-
-
Произ
водны
е
карбо
новых
кисло
т
-
-
-
-
-
сложн
ые
эфир
ы
амид
ы
Продукты
полного
-
CH3 CH2 Cl
+4
-
-
CH3
+3
-
CH3
H3C
CH3
H2C CH2 H3C HC CH2
+2
CH3
CH-
CH3
Cl
-
CH3
H
C
O
CH3
COCH3
-
-
-
-
-
-
-
-
-
-
-
-
-
-
CH3
Алехина Е.А.
COOH
CH3
CH3
COOC 2H5
CONH 2
-
-
CO2
9.
Изменение степени окисленияуглерода в органических
соединениях
Алехина Е.А.
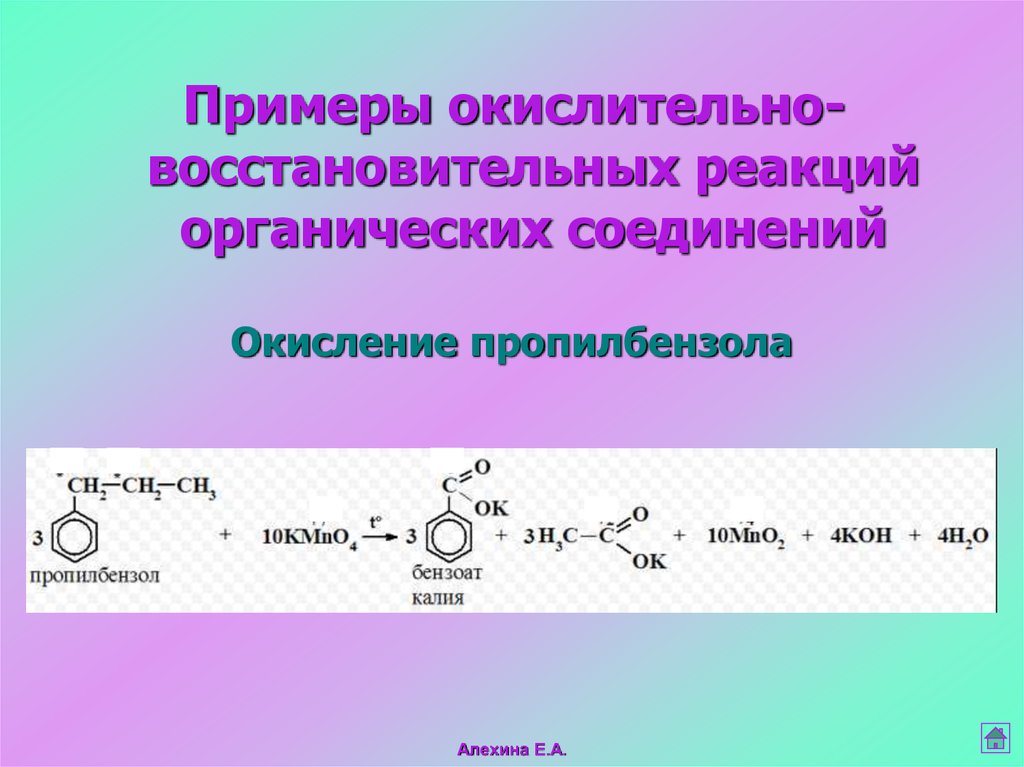
10.
Примеры окислительновосстановительных реакцийорганических соединений
Окисление пропилбензола
Алехина Е.А.
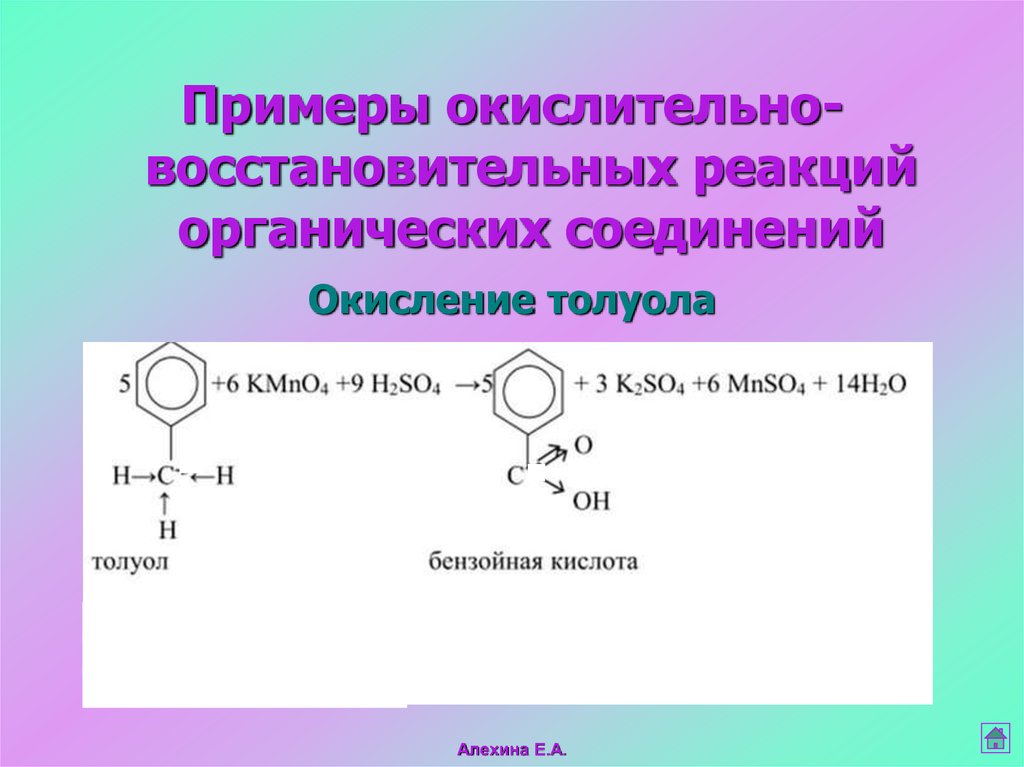
11.
Примеры окислительновосстановительных реакцийорганических соединений
Окисление толуола
Алехина Е.А.
12.
Примеры окислительновосстановительных реакцийорганических соединений
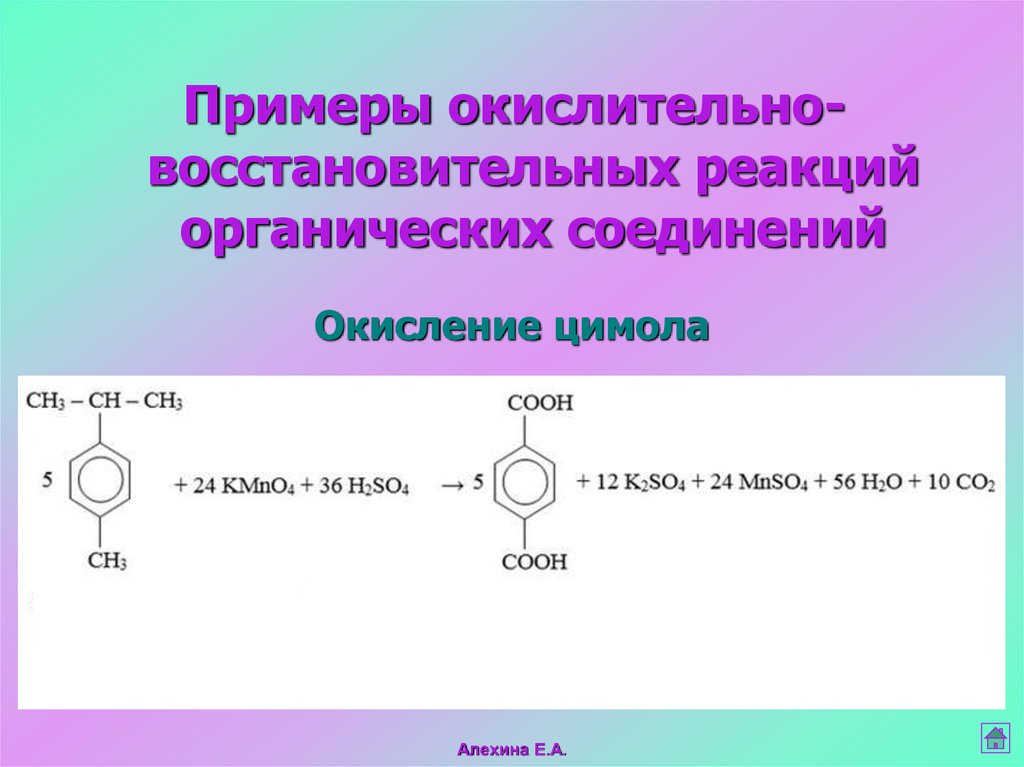
Окисление цимола
Алехина Е.А.
13.
Примеры окислительновосстановительных реакцийорганических соединений
Алехина Е.А.
14.
Примеры окислительновосстановительных реакцийорганических соединений
Алехина Е.А.
15. Реакции окисления
процесс отдачи электронов атомом, молекулойили ионом (по Г.П. Хомченко, с. 168);
-
образование новых связей углерода с более
электроотрицательными элементами (галогены,
кислород, азот, сера, фосфор и др.), но обычно с
кислородом (по А.М. Киму, с. 138);
-
увеличение массовой доли кислорода и
уменьшение массовой доли водорода.
-
Алехина Е.А.
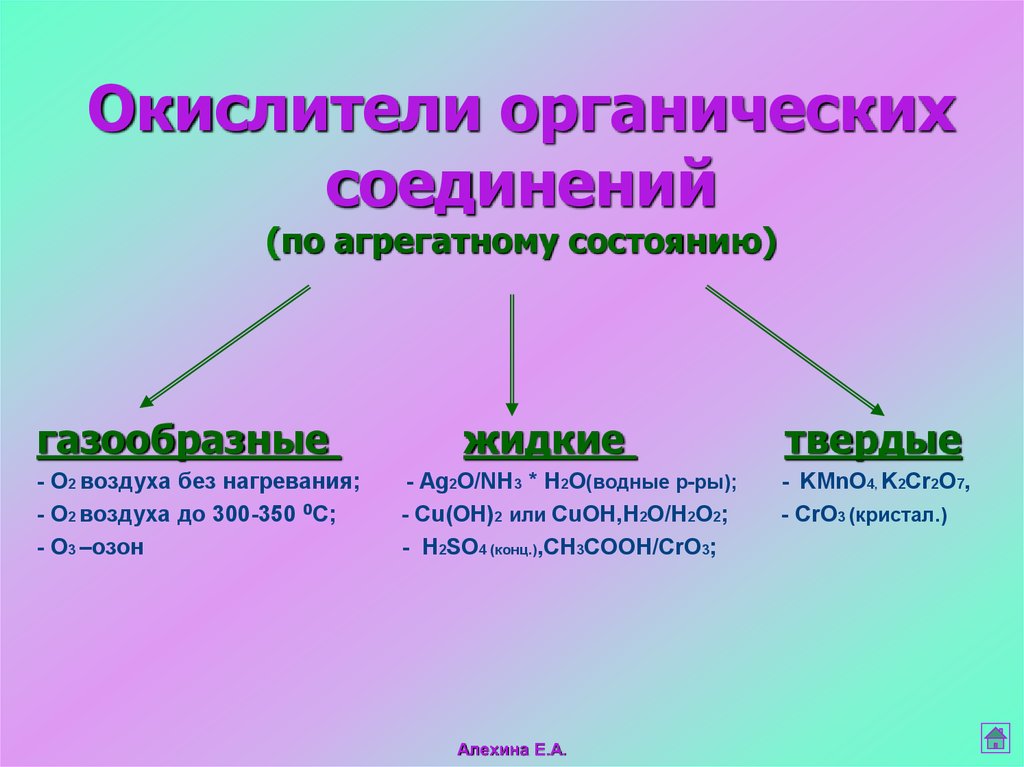
16. Окислители органических соединений (по агрегатному состоянию)
газообразные- O2 воздуха без нагревания;
- O2 воздуха до 300-350 0С;
- O3 –озон
жидкие
- Ag2O/NH3 * H2O(водные р-ры);
- Cu(OH)2 или CuOH,H2O/H2O2;
- H2SO4 (конц.),CH3COOH/CrO3;
Алехина Е.А.
твердые
- KMnO4, K2Cr2O7,
- CrO3 (кристал.)
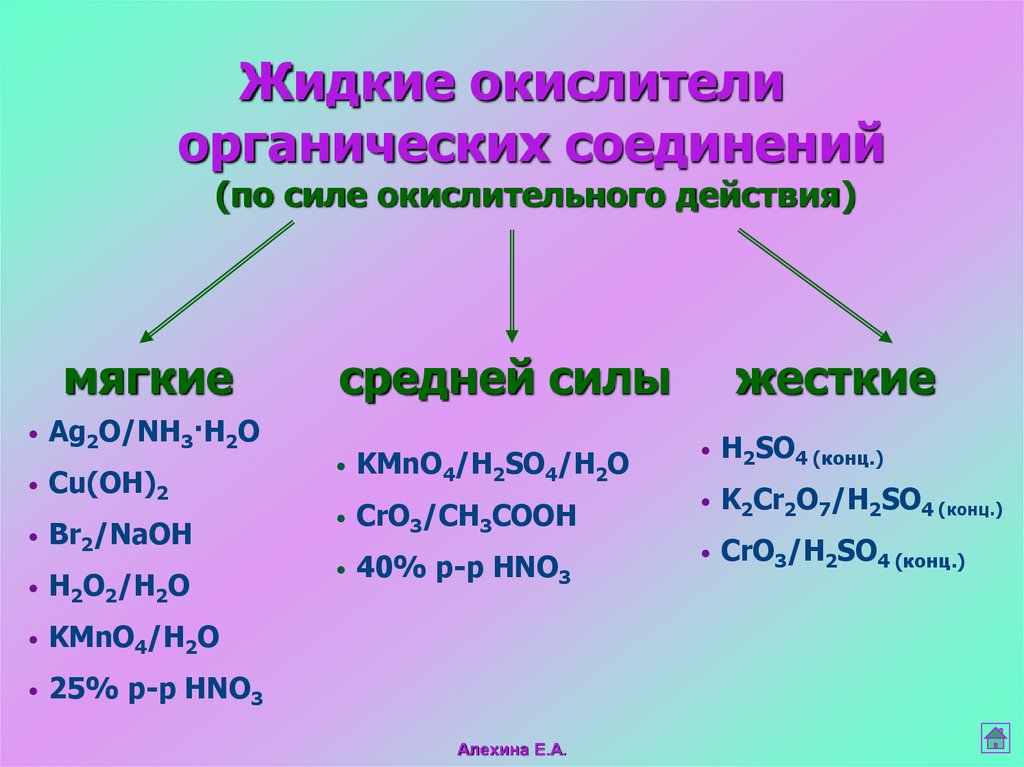
17.
Жидкие окислителиорганических соединений
(по силе окислительного действия)
мягкие
Ag2O/NH3·H2O
Cu(OH)2
Br2/NaOH
H2O2/H2O
KMnO4/H2O
25% р-р HNO3
средней силы
жесткие
KMnO4/H2SO4/H2O
H2SO4 (конц.)
CrO3/CH3COOH
K2Cr2O7/H2SO4 (конц.)
40% р-р HNO3
CrO3/H2SO4 (конц.)
Алехина Е.А.
18.
Классификация реакцийокисления
Горение
При нагревании
происходит
разрыв С-Н, С-С.
Практика
процесса горения
разработана Н.Н.
Семёновым.
Жидкофазное
окисление
Основная цель окисление алканов
до спиртов
предельного ряда.
Твердофазное
окисление
(окислительная деструкция)
наблюдается при
старении
полиолефинов под
действием
атмосферного
кислорода.
Все эти процессы – радикально- цепные,
автокаталитические и разветвленные – имеют единый
механизм реакции
Алехина Е.А.
19.
МЕХАНИЗМЫОКИСЛЕНИЯ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Алехина Е.А.
20.
Радикальный механизмокисления органических
соединений
Инициирование
R R
t
R H
R. + R.
Обрыв цепи
R. + H.
R\ COO.
Рост цепи
R. + O2
ROO. + RH
RH + ROOH
ROO.
.
ROOH + R
R.
R\ . + CO2
ROO.
R\CHO + HO.
HO. + RH
R. + H2O
R O R
R. + RO.
+ RO. + H2O
Алехина Е.А.
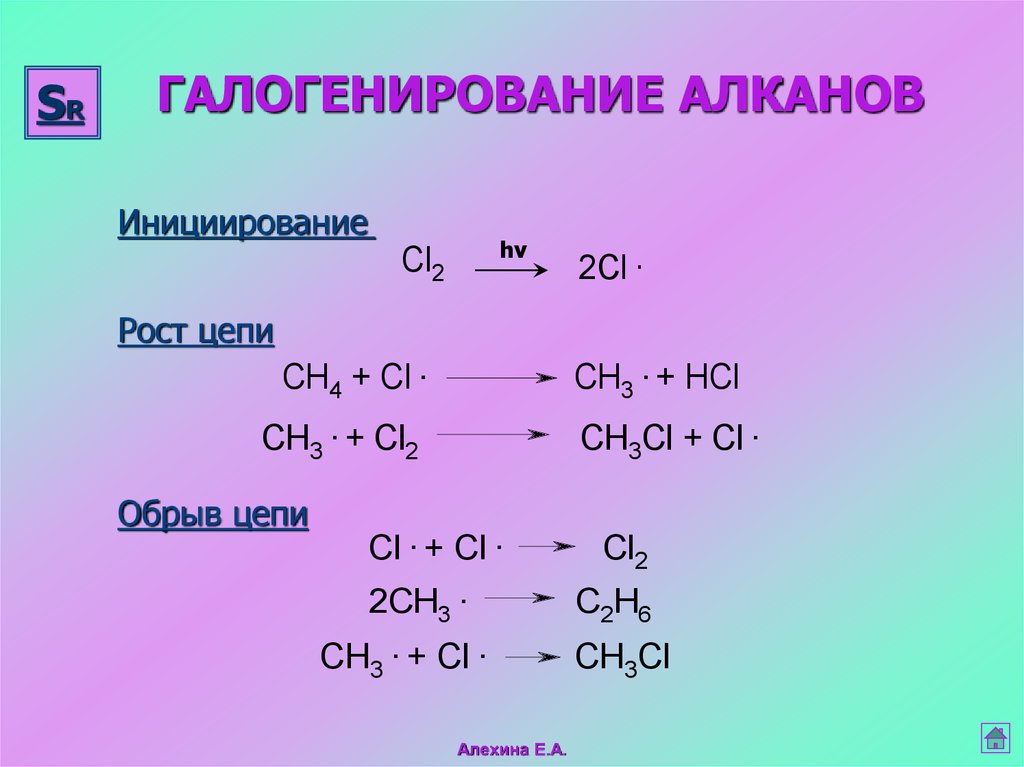
21. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ
SRГАЛОГЕНИРОВАНИЕ АЛКАНОВ
Инициирование
hν
Cl2
2Cl .
Рост цепи
CH4 + Cl .
CH3 . + HCl
CH3 . + Cl2
CH3Cl + Cl .
Обрыв цепи
Cl . + Cl .
2CH3 .
CH3 . + Cl .
Алехина Е.А.
Cl2
C2H6
CH3Cl
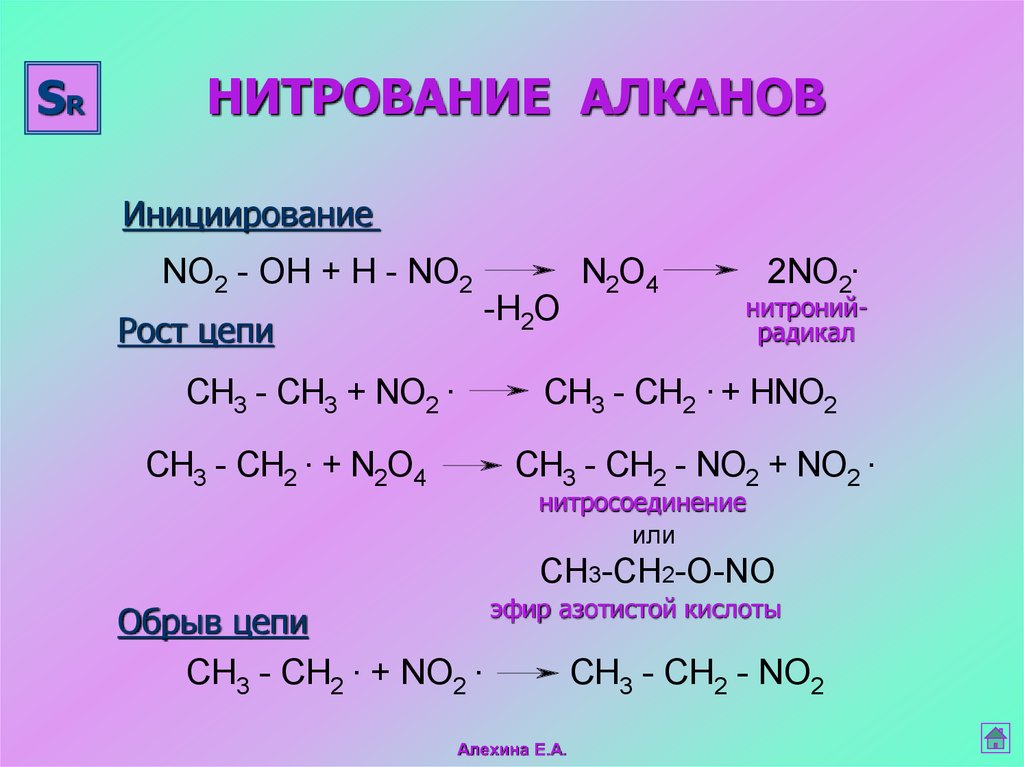
22. НИТРОВАНИЕ АЛКАНОВ
SRНИТРОВАНИЕ АЛКАНОВ
Инициирование
NO2 - OH + H - NO2
Рост цепи
CH3 - CH3 + NO2 .
CH3 - CH2 . + N2O4
-H2O
N2O4
2NO2.
нитронийрадикал
CH3 - CH2 . + HNO2
CH3 - CH2 - NO2 + NO2 .
нитросоединение
или
СH3-СН2-О-NO
эфир азотистой кислоты
Обрыв цепи
CH3 - CH2 . + NO2 .
CH3 - CH2 - NO2
Алехина Е.А.
23. СУЛЬФОХЛОРИРОВАНИЕ АЛКАНОВ
SRСУЛЬФОХЛОРИРОВАНИЕ
АЛКАНОВ
Инициирование
SO2Cl2
Рост цепи
hν
Cl2
hν
2Cl .
SO2 + Cl . + Cl .
R - H + Cl .
R . + HCl
R . + SO2
RSO2 .
RSO2 . + Cl2
RSO2Cl + Cl.
алкилсульфохлорид
Например
СН3-СH3 + SO2 + Cl2 → СН3-СН2-SO2Cl + HCl
этилсульфохлорид
Алехина Е.А.
24. СУЛЬФООКИСЛЕНИЕ АЛКАНОВ
SRСУЛЬФООКИСЛЕНИЕ АЛКАНОВ
I способ
t
R-H + НО-SO3Н → R-SO3H + H2O
алкилсульфокислота
II способ
t
2R-H + 2SO2 + O2 → 2R-SO3H
алкилсульфокислота
Например
t
2СН3-СH3 + 2SO2 + O2 → 2СН3-СН2-SO3H
этилсульфокислота
Алехина Е.А.
25.
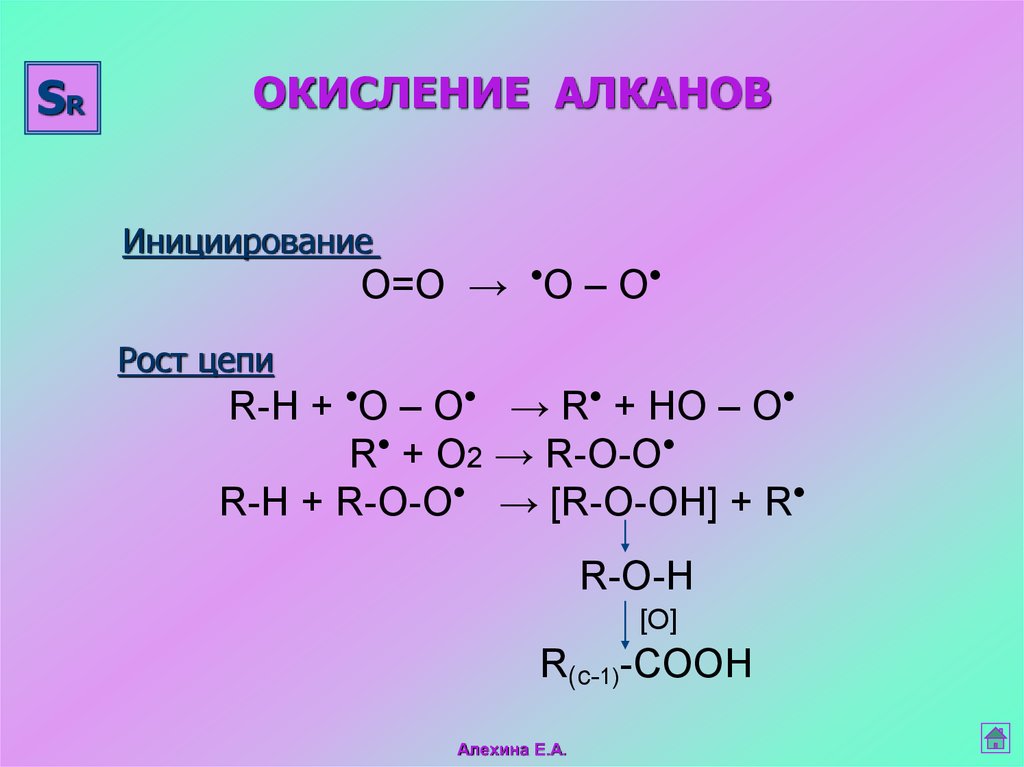
SRОКИСЛЕНИЕ АЛКАНОВ
Инициирование
О=О → О – О
Рост цепи
R-H + О – О → R + HО – О
R + O2 → R-О-O
R-H + R-О-O → [R-О-OН] + R
R-O-H
[O]
R(c-1)-COOH
Алехина Е.А.
26.
ОКИСЛЕНИЕ АЛКАНОВSR
Например
(СН3)3СН + О2 → [(СН3)3С-О-О-Н] → (СН3)3С-ОН
изобутан
гидроперекись изобутана
третбутанол
СН3-СН2-СН2-СН3 + О2 → [СН3-СН(OOH)-СН2-СН3]
н –бутан
гидроперекись вторбутана
→ СН3-СO-СН2-СН3 + H2O
бутанон
Алехина Е.А.
27.
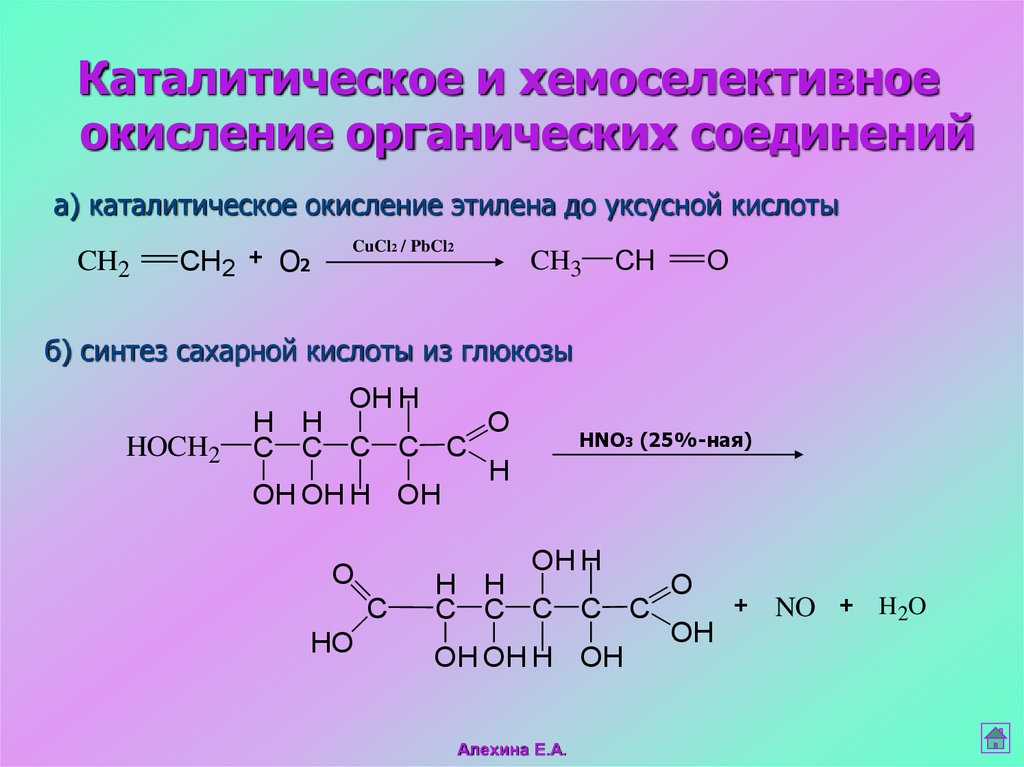
Каталитическое и хемоселективноеокисление органических соединений
а) каталитическое окисление этилена до уксусной кислоты
CH2
CH2
+
О2
CuCl2 / PbCl2
CH3
CH
O
б) синтез сахарной кислоты из глюкозы
OH H
HOCH2
H H
O
C C C C C
H
OH OH H OH
OH H
O
C
HO
HNO3 (25%-ная)
H H
O
C C C C C
OH
OH OH H OH
Алехина Е.А.
+
NO
+
H 2O
28.
Реакции восстановленияпроцесс присоединения электронов атомом,
молекулой или ионом (по Г.П. Хомченко, с. 168);
- образование новых С-Н связей (по А.М. Киму, с.
138);
- увеличение массовой доли водорода и
уменьшение массовой доли кислорода.
-
Гидрогенизация (гидрирование) –
присоединение водорода к различным
веществам (Химия. Большой
энциклопедический словарь, с. 131).
Алехина Е.А.
29.
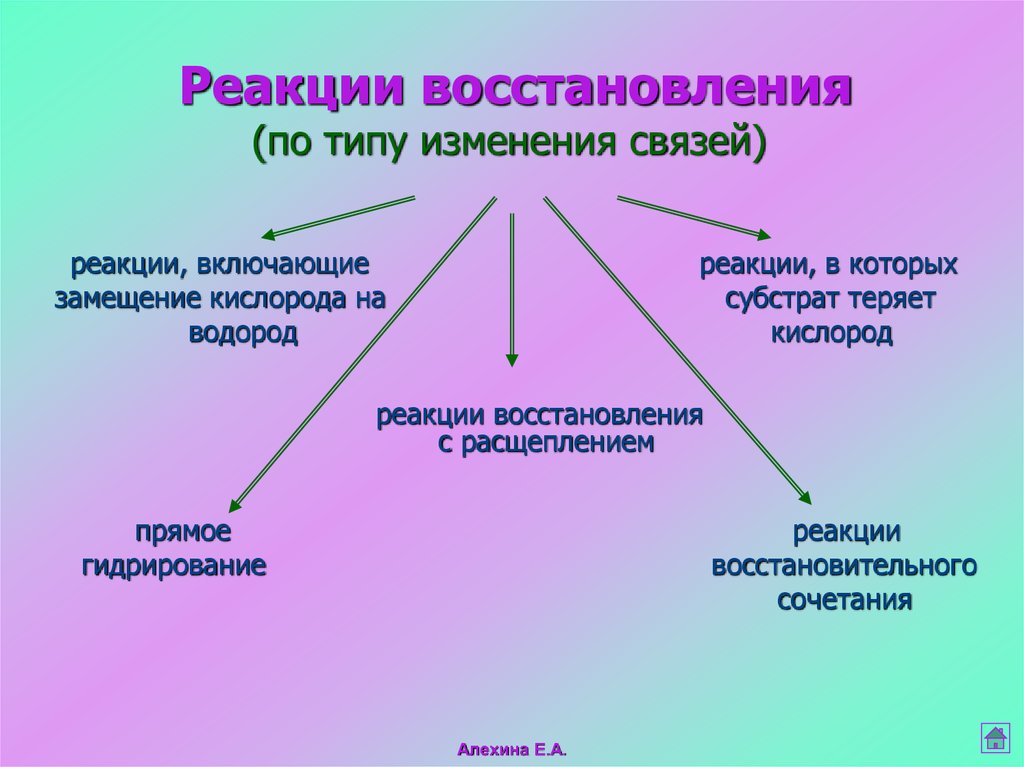
Реакции восстановления(по типу изменения связей)
реакции, включающие
замещение кислорода на
водород
реакции, в которых
субстрат теряет
кислород
реакции восстановления
с расщеплением
прямое
гидрирование
реакции
восстановительного
сочетания
Алехина Е.А.
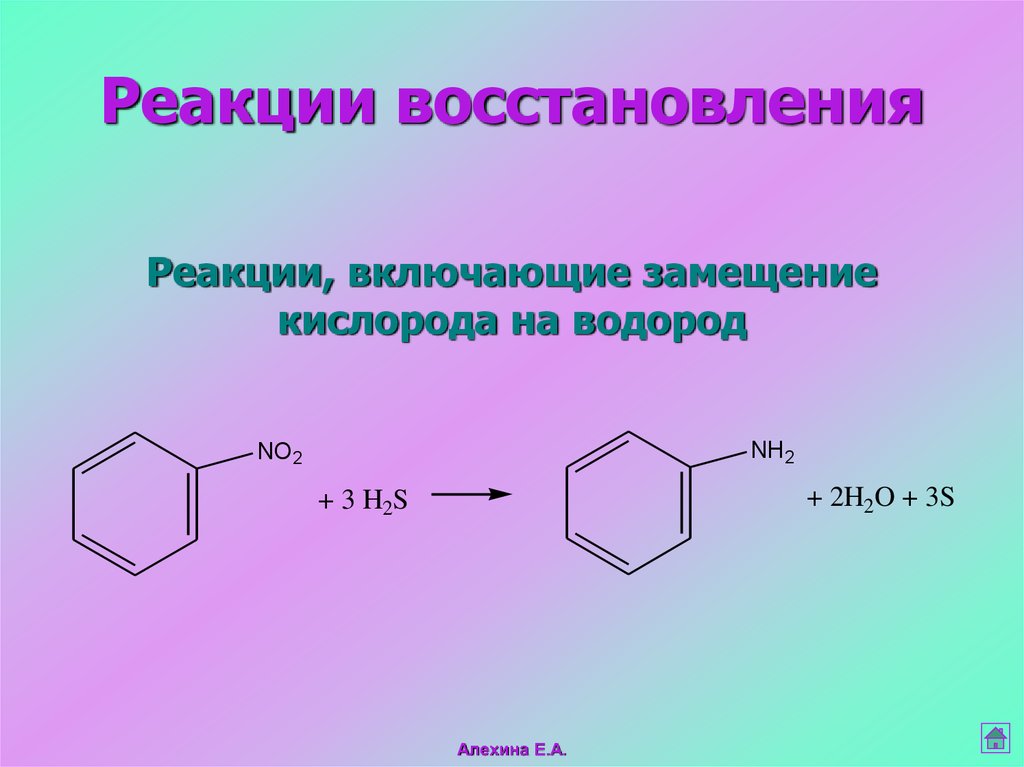
30. Реакции, включающие замещение кислорода на водород
Реакции восстановленияРеакции, включающие замещение
кислорода на водород
NH 2
NO 2
+ 2H2O + 3S
+ 3 H2S
Алехина Е.А.
31.
Реакции восстановленияРеакции, в которых субстрат теряет
кислород
(CH2)3SiCl, Zn
O
Алехина Е.А.
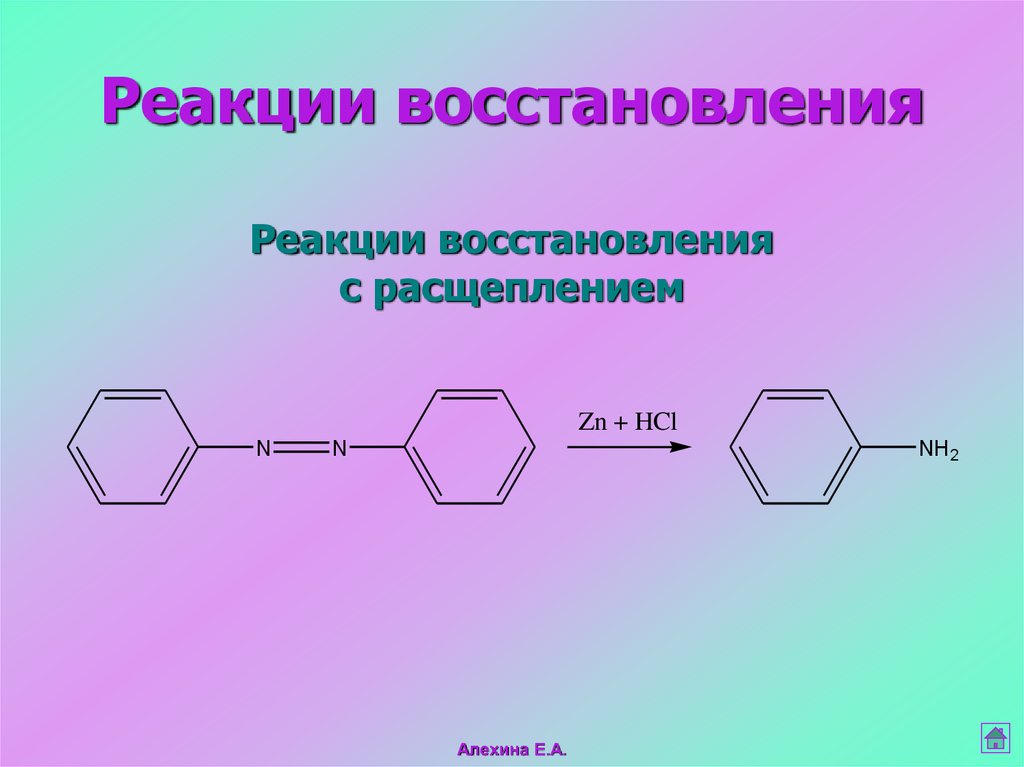
32. Реакции восстановления с расщеплением
Реакции восстановленияРеакции восстановления
с расщеплением
Zn + HCl
N
N
NH2
Алехина Е.А.
33.
Реакции восстановленияРеакции восстановительного сочетания
R
R
C
O
+ NH2
NH2
C
R
R
NH2
R
R
CNH2 O C+ NH
O2
NH2
NH2
R
N
R
RR
NH2 2N
+CNH
C
R
R
R
RR
NH
NH
C
N
22
OCC + ON
NH2+ NH
NH
NH
22 2
RR
R
Алехина Е.А.
R
C C
NH2N O
NH2
RR
R
NH
+ 2 NH2
C
NC
R
R
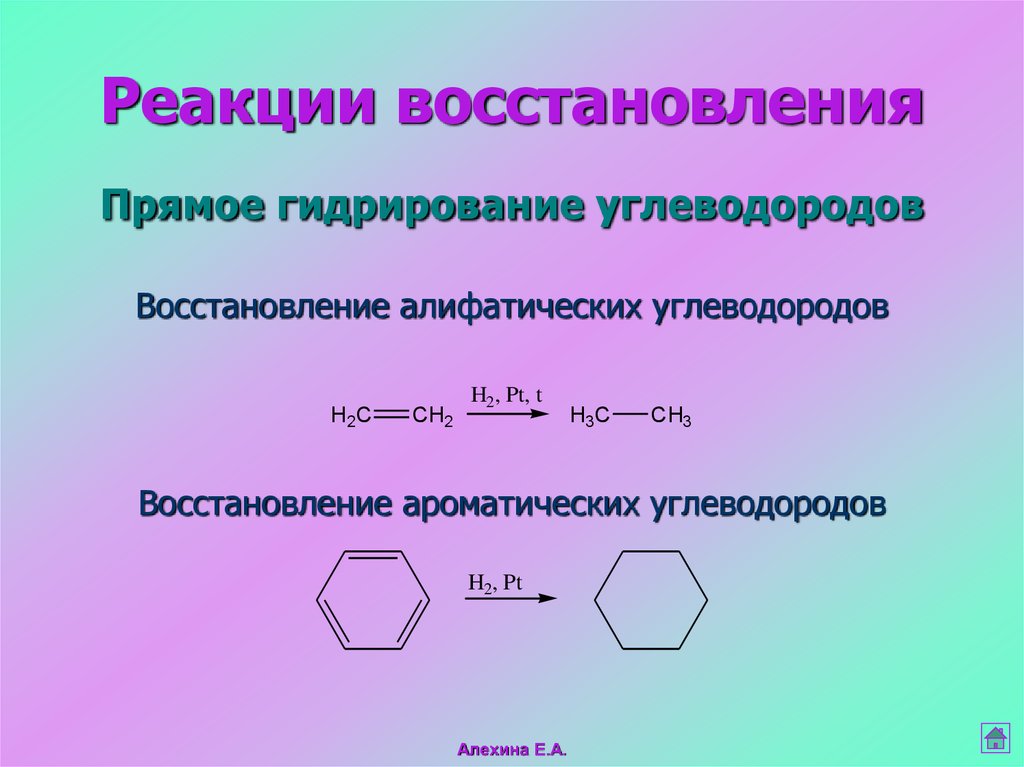
34. Прямое гидрирование углеводородов
Реакции восстановленияПрямое гидрирование углеводородов
Восстановление алифатических углеводородов
H2C
CH2
H2, Pt, t
H3C
CH3
Восстановление ароматических углеводородов
H2, Pt
Алехина Е.А.
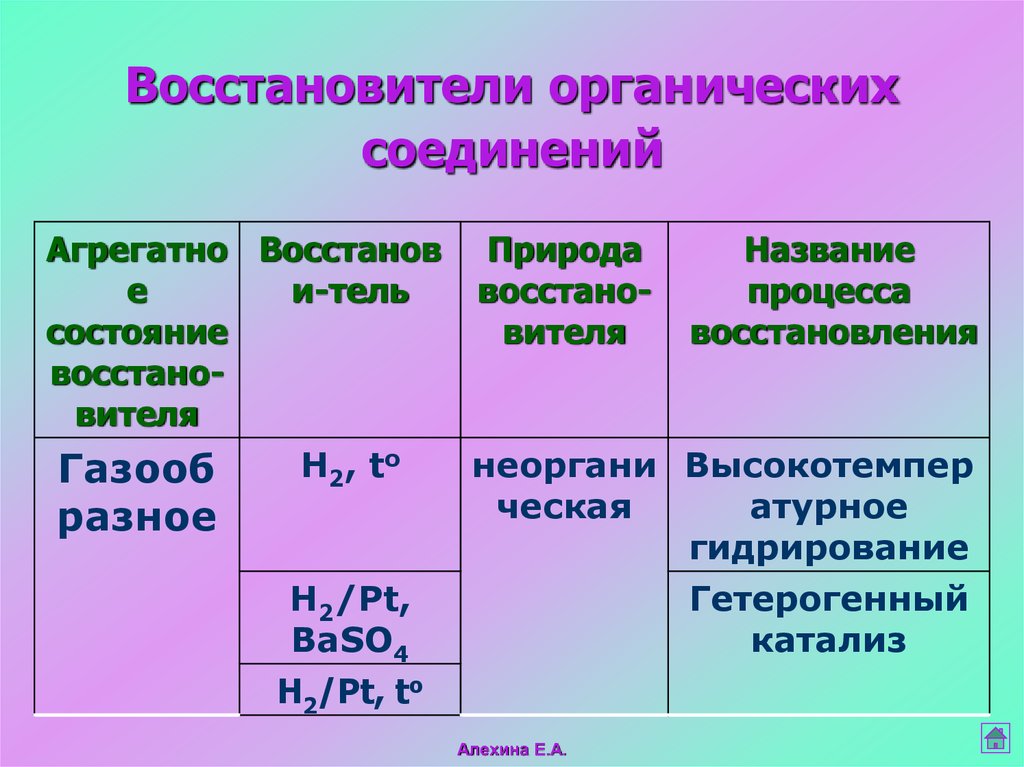
35. Восстановители органических соединений
Агрегатно Восстанов ПриродаНазвание
е
и-тель
восстанопроцесса
состояние
вителя
восстановления
восстановителя
Н2, to
неоргани Высокотемпер
Газооб
ческая
атурное
разное
гидрирование
H2/Рt,
Гетерогенный
BaSO4
катализ
H2/Рt, to
Алехина Е.А.
36.
Агрегатноесостояние
восстанови
теля
Восстановит
ель
Природа
восстановите
ля
Название процесса
восстановления
Жидкое
RbCl3 +3(C6H5)3P
+ C2H5OH, to
смешанная
Гомогенный
катализ
Na + C2H5OH
Na + C4H9OH
Zn + HCl,
неорганическая
Zn + CH3COOH
смешанный
Na(Hg) + HCl
неорганическая
Водородом
в
момент
выделения
Амальгамами металлов
Zn(Hg) + HCl,
Амальгамами металлов
Na/NH3 (ж)
Раствор металла
в сжиженном газе
HI (I2 + P + H2O)
Раствором йодоводородной кислоты
Алехина Е.А.
37.
Агрегатное Восстановит Природасостояние
ель
восстанови
восстанови
теля
теля
Жидкое
Твердое
H2N-NH2
органическая
Название процесса
восстановления
Восстановление
гидразином
H2N-OH
Восстановление
гидроксиламином
H2N-NH-C6H5
Восстановление
фенилгидразином
LiAlH4
неорганическ
ая
Алюмогидридами
щелочных металлов
Боргидридами
щелочных металлов
NaBH4
Алехина Е.А.
38. МЕХАНИЗМЫ ВОССТАНОВЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Алехина Е.А.39.
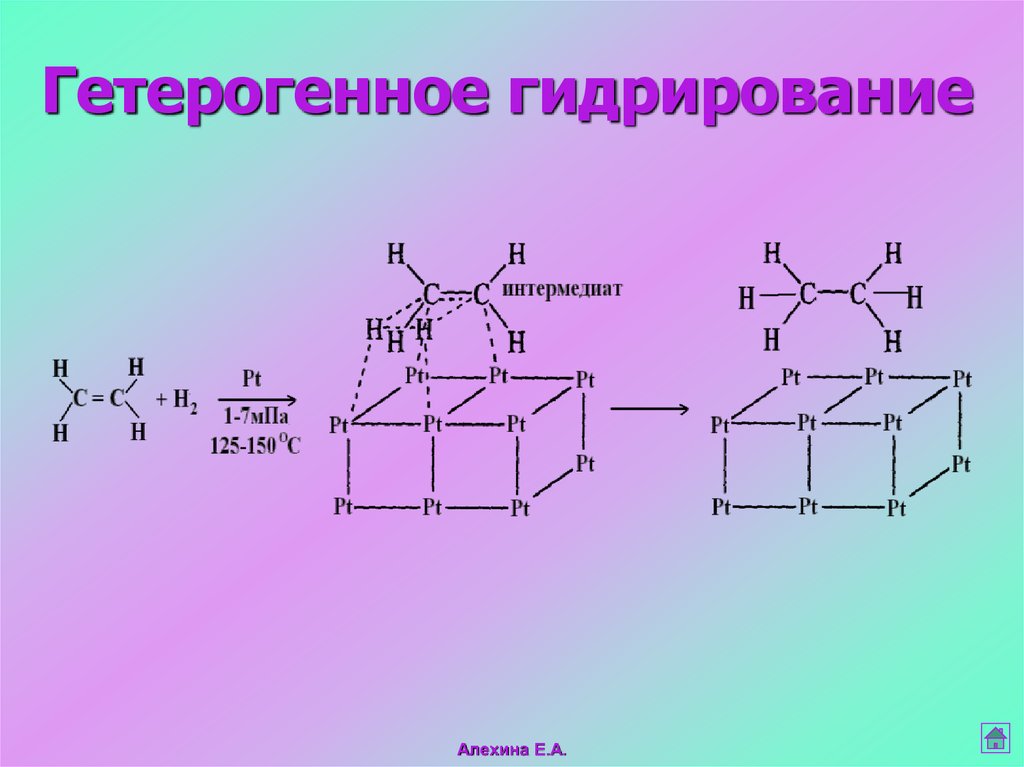
Гетерогенное гидрированиеАлехина Е.А.
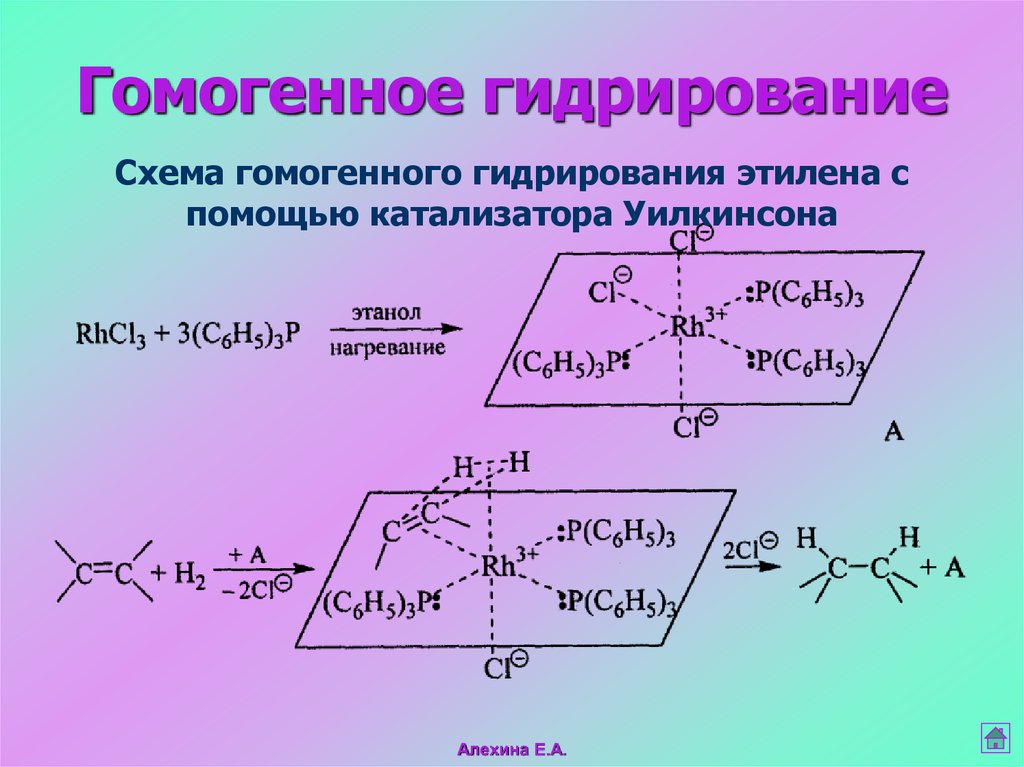
40.
Гомогенное гидрированиеСхема гомогенного гидрирования этилена с
помощью катализатора Уилкинсона
Алехина Е.А.
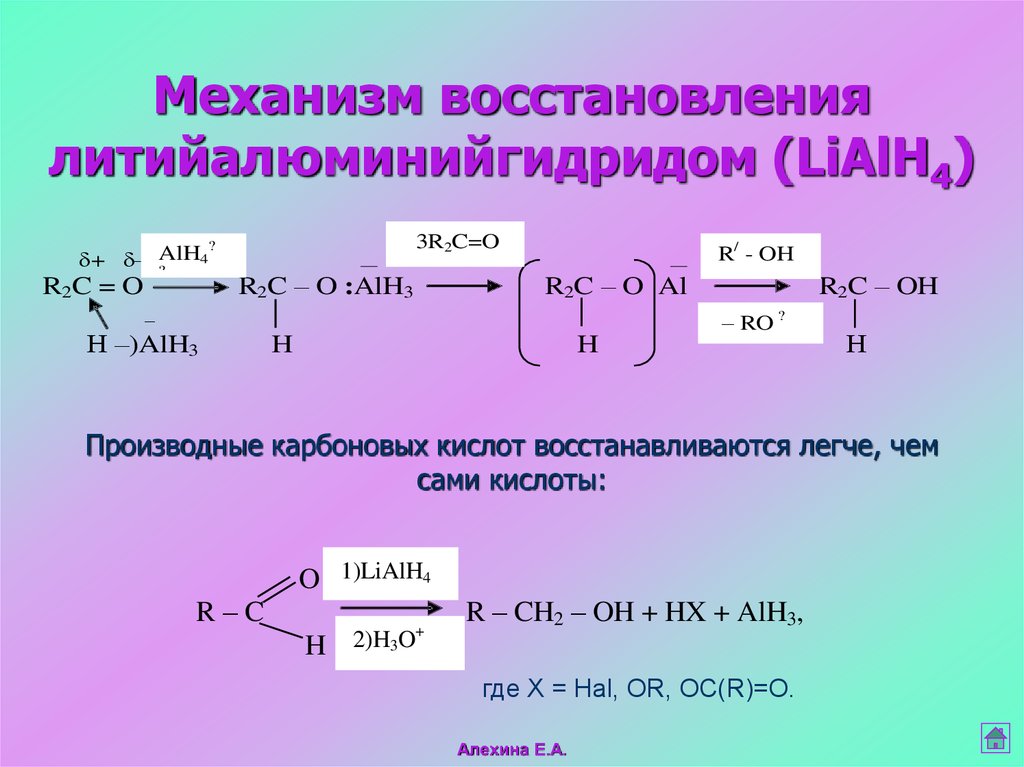
41. Механизм восстановления литийалюминийгидридом (LiAlH4)
?4
+ -AlH
?
R2C = O
3R2C=O
R2C – O :AlH3
R2C – O Al
R2C – OH
– RO ?
–
Н –)AlH3
R/ - OH
H
H
Н
Производные карбоновых кислот восстанавливаются легче, чем
сами кислоты:
O 1)LiAlH4
R–C
+
R – CH2 – OH + HX + AlH3,
H 2)H3O
где Х = Hal, OR, OC(R)=O.
Алехина Е.А.
42. Восстановление органических соединений амальгамами металлов
Амальгамами называют сплавы жидкой ртути сметаллами – Zn, Co, Rb, Sn, Cu, Na, Ba. Их
получают:
а) прямым контактом металла и ртути, лучше при
нагревании;
б) электролизом водных и неводных растворов солей;
в) электролизом низкотемпературных расплавов на
ртутном катоде;
г) контактным обменом между ионами металлов и
амальгамами других металлов.
Амальгамы могут оставаться жидкими или затвердевают
Алехина Е.А.
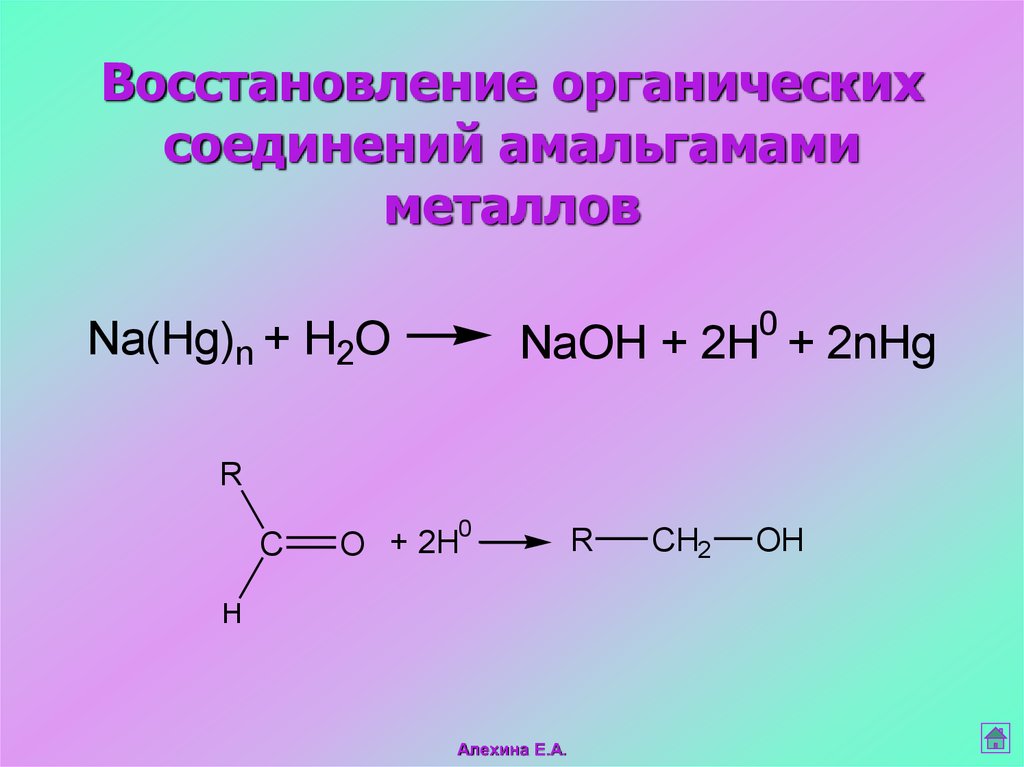
43. Восстановление органических соединений амальгамами металлов
0Na(Hg)n + H2O
NaOH + 2H + 2nHg
R
C
0
O + 2H
H
Алехина Е.А.
R
CH2
OH
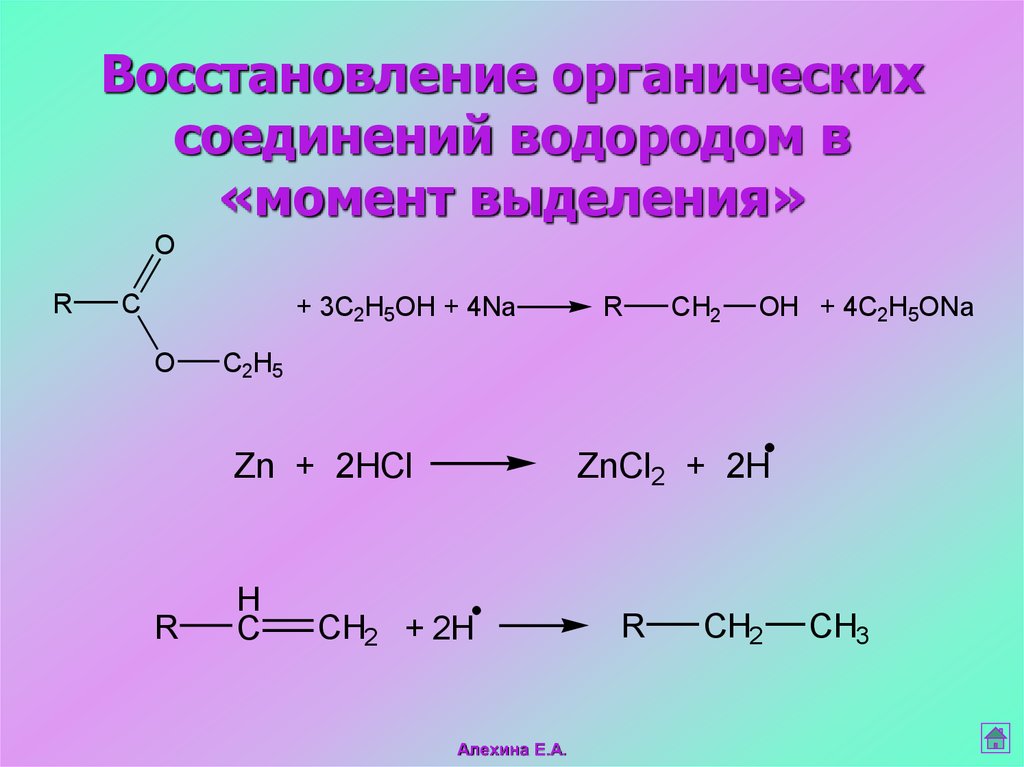
44. Восстановление органических соединений водородом в «момент выделения»
OR
C
+ 3C2H5OH + 4Na
O
CH2
OH + 4C2H5ONa
C2H5
Zn + 2HCl
R
R
H
C
ZnCl2 + 2H
CH2 + 2H
Алехина Е.А.
R
CH2
CH3
45.
Литература1. Ким А.А. Органическая химия. – Новосибирск: Сибирское универ.изд-во, 2001. – 814 с.
2. Козловский М.Т. и др. Амальгамы и их применение. – Алма-Ата: Наука, 1971. – 365 с.
3. Коршунов В.Н. Амальгамные системы: строение и электрохимические свойства. – М.:
Изд-во МГУ, 1990. – 201 с.
4. Макквелен Ф.Дж. Гомогенное гидрирование в органической химии. Пер. с англ. – М.:
Химия, 1988. – 160 с.
5. Марч Дж. Органическая химия. – М.: Мир, 1987-1988, т.4. – 468 с.
6. Мастекс К. Гомогенный катализ переходных металлов.–М.: Мир, 1983. – 304 с.
7. Матье Ж., Панико Р. Курс теоретических основ органической химии. Пер. с англ. – М.:
Мир, 1975. – 556 с.
8. Нечаев А.П. Органическая химия. – М.: Высшая школа, 1988. – 319с.
9. Сайкс П. Механизмы реакций в органической химии.– М.: Химия, 1991. – 448 с.
10.Смирнов В.А. Восстановление амальгамами. – Л.: Химия, 1971. – 228 с.
11.Шабаров Ю.С. Органическая химия: в 2-х томах. – М.: Химия, 1996. – Т.1. - 848 с.
12.Шалыгин С.П., Алехина Е.А., Романенко Н.В. Реакции окисления в органической
химии. // Химия в школе, 2006, № 1, с. 54-59.
13.Шалыгин С.П., Алехина Е.А. Реакции восстановления в органической химии. // Химия
в школе, 2006, № 9, с. 60-65.
14.Шалыгин С.П., Алехина Е.А. Механизмы восстановления органических соединений. //
Химия в школе, 2007, № 10, с. 52-56.
15.Шульпин Г.Б. Органические реакции, катализируемые комплексами металлов. – М.:
Наука, 1988. – 285 с.
Алехина Е.А.
























 Химия
Химия








