Похожие презентации:
Металлы II группы главной подгруппы
1. Металлы II группы главной подгруппы
Учитель МБОУ «ОСОШ № 2»Москвитина И.В.
2. Металлы II группы главной подгруппы Цель: Дать общую характеристику металлам II группы (А) главной подгруппы П.С.Х.Э.
Д.И.Менделеева.ЗАДАЧИ УРОКА:
Рассмотреть
электронное строение
атомов
Изучить физические и химические
свойства металлов II А группы
Формировать умение записывать
химические свойства в виде
уравнений
3.
Положение металлов в Периодическойсистеме
Изменение свойств в группе
История названия
Нахождение в природе
Физические свойства
Химические свойства
Закрепление
4. Металлы II группы главной подгруппы
BеMg
Ca
Sr
Ba
Rа
бериллий
магний
кальций
стронций
барий
радий
5. Щелочноземельные металлы: Mg Ca Sr Ba Rа
Происхождение этого названия связано с тем, чтоих гидроксиды являются щелочами, а оксиды по
тугоплавкости сходны с оксидами алюминия и
железа, носившими ранее общее название "земли"
Rа - редкий радиоактивный элемент, 40т
минерала карналлита содержит 1г радия.
6. Строение атома
MgCa
Sr
Ba
+12
+20
+38
+56
2ē, 8ē, 2ē
2ē, 8ē, 8 ē, 2ē
2ē, 8ē, 18 ē, 8ē, 2ē
2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Что общего в атомном строении ?
7.
Бериллий, магний и щелочноземельныеметаллы находятся в IIA-группе
Строение внешнего энергетического
уровня ns2
Максимальная степень окисления +2
Валентность - II
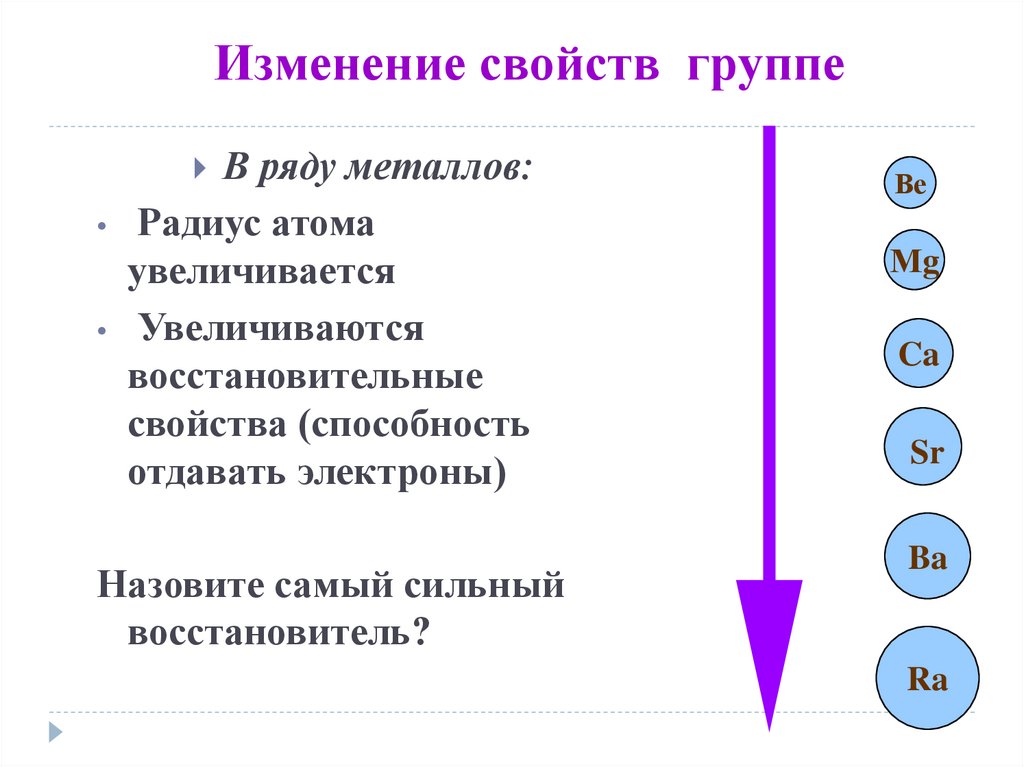
8. Изменение свойств группе
В ряду металлов:Радиус атома
увеличивается
Увеличиваются
восстановительные
свойства (способность
отдавать электроны)
Назовите самый сильный
восстановитель?
Ве
Мg
Ca
Sr
Ba
Ra
9.
Физические свойстваКальций - твердый и
пластичный
Магний - относительно
мягкий, пластичный,
9
ковкий
Щелочные металлы легкие,
мягкие и легкоплавкие,
серебристы, стронций
имеет золотистый оттенок.
Бериллий - светлосерый, твердый,
хрупкий
Стронций ковкий
10. Физические свойства
цвет пламениMg
Ca
Sr
Ba
þ
1,74г/см3
t плавления
651 С0
1,54г/см3
851С0
2,63г/см3
770С0
3,76г/см3
710С0
11. ОТКРЫТИЕ МЕТАЛЛОВ
Магний и кальций быливпервые получены
английским химиком и
физиком Г. Дэви в 1808 г.
Магний из белой магнезии.
По названию минерала дали
название элементу.
Название элемента кальций
происходит от лат. Слова
кальс, что означает «известь,
мягкий камень».
Гемфри Дэви
(1778 – 1829)
12.
Нахождение в природеКак активные металлы, они
встречаются в природе только в виде
соединений
Кальциевые горные породы –
известняк, мрамор, мел.
Магниевая горная порода –
магнезит.
13. MgCO3
Карбонат магния - широко применяется в производствестекла, цемента, кирпича, а также в металлургии для
перевода пустой породы в шлак.
14. В природе: CaCO3
Карбонат кальция – одно из самых распространённых на Земле соединений.Его содержат горные породы – мел, мрамор, известняк. Природный мел представляет собой остатки раковин древних животных используется при
производстве зубной пасты, школьного мела. Известняк – используется в
строительстве как прекрасный строительный камень и как сырьё для
получения: цемента, гашеной и негашеной извести, стекла. Мрамор минерал скульпторов, архитекторов и облицовщиков. Из него создавал свои
творения Микеланджело, стены всемирно известного индийского мавзолея
Тадж-Махал выложены из мрамора, им же облицованы многие станции
московского метро.
15. CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса,представляющего собой кристаллогидрат – сульфата кальция.
Используется в строительстве, в медицине для наложения
гипсовых повязок, для получения слепков.
16. MgSO4
Сульфат магния - известный под названием горькая, илианглийская, соль, используют в медицине в качестве
слабительного. Содержится в морской воде и придаёт
ей горький вкус
17. Ca3(PO4)2
Фосфат кальция - входит в состав фосфоритов (горная порода) иапатитов (минерал), а также в состав костей и зубов. В организме
взрослого человека содержится более 1 кг Са в виде фосфата
кальция.
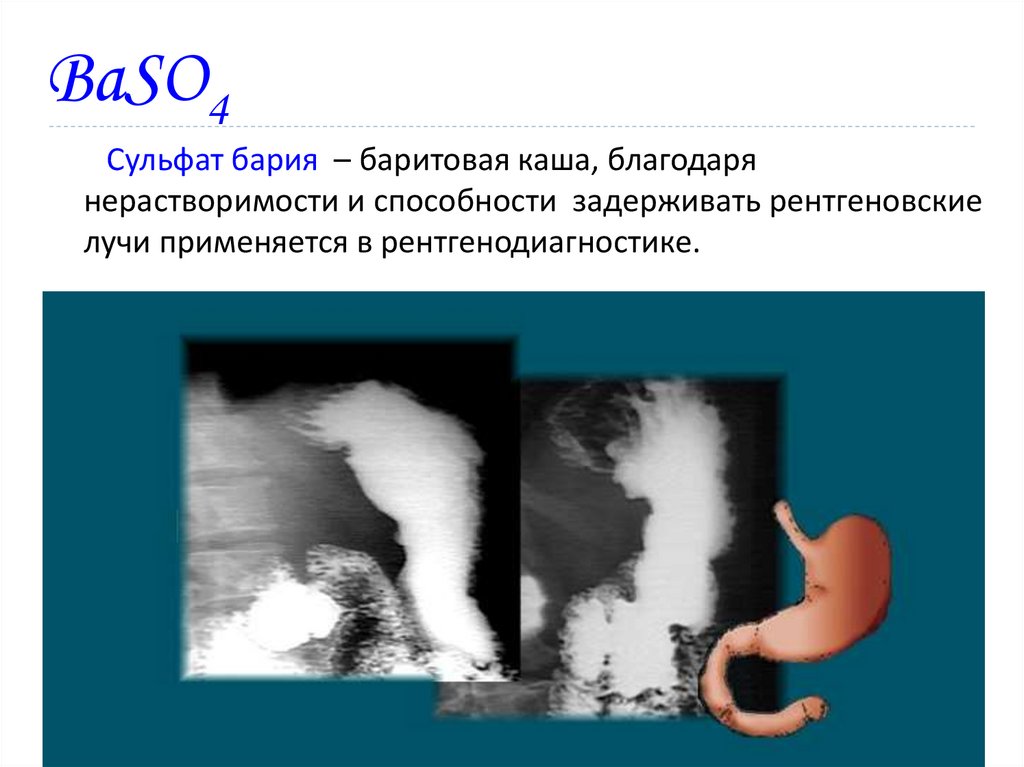
18. BaSO4
Сульфат бария – баритовая каша, благодарянерастворимости и способности задерживать рентгеновские
лучи применяется в рентгенодиагностике.
19. Са(ОН)2
Гидроксид кальция или гашеная известь называется известковымраствором, образуется при взаимодействии оксида кальция с
водой, реакция сопровождается большим количеством тепла.
Прозрачный раствор Са(ОН)2 называют известковой водой, а белую
взвесь в воде известковым молоком. Гашеную известь широко
используют в строительстве. Известковое молоко применяют в
сахарной промышленности для очистки свекловичного сока. При
нагревании Са(ОН)2 разлагается на оксид и воду.
20. Химические свойства
2Me0 + O02 → 2Me+2O-2 оксидMe0 + H02
→ Me+2H2
гидрид
Me0 +Cl02 → Me+2Cl2 хлорид
Me0 + N02 → Me3+2N-32 НИТРИД
Me0 + S0 → Me+2S-2 сульфид
Me0 + 2HCl → Me+2Cl2 + H2
Me0 + 2H2O → Me+2(OH)2 + Н2
гидроксид
вывод
21. Особенность бериллия:
Бериллий – переходный элементБериллий и его соединения проявляют амфотерные
свойства, реагируют с кислотами и щелочами
Ве + 2НСl = ВеСl 2 + Н2
Ве + 2NаОН = Nа2ВеО2 + Н2
Практически не взаимодействует с водой
Ве + Н2О =(реакция не идёт)
т.к. препятствует защитная плёнка на его поверхности
22. Проверка знаний (Самостоятельная работа)
Запишите конкретные уравнения реакции, напримере кальция, расставьте
коэффициенты методом электронного
баланса
а) Са + S = _______
г) Са + С12 = ______
б) Са + N2 = _______ д) Са + Н 2 О = ______
в) Са + Н 2 = _______
____
23. Домашнее задание:
§ 12. упр. № 3, 4,5.24. Итог урока
Познакомилисьс металлами II группы главной
подгруппы П.С.Х.Э. Д.И.Менделеева
Узнали общую характеристику металлов II
группы главной подгруппы
Рассмотрели электронное строение атомов
Изучили физические и химические свойства
Узнали о важнейших соединениях этих металлов
и области их применения
25. Используемая литература
Габриелян О.С. Химия 9.-Москва.:Дрофа, 2013Габриелян О.С., Остроумов И.Г. Настольная книга учителя.
Химия 9. -Москва: Дрофа 2010
Габриелян О.С. Контрольные и проверочные работы. Химия 9.
-Москва.:Дрофа, 2011.
26. Спасибо за внимание
27. Проверь себя (самостоятельная работа )
Решить задачу №1 стр.67Дано:
Решение:
ω (костей) = 0,2
пусть m(организма) =50 кг
ω (Са 3(РО 4) 2 = 0,2
m (костей) = m(организма) . ω (костей) =
Найти:
m (Са 3(РО 4) 2 - ?
m (Са) - ?
50 кг . 0.2=10 кг.
m (Са 3(РО 4) 2 = m (костей) . ω (Са 3(РО 4) 2=
10 . 0,2 = 2кг
М(Са 3(РО 4) 2 =40 . 3 +(31+18+ 16 . 4)2=310г/ моль
в 310 г содержится 120 г
x
2000г -----------------
Г

























 Химия
Химия








