Похожие презентации:
Метаболическая инженерия
1. Метаболическая инженерия
1Метаболическая инженерия
J. Villadsen, J. Nielsen, G.Liden. Bioreaction engineering principles,
Springer, 2011
E. Klipp, W.Liebermeister, C. Wierling, A.Kowald, H.Lehrach, R.Herwig.
Systems Biology, Wiley-VCH Verlag GmbH & Co. KGaA, 2009.
Безбородов А.М. Ферментативные процессы в биотехнологии / А.М.
Безбородов, Н.А. Загустина, В.О. Попов; Ин-т биохимии им. А.Н. Баха
РАН. – М.: Наука, 2008. – 335 с.
O. Demin, I.Goryanin. Kinetic modeling in Systems Biology, Chapman and
Hall/CRC, 2008.
Бирюков В.В. Основы промышленной биотехнологии. / В.В. Бирюков
М.: КолосС, 2004. – 296 с.
Дж. Бейли, Д. Оллис. Основы биохимической инженерии. Пер с англ. В
2-х частях. Ч. 1. / М.: Мир, 1989. – 692 с.
Дж. Бейли, Д. Оллис. Основы биохимической инженерии. Пер с англ. В
2-х частях. Ч. 2. / М.: Мир, 1989. – 692 с.
2. Управление технологическими режимами периодических и полупериодических процессов
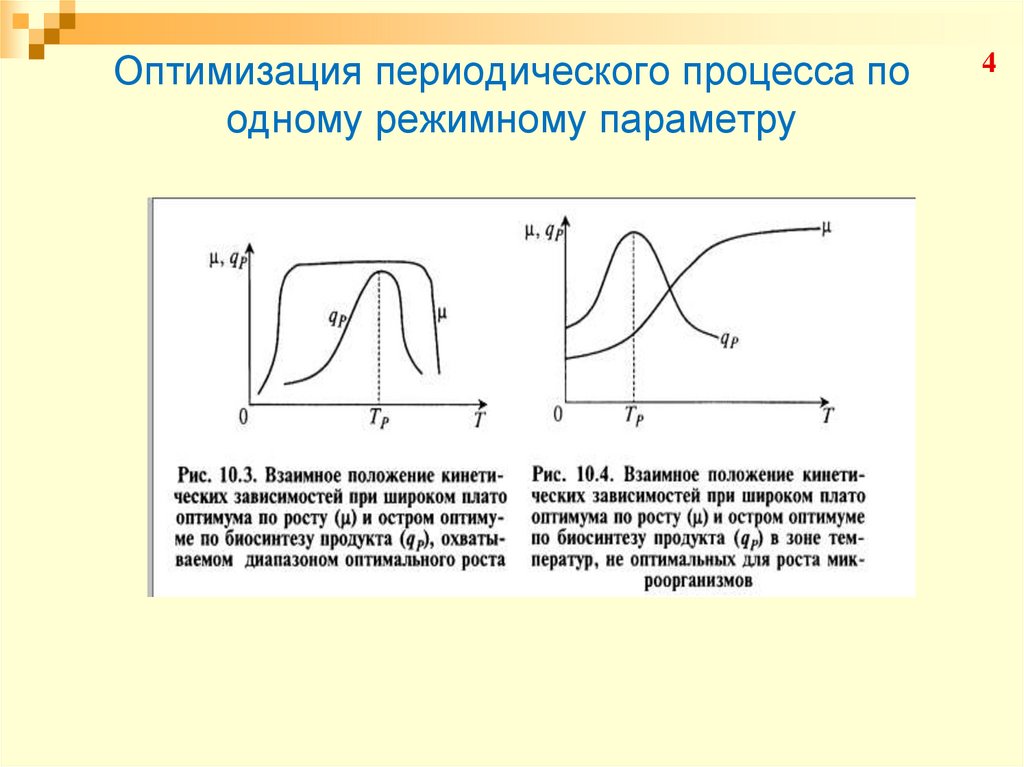
23. Оптимизация периодического процесса по одному режимному параметру
34. Оптимизация периодического процесса по одному режимному параметру
45. Оптимизация периодического процесса по одному режимному параметру
56. Оптимизация периодического процесса по одному режимному параметру
Конкординатными называются факторы, для которыхположение оптимума биосинтеза продукта
метаболизма находится в зоне, оптимальной и для
роста биомассы м/о
Дискординатными называются факторы, для которых
оптимум по биосинтезу продуктов метаболизма не
совпадает с оптимумом для роста м/о
6
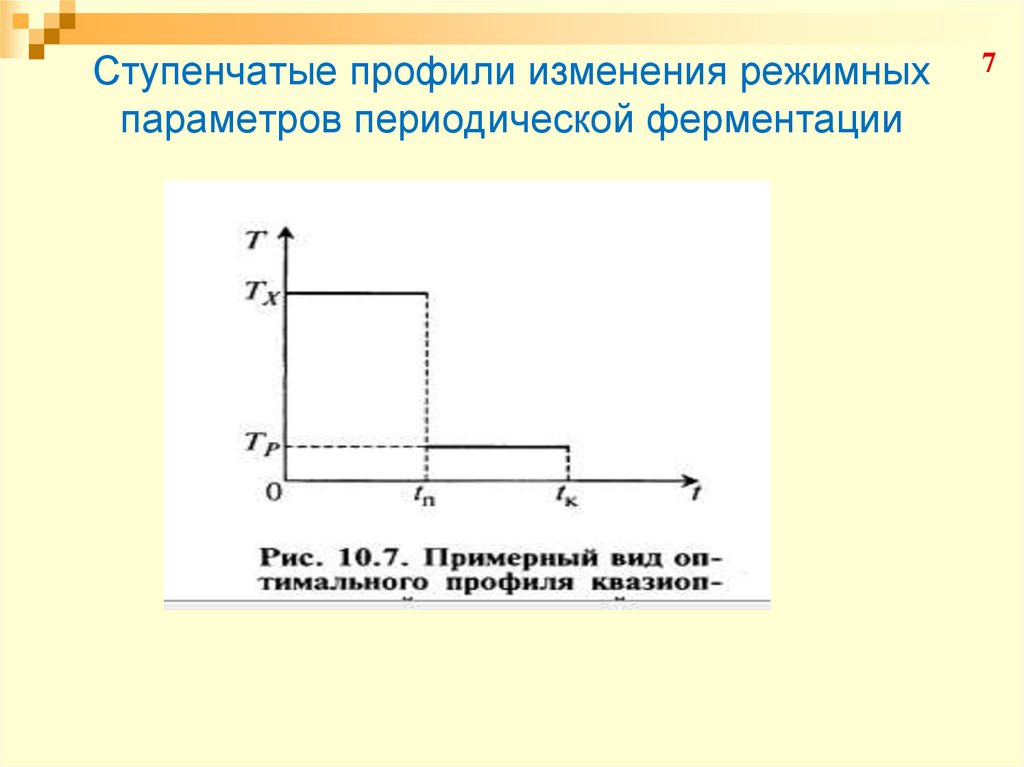
7. Ступенчатые профили изменения режимных параметров периодической ферментации
78. Ступенчатые профили изменения режимных параметров периодической ферментации
89. Ступенчатые профили изменения режимных параметров периодической ферментации
При (t = tк):В первом периоде ферментации (при t > tп):
В точке переключения (при t = tп):
9
10. Ступенчатые профили изменения режимных параметров периодической ферментации
При (t > tк) рост биомассы подчиняетсявыражению:
При t = tк :
10
11. Ступенчатые профили изменения режимных параметров периодической ферментации
Расчет квазиоптимальной программы управления:11
12. Ступенчатые профили изменения режимных параметров периодической ферментации
Расчет квазиоптимальной программы управления:12
13. Ступенчатые профили изменения режимных параметров периодической ферментации
Расчет квазиоптимальной программы управления:13
14. Особенности регулирования концентрации субстрата в периодических и полупериодических процессах
1415. Особенности регулирования концентрации субстрата в периодических и полупериодических процессах
1516. Косвенные методы управления в процессах с подпиткой
Заранее рассчитывается программа u(t) измененияподпитки во времени, и субстрат подается в аппарат без
информации о том, с какой скоростью его потребляется
культура (может привести как к избытку, так и недостатку
субстрата в среде);
Субстрат подается по одному из косвенных параметров,
связанных с ростом культуры. Это может быть величина
рН, концентрация растворенного кислорода,
интенсивность дыхания (подобно рН-стату, оксистату и
респиростату).
Процесс с подпиткой субстратом не может продолжаться сколь угодно
долго (объем жидкости возрастает). В этом случае переходят к
процессу с чередованием отбора части жидкости из аппарата с
продолжением подпитки между отборами (процесс ферментации с
повторяющимися попдитками «repeatead fed-batch»)
16
17. Оптимизация времени завершения периодической ферментации
Средняя продуктивность процесса:17
18. Оптимизация времени завершения периодической ферментации
Способы, при которых можно улучшить ход процессаферментации:
изыскание более продуктивного штамма-продуцента;
поддержание в ходе процесса ферментации оптимальной
концентрации субстрата;
поддержание в ходе процесса ферментации оптимальных
значений температуры и величины рН (не обязательно на
постоянном уровне, а меняя их по определенной программе);
поддержание в ходе процесса оптимального режима по
параметрам аэрации – концентрации в среде растворенного
кислорода и растворенного углекислого газа;
поддержание оптимального режима перемешивания
ферментационной жидкости в аппарате.
18
19. Преимущества и недостатки периодических и полупериодических процессов ферментации
Преимущества:малая стоимость аппарата и системы управления;
гибкость – возможность наработки в одном реакторе разных
продуктов;
процесс менее подвержен инфицированию и мутациям клеток
из-за отсутствия протока и притока и из-за относительно
малого времени процесса ферментации;
процесс удобен для получения малых количеств продукта;
условия культивирования можно поддерживать в оптимуме
как в фазе роста биомассы, так и в фазе биосинтеза
продукта (оптимальные условия биомассы и продукта могут
быть различны);
процесс удобен для реализации биосинтеза вторичных
метаболитов.
19
20. Преимущества и недостатки периодических и полупериодических процессов ферментации
Недостатки:необходимость приготовления посевного материала;
велико непродуктивное время ферментации;
в связи с необходимостью частой стерилизации быстрее
изнашиваются измерительные приборы, особенно датчики
величины рН);
производительность по биомассе и продукту часто ниже, чем
в непрерывном процессе;
труднее поддерживать необходимые параметры из-за
нестационарности периодического процесса;
процесс более опасен для персонала ( аппарат чаще
открывают, моют, что сопряжено с контактом человека с
м/о и продуктами их жизнедеятельности.
20
21. Кинетика процессов ферментации
21Кинетика процессов ферментации
Кинетика процессов ферментации изучает закономерности
изменения скорости роста м/о и биосинтеза продуктов
метаболизма в зависимости от текущих концентраций субстратов,
биомассы, продуктов метаболизма, температуры и рН
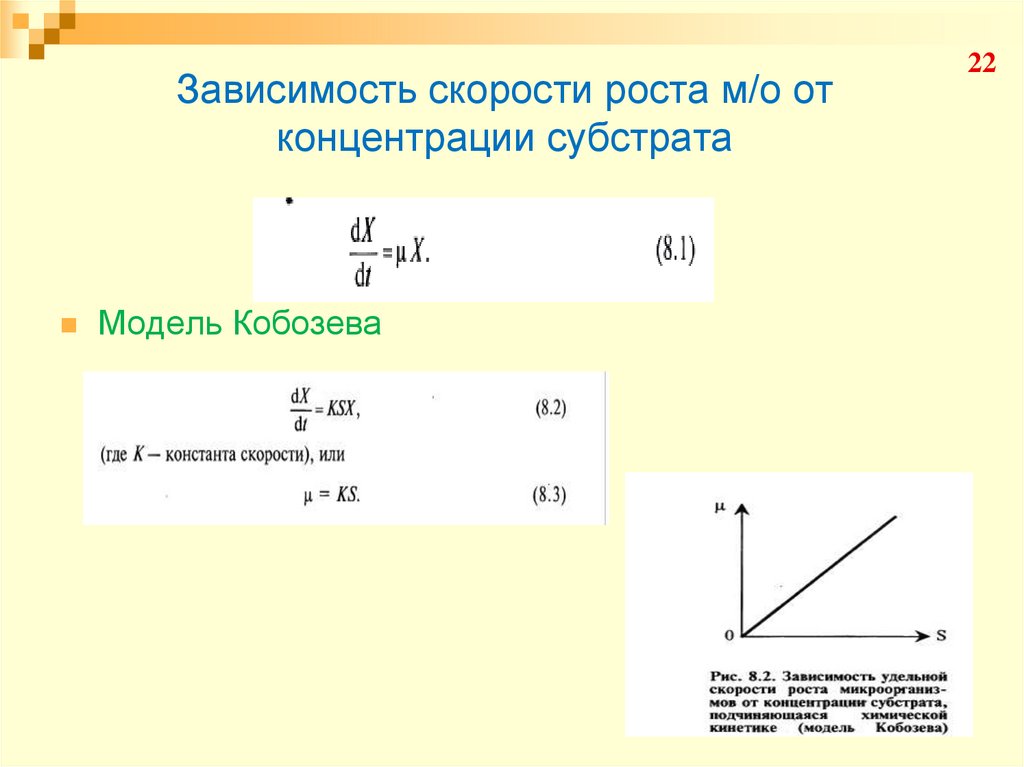
22. Зависимость скорости роста м/о от концентрации субстрата
Модель Кобозева22
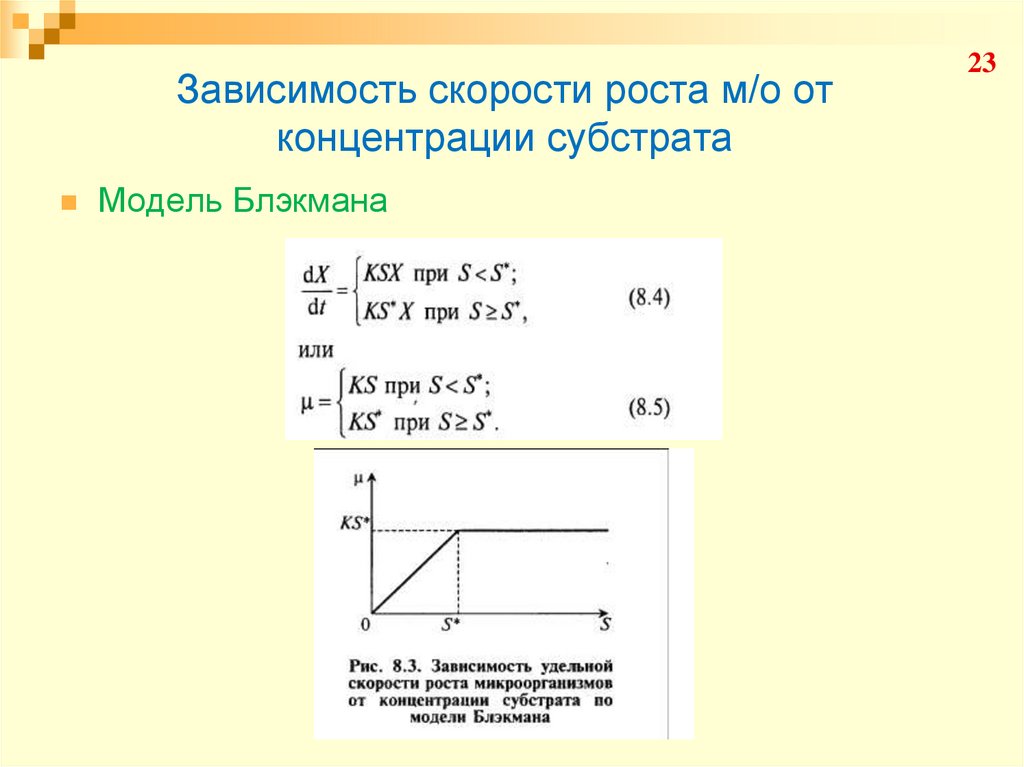
23. Зависимость скорости роста м/о от концентрации субстрата
Модель Блэкмана23
24. Зависимость скорости роста м/о от концентрации субстрата
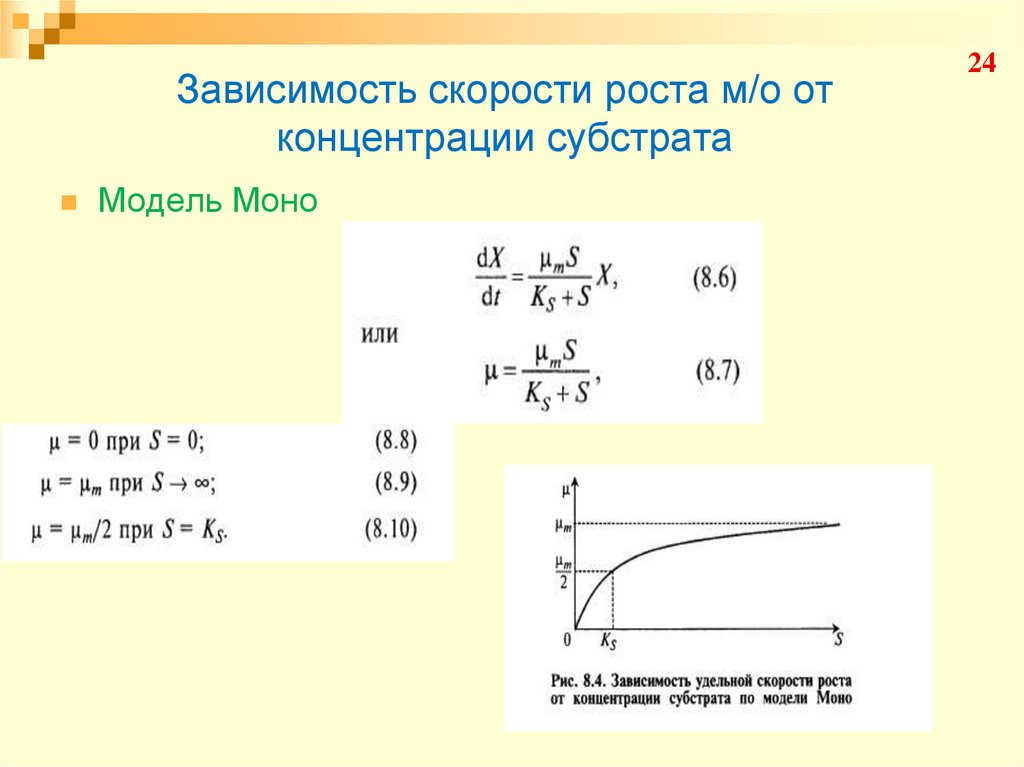
Модель Моно24
25. Зависимость скорости роста м/о от концентрации субстрата
Модель Моно25
26. Зависимость скорости роста м/о от концентрации субстрата
Модель Моно26
27. Зависимость скорости роста м/о от концентрации субстрата
Модель Мозера27
28. Зависимость скорости роста м/о от концентрации субстрата
Модель Перта:28
29. Зависимость скорости роста м/о от концентрации субстрата
Модель Андрюса:29
30. Зависимость скорости роста м/о от концентрации субстрата
Модель Андрюса:30
31. Зависимость скорости роста м/о от концентрации субстрата
Модель Андрюса:31
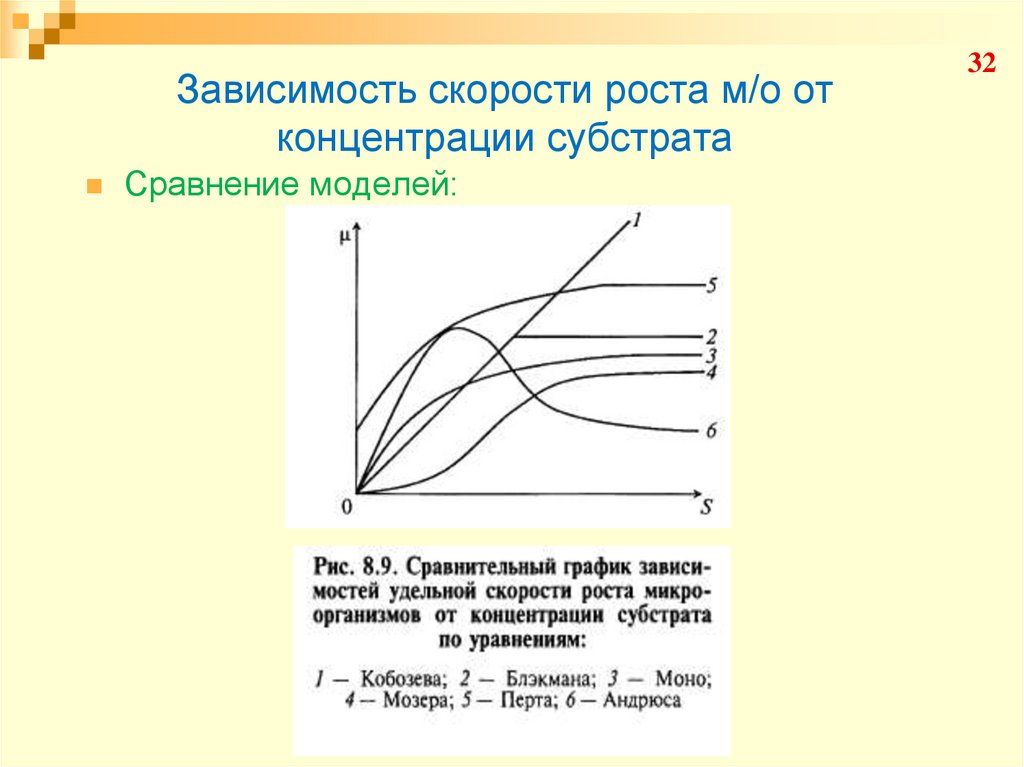
32. Зависимость скорости роста м/о от концентрации субстрата
Сравнение моделей:32
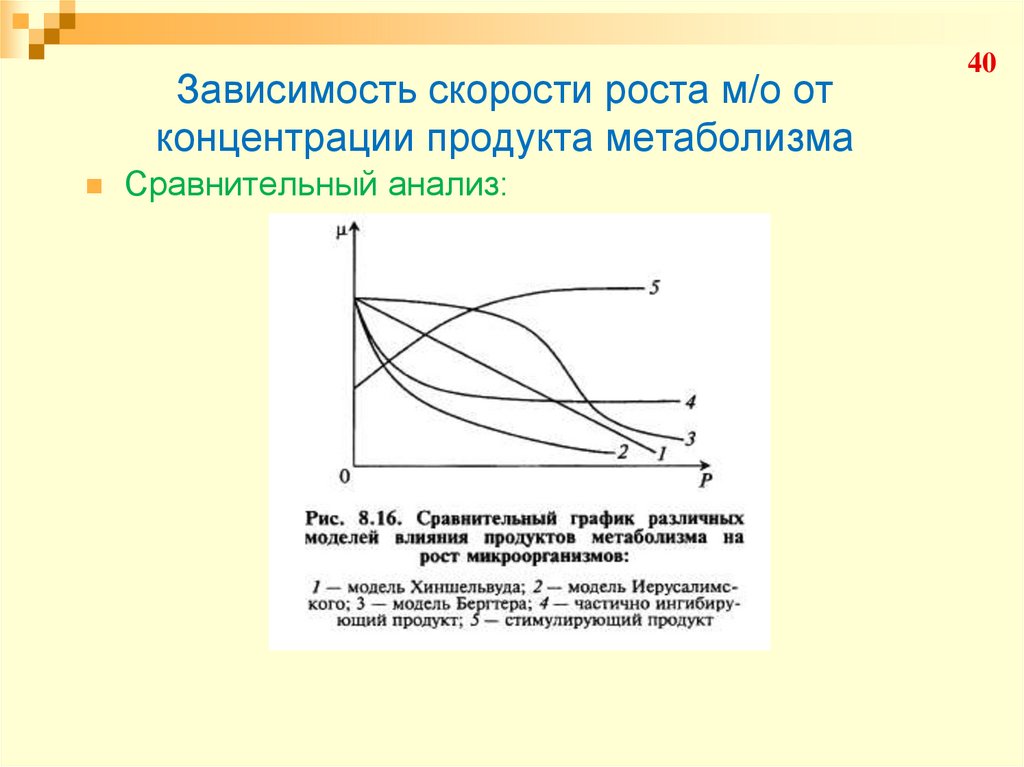
33. Зависимость скорости роста м/о от концентрации продукта метаболизма
Модель Хишельвуда:33
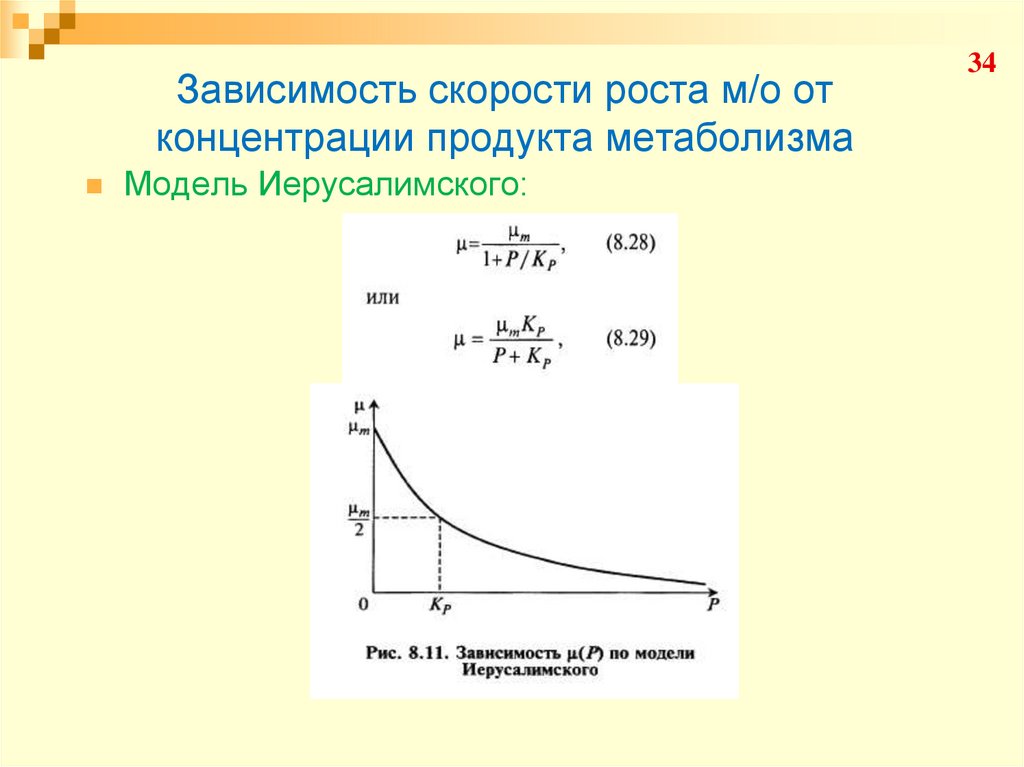
34. Зависимость скорости роста м/о от концентрации продукта метаболизма
Модель Иерусалимского:34
35. Зависимость скорости роста м/о от концентрации продукта метаболизма
Модель Иерусалимского:35
36. Зависимость скорости роста м/о от концентрации продукта метаболизма
Модель Иерусалимского:36
37. Зависимость скорости роста м/о от концентрации продукта метаболизма
Модель Бергтера:37
38. Зависимость скорости роста м/о от концентрации продукта метаболизма
Частично ингибирующий продукт:38
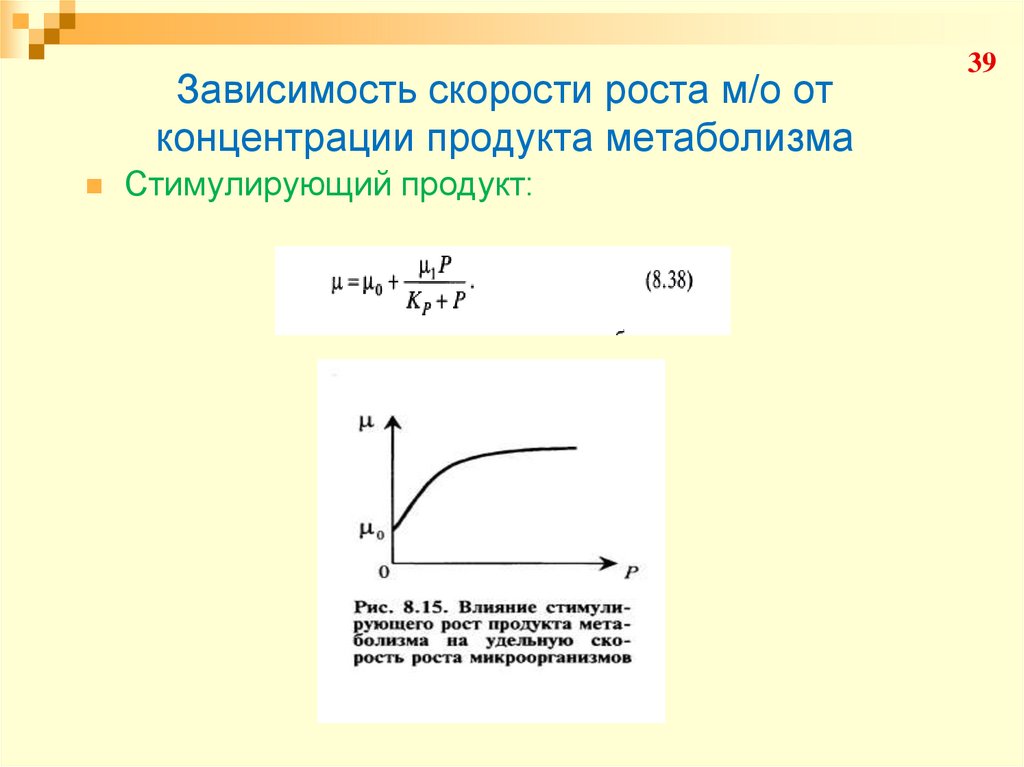
39. Зависимость скорости роста м/о от концентрации продукта метаболизма
Стимулирующий продукт:39
40. Зависимость скорости роста м/о от концентрации продукта метаболизма
Сравнительный анализ:40
41. Многофакторные кинетические уравнения
1.«Многосубстратные» уравнения:
Мультипликативные уравнения – функция является
произведением многофакторных зависимостей
Каждый фактор автономен и может иметь свою
собственную зависимость (один субстрат по Моно, а
второй – с ингибированием по Андрюсу):
41
42. Многофакторные кинетические уравнения
«Многосубстратные» уравнения:2. Аддитивные уравнения – многофакторная функция
является суммой однофакторных:
3. Альтернативные уравнения – многофакторная
зависимость подчиняется принципу кинетического
минимума:
Уравнение показывает, что для каждого субстрата
существует зависимость μ(Si), когда лимитирующим
фактором является только этот субстрат
42
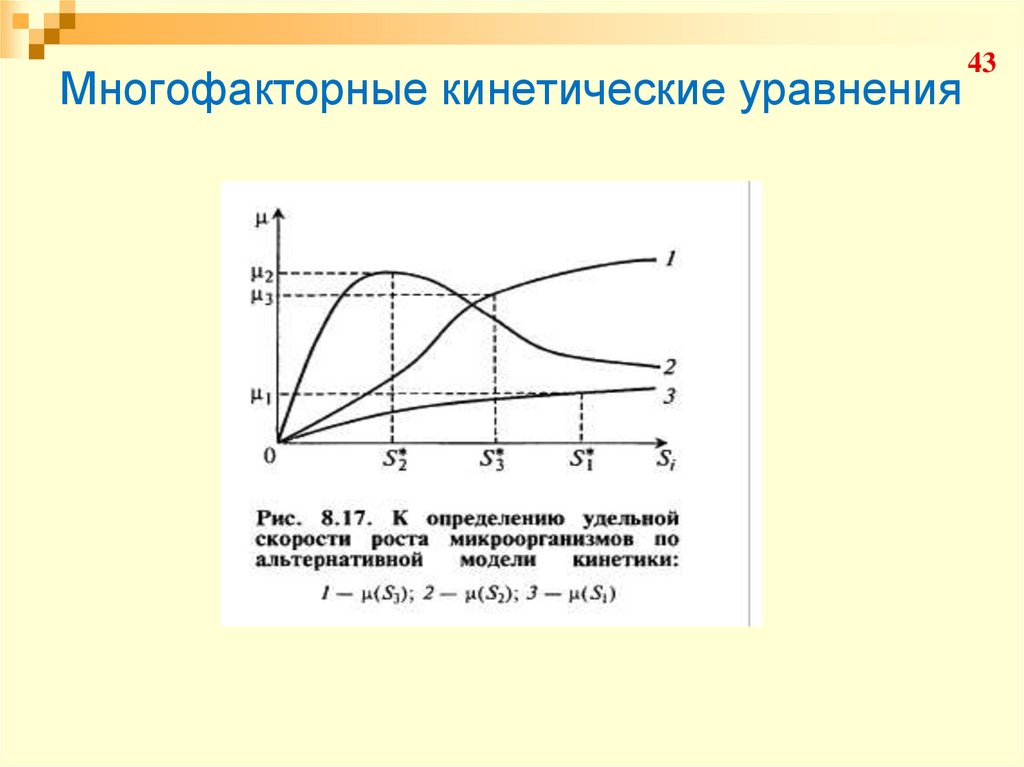
43. Многофакторные кинетические уравнения
4344. Многофакторные кинетические уравнения
«Многосубстратные» уравнения:4. Уравнения с неразделяющими переменными.
Существует уравнение конкурентного торможения
вторым субстратом:
44
45. Многофакторные кинетические уравнения
1.Многофакторные уравнения со смешанными
факторами:
Моно-Иерусалимского:
2. Конкурентного торможения продуктом метаболизма:
3 . Контуа – учитывающее влияние концентрации
биомассы на вид зависимости удельной скорости роста
от концентрации субстрата:
45
46. Многофакторные кинетические уравнения
4647. Многофакторные кинетические уравнения
47Многофакторные уравнения со смешанными
факторами:
Если в ур-е Моно-Иерусалимского подставить комплекс
Николаева (S0 – S) вместо Р, то получается вместо
двухфакторного однофакторное кинетическое
уравнение:
48. Отмирание (диссимиляция) биомассы
Рост-диссимиляцияОтсутствие отмирания:
Уравнение Герберта (удельная скорость отмирания биомассы
является величиной постоянной):
Уравнение Ферхюльста( удельная скорость роста принята
пропорциональной концентрации биомассы, а общая скорость
отмирания пропорциональна квадрату концентрации биомассы)
48
49. Отмирание (диссимиляция) биомассы
49Уравнение Рамкришны (удельная скорость диссимиляции биомассы
пропорциональна концентрации ингибирующих продуктов
метаболизма:
Уравнение Колпакова (связывает удельную скорость диссимиляции с
концентрацией субстрата):
50. Кинетика деградации (инактивации) продуктов метаболизма
Не всегда синтезированные продукты метаболизма отличаютсяустойчивостью (часто они лабильны и разрушаются уже в процессе
самой ферментации), поэтому описывая материальный баланс по
продукту метаболизма, необходимо учитывать кинетику его
инактивации:
Варианты моделирования:
Деградация отсутствует:
Деградация идет с постоянной скоростью:
Реакция разложения первого порядка:
Реакция разложения по уравнению химической кинетики:
50
51. Кинетика деградации (инактивации) продуктов метаболизма
Варианты моделирования:Реакция разложения зависит не только от концентрации продукта,
но и от концентрации биомассы:
Скорость реакции разложения зависит от концентрации биомассы и
возрастает с концентрацией продукта до какого-то предела::
51
52. Кинетика потребления субстрата
Чтобы «замкнуть» материальный баланс, в котором почти во всехуравнениях участвует концентрация субстрата, необходимо
дополнить его уравнением кинетики потребления:
52
53. Кинетика потребления субстрата
Для каждого интервала времени Δt можно определить ΔX, ΔP и Х(берут среднее значение для интервала). Подставив найденные
числовые значения, получаем линейное уравнение с тремя
неизвестными:
Для одного интервала для определения всех трех коэффициентов
недостаточно. Нужны минимум 3 точки, которые дадут три
уравнения (можно найти 3 коэффициента). Лучше взять больше
точек, чем число искомых коэффициентов, тогда получается
система уравнений, в которой коэффициенты находят методом
наименьших квадратов
53
54. Расчет коэффициентов выхода и скоростей роста и биосинтеза продукта по данным периодической ферментации
5455. Расчет коэффициентов выхода и скоростей роста и биосинтеза продукта по данным периодической ферментации
5556. Расчет коэффициентов выхода и скоростей роста и биосинтеза продукта по данным периодической ферментации
5657. Графический метод расчет коэффициентов Yхs и m о экспериментальным данным
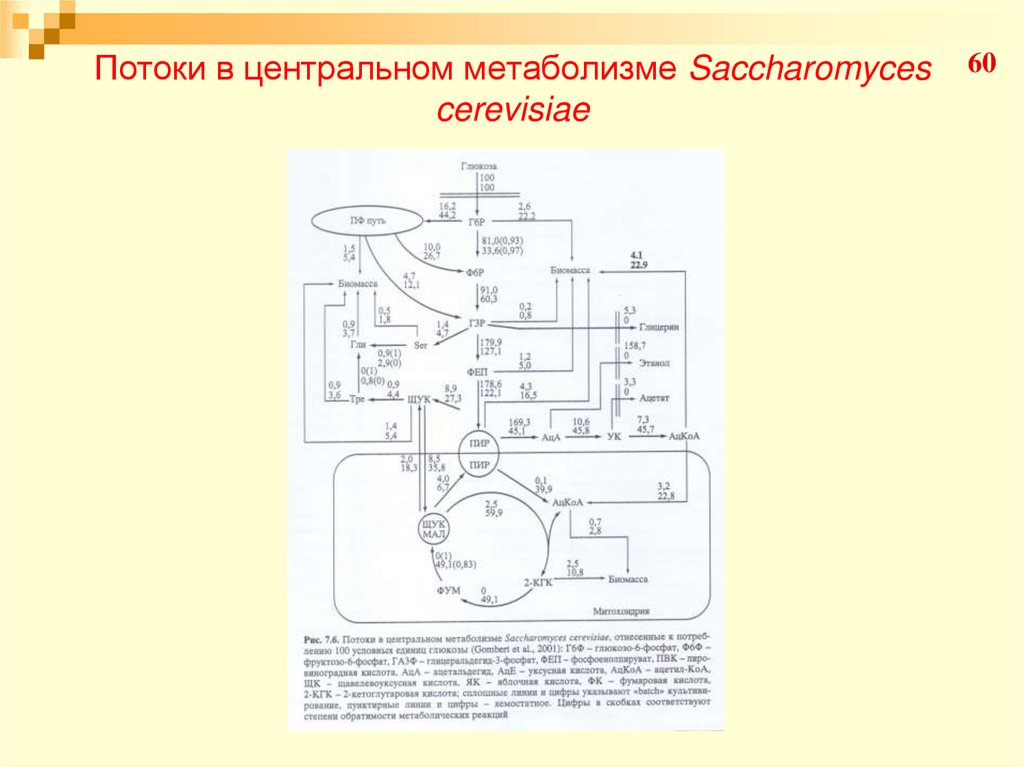
5758. Потоки в центральном метаболизме Saccharomyces cerevisiae
58Процесс оценки потоков сводится к поиску
наиболее подходящей модели, которая описывает
метаболизм. Для изучения метаболических потоков
в центральном метаболизме углерода модельной
системой S. Cerevisiae (клетки выращивают в
хемостате в аэробных условиях в режиме «stadystate» с удельной скоростью роста 0,1 ч-1 и в
«batch» культуре с удельной скоростью роста 0,37
ч-1. (глюкоза лимитирующий субстрат).
59.
5960. Потоки в центральном метаболизме Saccharomyces cerevisiae
6061. Потоки в центральном метаболизме Saccharomyces cerevisiae
61В «batch» культуре16,2 молекул глюкозы из
каждых 100 расходуется по пентозофосфатному
пути, в хемостате – 44,2 молекул глюкозы на 100.
В противоположность культуре, растущей в
хемостате, ЦТК не функционировал как цикл в
«batch» культуре
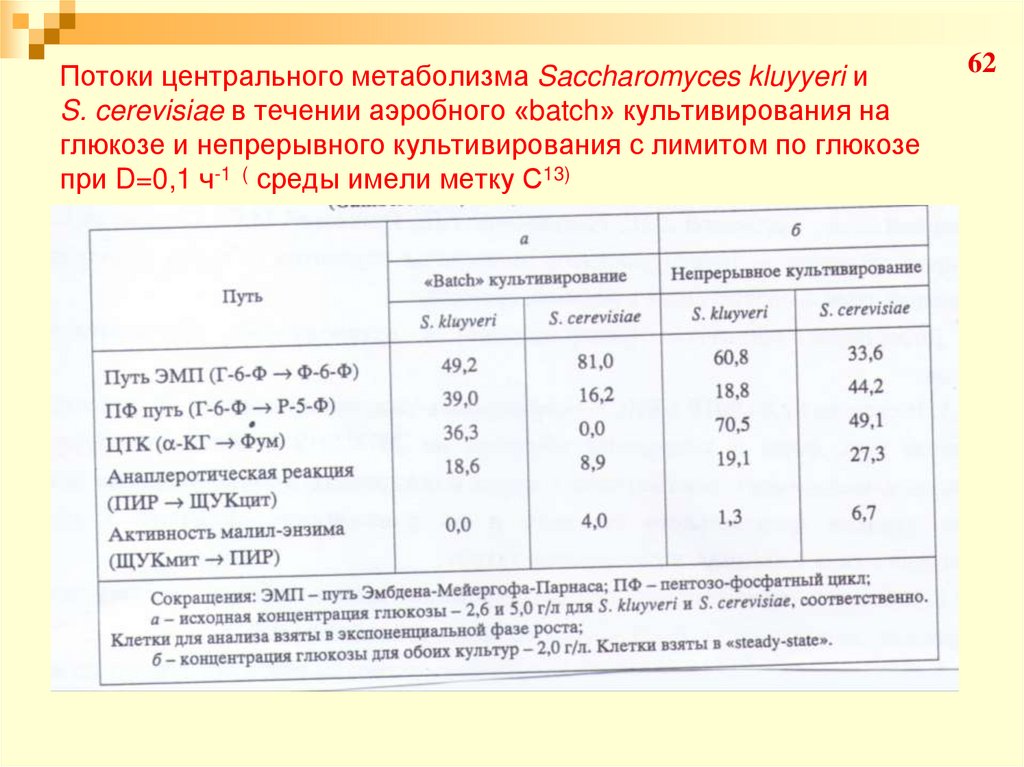
62. Потоки центрального метаболизма Saccharomyces kluyyeri и S. cerevisiae в течении аэробного «batch» культивирования на глюкозе и
непрерывного культивирования с лимитом по глюкозепри D=0,1 ч-1 ( среды имели метку С13)
62
63. Потоки центрального метаболизма Saccharomyces kluyyeri и S. cerevisiae
63Для S. Kluyyeri:
Потоки ЭМП : ПФ : биомасса распределились в соотношении 49
: 39 : 12 («batch») и 61 : 19 : 20 (непр.)
Увеличение потока ЭМП и потока в биомассе, падал поток в
направлении ПФ в непрерывной культуре по сравнению с «batch»
Для S. Cerevisiae:
ЭМП : ПФ : биомасса – 81 : 16 : 3 («batch») и 34 : 44 : 22 (непр.).
Увеличенную активность ПФ пути относительно потребления
глюкозы в непрерывной по сравнению с («batch»), объясняется
нарастающей потребностью в НАДФН для синтеза биомассы.
Наблюдаемое различие в потоках, расходящихся от глюкозо-6фосфата, как точки ответвления при «batch» сахаромицетов,
объясняет различие в выходе биомассы (0,39 и 0,11г/г глюкозы )
64. Потоки центрального метаболизма Saccharomyces kluyyeri и S.сerevisiae
64Анализ потоков на уровне ЦТК необходимы для оценки этапов
метаболизма.
При («batch») культивировании S.сerevisiae поток от α-кетоглутаровой
кислоты до фумаровой практически отсутствует (ЦТК функционирует
как две ветви), а у S.kluyyeri он составлял 36 ммоль/100 ммоль
использованной глюкозы ( в («batch» условиях ЦТК функционирует как
цикл).
При непрерывном культивировании поток от α-кетоглутаровой кислоты
до фумаровой был определен величиной в 70,5 ммоль/100 ммоль
глюкозы у S.kluyyeri и 49 ммоль/100 ммоль глюкозы у S.сerevisiae .
Для оптимизации процесса получения лимонной кислоты была создана
модель идиофазы




















































 Биология
Биология








