Похожие презентации:
Чистые вещества и смеси
1.
Повторение за 8класс
2.
Повторение основных вопросов курса 8 класса.1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Чистые вещества и смеси.
Химический элемент и простое вещество.
Физические свойства кислорода и водорода.
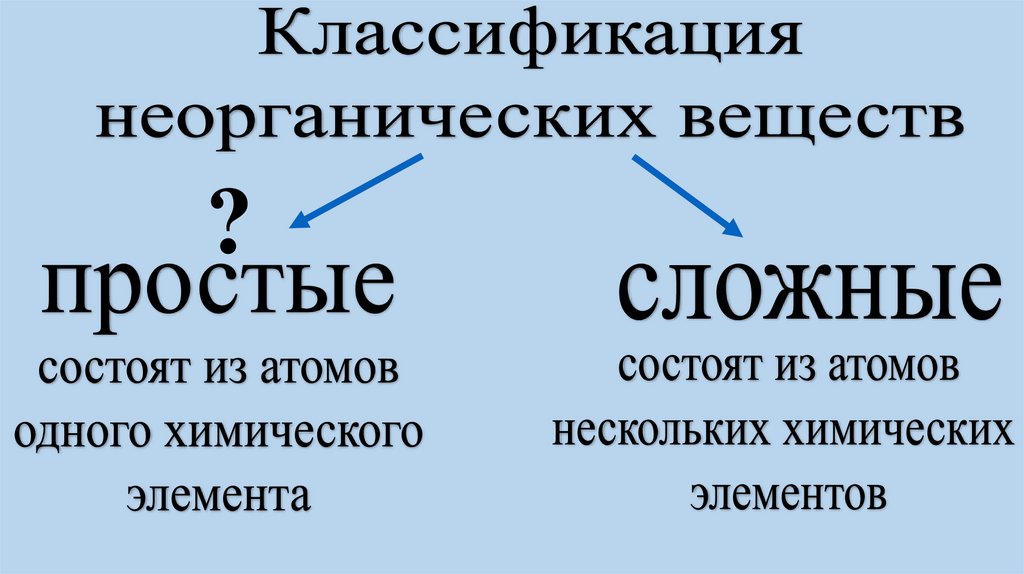
Классы неорганических веществ, их состав и свойства.
Генетическая связь между классами неорганических веществ.
Типы химических реакций.
Расчёт массовой доли элемента.
Массовая доля растворённого вещества в растворе.
Расчёты по уравнениям химических реакций.
Периодический закон
Строение атома.
3.
Чистые вещества и смесиВыпишите в два столбика названия чистых
веществ и смесей:
спиртовой раствор йода, железная руда, водород, медная руда,
чернила, дистиллированная вода, железо, воздух, сера, медь,
морская вода, сладкий чай, сахар, кислород.
Чистые вещества
Водород
Дистиллированная вода
Железо
Сера
Медь
Сахар
Кислород
Смеси
Спиртовой раствор йода
Железная руда
Медная руда
Чернила
Воздух
Морская вода
Сладкий чай
4.
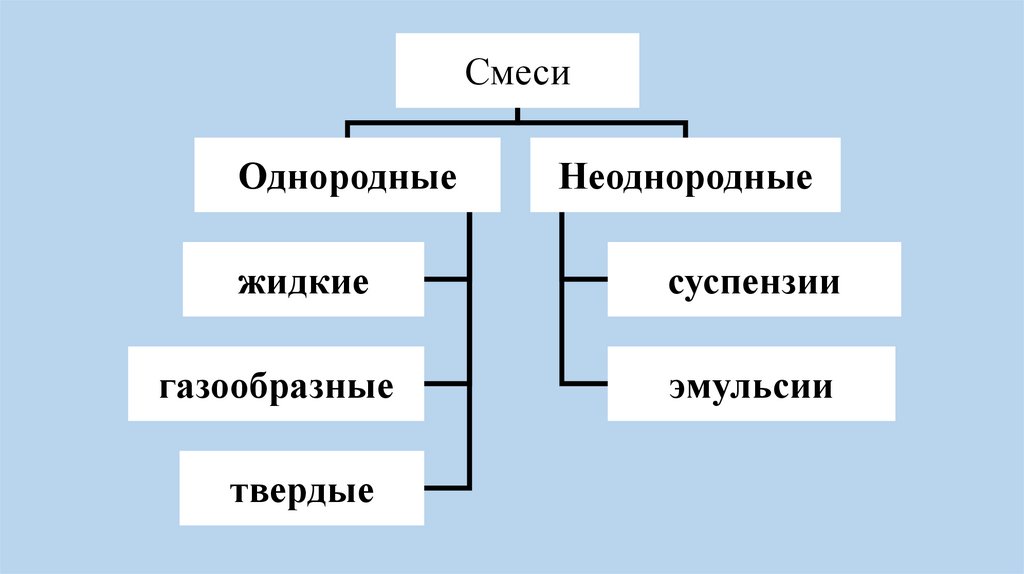
СмесиОднородные
жидкие
газообразные
твердые
Неоднородные
суспензии
эмульсии
5.
Методы разделения смесейГомогенных
Гетерогенных
Выпаривание
(кристаллизация)
Фильтрование
Дистилляция
(перегонка)
Отстаивание
Хроматография
Действие магнитом
6.
Химический элемент и простое веществоВ каком высказывании речь идёт о химическом элементе, а в
каком – о простом веществе?
1. Азот – составная часть воздуха.
2. Сера входит в состав сероводорода.
3. Железо обладает магнитными свойствами.
4. Валентность железа в соединениях равна II и III.
5. Кислород плохо растворим в воде.
6. Водород входит в состав воды.
7.
?8.
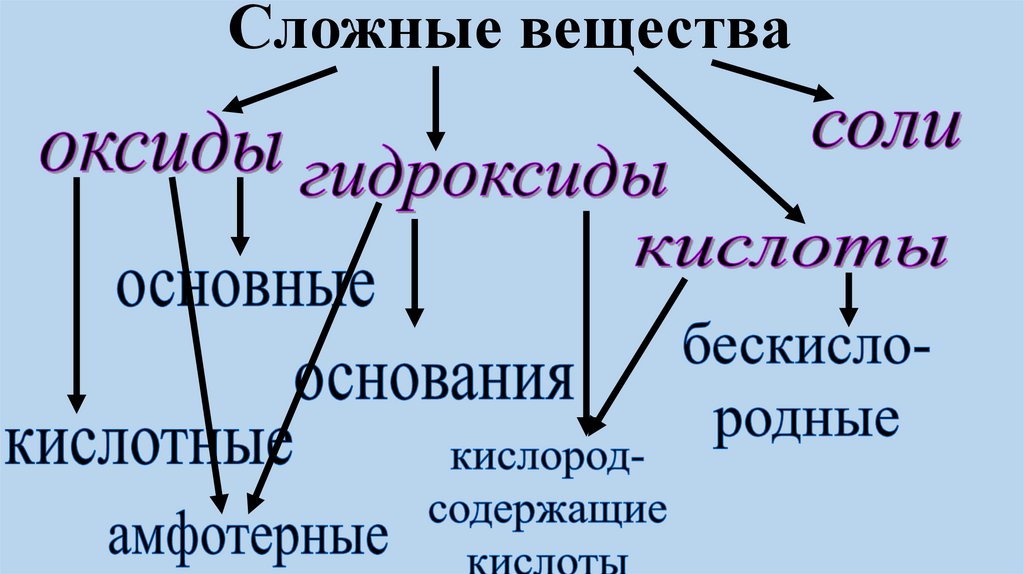
Сложные вещества9.
1. Определите принадлежность веществ копределённым классам. Ответ объясните.
CuO, H2SO4 , Fe(OH)2 , Al2O3, NaCl, KOH, SO2,
HF, AlPO4 , CrO3
2. Напишите формулы солей, названия которых:
Карбонат натрия, сульфат меди (II), хлорид магния,
фосфат кальция, силикат калия.
10.
Химические свойства основных оксидов1. + вода → растворимое основание
2. + кислотный оксид → соль
3. + кислота → соль + вода
Химические свойства кислотных оксидов
1. + вода → кислородная кислота
2. + основный оксид → соль
3. + щёлочь → соль + вода
11.
Химические свойства амфотерных оксидов1. + вода → 2. + кислотный оксид → соль
3. + кислота → соль + вода
4. + основный оксид → соль
5. + щёлочь → соль + вода
12.
Химические свойства оснований• + кислота → соль + вода
( реакция нейтрализации )
• щёлочь + кислотный оксид → соль + вода
• щёлочь + соль (р-р) → гидроксид Ме + соль’
( реакция возможна, если один из продуктов реакции
выпадает в осадок )
• нерастворимые основания при нагревании
разлагаются на оксид и воду
13.
Химические свойства кислот1. + Ме (до Н) → соль + Н2↑
2. + основные оксиды→соль + вода
3. + основания → соль + вода
4. + соль → соль’ + кислота’
(реакция возможна, если выпадает осадок или
образуется газ: H2S↑, H2CO3→H2O+CO2↑,
H2SO3→H2O+SO2↑)
14.
Химические свойства солей1. Соль(р-р)+щёлочь → соль’+гидроксид Ме
( один из продуктов реакции ↓ )
2. Соль + кислота → соль’ + кислота’
(реакция возможна, если ↓ или H2CO3 → H2O + CO2↑,
H2SO3 → H2O + SO2↑, H2S↑ )
3. Соль(р-р) + соль(р-р) → две новых соли
(один из продуктов реакции ↓ )
4. Соль(р-р) + Ме → соль’ + Ме’ (сильный Ме
вытесняет более слабый из соли, см.ряд активности)











 Химия
Химия








