Похожие презентации:
Основные классы неорганических соединений. Гидроксиды
1. Основные классы неорганических соединений. Гидроксиды
Преподаватель:Ассистент ОЕН ШБИП
к.х.н. Абрамова Полина
Владимировна
еmail: bozhkopv@tpu.ru
2.
ПЛАН ЗАНЯТИЯI. Основания
II. Кислоты
2
3.
I. ОснованияМе(ОН)у
Основания
– это сложные вещества,
молекулы которых состоят из катионов металла и
одной или нескольких гидроксид ионов – ОН-.
Исключением
является
NH4OH
(гидроксид
аммония), которое не содержит атомов металла.
Число гидроксильных групп равно валентности
металла (Ме).
3
4.
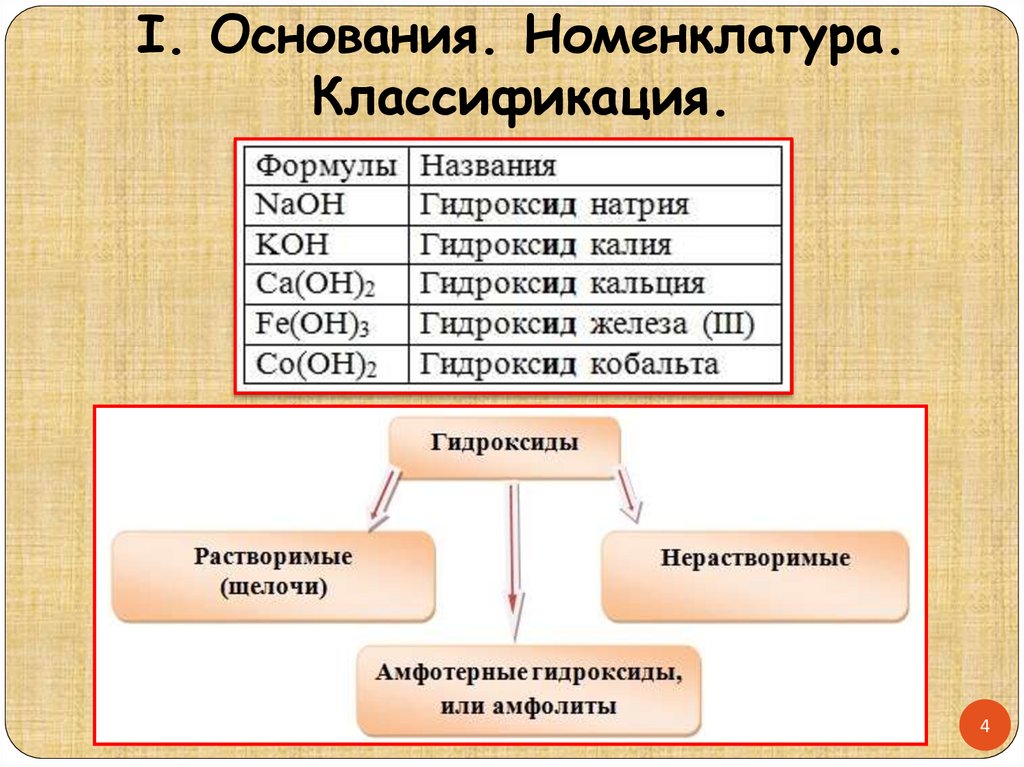
I. Основания. Номенклатура.Классификация.
4
5.
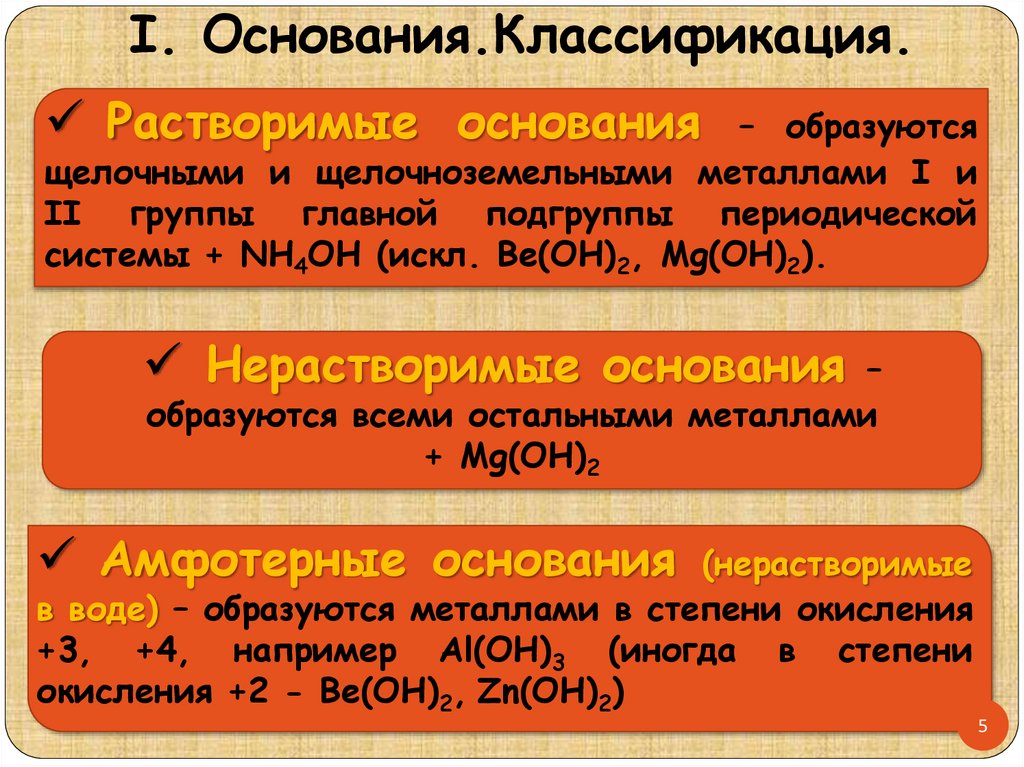
I. Основания.Классификация.Растворимые основания
– образуются
щелочными и щелочноземельными металлами I и
II группы главной подгруппы периодической
системы + NH4OH (искл. Be(OH)2, Mg(OH)2).
Нерастворимые основания
–
образуются всеми остальными металлами
+ Mg(OH)2
Амфотерные основания
(нерастворимые
в воде) – образуются металлами в степени окисления
+3, +4, например Al(OH)3 (иногда в степени
окисления +2 - Be(OH)2, Zn(OH)2)
5
6.
I. Основания.Получение.1. Некоторые щелочи получают электролизом растворов
солей:
2NaCl + 2H2O
электр олиз
H2 + 2NaOH + Cl2
2. Щелочи можно получить взаимодействием щелочных
и щелочноземельных металлов или их оксидов с
водой:
2K + 2H2O = 2KOH + H2
Ca + 2H2O = Ca(OH)2 + H2
BaO + H2O = Ba(OH)2
6
7.
I. Основания. Получение.3. Нерастворимые в воде основания получают
действием щелочи на соответствующую соль:
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
4.
Общим
способом
получения
амфотерных
гидроксидов является действие щелочи на соль
соответствующего металла, например:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl.
7
8.
I. Основания.Физические свойства.
8
9.
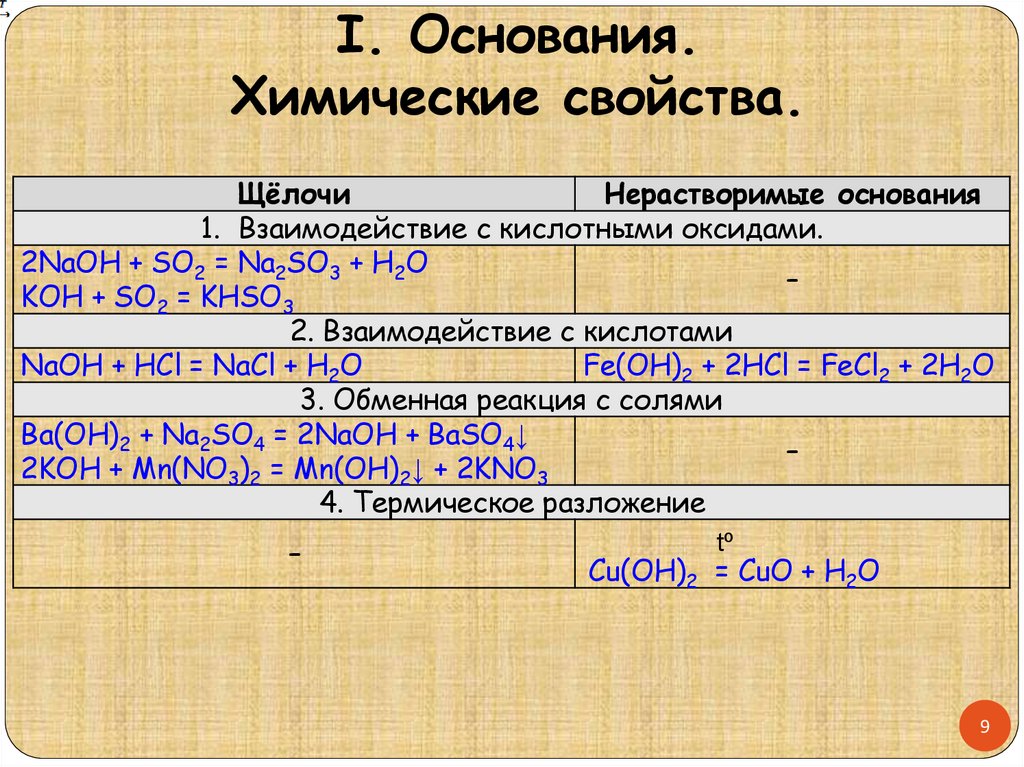
I. Основания.Химические свойства.
Щёлочи
Нерастворимые основания
1. Взаимодействие с кислотными оксидами.
2NaOH + SO2 = Na2SO3 + H2O
–
KOH + SO2 = KHSO3
2. Взаимодействие с кислотами
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
3. Обменная реакция с солями
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
–
2KOH + Mn(NO3)2 = Mn(OH)2↓ + 2KNO3
4. Термическое разложение
–
tº
Cu(OH)2 = CuO + H2O
9
10.
I. Основания.Химические свойства.
Амфолиты реагируют с кислотами и щелочами. При
этом в кислой среде равновесие смещается в сторону
образования солей, а в щелочной среде – в сторону
образования гидроксокомплексов.
При сплавлении со щелочами образуются оксосоли.
Амфолиты (амфотерные гидроксиды)
1. Взаимодействие с кислотами
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Взаимодействие с расплавами щелочей
Zn(OH)2 + 2NaOH (расплав) = Na2ZnO2 + 2H2O
3. Взаимодействие с растворами щелочей
Zn(OH)2 + 2NaOH (раствор) = Na2[Zn(OH)4]
10
11.
II. КислотыHn X
где Xn- кислотный
остаток
Кислоты
– это сложные вещества, которые
способны диссоциировать в водных растворах на
ион(ы) водорода и кислотный остаток.
Кислоты
можно
классифицировать
в
зависимости от:
1) наличия или от сут ст вия ат омов кислорода в
формуле кислоты;
2) числа кат ионов водорода в молекуле;
3)
по
их
силе
(величине
константы
диссоциации).
11
12.
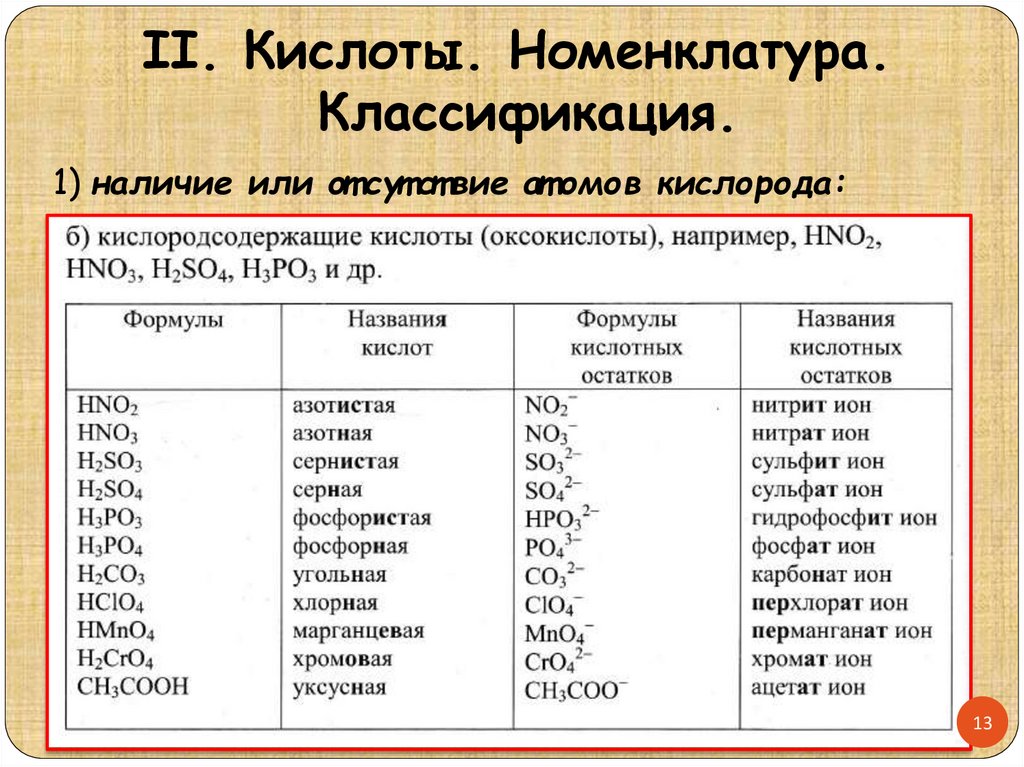
II. Кислоты. Номенклатура.Классификация.
1) наличие или от сут ст вие ат омов кислорода:
12
13.
II. Кислоты. Номенклатура.Классификация.
1) наличие или от сут ст вие ат омов кислорода:
13
14.
II. Кислоты. Классификация.2) число кат ионов водорода:
14
15.
II. Кислоты.Классификация.2) число кат ионов водорода:
3) по силе:
15
16.
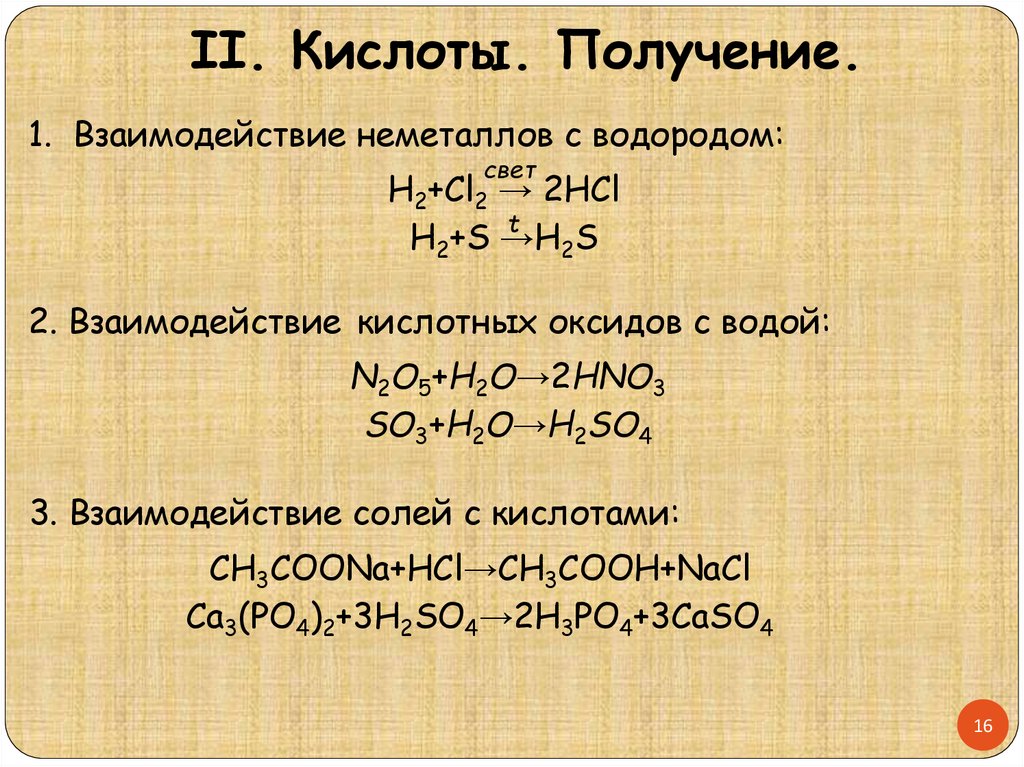
II. Кислоты. Получение.1. Взаимодействие неметаллов с водородом:
свет
H2+Cl2 → 2HCl
t
H2+S →H
2S
2. Взаимодействие кислотных оксидов с водой:
N2O5+H2O→2HNO3
SO3+H2O→H2SO4
3. Взаимодействие солей с кислотами:
CH3COONa+HCl→CH3COOH+NaCl
Ca3(PO4)2+3H2SO4→2H3PO4+3CaSO4
16
17.
II. Кислоты. Физические свойства.17
18.
II. Кислоты. Химические свойства.1. Взаимодействие с основными оксидами
2HBr + FeO = FeBr2 + H2O
H2SO4 + MnO = MnSO4 + H2O
2. Взаимодействие с основаниями
H2SO4 + 2KOH = K2SO4 + 2H2O
2HI + Mn(OH)2 = MnI2 + 2H2O
3. Обменная реакция с солями
HCl + AgNO3 = AgCl↓+ HNO3
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
4. Взаимодействие с металлами
Состав продуктов зависит от концентрации
кислоты и природы металла
18













 Химия
Химия








