Похожие презентации:
Химические равновесия в растворах. Лекция 2. Часть 1
1.
АНАЛИТИЧЕСКАЯ ХИМИЯЛЕКЦИЯ 2, часть 1
Химические равновесия в растворах
Лектор Семенова Ирина Николаевна
2.
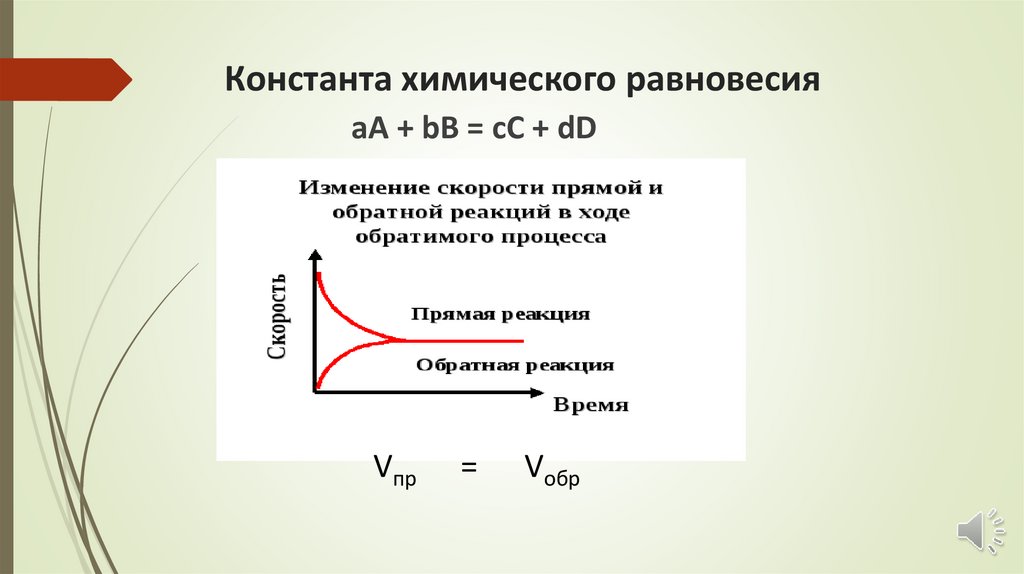
Константа химического равновесияaA + bB = cC + dD
Vпр
=
Vобр
3.
С кинетической точки зренияхимическое равновесие – состояние динамического
равновесия реакций в растворе, при котором каждый
компонент образуется точно с такой же скоростью, с
которой и расходуется.
4.
В соответствии с законом действующих массVпр = kпр[A]a[B]b,
[A],[B],[C],[D] -
Vобр=kобр[C]c[D]d
равновесные концентрации компонентов
kпр[A]a[B]b =kобр[C]c[D]d или
Kc =
[








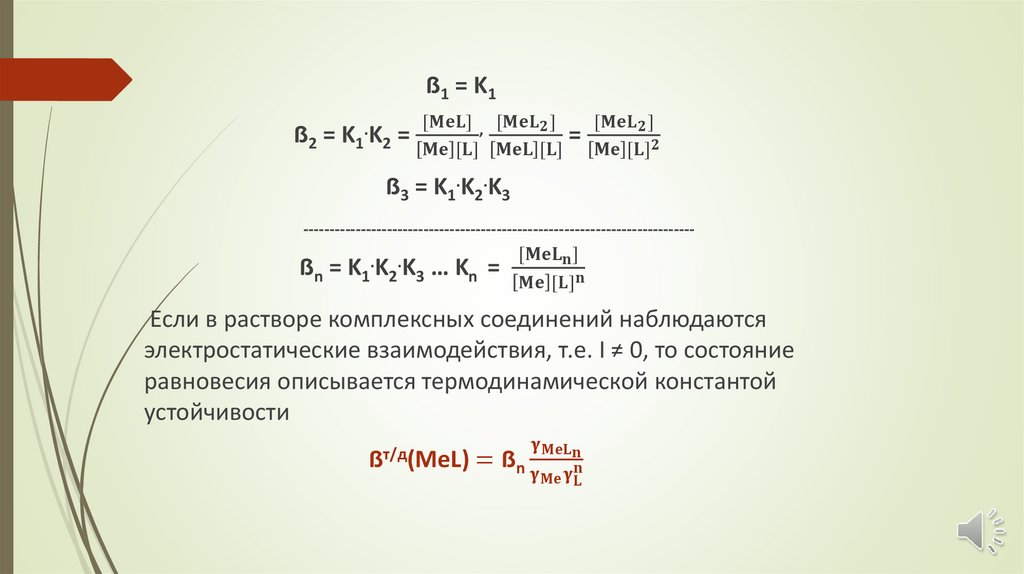







 Химия
Химия








