Похожие презентации:
Кинетика и равновесие химических реакций
1. КИНЕТИКА И РАВНОВЕСИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
2. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. ГОМОГЕННЫЕ И ГЕТЕРОГЕННЫЕ СИСТЕМЫ
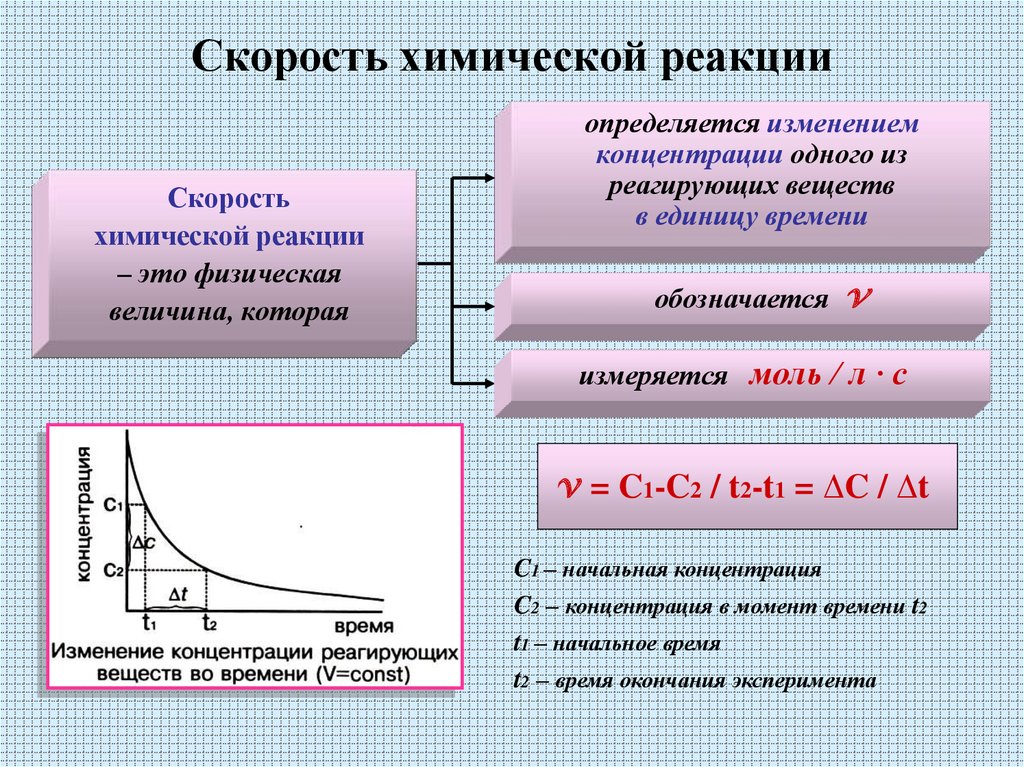
3. Скорость химической реакции
Скоростьхимической реакции
– это физическая
величина, которая
определяется изменением
концентрации одного из
реагирующих веществ
в единицу времени
обозначается
v
измеряется моль / л · с
v = C1-C2 / t2-t1 = ΔC / Δt
C1 – начальная концентрация
C2 – концентрация в момент времени t2
t1 – начальное время
t2 – время окончания эксперимента
4. Термин «скорость» в физике и в химии
«скорость»в физике
в химии
определение
Отношение пути ко
времени, в течение которого
этот путь пройден (движение
равномерное,
прямолинейное)
Скорость химической
реакции – это изменение
концентрации одного из
реагирующих веществ в
единицу времени
обозначение
v
v
формула
v=S/t
v = C1-C2 / t2-t1 = ΔC / Δt
единицы
измерения
м/с
моль / л·с
примеры
Машина прошла 10 м за 2 с.
Какова скорость её
движения?
v = 10 / 2 = 5
5 м/с
Начальная концентрация
SO2 в реакции окисления –
2 моль/л, через 50 с – 0,5
моль/л. Определить
скорость реакции.
v = 2-0,5/50 = 0,03
0,03 моль/л·с
5.
• СИСТЕМА – это одно или несколько веществ,физически ограниченных от внешней среды.
Система может быть замкнутой или открытой. В
открытой системе возможен обмен веществ и
энергией с внешней средой.
ФАЗА – это часть системы, отдаленная от других ее
частей поверхностью раздела, при переходе через
которую свойства системы меняются скачком.
6.
• ГОМОГЕННАЯ СИСТЕМА – это система, состоящая изодной фазы.
(Например, воздух, любая газовая смесь, раствор соли в воде
(без остатка), однородный сплав металлов)
• разложение 2N2O5 (г) → 4NO2 (г) + O2 (г)
• горение этана 2C2H6 (г) + 7O2 (г) → 4CO2 (г) + 6H2O
(г)
ГЕТЕРОГЕННАЯ СИСТЕМА – это система, состоящая из
нескольких фаз.
(Например, вода со льдом, любой раствор с осадком,
эмульсия масла в воде и т.д.)
• СаО(к) + СО2(г) → СаСО3 (к)
• СО2 (г) + КОН (р-р) → КНСО3 (р-р)
• СаСО3 (к) + НСl (р-р) → CaCl2 (р-р) + CO2 + H2O (ж)
7.
Время протекания реакциискорость реакции
кинетика
«kinẽtikos”, что означает “движущийся”.
Кинетика – раздел физической химии,
механизм и скорость протекания реакций
изучающий
По количеству участвующих в реакции частиц:
Мономолекулярные реакции полимеризации либо
разложения:
CH3 – N =C → CH3 – C ≡ N
Br2 → 2Br.
Бимолекулярные реакции:
2 NOCl (г) → 2NO (г) + Cl2 ,
Br• + H2 → HBr + H•.
Тримолекулярные реакции встречаются очень редко:
2NO + O2 → 2NO2
2I• + H2 → 2HI,
где I• - свободный радикал йода – активная частица, имеющая
неспаренный электрон.
8. Факторы, влияющие на скорость реакции: - концентрация реагентов, - температура, - физическое состояние реагентов, - наличие
катализаторов.9. 1. Зависимость скорости реакции от концентраций реагирующих веществ выражается законом действующих масс (ЗДМ)
• В 1864 – 1867 годахнорвежские ученые Като
Максимилиан Гульдберг
и Петер Ваге для расчета
скорости химической
реакции предложили
закон действующих масс,
который был установлен
экспериментальным
путем для многих
реакций.
10. ЗАКОН ДЕЙСТВИЯ МАСС
• При постоянной температуре скоростьхимической реакции прямо
пропорциональна произведению
концентраций реагирующих веществ в
степенях их стехиометрических
коэффициентов
11. Концентрация Чем больше концентрация, тем чаще происходят столкновения – скорость реакции больше Закон действия масс: скорость
реакции прямо пропорциональна произведениюконцентраций реагирующих веществ
Для реакции aA + bB → C :
v = k·[А]ª·[В]b
– кинетическое уравнение,
где k – константа скорости данной реакции;
[А] и [В] -молярные концентрации веществ А иВ
(моль/л)
a и b - стехиометрические коэффициенты
реакции
Для реакций без участия твёрдых веществ
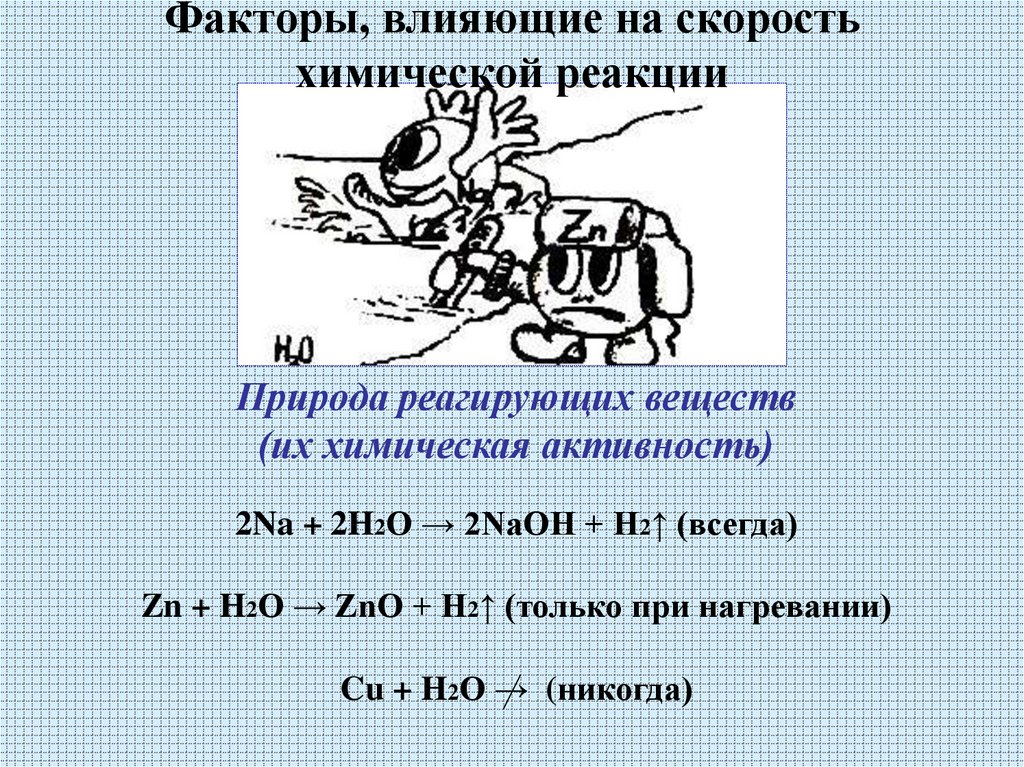
12. Факторы, влияющие на скорость химической реакции
Природа реагирующих веществ(их химическая активность)
2Na + 2H2O → 2NaOH + H2↑ (всегда)
Zn + H2O → ZnO + H2↑ (только при нагревании)
Cu + H2O → (никогда)
13. ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ
• ЭНЕРГИЯ АКТИВАЦИИ (ЕА,кДж/моль) –это избыточная энергия, которой
должны обладать молекулы, чтобы
вступить в химическую реакцию.
14.
ТемператураЧем больше температура, тем больше скорость движения
частиц, тем чаще происходят столкновения – скорость
реакции больше
Правило Вант-Гоффа:
При изменении температуры на каждые 10 градусов
скорость реакции изменяется в 2-4 раза
vt
2
= vt1
t2 -t1 /10°
· γ,
где vt2 – скорость реакции
при температуре t2
где vt1 – скорость реакции
при температуре t1
γ – температурный
коэффициент реакции
15. Площадь поверхности соприкосновения реагирующих веществ Для гетерогенных реакций скорость прямо пропорциональна площади
поверхности соприкосновенияреагирующих веществ. Твёрдое вещество необходимо
измельчить, если возможно, растворить в воде
(измельчить до молекул)
16. Катализатор Вещества, которые участвуют в химической реакции и увеличивают её скорость, оставаясь к концу реакции неизменными,
называют катализаторами.Вещества, которые замедляют скорость химической
реакции, называют ингибиторами.
17. Катализ
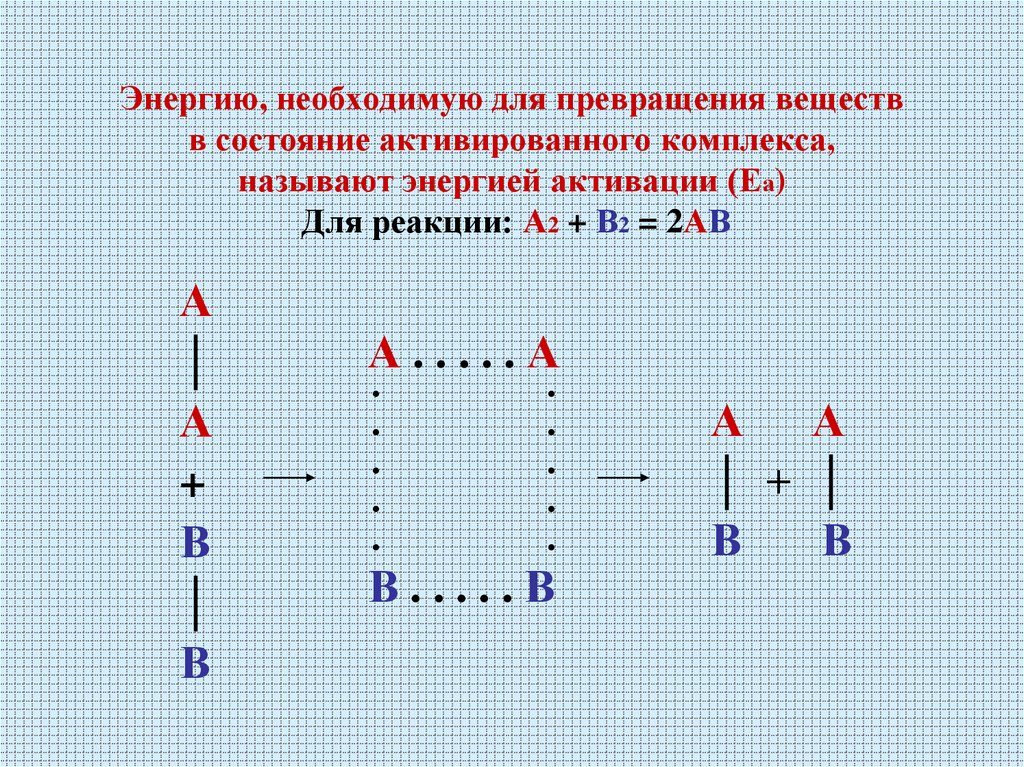
18. Энергию, необходимую для превращения веществ в состояние активированного комплекса, называют энергией активации (Еа) Для
реакции: А2 + В2 = 2АВА
│
А
+
В
│
В
А.....А
·
·
·
·
·
·
·
·
·
·
В.....В
А А
│ + │
В
В
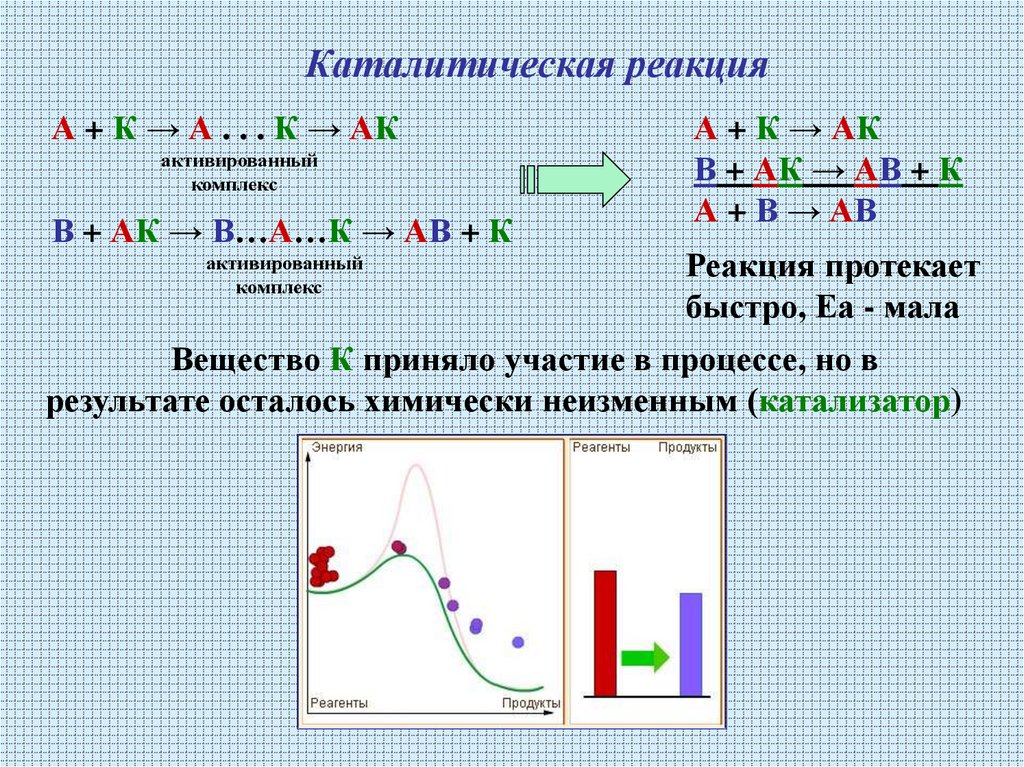
19. Каталитическая реакция
А + К → А . . . К → АКактивированный
комплекс
В + АК → В…А…К → АВ + К
активированный
комплекс
А + К → АК
В + АК → АВ + К
А + В → АВ
Реакция протекает
быстро, Еа - мала
Вещество К приняло участие в процессе, но в
результате осталось химически неизменным (катализатор)















 Химия
Химия








