Похожие презентации:
Основные закономерности протекания химических процессов
1.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
КАФЕДРА ХИМИИ И ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
Русаков Максим Владимирович
(фамилия, имя, отчество студента – автор работы)
Химия
(наименование дисциплины)
Основные закономерности протекания химических процессов
(химическая термодинамика)
(тема РГР)
Выполнил:
Проверил:
Студент Русаков Максим Владимирович
.
(Ф. И. О.)
Группа ЭН2-02
Факультет ФЭН
Преподаватель Апарнев Александр Иванович
(Ф. И. О.)
Балл: __________
.
.
Оценка:
«зачтено» / «незачтено»
.
______________________
______________________
«___» ______________ 2020 г.
«___» __________________ 2020 г.
подпись
подпись
Новосибирск 2020
2.
Задание. Дано уравнение реакции СН
4(
г) + 3 СО2(г) = 4 СО(г) + 2 H2O
(г)
.
1.
Для всех веществ, участвующих в реакции, выпишите из приложения 1
значения стандартных термодинамических величин
2.
Вычислите изменение энтальпии реакции
и
.
и определите, является
ли данная реакция экзо- или эндотермической. Запишите термохимическое
уравнение реакции.
3.
По виду уравнения реакции, не прибегая к расчетам, определите знак
изменения энтропии реакции
. Вычислив изменение энтропии реакции в
стандартных условиях, объясните знак
4.
.
Вычислите энергию Гиббса прямой реакции в стандартных условиях
и установите возможность самопроизвольного протекания реакции.
5.
Определите температуру, при которой реакция находится в равновесии
(
Тр).
6.
Рассчитайте
при Т1= Т
р – 100 и при
Т2
= Тр + 100.
7.
Постройте график зависимости
от Т и обозначьте на графике область
температур самопроизвольного протекания реакции.
8.
Вычислите значения константы равновесия
Kравн
при температурах Т1 и Т2.
Cделайте вывод о влиянии температуры на величину
K
равн и на смещение
химического равновесия.
Расчеты и пояснения
1. Записываем стандартные энтальпии образования и стандартные энтропии для
реагентов и продуктов реакции, используя справочные данные
3.
СН4(г)СО
2(г)
СО(г)
H
2O(г)
-74,81
-393,51
-110,5
-241,82
186,31
213,68
197,54
188,72
,
2. Вычисляем изменение энтальпии при протекании прямой реакции в
стандартных условиях, используя
следствие из закона Гесса : изменение
энтальпии химической реакции равно разности сумм энтальпий исходных
веществ и продуктов реакции с учетом стехиометрических коэффициентов.
∆r H 0298 = ∑ ϑ·∆f H 0298 (продуктов реакции) − ∑ ϑ·∆f H 0298 (реагентов)
∆r H 0298 = (4·∆f H 0298 (CO) + 2·∆f H 0298 (H 2 O)) − (3·∆f H 0298 (CO2 ) + ∆f H 0298 (СH4))
=(-442+(-484,64))-((-1180,53)+(-74,81))=328,7кДж
Термохимическое уравнение реакции будет иметь вид:
СН
4(г) + 3 СО
2(г) = 4 СО(г) + 2 H
2O
(г)=328,7кДж
Так как
> 0, то реакция является эндотермической
3. Вычисляем изменение энтропии реакции
в стандартных условиях,
используя следствие из закона Гесса: изменение энтропии
химической
в процессе
реакции равно разности сумм энтропий исходных веществ и
продуктов реакции с учетом стехиометрических коэффициентов.
∆r S 0298 = ∑ ϑ·S 0298 (продуктов реакции) − ∑ ϑ·S 0298 (реагентов)
0
f 298
S =[ 4(
(CO2) )]
0
f 298
S (CO))+ 2(
0
f 298
S (H
2O))] - [
0
f 298
S (CH
4)
+3(
0
f 298
S
4.
0r 298
S = (4 · 197,54Дж\К · моль +2 · 188,72 Дж\К · моль) – ( 186,31 Дж\К ·
моль +3 · 213,68 Дж\К · моль) = 340,25 Дж\К · моль
Объясните знак
, не прибегая к расчетам
Так как в результате реакции количество моль газообразных веществ
увеличивается, то
>0. Такую закономерность изменения энтропии можно
объяснить тем, что газообразные вещества обладают наибольшей энтропией, и,
как следствие, изменение количества моль газообразных веществ влияет на
изменение энтропии реакции сильнее всего.
Изменение энтропии действительно больше нуля, т.к. количество моль
газообразных веществ увеличивается. Исходя из выводов, сделанных выше,
изменением энтропии твердых веществ можно пренебречь, т.к. оно несравнимо
с изменением энтропии газов.
4. Вычисляем энергию Гиббса прямой реакции в стандартных условиях
,
используя уравнение Гиббса-Гельмгольца.
Δr G0298
Δr G0T = ∆r H 0T – T ·∆r S 0T
Δr G0298 = ∆r H 0298 – 298·∆r S 0298
= 328700Дж – (298·340, 25) = 227305, 5 (Дж)
и объясняете направление самопроизвольного протекания реакции.
ΔG > 0 указывает на то, что процесс термодинамически запрещен
5. Рассчитываем температуру, при которой реакция будет находиться в
равновесии. Реакция будет находиться в равновесии при
T равн =
∆r H 0298
0
∆r S 298
=
328700
340,25
= 966, 05 К
= 0, тогда
5.
6.Рассчитываем
при Т
1= Т
р–
100 и при Т
2= Т
р+
100:
= 866, 05 K
= 328700Дж - ( 866, 05 К · 340,25 Дж\К · моль) = 34,027
кДж
= 1066, 05 К
=
328700Дж -( 1066, 05 К · 340,25 Дж\К · моль)=-34,024
кДж
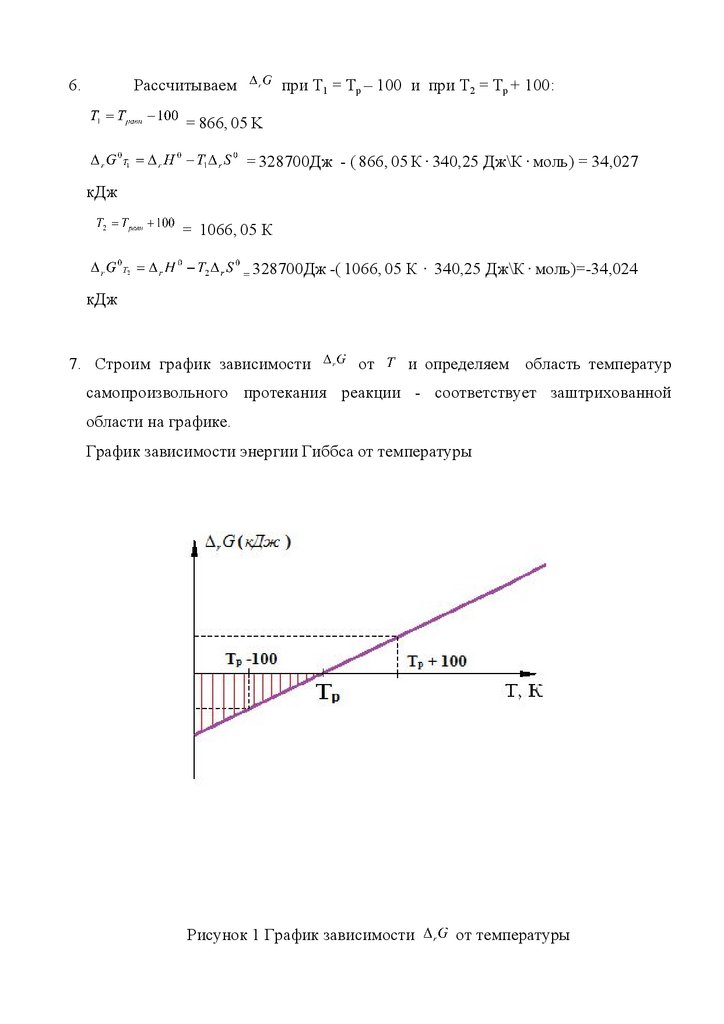
7. Строим график зависимости
от
и определяем область температур
самопроизвольного протекания реакции - соответствует заштрихованной
области на графике.
График зависимости энергии Гиббса от температуры
Рисунок 1 График зависимости
от температуры
6.
8.Вычисляем значения константы равновесия для температур Т
:
1и Т
2
34027
e− 8,314*866,05 = 0,0089
−34024
e− 8,314*1066,05 =1,468
Вывод
Исходя из полученных значений константы равновесия при разных
температурах, можно сделать вывод: при увеличении температуры, константа
равновесия возрастает. Также можно установить: чтобы реакция проходила
быстрее, нужно передать системе некоторое количество теплоты для
увеличения ее температуры, т.к. реакция проходит только в
высокотемпературном режиме.





 Химия
Химия








