Похожие презентации:
Свойства простых и сложных белков
1.
СВОЙСТВАПРОСТЫХ И СЛОЖНЫХ
БЕЛКОВ
2.
3.
4.
Поглощение света в видимом и ультрафиолетовом диапазонахобусловлено электронными переходами в молекулах поглощающего
вещества. Поглощение света в инфракрасном диапазоне имеет иную
природу. Оно связано с переходами между колебательными уровнями
основного состояния молекулы. Полосы поглощения, отвечающие
колебательным переходам, обычно лежат в диапазоне длин волн от 2000
до 50000 нм или, как принято записывать для ИК-спектров, в диапазоне
волновых чисел от 5000 до 200 см-1.
5.
6.
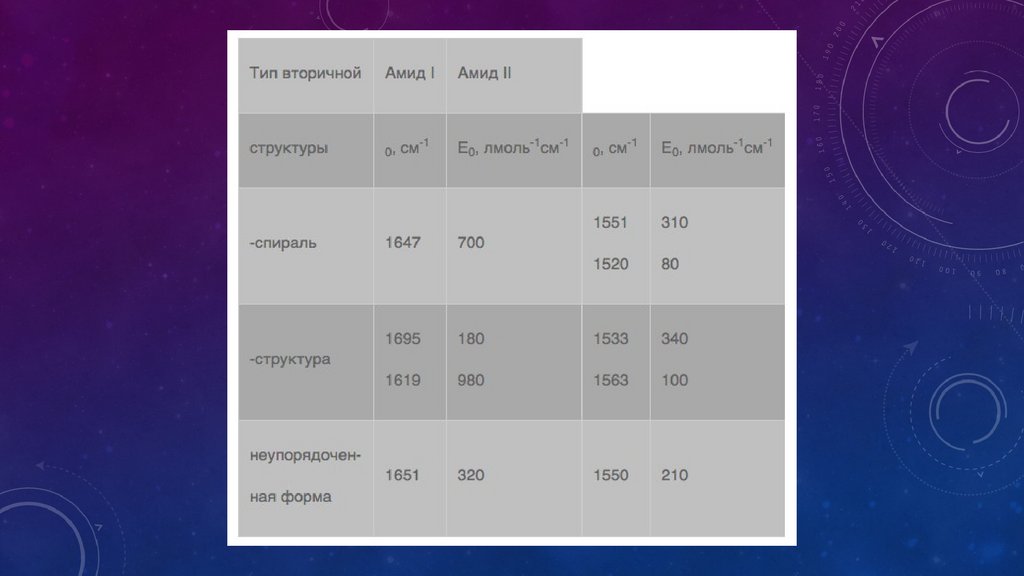
ИК – спектр белковДля ИК-спектров белков и продуктов их распада — пептидов — характерно наличие
двух основных полос поглощения — амида I (1650 см-1) и амида II (1550 см-1),
обусловленных валентными колебаниями С=О-связи (амид I) и плоскостными
деформационными колебаниями NH-связи (амид II). Таким образом, если в спектрах
исследуемого вещества прослеживаются обе полосы, то с большой вероятностью
можно утверждать, что в анализируемой пробе есть полипептид или белок. Это
означает, что в качестве связующего могли быть использованы яичный желток или
белок, казеин или желатина. Дополнительным свидетельством присутствия желатины
может служить наличие в ИК-спектре полосы поглощения при 3330 см-1 (амид А),
характерной для коллагена или желатины.
7.
8.
УФ – спектр белковРастворы белков имеют характерный спектр поглощения электромагнитного излучения
в ультрафиолетовой области.
Получаемые УФ-спектры белковых растворов имеют максимумы поглощения при
длине волны 190 нм и 280 нм. Поглощение при 190 нм обусловлено пептидными
группами белка, а поглощение при 280 нм — его ароматическими группами.
По оптической плотности, измеренной при определенной длине волны, можно
установить количество белка в растворе: чем она выше, тем выше концентрация белка.
Однако этот метод имеет ограничения: во-первых, необходим раствор белка и, вовторых, этот раствор должен быть не опалесцирующим, т.е. абсолютно прозрачным.
9.
УФ-спектр белков10.
Как рассмотрено выше, ультрафиолетовое излучение поглощается главным образомаминокислотами триптофаном, тирозином и фенилаланином. Эти аминокислоты
высоко чувствительны к повреждающему действию ультрафиолета. Но наибольшей
фоточувствительностью к коротковолновому ультрафиолетовому излучению в белках
отличаются дисульфидные мостики, разрываемые при поглощении фотона. Это
подтверждают данные Табл. 3 о молярных коэффициентах поглощения , квантовых
выходах и поперечных сечениях фотоинактивации основных хромофорных групп в
белках для УФС излучения с длиной волны 254 нм. Они демонстрируют в 3 раза
большую чувствительность (-S-S-) сшивок по сравнению с триптофаном.
Фотодеструкция фенилаланина, тирозина, а также пептидных связей намного менее
существенна.
При облучении УФВ светом с длиной волны более 280 нм фотоповреждение белков в
большей мере обусловлено поглощением триптофана и тирозина.
Процессы ультрафиолетовой инактивации белков, конечно, сложнее, чем
фотопревращения отдельных аминокислот.











 Биология
Биология Физика
Физика








