Похожие презентации:
Скорость химической реакции
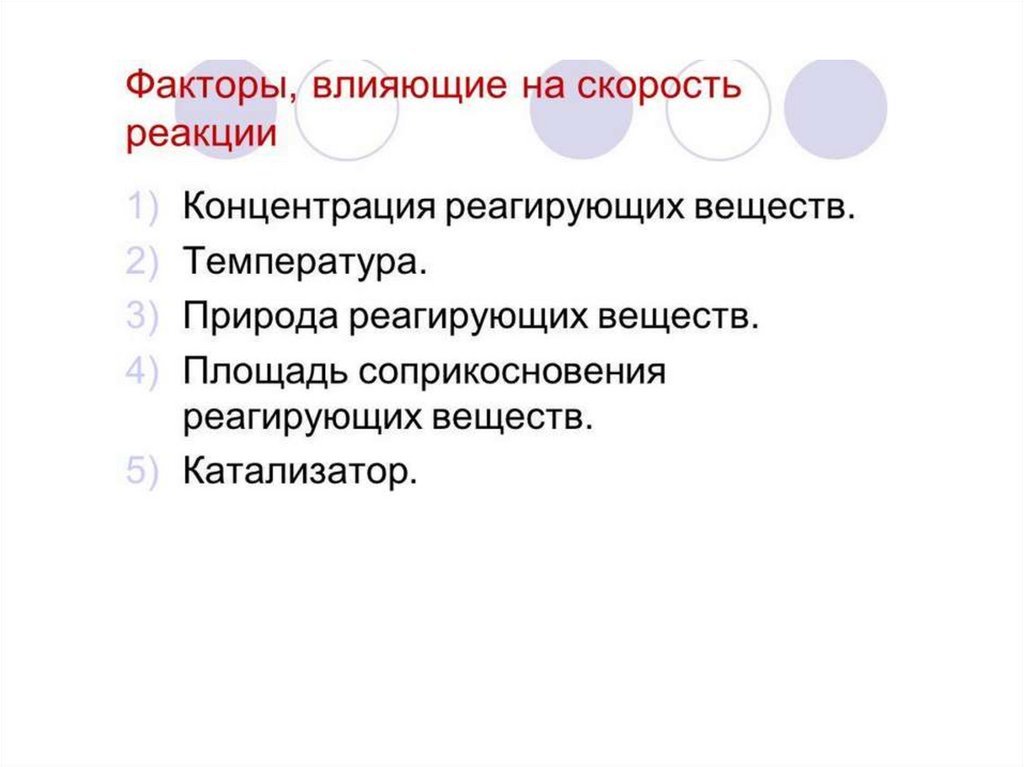
1.
Скорость химической реакции2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
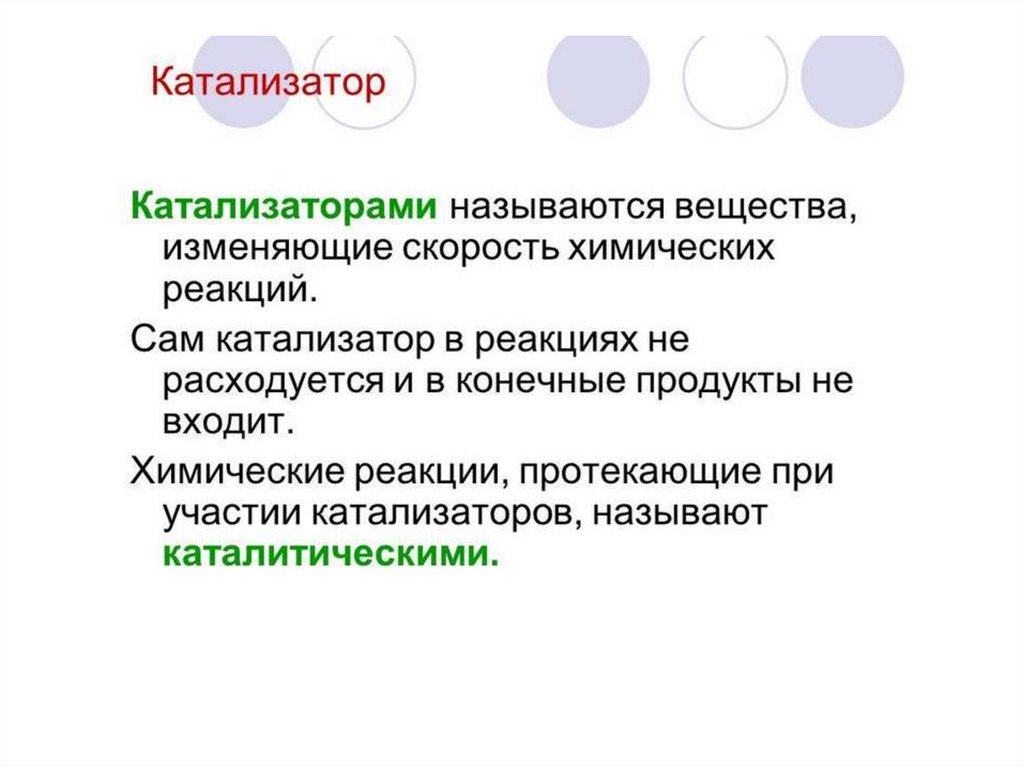
Катализаторы — это вещества, изменяющиескорость химической реакции или путь, по
которому она протекает, но остающиеся
неизменёнными качественно и количественно
по окончании реакции.
15.
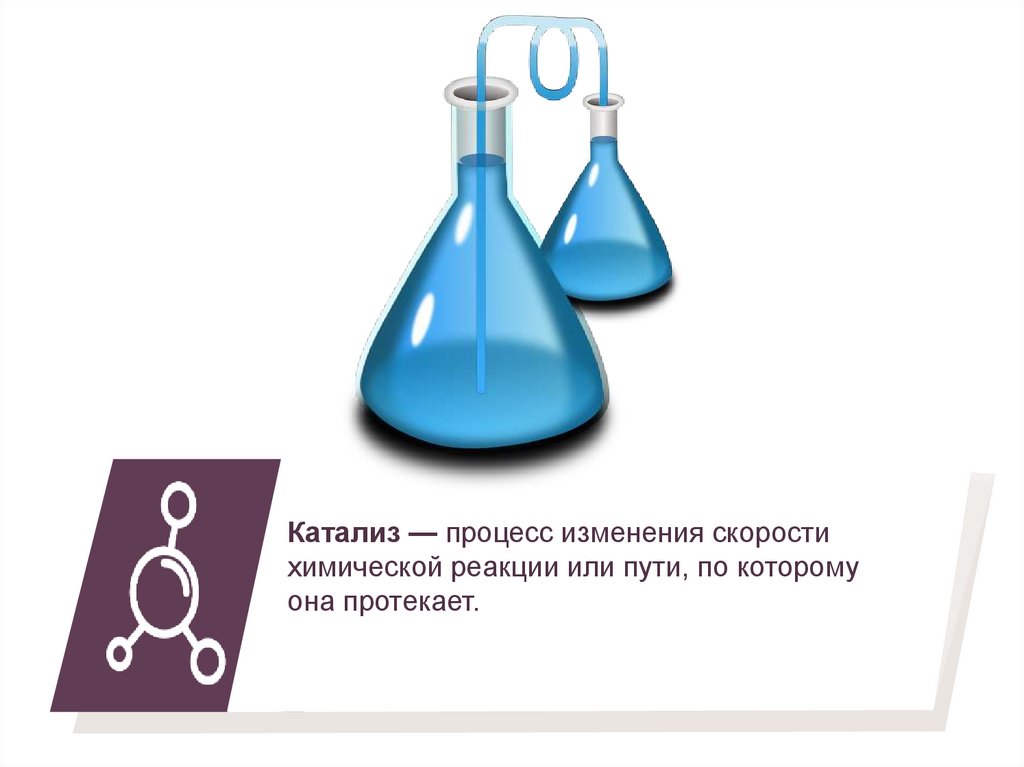
Катализ — процесс изменения скоростихимической реакции или пути, по которому
она протекает.
16.
17.
18.
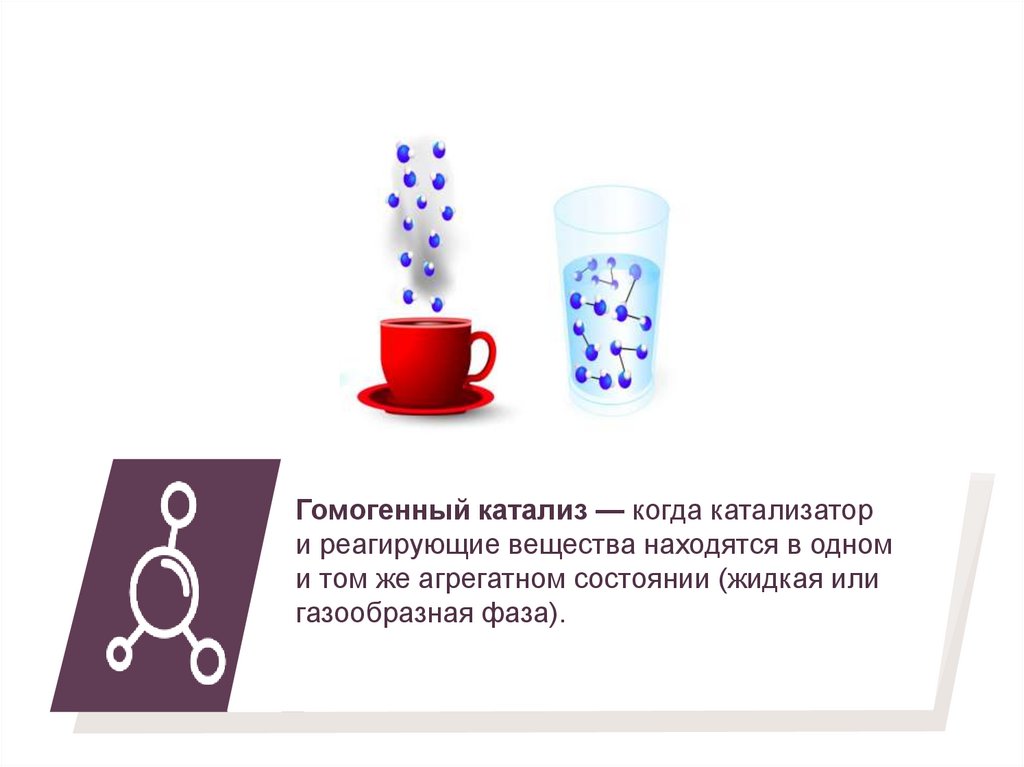
Гомогенный катализ — когда катализатори реагирующие вещества находятся в одном
и том же агрегатном состоянии (жидкая или
газообразная фаза).
19.
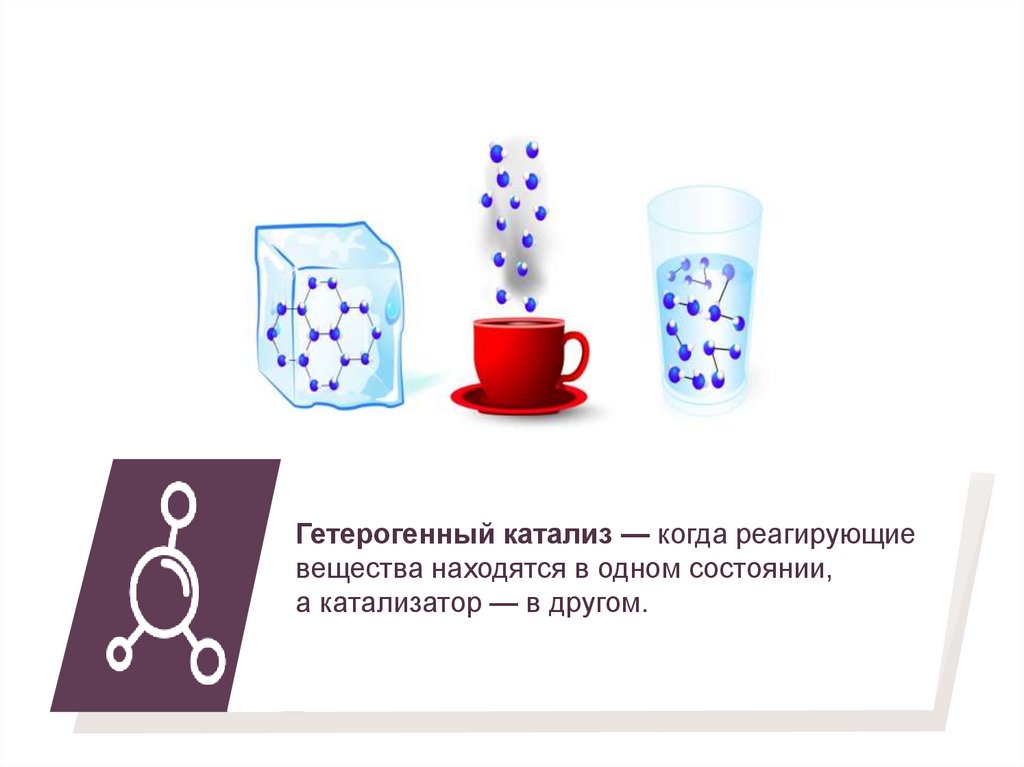
Гетерогенный катализ — когда реагирующиевещества находятся в одном состоянии,
а катализатор — в другом.
20.
21.
22.
23.
24.
25.
26.
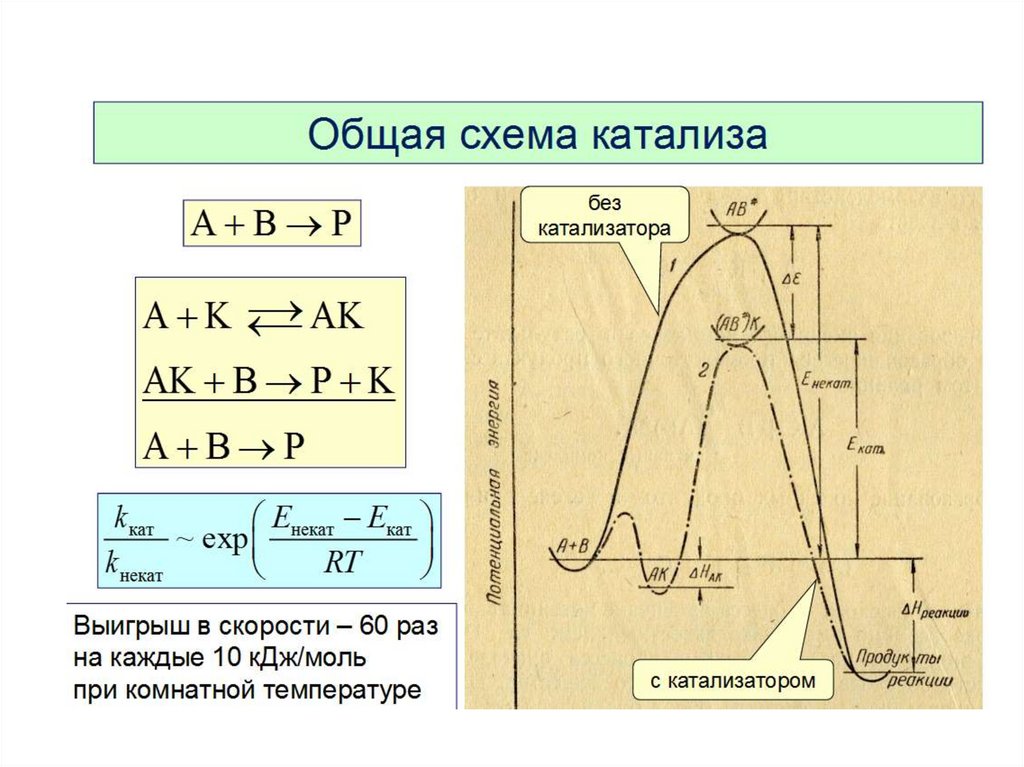
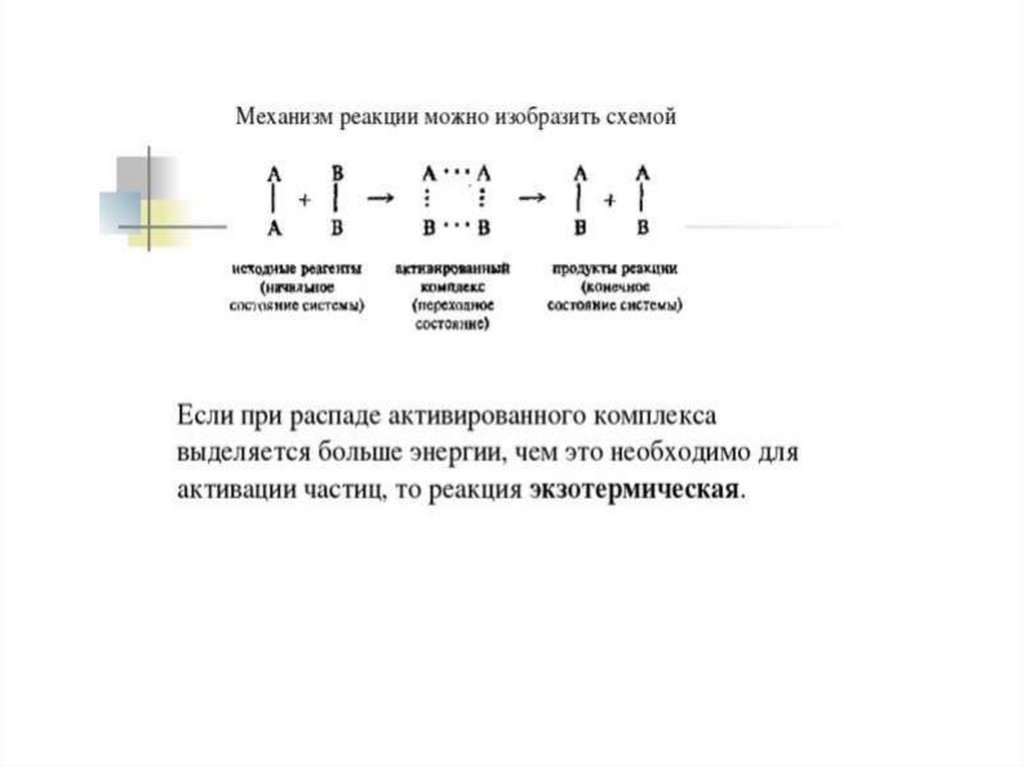
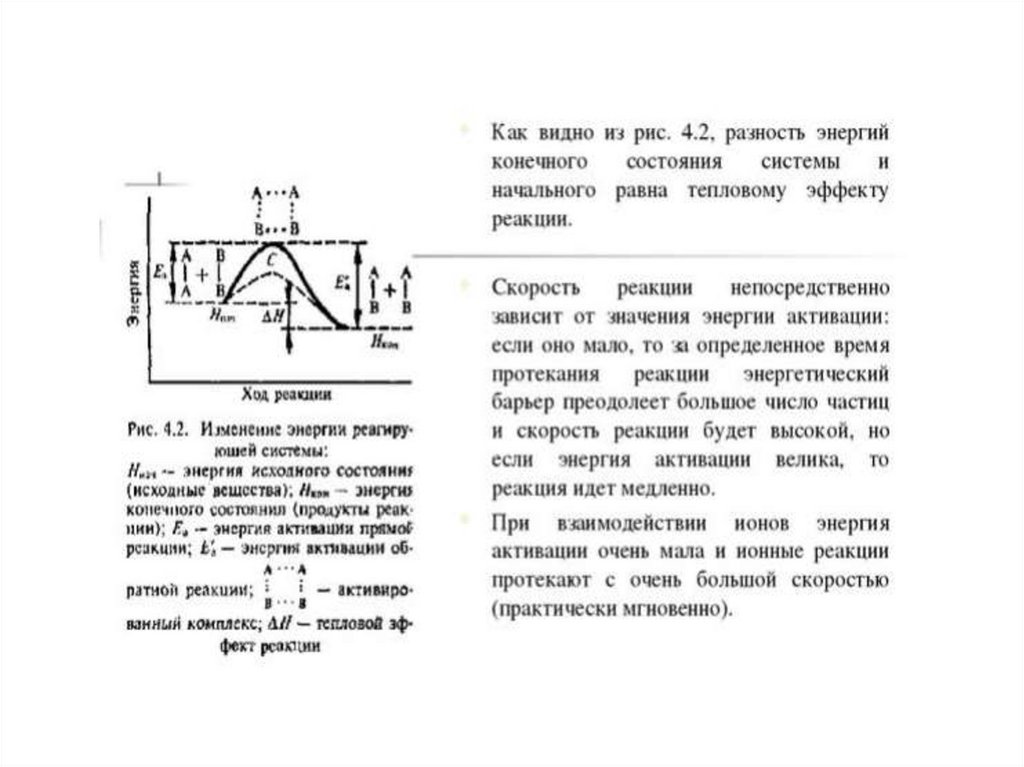
Для того чтобы вещества началивзаимодействовать,
их частицам нужно сообщить определённую
энергию, называемую энергией активации.
27.
28.
• Энергия активации зависит от природыреагирующих веществ и пути протекания
реакции и не зависит от температуры , если
с ее изменением не произошло изменений
механизма реакции. Опытным путем
установлено, что реакция с Еа <50
кДж/моль при 298 К идут с высокой
скоростью, это характерно для реакций с
участием радикалов или ионов. Если
реакция имеет Еа > 100 кДж/моль, то ее
скорость при 298 К неизмеримо мала
29.
Источники активации реагирующихвеществ:
• 1) термическая активация в результате
подвода теплоты из окружающей среды4
• 2) действие различного рода излучений
(свет, проникающая радиация);
• 3) действие быстрых частиц, возникающих
при ядерном распаде или в электрическом
разряде
30.
Энергия активации является оченьважной энергетической
характеристикой реакции, которая связана с
константой скорости реакции уравнением
Ea
Аррениуса:
k=A e
RT
где k – константа скорости реакции при
температуре Т; А – коэффициент Аррениуса
(предэкспоненциальный коэффициент),
учитывающий частоту столкновения частиц
31.
ориентированных определенным образом;
е – основание натурального логарифма;
Еа – энергия активации реакции,Дж/моль;
R – универсальная газовая постоянная =
8,31 Дж/моль ٠К
• Из этого уравнения следует, что чем больше
энергия активации, тем меньше будут
константа и скорость химической реакции,
т.к. в системе будет меньше число активных
частиц
32.
Значение энергии активации реакцииможно определить, измерив константы
скорости этой реакции при двух разных
температурах и используя следующее
уравнение:
k1
T1 T2
Ea =
2,3 R
T1 T2
lg
k2
k1 и k2 – константы скорости реакции при
температуре Т1 и Т2 .


























 Химия
Химия








