Похожие презентации:
Химическое равновесие и химическая кинетика
1.
Химическоеравновесие и
химическая
кинетика
2.
Обратимыми по направлениюхимическими реакциями
называются такие реакции,
которые при данных внешних
условиях могут самопроизвольно
протекать как в прямом, так и в
обратном направлении.
3.
Н2(газ) + J2(газ) 2HJ (газ),Go = 1,6 кДж/моль
Hb(р-р) + О2(газ) НbО2(р-р),
Go = -11 кДж/моль
С6Н12О6(тв) + 6О2(газ) 6СО2(газ) + 6Н2О(ж-ть),
Go = -2880 кДж/моль
Реакции обратимы, если
| Gреакции| 10 кДж/моль
4.
Гульдберг, Вааге и Бекетов открыли закон действующихмасс (здм).
Он отражает соотношение между равновесными
концентрациями реагирующих веществ. Вытекает из II
закона термодинамики.
Для реакции:
аА + bB dD + eE
G
Пс =
C Dd C Ee
C Aa C Bb
р-ции
= G +RTlnПc , где
, в отличие от
Кс
[ D ] d [ E ]e
[ A]a [ B ]b - это константа равновесия.
5.
Gор-ции
Gо
= -RTlnkc, т.к. при равновесии
р-ции
= 0 (стандартные условия)
С учетом этого:
Пс
G RT ln
К
Это уравнение изотермы химической реакции.
при Пс>К G>0 - в системе будет протекать обратная реакция
при Пс<К G<0 - в системе будет протекать прямая реакция
6.
КОНСТАНТЫ РАВНОВЕСИЯ:1) По способу выражения
а Dd а Ee
а) термодинамическая Ка = a
а A а Bb
б) концентрационная К с
[ D ] d [ E ]e
[ A]a [ B]b
РDd РEe
в) для газов через давление Кр = Р Aa РBb
7.
КОНСТАНТЫ РАВНОВЕСИЯ:2) По типу реакции
а) константа диссоциации (ионизации)
HNO2 H+ + NO2-
K(HNO2)
б) константа гидролиза
NH4+ + HOH NH4OH + H+
Kгидр.
в) константа автопротолиза воды
H2O + H2O H3O+ + OH-
K(H2O)
г) константа образования (нестойкости)
комплексов
Cu2+ + 4NH3 [Cu(NH3)4]2+
Kобр.
8.
Влияние температуры на величинуконстанты химического равновесия
выражается уравнением:
K 2 H 1
1
ln
K1
R T1 T2
o
К2 и К1 – константы равновесия при температурах Т2 и Т1,
соответственно;
Но – стандартная энтальпия данной реакции.
Это уравнение называют
уравнением изобары химической реакции.
9.
Принцип смещения химического равновесия былсформулирован Ле-Шателье в 1884 году.
Если на систему, находящуюся в
равновесии, воздействовать извне,
изменив какое-либо из условий, то в
результате протекающих в ней
процессов равновесие начнет
смещаться в том направлении, в
котором эффект воздействия
уменьшается.
Это Т, С, Р (для газов).
! катализаторы не влияют на химическое
равновесие
10.
Химическая кинетика – учение озакономерностях протекания
химических реакций.
Она рассматривает скорость и механизм
реакций.
Их знание позволяет управлять
реакциями, выбирать оптимальные
условия для их проведения.
11.
По механизму реакции делятся напростые и сложные.
Простые реакции осуществляются посредством
однотипных элементарных актов.
Под элементарным актом понимают единичный
акт взаимодействия или превращения частиц, в
результате которого образуются новые частицы
продуктов реакции или промежуточных
соединений.
12.
Для осуществления сложных реакцийнеобходимы два или более элементарных акта
(биохимические реакции).
а) параллельные
V1
А В
V2
D
V1
V2
б) последовательные
А В D
в) сопряженные
А D
В Е
кат
г) каталитические
А В
д) цепные
А В Е
G D
F
и т.д.
13.
Молекулярность реакции – число молекул,участвующих одновременно в элементарном акте.
Различают: мономолекулярные (термическое
разложение, цис-транс –
изомеризации и т.д.),
бимолекулярные (СО+О2 СО2+О)
К+HBr KBr + H
Hb+O2 HbO2
тримолекулярные (2NO+O2 2NO2)
2NO+Cl2 2NOCl
14.
Порядок реакции – это эмпирическиустановленная зависимость скорости от
концентрации реагирующих веществ.
Известны реакции:
нулевого порядка
первого порядка
второго порядка
дробного порядка
Скорость химической реакции – это изменение
концентрации реагирующих веществ за единицу
времени
15.
V = CA / tдля реакции А В
Средняя скорость
С
Vср
t
Истинная скорость
Vист
dС
dt
Единица измерения
моль
л с
16.
Гульдберг, Вааге и Бекетов (здм)Скорость простой реакции прямо пропорциональна
произведению концентрации реагирующих веществ
А+В D
V = k CA CB
где k = V,
если СА = СВ=1 моль/л
(константа скорости – единичная скорость)
17.
Для гетерогенных реакцийС(тв.фазы) = const
Например: СО2 + С = 2СО
V = - d(CO2) / dt = k C(CO2)
18.
Кинетическое уравнение реакции –функциональная зависимость
концентрации реагирующих веществ от
времени.
Они получаются из уравнений здм.
19.
1) Реакции нулевого порядка (скорость не зависит оконцентрации исходных веществ). Это гетерогенные
реакции.
А продукты
dC A
V
k
dt
dC A kdt
или
После решения уравнения:
СА = САо - kt (интегральное)
Если СА= САо/2,
то
t0,5 = CAo/2k
t0,5 – период полупревращения веществ
20.
2) Реакции первого порядкаА продукты реакции
dC A
kC A
dt
или
dC A
kdt
CA
После интегрирования:
CA
ln
kt
C Ao
или
C A C Ao e kt
21.
CAГрафик зависимости ln
C Ao
от t – прямая линия, где -tg =k
CA
ln
C Ao
Для СА = САо/2 имеем t0,5 = ln2/k,
т.е время полупревращения не зависит от СА.
22.
3) Реакции второго порядка2А продукты реакции
или
А + В продукты реакции
dC A
k C A2
dt
или
dC A
kdt
2
CA
Интегральное уравнение:
1
1
kt
С А С Ао
Для t0,5, когда СА=САо/2 t0,5
1
k C Ao
Реакции второго порядка – самые распространенные реакции
23.
Есть реакции псевдопервого порядка,если концентрация одного из веществ
большая и практически не меняется.
СН3СООС2Н5 + Н2О СН3СООН + С2Н5ОН
С(Н О) const
2
V k-Cэфира
24.
Порядок реакцииопределяется:
1. Физическими методами
2. Химическими методами (по t0,5)
3. Биохимическими методами
25.
Порядо ДифференциальнаяИнтегральная
к
форма уравнения
форма уравнения
реакции
реакции
реакции
0
dC
k
dt
C 0 Ct k t
I
dC
k C
dt
C0
ln
k t
Ct
II
dC
2
k C
dt
1
1
k t
Ct C 0
t0,5
Размерность
t0,5
t 0,5
Co
2k
моль
л с
t 0,5
ln 2
k
с
t 0,5
1
Co k
л
моль с
1
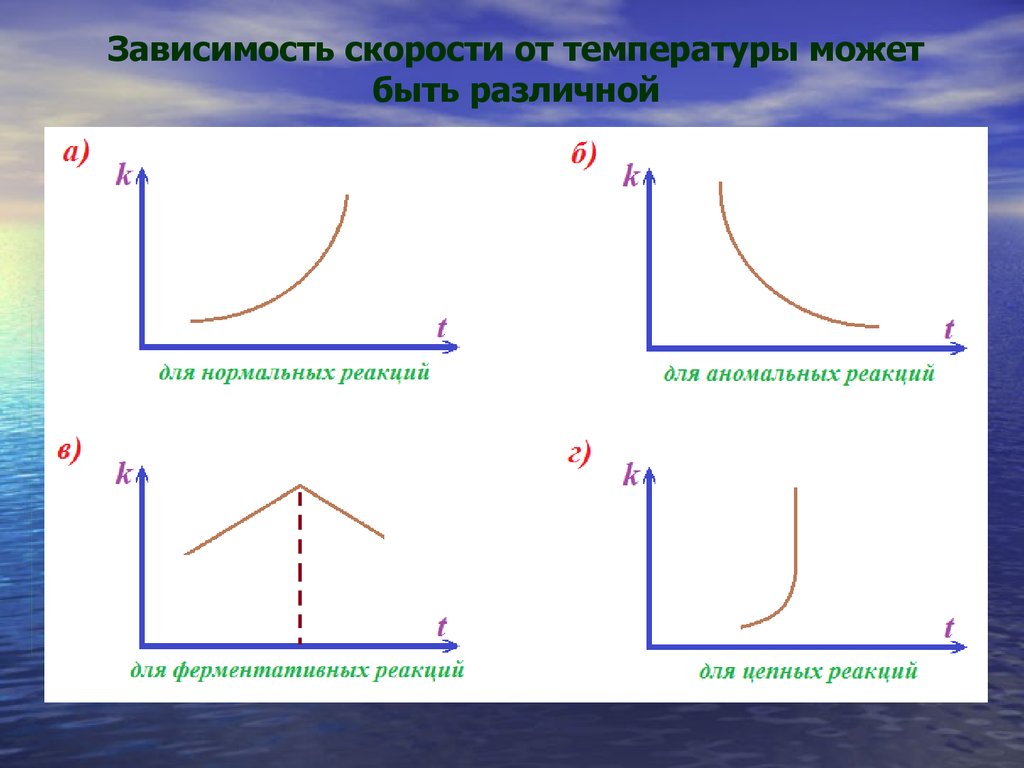
26.
Зависимость скорости от температуры можетбыть различной
27.
Правило Вант-Гоффа (для небольшихтемператур)
V2
V1
t 20 t10
10
или
Т1 10
Т1
=2 4 раз
Но для биохимических реакций
= 1,06 – 1,82 (при 310 50 К)
28.
С. Аррениус создал теорию активныхсоударений. Уравнение Аррениуса:
k A e
где
Eа
R T
А – предэкспоненциальный множитель,
пропорциональный числу столкновений
реагирующих частиц;
Еа – энергия активации реакции;
Дж
R = 8,31 моль К ;
е – основание ln.
о
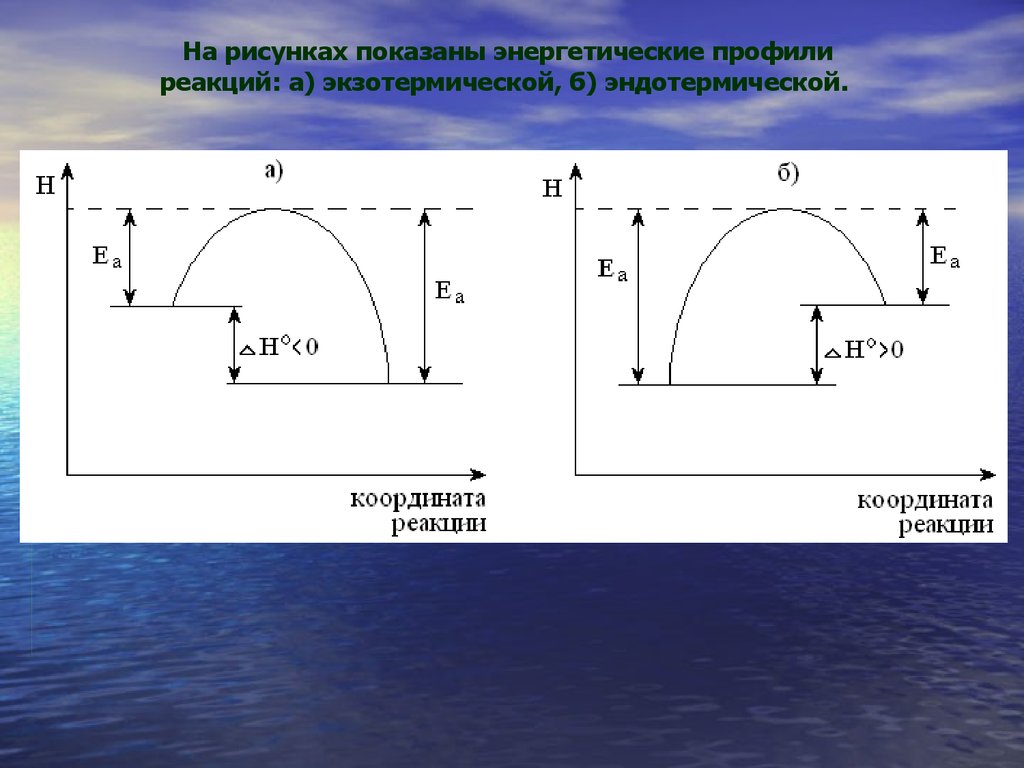
29.
На рисунках показаны энергетические профилиреакций: а) экзотермической, б) эндотермической.
30.
Энергия активации тот энергетическийбарьер, который должны
преодолеть исходные
вещества по пути
превращения в продукты
реакции, [Дж/моль].
31.
Для двух температуруравнение Аррениуса имеет вид:
k 2 Ea 1 1
ln
k1
R T1 T2
или
k2
2,3R lg
k1
Еа
1
1
T1 T2
k1 и k2 – константы скорости при температурах Т1 и Т2
32.
Катализ – это явление изменения скоростихимических реакций в присутствии веществ,
которые после завершения реакции остаются в
неизменном виде и количестве.
Положительный катализ - увеличение скорости реакции,
отрицательный катализ – уменьшение скорости реакции.
Катализаторы – увеличивают скорость реакции
(вызывают положительный катализ).
Ингибиторы – уменьшают скорость реакции
(вызывают отрицательный катализ).
Каталитические яды выводят катализаторы из строя,
отравляя их.
33.
Для ферментативных процессов:k1
Е S
ES
P
k
k2
1
где Е – энзим (фермент);
S – субстрат, вещество на которое
действует фермент;
ЕS – фермент-субстратный комплекс
или интермедиат;
Р – продукты реакции.
34.
Михаэлис и Ментен дали уравнениеферментативного катализа (уравнение
Михаэлиса – Ментен)
Vст
Vm S
Vo
kM S
Vст – стационарная скорость (она равна начальной скорости);
[S] – равновесная концентрация субстрата;
KM – константа Михаэлиса, равная k M k 1 k 2
k1
Vm – максимальная скорость процесса, равная Vm k C0 ( E ),
где Со(Е) – начальная концентрация фермента, k`- число
оборотов фермента.
35.
Ферменты - белковые вещества.Содержат один или несколько
активных центров, где и
происходит превращение
субстратов.
Металлоферменты – содержат
ионы металлов (Fe2+, Cu2+, Zn2+ и
др.)
36.
Механизм действия ферментов заключается визменении пути процесса превращения реагентов в
продукты. Новый путь характеризуется меньшим
энергетическим барьером, т.е. меньшей энергией
активации.
Обычно Еакт 10-100 кДж/моль
Ферменты ускоряют реакции в 104-105 раз.
Каталитические реакции – сложные,
многостадийные. Катализатор учавствует в
элементарном акте.
37.
Итак, на скорость химическихреакций оказывают влияние:
• природа реагирующих веществ;
• концентрации исходных веществ;
• температура;
• катализаторы;
• давление (если реагируют
газообразные вещества).
38.
БЛАГОДАРЮЗА ВНИМАНИЕ!




































 Физика
Физика Химия
Химия








