Похожие презентации:
Реакции ионного обмена
1.
Реакции ионногообмена
2.
Проверка домашнего задания №2-2 (а,б)3.
4.
Задание:1. Учебник: с.36-37 алгоритм составления
ионных уравнений
2. Прочитать этапы последовательных
действий, уравнения записать в тетрадь
(молекулярное, полное ионное и
сокращенное ионное)
5.
Записать в тетрадьмолекулярное уравнение
FeCl2 + 2KOH = Fe(OH)2↓ + 2KCl
полное ионное уравнение (расписываем по
таблице растворимости каждое вещество)
Fe2+ +2Cl- +2K+ +2OH- = Fe(OH)2↓ + 2K+ +2Clсокращенное ионное уравнение
Fe2+ + 2OH- = Fe(OH)2↓
6.
Реакции ионного обмена идут до конца, если:- выпадает осадок
BaCl2 + K2SO4 = BaSO4↓ + 2KCl
Ba2+ + 2Cl- + 2К+ + SO42- = BaSO4↓ + 2К+ + 2ClBa2+ + SO42- = BaSO4↓
7.
- выделяется газK2CO3 + 2HCl = 2KCl + CO2↑ + H2O
2К+ + CO32- +2H+ + 2Cl- =2К+ +2Cl- + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
8.
- образуется вода, как слабый электролитKOH + HCl = KCl + H2O
К+ + OH- + H+ + Cl- = К+ + Cl- + H2O
OH- + H+ = H2O
Учебник: с.38, таблица
уравнения в тетрадь
№3,
записать
9.
Домашнее задание:У: п.8
повторить химические свойства
кислот, оснований и солей
(смотреть шпаргалку)
10.
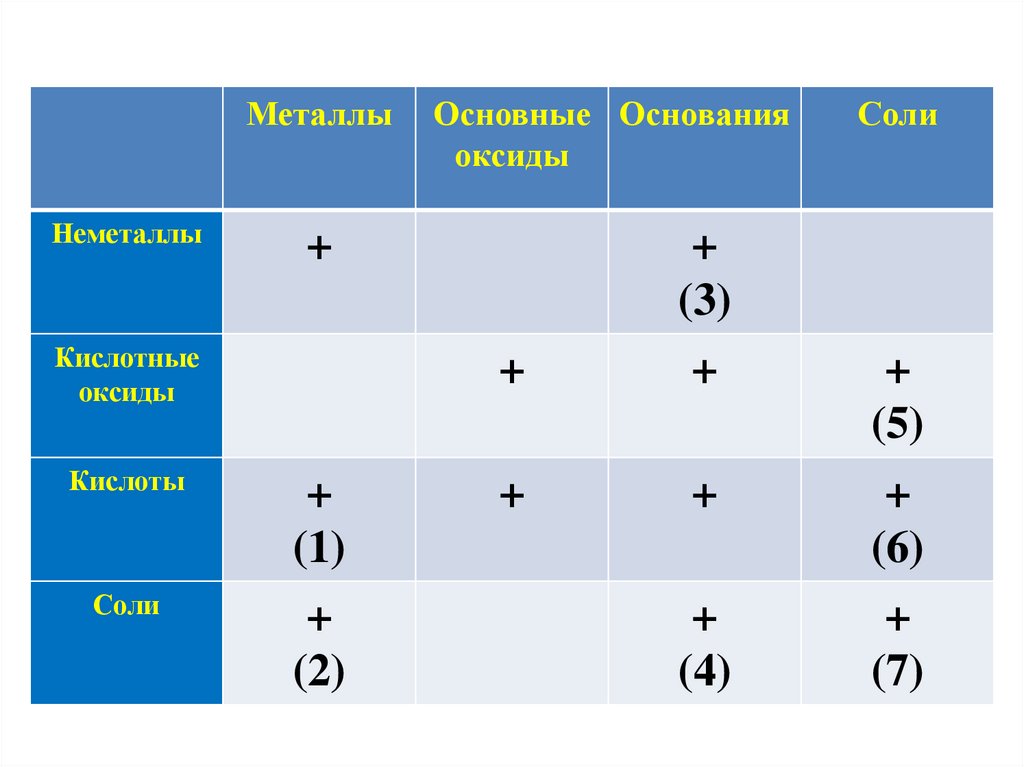
МеталлыНеметаллы
Основные Основания
оксиды
+
Кислотные
оксиды
Кислоты
+
(1)
Соли
+
(2)
Соли
+
(3)
+
+
+
(5)
+
+
+
(6)
+
(4)
+
(7)
11.
(1). Металлы взаимодействуют с кислотамисогласно ряда активности металлов:
- с разбавленными кислотами взаимодействуют
металлы, стоящие в ряду активности металлов
до Н2 (кроме НNO3)
Zn + 2HCl = ZnCl2 + H2
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
- с концентрированными кислотами
взаимодействуют практически все металлы
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
- Al, Cr, Fe – не взаимодействуют
12.
(2). Металлы взаимодействуют с солями приусловии:
- соль должна быть растворима;
- металл должен быть активнее металла,
входящего в состав соли (согласно ряда
активности металлов)
Fe + CuCl2 = Cu + FeCl2
Cu + FeCl2 = реакция не возможна
13.
(3).Основания
взаимодействуют
некоторыми неметаллами:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2KOH(хол.) + CL2 = KCl + KClO + H2O
6KOH(гор.) + 3CL2 = 5KCl + KClO3 + 3H2O
с
14.
(4). Основания взаимодействуют с солямипри условии:
- основание и соль должны быть растворимы;
- в продуктах образуется нерастворимое
основание
2KOH + CuSO4 = K2SO4 + Cu(OH)2↓
(р-р)
(р-р)
15.
(5). Соли взаимодействуют с некоторымикислотными оксидами:
CaCO3 + SiO2 = CaSiO3 + CO2↑
16.
(6). Соли взаимодействуют с кислотамипри условии:
- учитывать силу кислоты;
- в продуктах образуется газ или осадок
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
AgNO3 + HCl = AgCl↓ + HNO3
NaNO3 + HCl = реакция не возможна
17.
(7). Соли взаимодействуют друг с другомпри условии:
- взаимодействующие соли должны быть
растворимы;
- в продуктах должен образоваться осадок
BaCl2 + K2SO4 = BaSO4↓ + 2KCl
















 Химия
Химия








