Похожие презентации:
Дисперсные системы
1.
Дисперсные системыАйрапетян Л.Р.
2020 г
2. Дисперсные системы
Крайне редко в природе встречаются вещества видеально чистом виде и состоянии. Обычно это
гетерогенная система, состоящая как из
равномерно, так и из неравномерно
распределенных компонентов. В 1-ом случае
гетерогенные системы называются дисперсными.
Причем это необязательно 2 элемента,
встречаются соединения с тремя и более.
Гетерогенные системы, в которых одно вещество в
виде очень мелких частиц, равномерно
распределяется в другой, но не растворяется в ней,
— называются дисперсными системами.
3. Дисперсные системы
4. Дисперсные системы
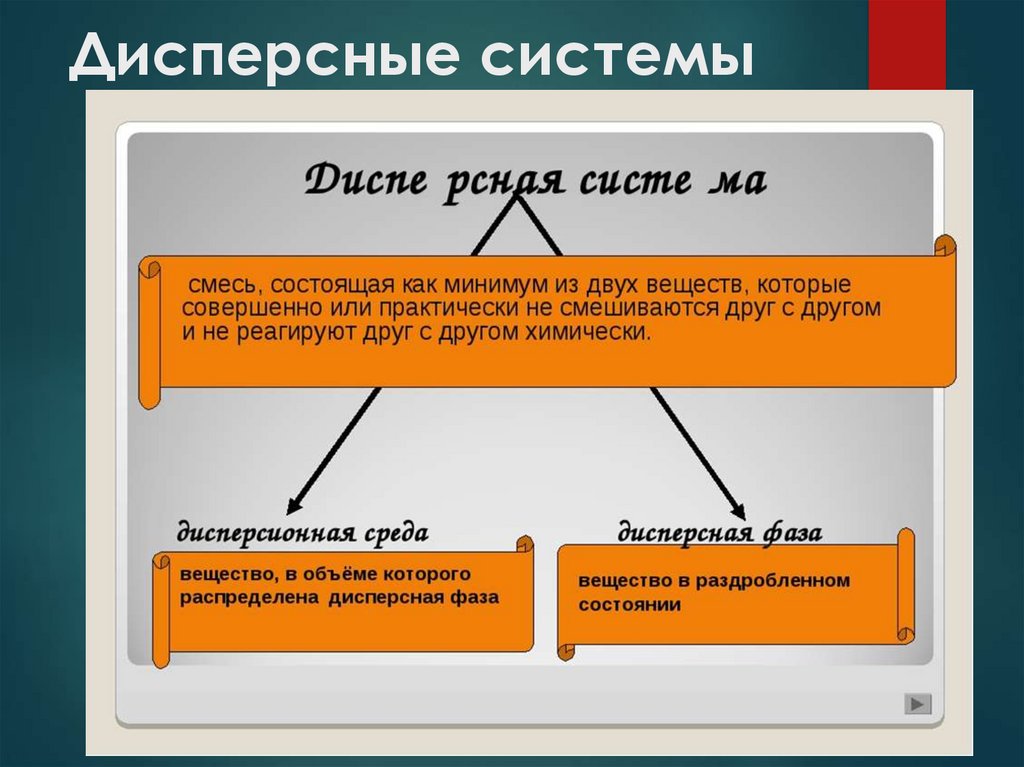
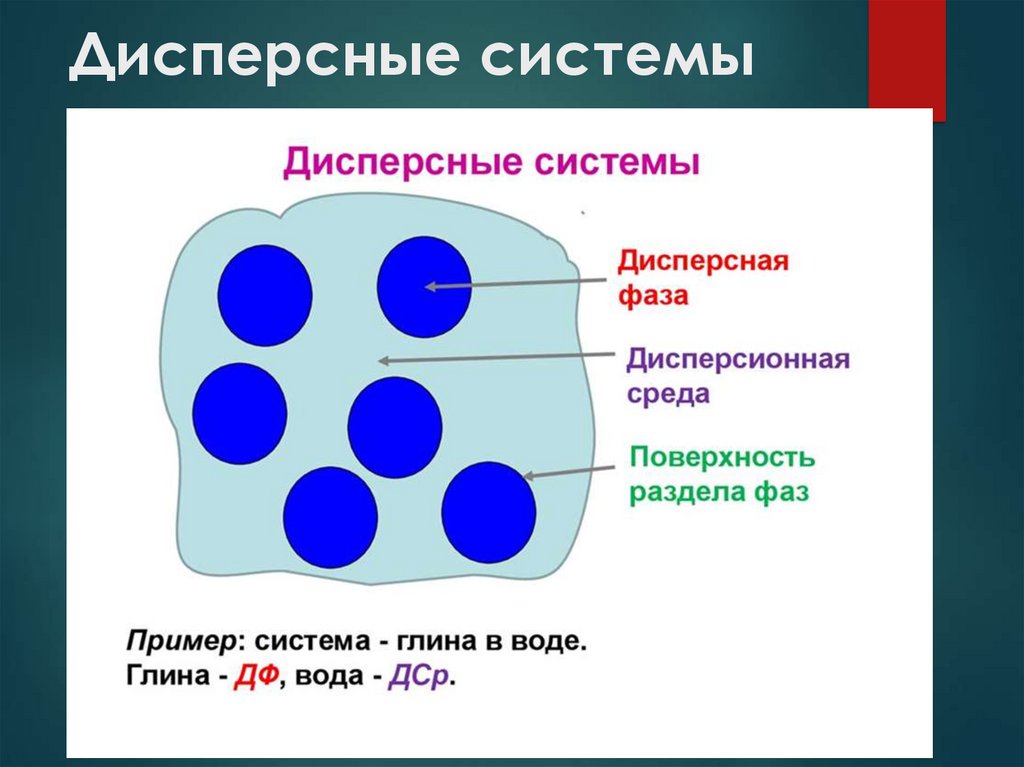
Дисперсные системы представляют собойгетерогенные структуры, внутри которых одно или более
веществ распределяются в другом. Они никак не
контактируют друг с другом, химические или иные
реакции полностью отсутствуют. Нет и смешения.
То вещество, которое распределено в другом,
называется дисперсной фазой. Вещество, в котором
распределена дисперсная фаза, называется
дисперсионной средой.
Частицы между собой не взаимодействуют, даже
имеется некая прослойка, которая разделяет их.
Поэтому системы являются гетерогенными или
неоднородными. Примеры дисперсных систем
встречаются в природе постоянно — морская вода,
почва, большинство продуктов питания и т. д. Они могут
иметь любое агрегатное состояние.
5. Дисперсные системы
6. Дисперсные системы
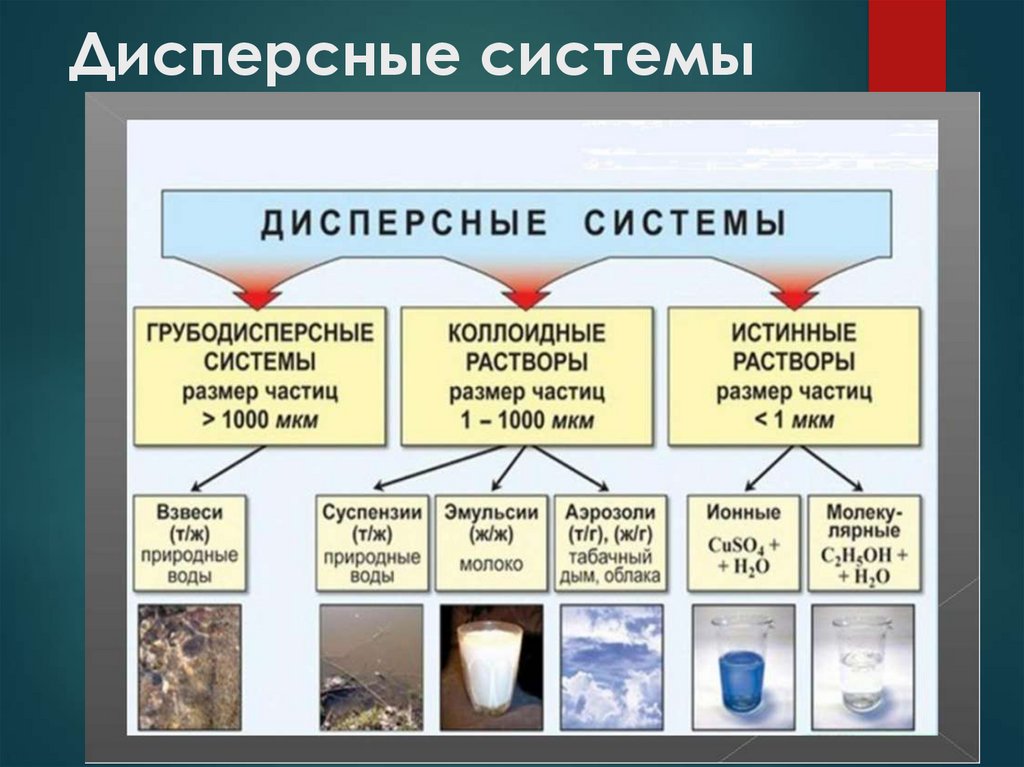
В зависимости от размера частиц дисперснойфазы различают грубодисперсные (взвеси) размер частиц больше 100 нм и тонкодисперсные
или коллоидные системы - от 1 до 100 нм. Если
размер частиц дисперсной фазы становится
меньше 1 нм, система перестает быть
гетерогенной, образуется истинный раствор. В
истинном растворе вещество раздроблено до
отдельных молекул или ионов.
Классификация дисперсных систем
осуществляется в соответствии с агрегатными
состояниями вещества. Имеется три вида
дисперсных систем: жидкое, твердое и
газообразное. Поэтому разделение происходит на
9 основных категорий.
7. Дисперсные системы
8. Дисперсные системы
9. Дисперсные системы
В зависимости от агрегатного состояниядисперсной фазы и дисперсионной среды
дисперсные системы разделяют на суспензии,
эмульсии, пены и аэрозоли. В суспензии твёрдые
частицы распределены в жидкости. Эмульсия
состоит из мелких капель жидкости, равномерно
распределённых в другой жидкости, причем эти
жидкости взаимно нерастворимы. Пена – это
мелкие пузырьки газа в жидкости. Аэрозоль
представляет собой газообразную среду, в которой
распылены мелкие твёрдые или жидкие частицы.
10. Дисперсные системы
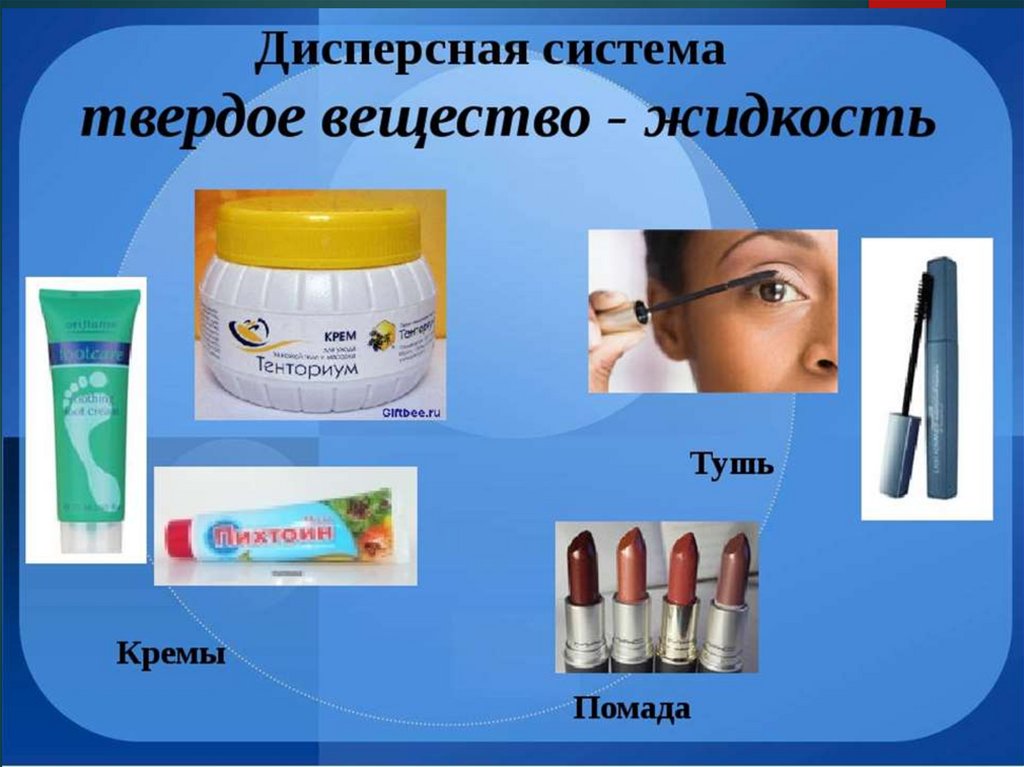
Суспензия – грубодисперсная система, в которойтвёрдые частицы размером более 10-3 см равномерно
распределены в жидкой дисперсионной среде.
Эмульсия – грубодисперсная система, в которой одна
жидкая фаза в виде отдельных мелких капель
равномерно распределена в другой жидкости, при
этом жидкости взаимно нерастворимы. Н-р, эмульсия
масла в воде, майонез, молоко.
Золь (коллоидный раствор) – тонкодисперсная
система, в которой твёрдые частицы дисперсной фазы
размером 10-7 – 10-5 см равномерно распределены в
жидкой среде.
11. Дисперсные системы
Аэрозоль – грубодисперсная система, в которой твёрдые (н-р,смог, пылевое облако) или жидкие (облака, радуга,
дезодорант, лак для волос из баллончика) частицы размером
более 10-3 см равномерно распределены в газообразной
среде.
Гель – полутвёрдая студнеобразная трёхмерная ячеистая
структура, каркас которой образован коллоидными
частицами, а в прослойках между частицами удерживается
дисперсионная среда. При нагревании гель может
превратиться в золь.
Размеры частиц дисперсной фазы в грубодисперсных
системах слишком большие, со временем они оседают –
происходит седиментация.
Седиментация – процесс оседания крупных частиц
дисперсной фазы.
Синерезис – самопроизвольное выделение жидкости из гелей.
12. Дисперсные системы
Получение и свойства коллоидных растворовТонкодисперсные коллоидные системы получили
название «золь». Золи могут быть образованы как
неорганическими веществами, так и
органическими макромолекулами, размеры
которых превышают 1 нм, например, белками.
Приготовить золь можно смешиванием
малорастворимого вещества с растворителем
(раствор крахмала, яичного белка).
13. Дисперсные системы
Получение и свойства коллоидных растворовЗоли прозрачны, как и истинные растворы. Чтобы
отличить золь от истинного раствора, надо посмотреть
на проходящий через раствор луч в отражённом
свете. В коллоидном растворе свет рассеивается,
образуя светлый конус. Это явление получило
название «эффект Тиндаля» - по фамилии
английского физика Джона Тиндаля, который впервые
описал и объяснил это явление. С древних времён
люди ценили драгоценный камень опал за игру света.
Его окраска в зависимости от угла зрения изменяется
с голубой на желтоватую. Опал – это затвердевший
коллоидный раствор, а свойство золей изменять
окраску в проходящем и отражённом свете получило
название «опалесценция».
14. Дисперсные системы
15. Дисперсные системы
Коагуляция коллоидных растворовЕсли к золю добавить раствор электролита, произойдет
нейтрализация заряда коллоидных частиц. Золь потеряет
устойчивость, частицы начнут слипаться. Слипание
коллоидных частиц называется коагуляцией. Коагуляцию
можно вызвать длительным нагреванием золя, а также
сливанием золей с противоположно заряженными
частицами. Если коллоидные частицы слабо
взаимодействуют с дисперсионной средой, то в
результате коагуляции образуется осадок. Если
коллоидные частицы хорошо взаимодействуют с
растворителем, то они захватывают часть жидкости, в
результате образуется гель. Гель – трёхмерная ячеистая
структура, каркас которой образован коллоидными
частицами, а в ячейках удерживается жидкость.
16. Дисперсные системы
17.
18.
19.
20.
21. Домашнее задание
Раздел 3.6.Контрольные вопросы и задания № 1-5 стр.
56.


















 Химия
Химия