Похожие презентации:
Галогены: фтор F, хлор Cl, бром Br, иод I, астат At
1.
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3.
F+9
))
2s22р5
Иод
I
+53
Астат
At
+85
2 8 7
))))
4s24p5
2 8 18 7
)))))
2 8 18 18 7
))))))
2 8 18 32 18 7
5s25p5
6s26p5
Окислительные свойства
Br
+35
Бром
3s23p5
Электроотрицательность
)))
Cl
+17
Хлор
Радиус атома
2 7
Неметаллические свойства
Фтор
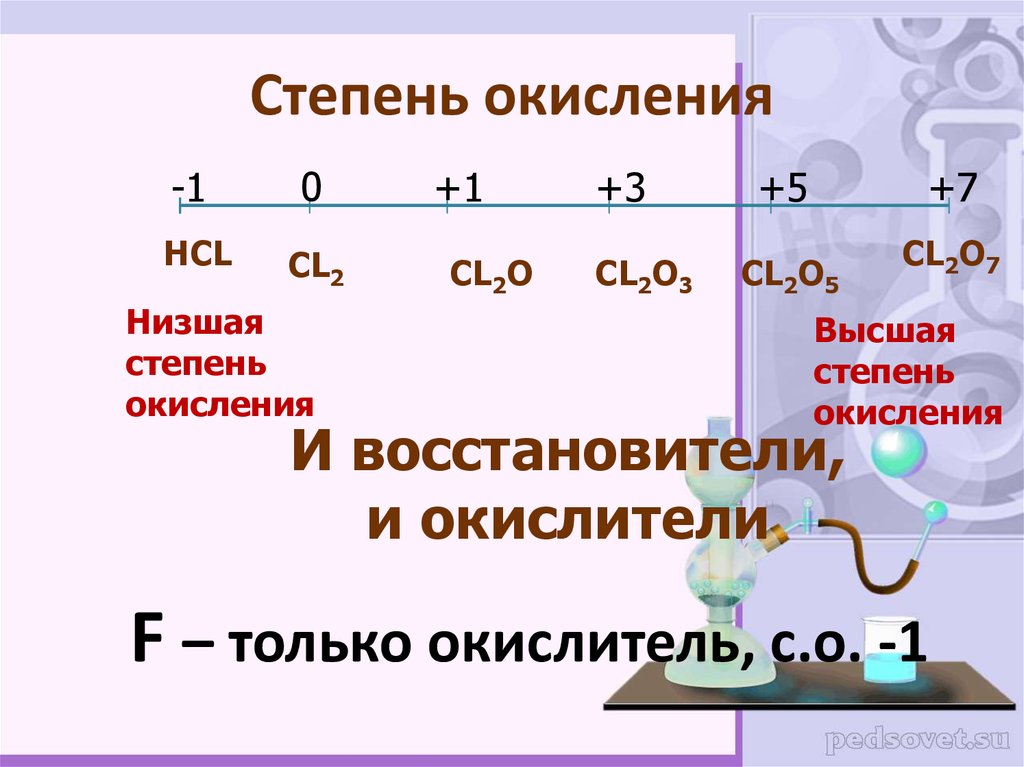
4. Степень окисления
-10
НCL
CL2
Низшая
степень
окисления
+1
CL2O
+3
CL2O3
+5
+7
CL2O5
CL2O7
Высшая
степень
окисления
И восстановители,
и окислители
F – только окислитель, с.о. -1
5.
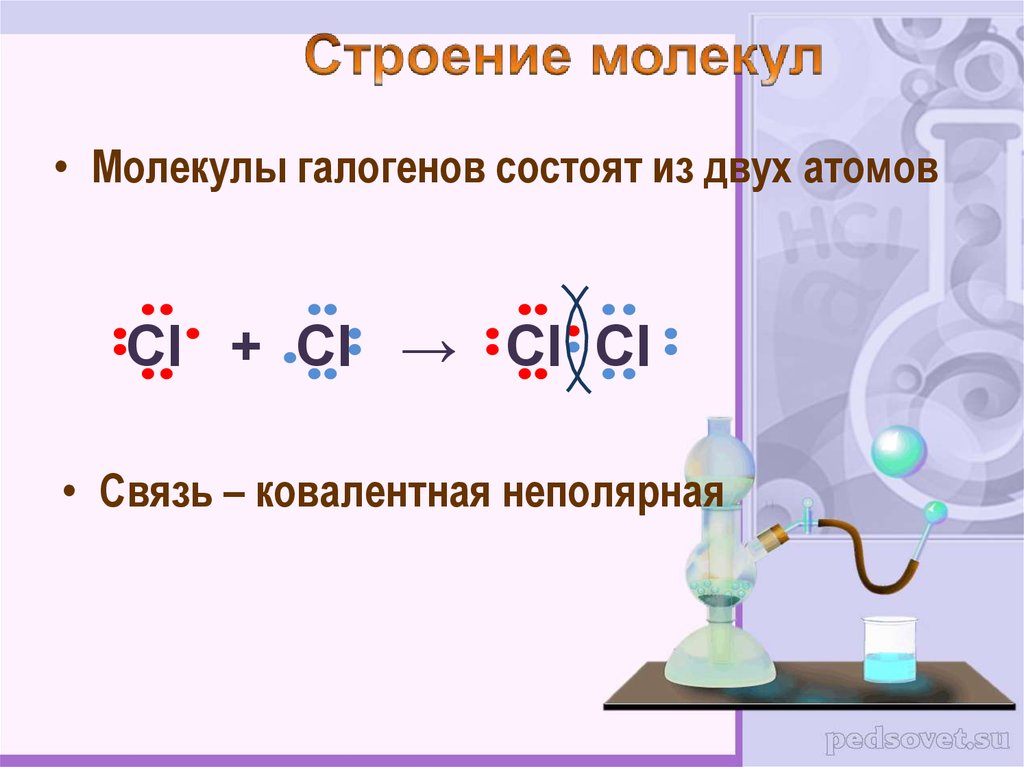
• Молекулы галогенов состоят из двух атомовCl + Cl → Cl Cl
• Связь – ковалентная неполярная
6.
В твердом состоянии фтор, хлор, бром,йод имеют молекулярные
кристаллические решётки.
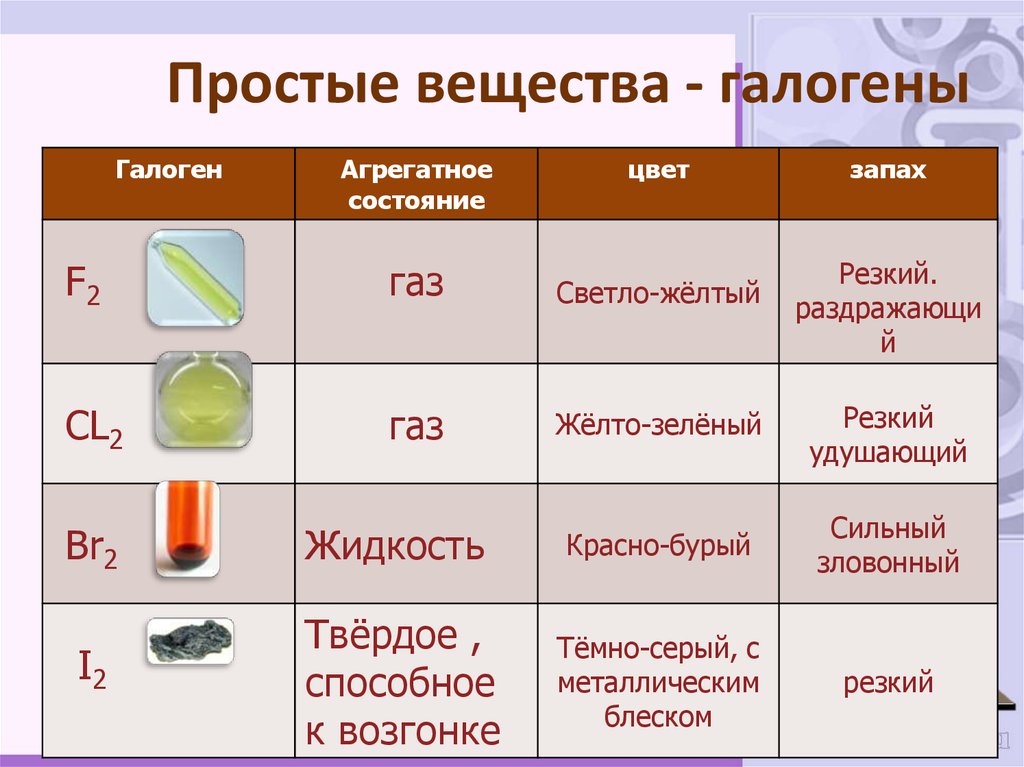
7. Простые вещества - галогены
ГалогенАгрегатное
состояние
цвет
запах
F2
газ
Светло-жёлтый
CL2
газ
Жёлто-зелёный
Резкий
удушающий
Сильный
зловонный
резкий
Br2
Жидкость
Красно-бурый
I2
Твёрдое ,
способное
к возгонке
Тёмно-серый, с
металлическим
блеском
Резкий.
раздражающи
й
8. Температуры кипения и плавления с увеличением атомной массы галогенов увеличиваются.
Галогены как простые вещества.Температуры кипения и плавления с
увеличением атомной массы галогенов
увеличиваются.
9.
Галогены как простые вещества.Все галогены – токсичные вещества!
Жидкий хлор вызывает
серьезные ожоги кожи.
Очень радиоактивен,
поэтому о нём сравнительно
мало известно.
Газообразный хлор оказывает сильное
раздражающее действие, особенно
на глаза и дыхательную систему.
8. Галогены имеют характерный резкий
запах .
10. ФТОР
1. Повышает устойчивостьзубов к кариесу,
2. Стимулирует
кроветворение,
3. Репаративные процессы
при переломах костей,
4. Реакции иммунитета,
5. Участвует в росте скелета,
6. Предупреждает развитие
старческого остеопороза.
11.
Потребность во фторе взрослогочеловека - 2-3 мг/сут. Накапливается
в костной ткани и зубах.
!!!При недостатке фтора
развивается кариес!!!
12. ХЛОР
1.Убиваетболезнетворные
бактерии
13.
14.
Жидкий хлор вызывает серьезныеожоги кожи.
Газообразный хлор оказывает сильное
раздражающее действие, особенно на
глаза и дыхательную систему.
15.
16. БРОМ
1. NaBr и KBr – одни из лучшихсредств против бессонницы и
усталости!!!
2. LiBr - предотвращает коррозию в
холодильных установках,
обезвоживает минеральные
масла, помогает
кондиционировать воздух.
3. NaBr добавляют в дубильные
растворы
4. Потребность в Br у органов
практически всех живых существ!
В особенности, в этом вещ-ве
нуждается человеческий мозг
17. ЙОД
1. Антисептическоесредство
2. I играет огромную
роль в человеческом
организме!!!
Нехватка в организме
йода приводит к
гормональным
нарушениям!
18.
19.
20. АСТАТ
1. Оченьрадиоактивен!!
!
2. Необходим
человеческому
организму в
небольших
количествах
(щитовидная
железа)
21.
22. Распространенность в природе
флюорит CaF2галит NaCl
сильвин KCl
сильвинит KCl•NaCl
23.
1. Взаимодействие с металламиХлор непосредственно реагирует почти со
всеми металлами (с некоторыми только в
присутствии влаги или при нагревании):
2Na + Cl2
2Fe + 3Cl2
-1
2NaCl
-1
2FeCl3
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота,
кислорода и инертных газов), образует
соответствующие хлориды.
5Cl2 + 2P
-1
2PCl5
F2 -наиболее
реакционноспо
собен , реакции
идут на холоду,
при
нагревании –
даже с
участием Au,
Pt.
24. 4. Взаимодействие с водородом
H2 + F2 = 2HF (со взрывом)H2 + Cl2 = 2HCl (на свету)
H2 + Br2 = 2HBr (при нагревании)
H2 + I2 = 2HI (при нагревании,
обратимая реакция)
25.
3. Взаимодействие с водой2F2 + 2H2O = 4HF + O2
с образованием смеси кислот
Cl02 + H2О
+1
-1
HCl + HClO
соляная хлорноватистая
4. Взаимодействие с солями других галогенов
более активные галогены вытесняют менее активные из
растворов их солей
-1
0
-1
0
Cl2 + 2NaBr
2NaCl + Br2
5. Взаимодействие с растворами щелочей
с образованием солей
2NaOH + Cl2
NaCl + NaClO + H2O холодный раствор
гипохлорит натрия
6NaOH + 3Cl2 t 5NaCl + NaClO3 + 3H2O горячий раствор
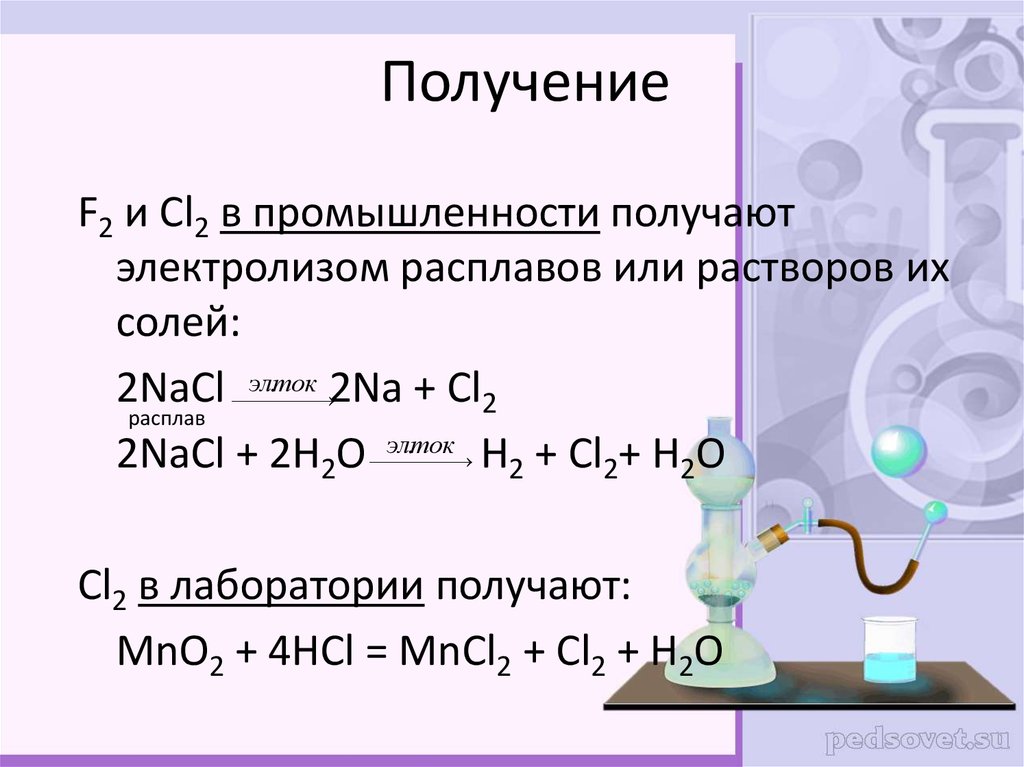
26. Получение
F2 и Cl2 в промышленности получаютэлектролизом расплавов или растворов их
солей:
2NaCl эл.ток 2Na + Cl2
расплав
2NaCl + 2H2O эл.ток H2 + Cl2+ H2O
Cl2 в лаборатории получают:
MnO2 + 4HCl = MnCl2 + Cl2 + H2O
27.
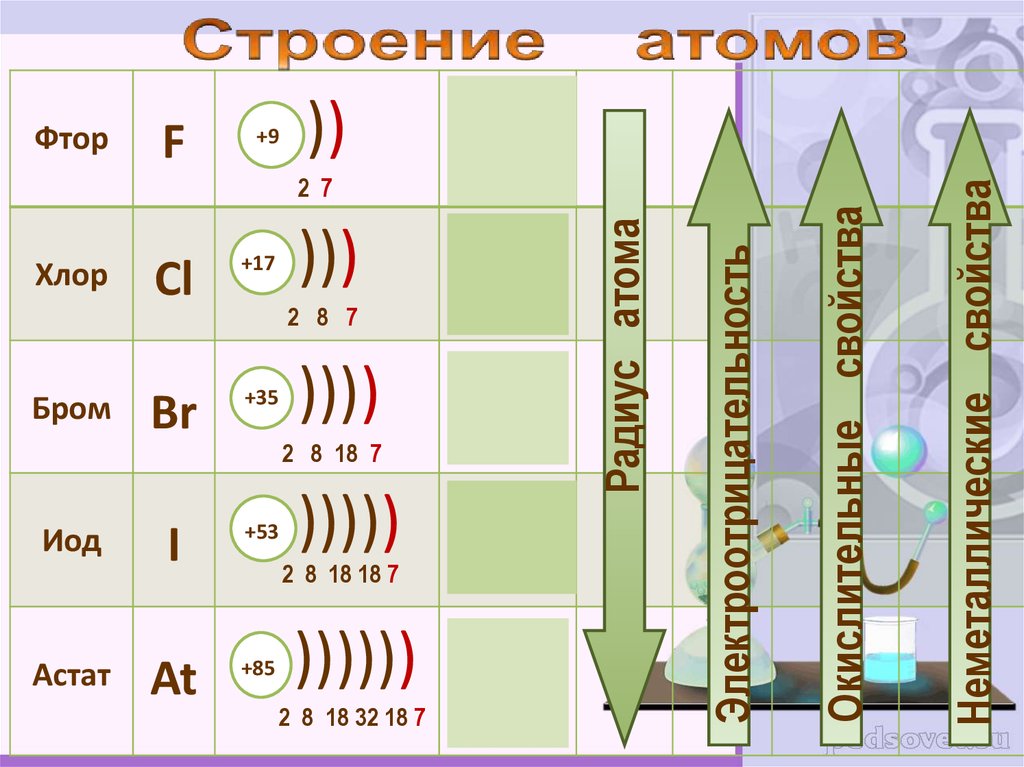
1.В состав VΙΙА подгруппы ПС входят элементы –фтор, хлор, бром, йод, астат.
2.Эти элементы имеют общее название – галогены.
3.Строение последнего уровня элементов
VΙΙА подгруппы имеет вид – ns2np5
4.Галогены проявляют сильные окислительные
свойства.
5.Фтор в химических реакциях проявляет только
окислительные свойства, характерная для него
Степень окисления - -1 .
28.
6.Способность элементов притягивать к себеэлектроны других элементов называется величиной
электроотрицательности.
7.В группах ПС сверху вниз радиус атомов
увеличивается.
8.В группах ПС сверху вниз величина
электроотрицателности уменьшается.
9.В периодах ПС радиус атомов уменьшается,
величина электроотрицательности увеличивается.
29.
10.Молекулы галогенов в свободном состояниисостоят из двух атомов.
11.Связь в молекулах галогенов – ковалентная
неполярная.
12.В твердом состоянии F2, Cl2, Br2, J2 имеют
молекулярные кристаллические решетки.
13.В своем периоде каждый галоген является самым
сильным окислителем.
14.Химическая активность галогенов от F к J как
неметаллов ослабевает, у кристаллов иода
появляется металлический блеск.
30.
В периодической системе галогены находятсяв:
А) главной подгруппе VIII группы;
Б) побочной подгруппе VII группы;
В) главной подгруппе VII группы;
Г) главной подгруппе VI группы.
31.
Для галогенов характерна степеньокисления:
А) -2;
Б) -1 и -2;
В) -2 и -3;
Г) -1.
32.
Галогены могут проявлять положительнуюстепень окисления в соединениях с:
А) водородом;
Б) кислородом;
В) с металлами;
Г) ни с одним из этих веществ.
33.
Как меняется химическая активностьгалогенов в ряду: F, Cl, Br, I?
А) увеличивается;
Б) меняется беспорядочно;
В) уменьшается;
Г) не меняется.
34.
При обычных условиях бром - это:А) газ;
Б) жидкость;
В) кристаллическое в-во;
Г) жидкость или кристаллическое в-во.
35.
Свободных орбиталей нет у:А) хлора;
Б) брома;
В) йода;
Г) фтора.
36.
Галогены в твердом состоянии имеют:А) атомную кристаллическую решетку;
Б) молекулярную кристаллическую решетку;
В) А и Б;
Г) имеют особое строение.
37. Соединения галогенов: 1. Галогеноводороды
Прочностьсвязи Н-Hal
Длина
связи Н-Hal
38. Физические свойства галогеноводородов
1) Бесцветные газы (HF при t<19,5 0C –жидкость)
2) С резким запахом
3) Токсичны
4) Хорошо растворяются в воде
5) Дымят во влажном воздухе
6) Растворы галогеноводородов – кислоты
1V (H2O) растворяется 500V (HCl)
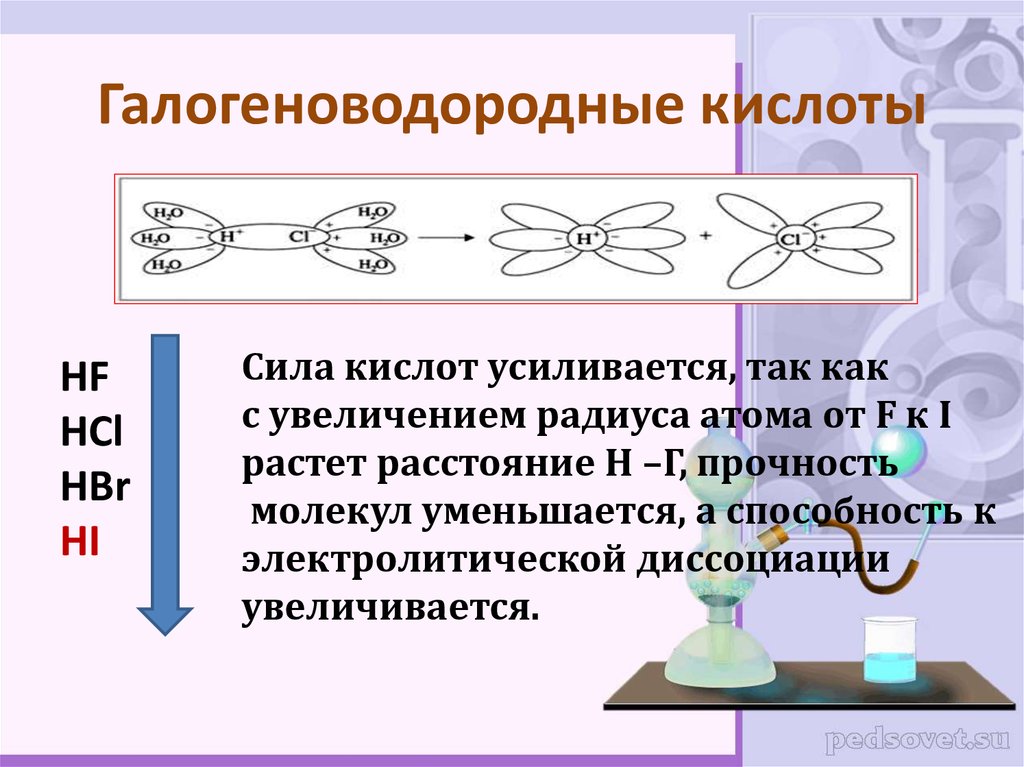
39. Галогеноводородные кислоты
HFHCl
HBr
HI
Сила кислот усиливается, так как
с увеличением радиуса атома от F к I
растет расстояние Н –Г, прочность
молекул уменьшается, а способность к
электролитической диссоциации
увеличивается.
40. Получение хлороводорода
1) В промышленности: синтезом изводорода и хлора:
H2 + Cl2 = 2HCl
2) В лаборатории:
t
NaCl (крист.) + H2SO4 (конц.) = HCl↑ + NaHSO4
41. Соляная кислота
Физические свойства: бесцветная,дымящая на воздухе жидкость,
тяжелее воды
Химические свойства:
Типичная кислота
С какими веществами
взаимодействуют кислоты?
42. Плавиковая кислота
Используют для изготовления надписей ирисунков на стекле.
SiO2 + 2HF = SiF4↑ + 2H2O
Травление или сатинирование
Эту технологию начали использовать в
1771 г. с открытием плавиковой кислоты.
Сама эта кислота делает стекло
блестящим, а ее газы - матовым. Травить
можно всю поверхность полностью (при
этом она остается гладкой) или выборочно
(только рисунок).
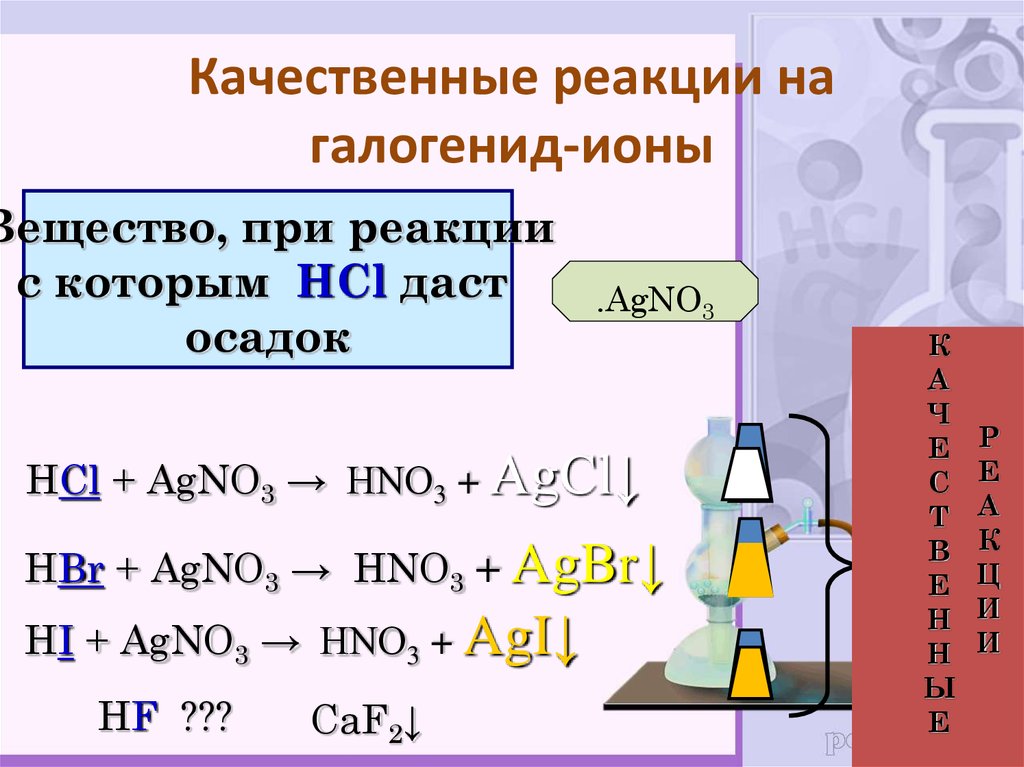
43. Качественные реакции на галогенид-ионы
Вещество, при реакциис которым HCl даст
осадок
.AgNO3
HCl + AgNO3 → HNO3 + AgCl↓
HBr + AgNO3 → HNO3 + AgBr↓
HI + AgNO3 → HNO3 + AgI↓
HF ???
CaF2↓
К
А
Ч
Е
С
Т
В
Е
Н
Н
Ы
Е
Р
Е
А
К
Ц
И
И
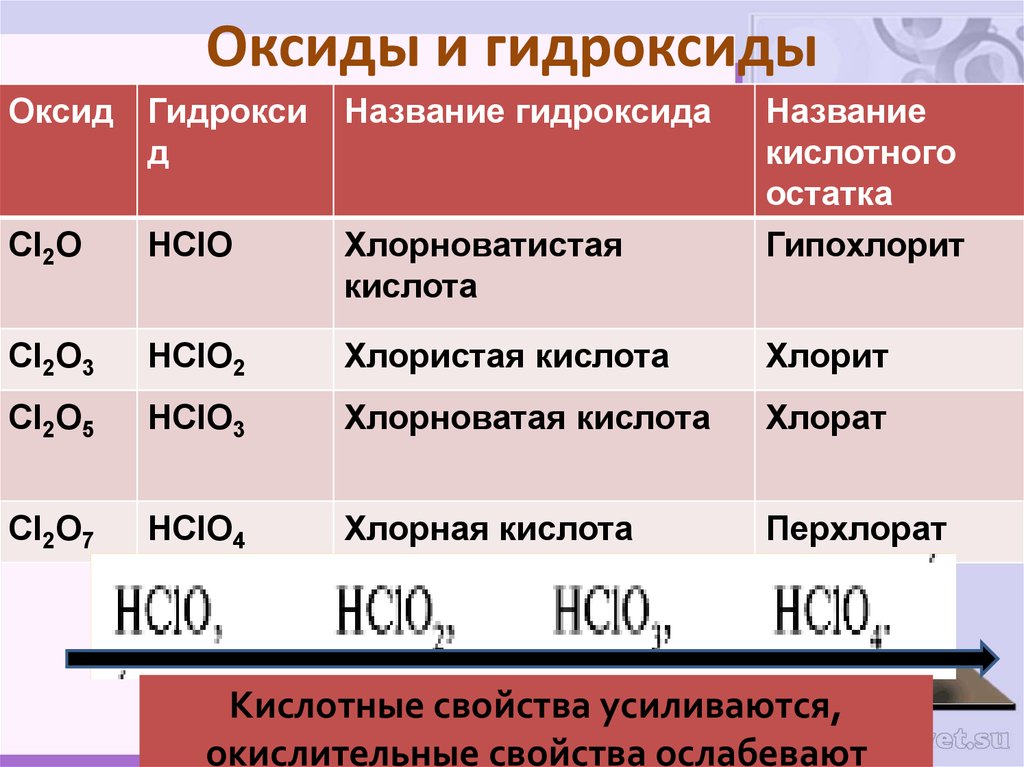
44. Оксиды и гидроксиды
Оксид Гидроксид
Название гидроксида
Название
кислотного
остатка
Гипохлорит
Cl2O
HClO
Хлорноватистая
кислота
Cl2O3
HClO2
Хлористая кислота
Хлорит
Cl2O5
HClO3
Хлорноватая кислота
Хлорат
Cl2O7
HClO4
Хлорная кислота
Перхлорат
Кислотные свойства усиливаются,
окислительные свойства ослабевают
45.
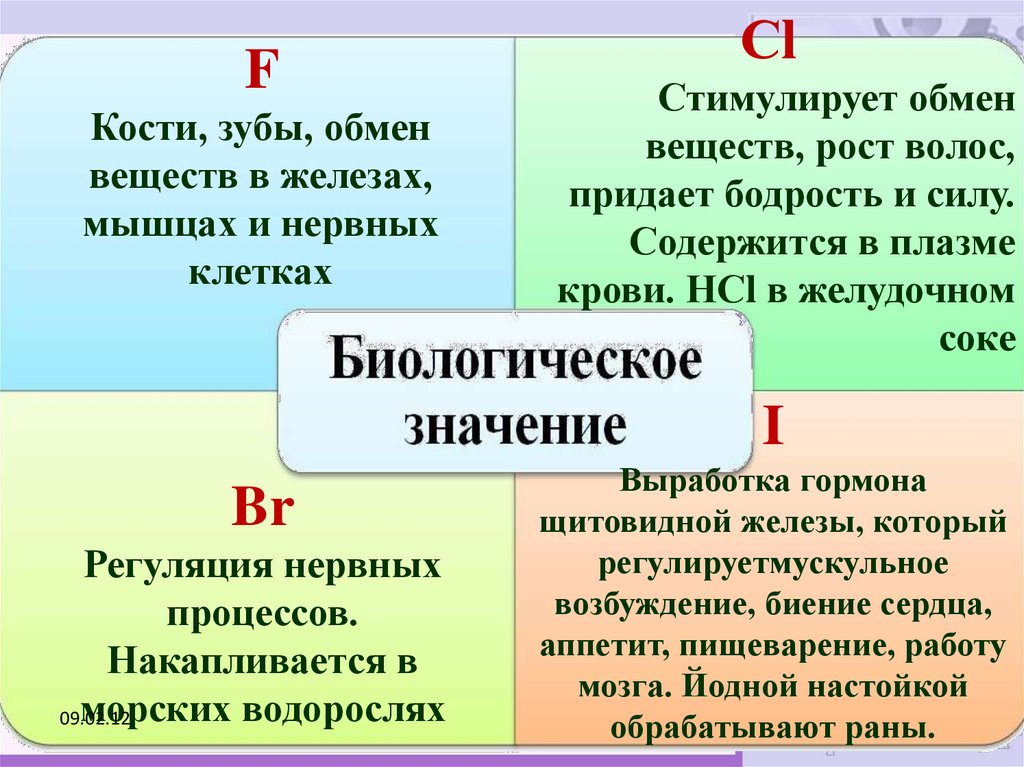
FКости, зубы, обмен
веществ в железах,
мышцах и нервных
клетках
Сl
Стимулирует обмен
веществ, рост волос,
придает бодрость и силу.
Содержится в плазме
крови. НСl в желудочном
соке
I
Br
Регуляция нервных
процессов.
Накапливается в
морских водорослях
09.02.12
Выработка гормона
щитовидной железы, который
регулируетмускульное
возбуждение, биение сердца,
аппетит, пищеварение, работу
мозга. Йодной настойкой
обрабатывают раны.
46.
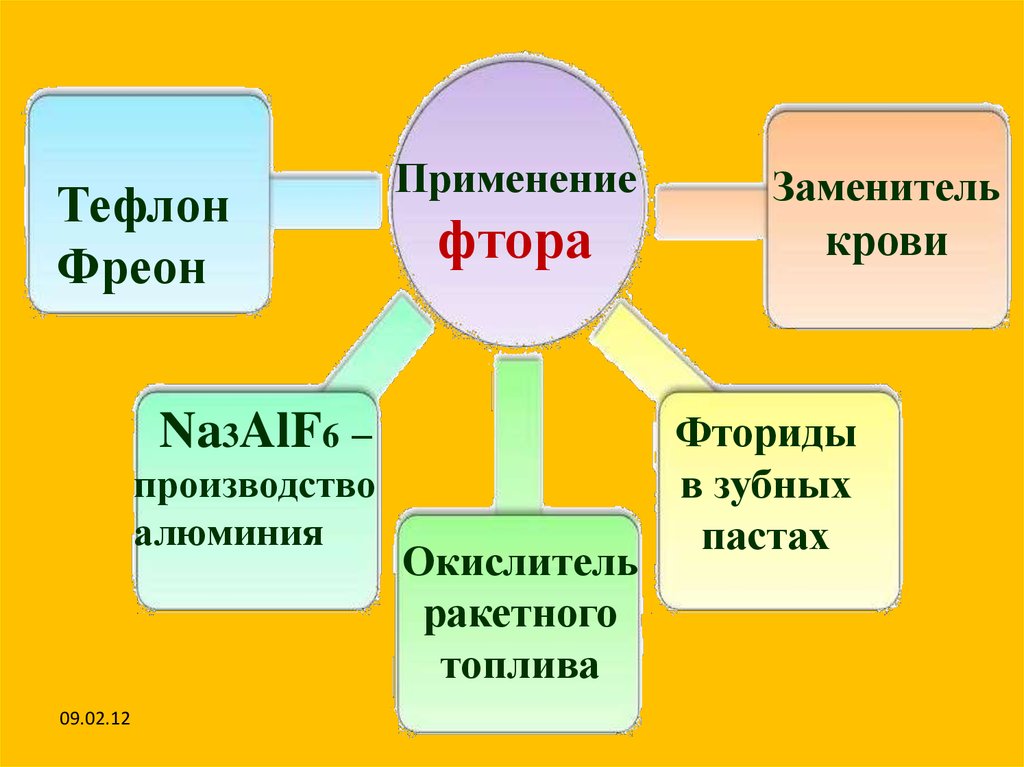
ТефлонФреон
Применение
фтора
Na3AlF6 –
производство
алюминия
09.02.12
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
47.
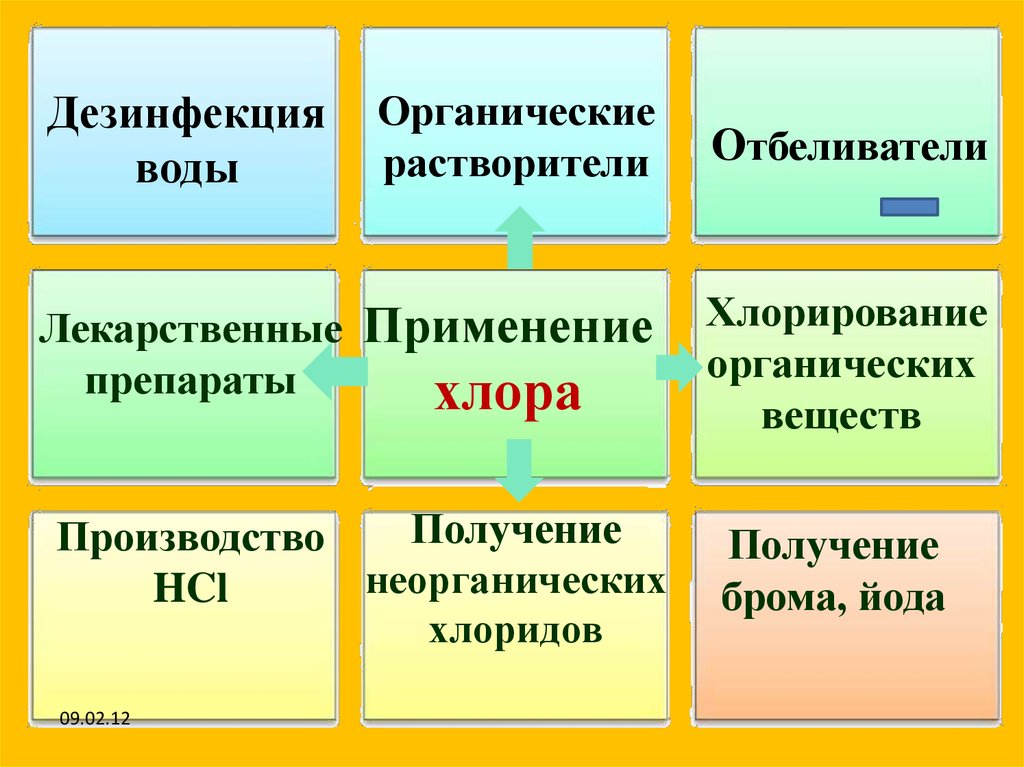
Дезинфекцияводы
Органические
растворители
Лекарственные
препараты
Применение
хлора
Получение
Производство
неорганических
HCl
хлоридов
09.02.12
Отбеливатели
Хлорирование
органических
веществ
Получение
брома, йода
48.
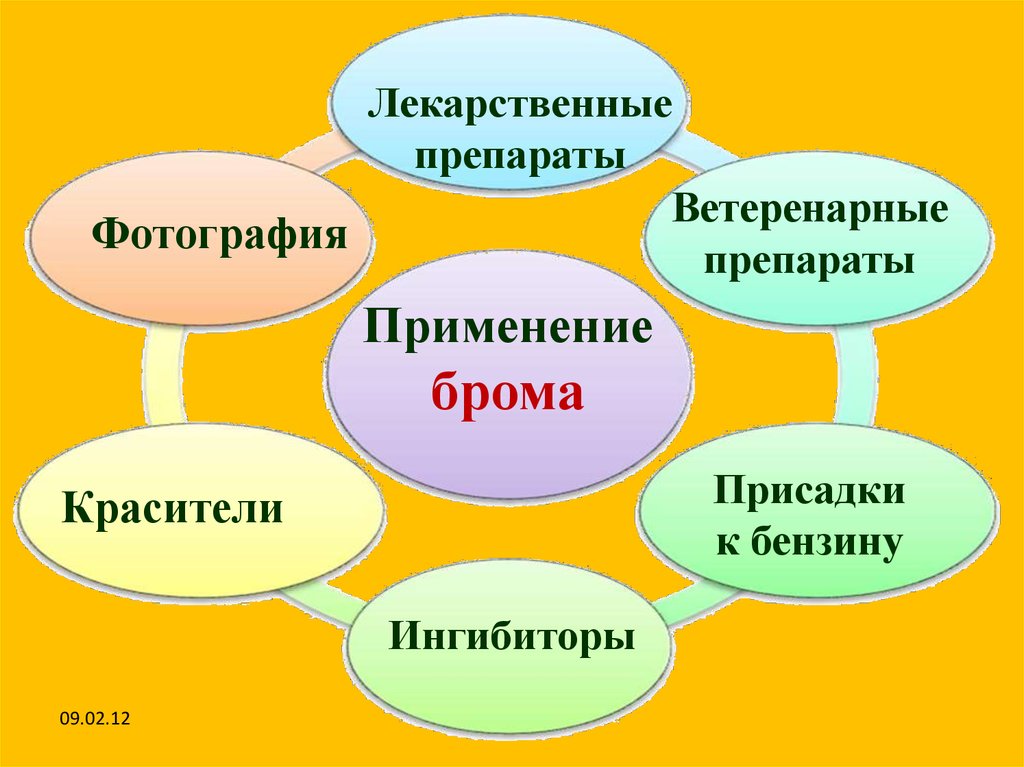
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Присадки
к бензину
Красители
Ингибиторы
09.02.12
49.
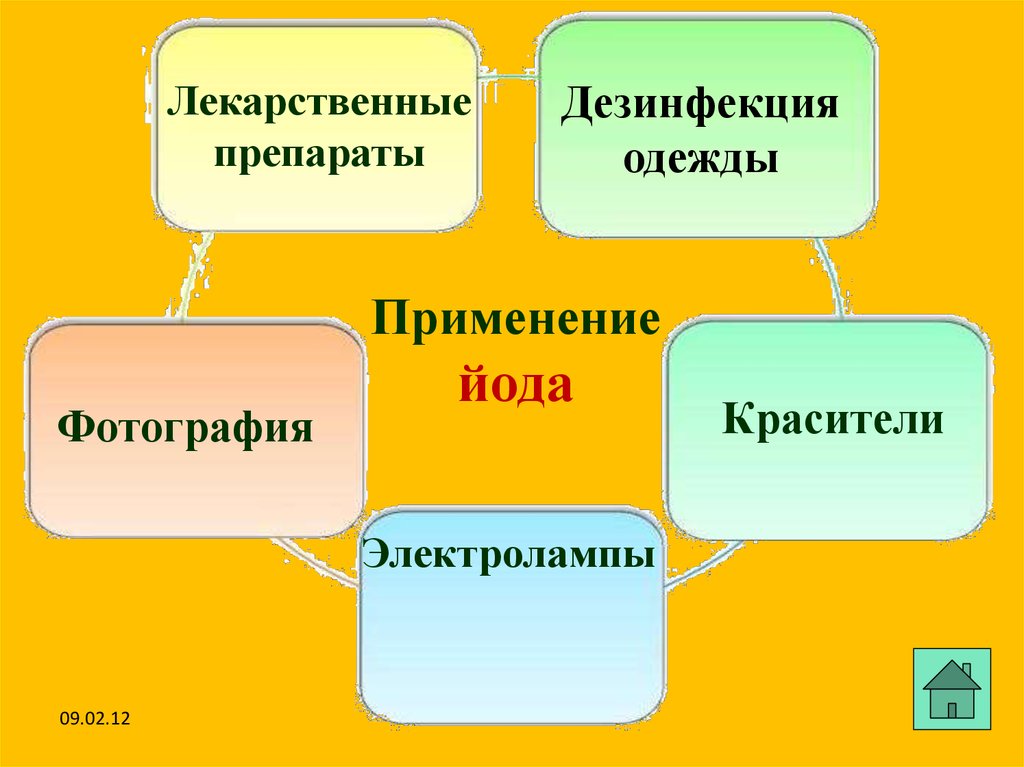
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
09.02.12
Красители

































 Химия
Химия