Похожие презентации:
Основные положения молекулярно – кинетической теории
1.
Основные положениямолекулярно – кинетической
теории
2.
Запахи мы обоняем различного рода,Хоть и не видим совсем, как в ноздри они
проникают…
На морском берегу, разбивающем волны,
Платье сыреет всегда, а на солнце вися, оно
сохнет;
Видеть, однако, нельзя, как влага на нем
оседает.
Как и не видно того, как она исчезает от зноя.
3.
Значит, дробится вода на такие мельчайшиечасти.
Что недоступны они совершенно
для нашего глаза.
4.
Основные понятия МКТ• Количество вещества – отношение числа
молекул в данном теле N к числу атомов в
0,012 кг углерода
• υ = N / NA
• N - число молекул в теле
• NA – число атомов в 0, 012 кг углерода
• NA = 6, 02*1023 моль-1 - число Авогадро
5.
• Постоянная Авогадро показывает , сколькомолекул (атомов) содержится в одном моле
любого вещества.
• Относительная молекулярная (атомная)
масса вещества –это отношение массы
молекулы (или атома) данного вещества к
1/12 массы атома углерода
• Mr = m0/1/12 m0c Mr(H2O) = (1*2 +16= 18 )
• Молярная масса – это масса одного моля
вещества
M= m0NA
M = Mr*10-3кг/моль
M (H2O) = 18*10-3кг/моль
6.
• Масса молекулы определяется по формуле• m0 = M/NA
• Количество вещества (число молей) можно
определить по формуле
• υ = m/M
7.
Задачи1. Вычислите массу молекулы: а) азота N2
б)озона O3
2. Сколько молекул водорода содержится в
воздушном шарике, если масса водорода в
нем 4 г?
3. Определите число молекул, содержащихся
в куске «сухого льда» СО2
массой 200 г.
8.
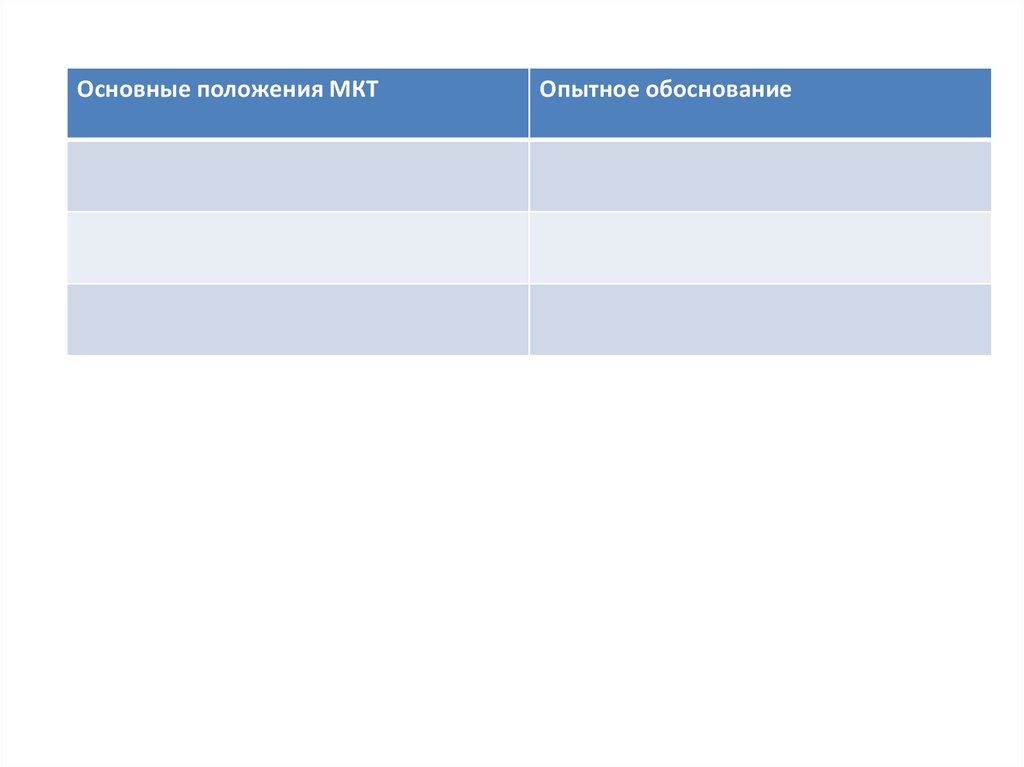
Основные положения МКТОпытное обоснование
9.
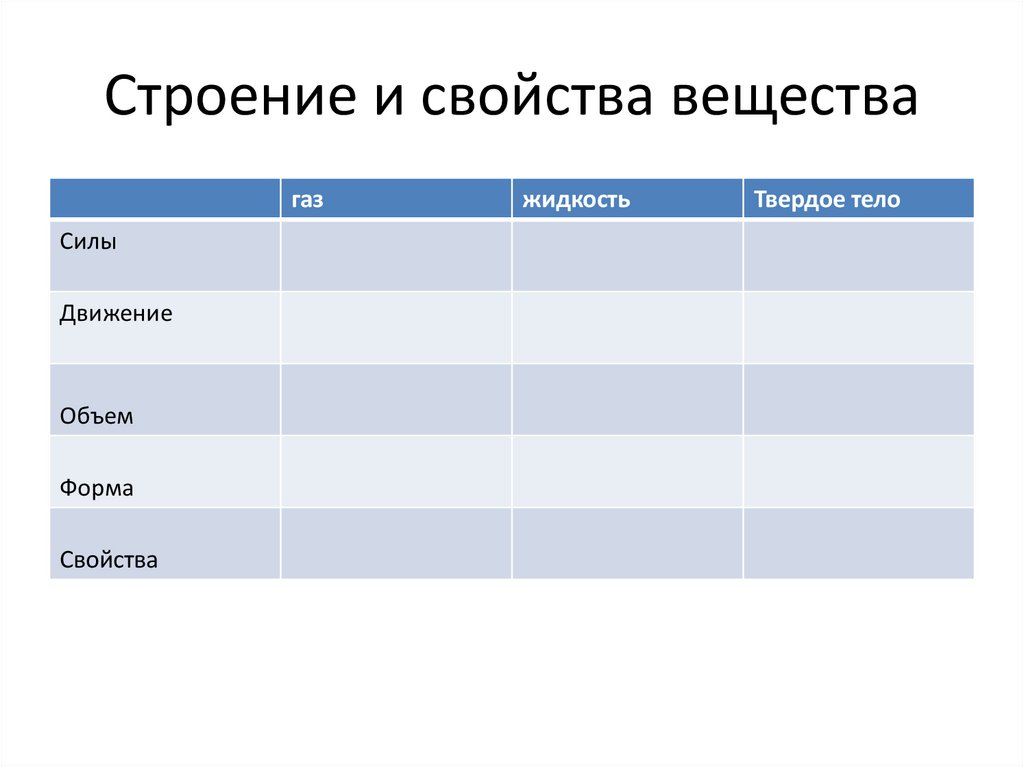
Строение и свойства веществагаз
Силы
Движение
Объем
Форма
Свойства
жидкость
Твердое тело







 Физика
Физика








