Похожие презентации:
Уравнение состояния идеального газа. Газовые законы
1.
ПОВТОРЕНИЕ1. Что является объектом изучения МКТ?
(идеальный газ)
2. Что в МКТ называют идеальным газом?
(идеальный газ- газ, в котором взаимодействие между
молекулами можно не учитывать)
3. Для того чтобы описать состояние идеального газа
используют три термодинамических параметра. Какие?
(давление, температура и объём)
4.Как создаётся давление?
(число ударов молекул)
5. Зависимость давления газа от концентрации при
T, V=const
p=nkT
2.
Уравнениесостояния
идеального газа.
Уравнение
Газовыесостояния
законы.
идеального газа.
Газовые законы.
3.
• Уравнение, связывающееосновные параметры состояния
идеального газа вывел великий
русский ученый Д.И. Менделеев.
4.
• Основное уравнение МКТ: p=nkT• Концентрация
N
n
V
;
mN A
p
kT
MV
5.
• NA –постоянная Авогадро• k- постоянная Больцмана
• NAk= R – универсальная(молярная)
газовая постоянная
• R = 8,31 Дж/моль·К.
6.
Уравнение состояния дляидеального газа произвольной
массы.
Уравнение Менделеева
m
рV
RT
M
7.
• Из уравнения состояния вытекает связьмежду давлением, объемом и
температурой идеального газа, который
может находиться в двух любых
состояниях.
• Обозначим индексом 1 параметры
первого состояния, индексом 2
параметры второго состояния
8.
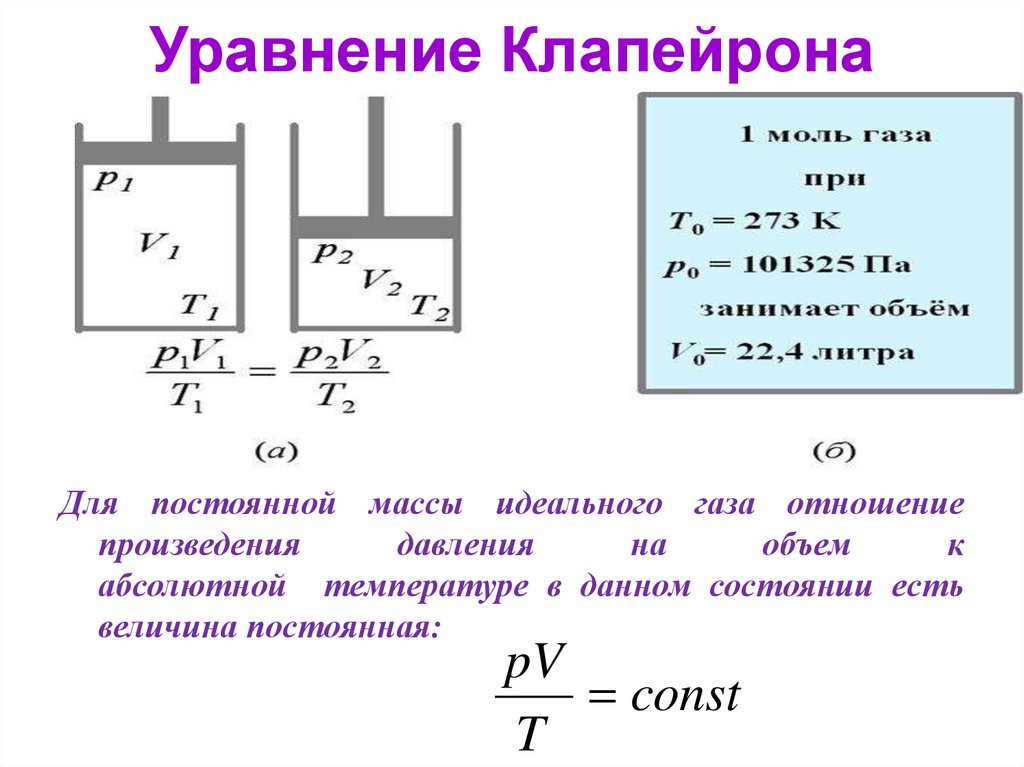
Уравнение КлапейронаДля постоянной массы идеального газа отношение
произведения
давления
на
объем
к
абсолютной температуре в данном состоянии есть
величина постоянная:
pV
const
T
9.
Газовые законы• С помощью уравнения p1V1 p2V2 const
T1
T2
Можно исследовать процессы, в которых
один из трех параметров остается
неизменным.
Количественные зависимости между двумя
параметрами газа при фиксированном
значении третьего называют газовыми
законами.
10.
• Процессы, протекающие принеизменном значении одного из трех
параметров (V, T, p) называются
изопроцессами ( «изос»- равный)
11.
1. Изотермический процесс• Процесс изменения состояния
макроскопических тел
(термодинамической системы)
при постоянной температуре
называют изотермическим
12.
Закон Бойля- МариоттаДля газа данной массы при
постоянной температуре
произведение давления газа на
его объем постоянно.
при Т=const
(анимация)
pV =const
13.
• Зависимость давления от объема приТ=const изображают кривой,
называемой изотермой.
Т1 < Т2 <Т3
14.
2. Изобарный процесс• Процесс изменения состояния
термодинамической системы при
постоянном давлении называют
изобарным («барос»-вес)
15.
Закон Гей-Люссака• Для газа данной массы при
постоянном давлении отношение
объема к температуре постоянно
при р = const
V
T
(анимация)
сonst
16.
Графическая зависимость объема оттемпературы (изобара)
17.
3. Изохорный процесс• Процесс изменения состояния
термодинамической системы при
постоянном объеме называют
изохорным («хорема»-вместимость)
18.
Закон Шарля• Для газа данной массы отношение
давления к температуре постоянно.
Если объем не меняется
• При V=const
р
T
• (видео с 3,34мин)
сonst
19.
Графическая зависимость давленияот температуры (изохора)
• V1 < V2 < V3
20.
21.
Домашнее задание• §68,§69
22.
• Нормальные условия:• атмосферное давление p=105 Па,
• температура 00С, или Т=273 К





















 Физика
Физика Химия
Химия








