Похожие презентации:
Каустическая сода
1. Выполнить задание
ВЫПОЛНИТЬ ЗАДАНИЕУстановите соответствие:
1. Каустическая сода.
2.Кальцинированная сода.
3.Пищевая сода.
4.Калиевая селитра.
5.Поташ.
А) KNO3
Б) NaOH
В) K2CO3
Г) Na2CO3
Д) NaHCO3
Используя схему, напишите уравнения соответствующих реакций:
NaH
↑
NaCl ← Na → Na2O2
↓
NaNO3 ← NaOH → Cu(OH)2
2. Домашнее задание: § 15, упр 3,5 (стр. 106)
Бериллий,магний и
щелочноземельные
металлы
ДОМАШНЕЕ ЗАДАНИЕ:
§ 15, УПР 3,5 (СТР. 106)
3. Общая характеристика элементов
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ
Элемент
Be
(бериллий)
Mg
(магний)
Ca
(кальций)
Sr
(стронций)
Ar
9
Количество
ē на
внешнем
энергетическом
уровне
24
40
88
Ba
(барий)
137
Ra
(радий)
226
ПОСТОЯННОЕ
2s2
7s2
5s2
4s2
6s2
3s2
о
Ск
ти
ес
пл
ее
нн
ьи
я
П
О
С
Т
О
Я
Н
Н
А
Я
А
т
о
м
н
ы
й
р
а
д
и
у
с
у
в
е
л
и
ч
и
в
а
е
т
с
я
М
е
т
а
л
л
и
ч
е
с
к
и
е
с
в
о
й
с
т
в
а
у
в
е
л
и
ч
и
в
а
ю
т
с
я
4.
В природе ЩЗ металлы в самородном состоянии не встречаются.Самые распространенный из них – магний и кальций входят в состав
минералов, в основном содержащих карбонаты и сульфаты этих
элементов.
Также соли кальция и магния растворимые в воде, содержатся в
пресной и морской воде.
Радий является радиоактивным элементом и встречается в природе в
составе минералов, содержащих уран.
5. Физические свойства
магнийбериллий
ФИЗИЧЕСКИЕ
СВОЙСТВА
кальций
стронций
6. Окраска пламени соединениями щелочных и щелочноземельных металлов
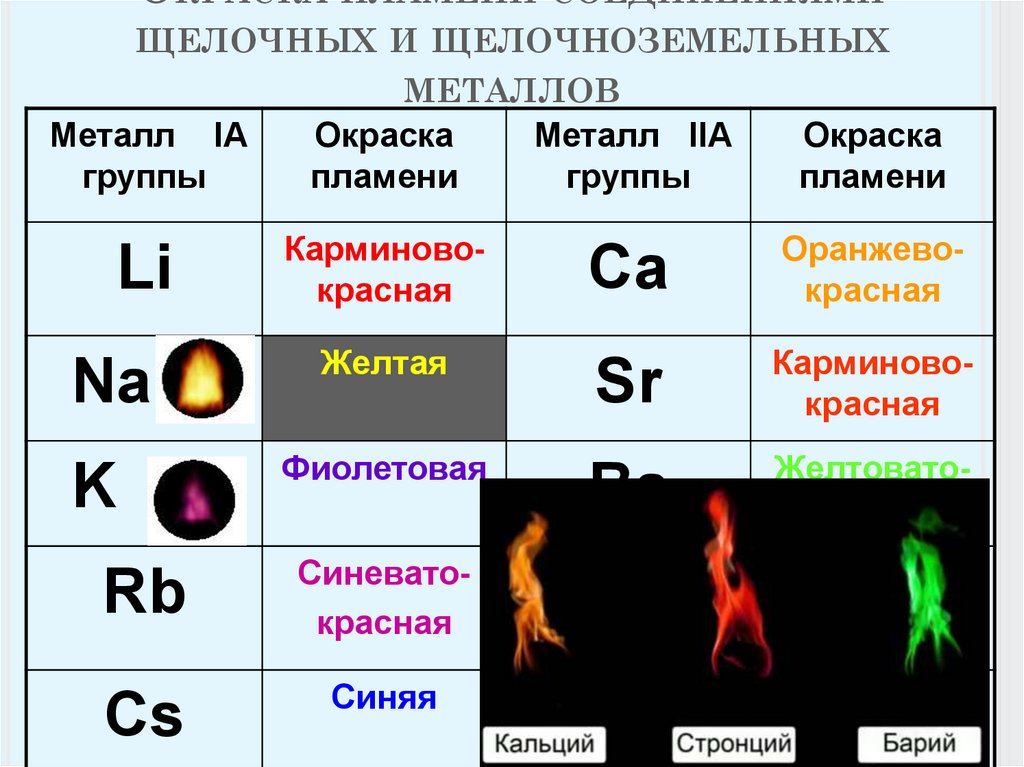
ОКРАСКА ПЛАМЕНИ СОЕДИНЕНИЯМИЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ
Металл IА
группы
Li
Na
K
МЕТАЛЛОВ
Окраска
Металл IIА
пламени
группы
Карминовокрасная
Желтая
Фиолетовая
Rb
Синеватокрасная
Cs
Синяя
Окраска
пламени
Ca
Оранжевокрасная
Sr
Карминовокрасная
Ba
Желтоватозеленая
7. Химические свойства щелочноземельных металлов
ХИМИЧЕСКИЕ СВОЙСТВАЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
I.
Взаимодействие с неметаллами
1.С кислородом: 2Mе+O2=2MеO (оксид)
2Mg + O2 = 2MgO
2.С галогенами: Mе+Cl2=MеCl2 (хлорид)
3.С серой:
Mе+S=MеS (сульфид)
4.С азотом:
3Mе+N2=Mе3N2 (нитрид)
5.С водородом: Mе+H2=MеH2 (гидрид)
8.
II. Взаимодействие с водойМе + 2Н2О = Mе(OH)2 + H2
(Be, Мg – медленно, при нагревании;
Щ/З – реагируют бурно)
III. Взаимодействие с кислотами
Me +2HCl → MeCl2 + H2
(Be, Мg - реагируют, образуя соответствующие соли;
Щ\З – сопровождается реакцией с водой)
Be(OH)2 +2 HCL = BeCL2 + 2H2O
Гидроксид бериллия также реагирует с
концентрированными растворами щелочей:
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
тетрагидроксобериллат натрия
9.
Магнийтермия – восстановлениередких металлов из их оксидов
магнием
2Mg + TiO2 = 2MgO +Ti
Кальцийтермия – восстановление
редких металлов из их оксидов
кальцием
5Ca + V2O5 = 5CaO +2V
10. Щелочноземельные металлы-элементы IIA группы
CaЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫЭЛЕМЕНТЫ IIA ГРУППЫ
Щелочноземельными являются не все
элементы IIА группы, а только начиная с
кальция и вниз по группе.
Оксиды этих элементов («земли» - по
старинной терминологии) взаимодействуют с
с водой, образуя щелочи.
Sr
Напишите уравнения реакции любого
из оксидов металлов с водой.
Ra
СаО + H2O = Ca(OH)2
Ba
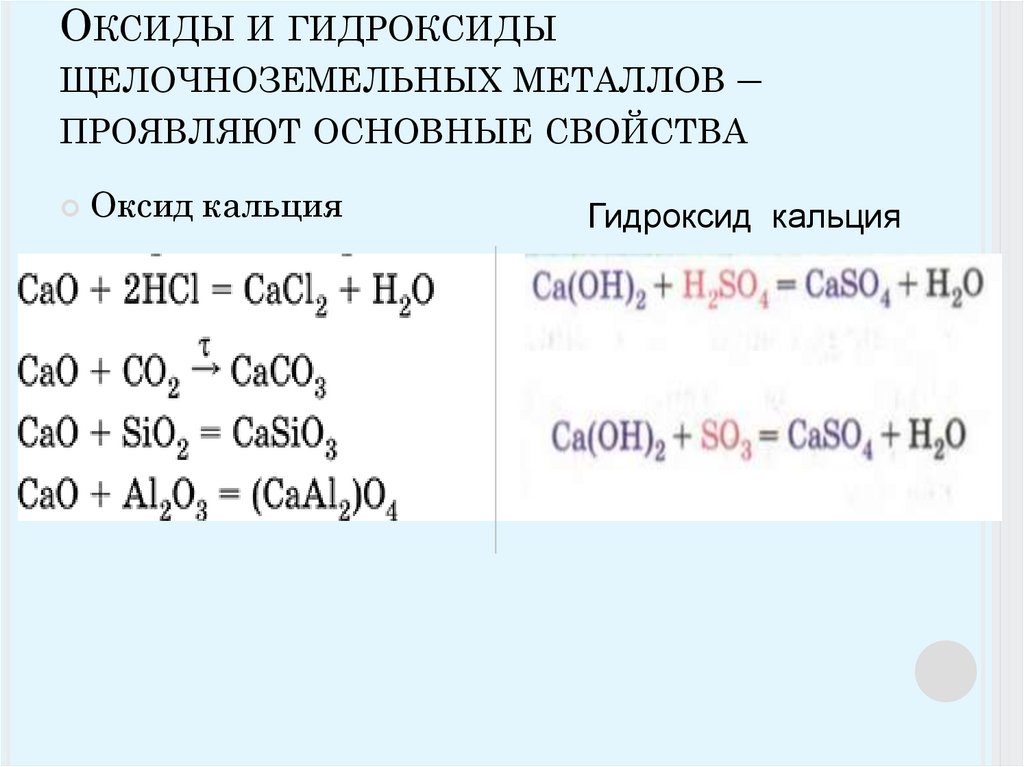
11. Оксиды и гидроксиды щелочноземельных металлов – проявляют основные свойства
ОКСИДЫ И ГИДРОКСИДЫЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ –
ПРОЯВЛЯЮТ ОСНОВНЫЕ СВОЙСТВА
Оксид кальция
Гидроксид кальция
12. Жесткость воды
ЖЕСТКОСТЬ ВОДЫВиды жесткости
воды
Присутствующие
ионы
Способы
устранения
жесткости воды
Временная
(карбонатная)
Ca(2+), Mg(2+)
HCO3(-)
1. Кипячение
2. Добавление
соды или Са(ОН)2
Постоянная
Ca(2+), Mg(2+)
SO4(2-)
1.Добавление соды.
2. Использование
катионообменников
Ca(2+), Mg(2+),
HCO3(-), Cl(-)
SO4(2-)
Сочетание всех
вышеуказанных
способов.
Общая
13.
14.
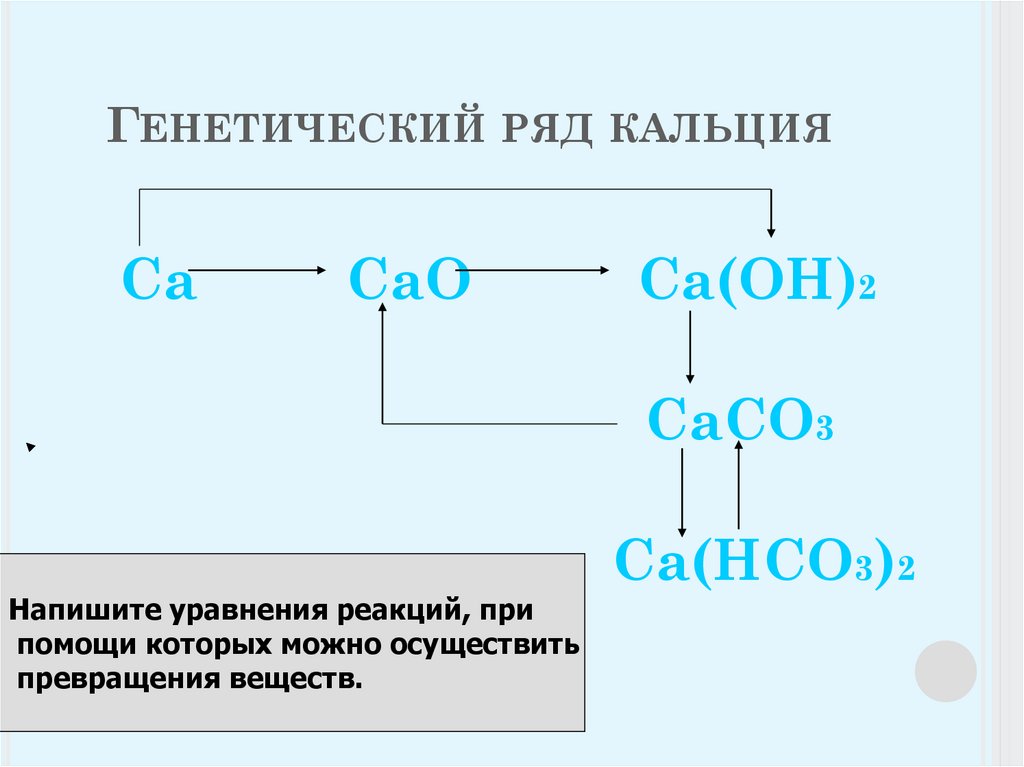
15. Генетический ряд кальция
ГЕНЕТИЧЕСКИЙ РЯД КАЛЬЦИЯСа
СаО
Са(ОН)2
СаСО3
Са(НСО3)2
Напишите уравнения реакций, при
помощи которых можно осуществить
превращения веществ.
16. Кальций –типичный представитель щелочноземельных металлов
КАЛЬЦИЙ –ТИПИЧНЫЙПРЕДСТАВИТЕЛЬ ЩЕЛОЧНОЗЕМЕЛЬНЫХ
МЕТАЛЛОВ
Дайте названия
соединениям
кальция:
CaO Негашеная известь
Ca(OH)2 Гашеная известь
CaCO3 Мел, мрамор
CaHCO3 Сода
Вспомните
тривиальные
названия этих
веществ
Как изменяются
свойства элементов
IIA группы с
увеличением размера
атомов и образуемых
ими ионов при
движении по группе
сверху вниз?
Какие свойства
проявляют оксиды и
гидроксиды этих
элементов.
17.
Ca18.
2.Как называются
отложения, свисающие в
виде гигантских сосулек
со свода пещеры? А
растущие навстречу им
со дна пещеры колонны?
Если породы
залегают на
большой глубине
–
возникают
подземные
карстовые
пещеры.
19.
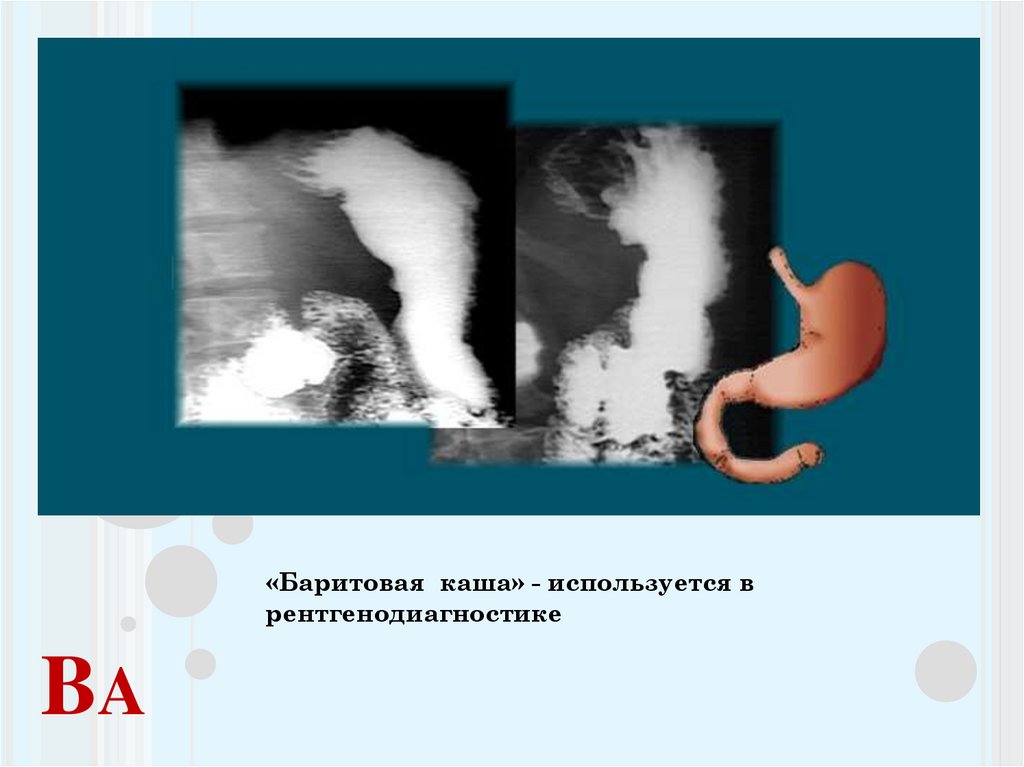
Mg20. Ba
«Баритовая каша» - используется врентгенодиагностике
BA
21. Продолжите высказывание.
ПРОДОЛЖИТЕ ВЫСКАЗЫВАНИЕ.1. Оксид кальция получают в промышленности:
а) при разложении сульфата кальция;
б) Взаимодействием кальция с кислородом;
в) разложением карбоната кальция;
г) действием на соли кальция щелочью.
2. С какими из перечисленных веществ взаимодействует оксид бария:
а) H2SO4; в) SO3;
б) CaO;
г) NaOH.
3. С какими из перечисленных веществ взаимодействует гидроксид
кальция:
а) HNO3 б) Mg(OH)2; в) Li2O г) CO2;
4. У кальция электроны распределены по энергетическим уровням.
а) 2,8.8,3; б) 2,8,8,1; в) 2,8,8,2.
5. Кальций проявляет свойства.
а) Окислительные;
б) Восстановительные;
в) Окислительные и восстановительные.
22.
1.Наиболее выраженные металлические свойства проявляет:а) Al;
б) Mg;
в) Сa;
г) Be.
2. Химическая реакция проходит между:
а) Mg и ZnSO4 (раствор);
б) Cu и FeSO4 (раствор);
в) Ag и AlCl3 (раствор);
г) Pb и Mg(NO3)2 (раствор).
3.На внешнем энергетическом уровне два электрона у атомов:
а) щелочно-земельных металлов;
б) щелочных металлов;
в) алюминия;
г) свинца.
4.Пламя газовой горелки окрашивается солями кальция в
цвет:
а) кирпично-красный;
в) желтый; б) зеленый; г) фиолетовый.
23.
Спасибо заработу!!!



















 Химия
Химия








