Похожие презентации:
Классификация неорганических веществ. Оксиды
1. Классификация неорганических веществ. Оксиды.
2.
3. ОКСИДЫ Смотрите в папках данную тему!
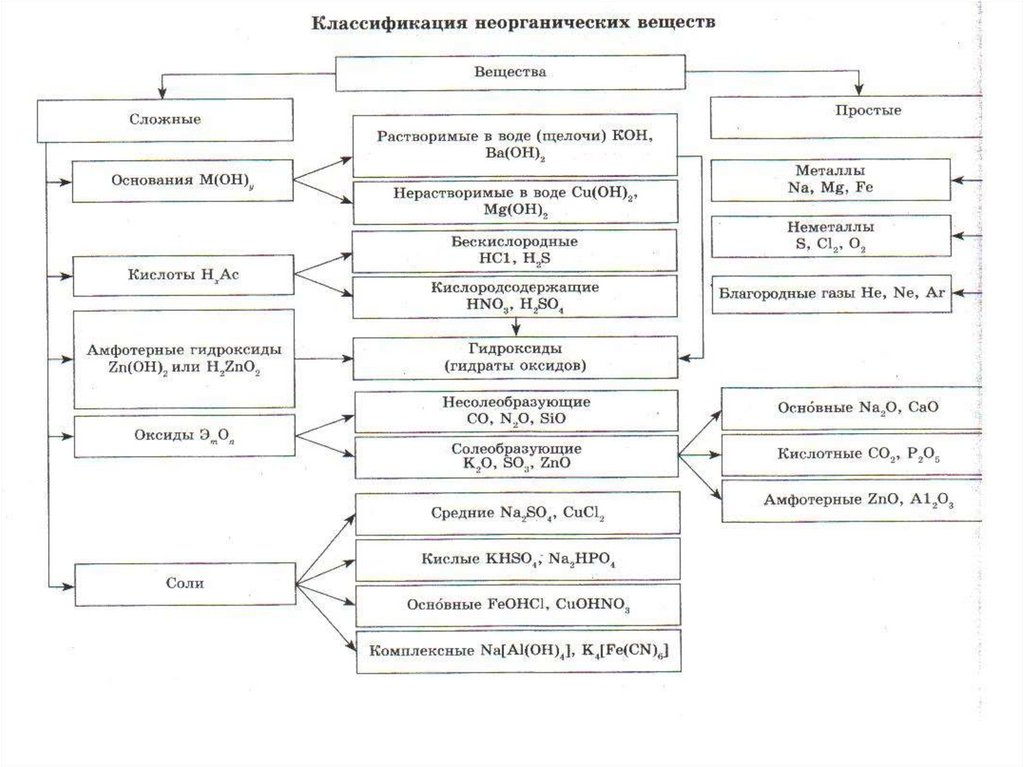
• Оксиды- бинарные соединения скислородом в степени окисления (-2).
• Общая формула оксидов: ЭmOn
где m число атомов элемента Э, а
n – число атомов кислорода.
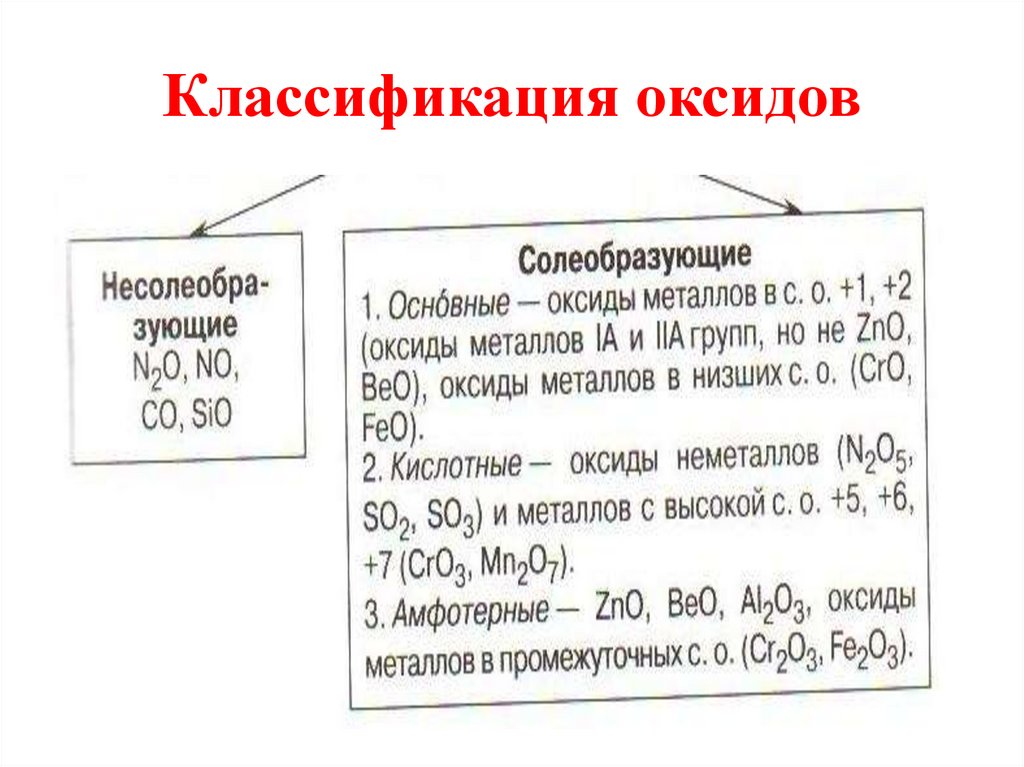
4. Классификация оксидов
5. Несолеобразующие оксиды
• Несолеебразующими называютсятакие оксиды, которые не
взаимодействуют ни со щелочами,
ни с кислотами и не образуют солей.
Их немного, в их состав входят
неметаллы.
6. Солеобразующие
• Солеобразующими называютсятакие оксиды, которые
взаимодействуют с кислотами или
основаниями и образуют при этом
соль и воду.
• Среди солеобразующих оксидов
различают оксиды: основные,
кислотные, амфотерные.
7. Основные оксиды
• Основные оксиды - это такиеоксиды, которым соответствуют
основания. Например:
СаО - Са(ОН)2
Na2O - NaOH
8. Кислотные оксиды
• Кислотные оксиды - это такие оксиды,которым соответствуют кислоты.
• Это оксиды неметаллов:
N2O 5 соответствует Н NO 3 ,
SO3 – H2SO4
А так же оксиды металлов с большим
значением степеней окисления:
Сr2 O3 - H2 Сr O4
Mn2O7 - H MnO4
9. Амфотерные оксиды
• Амфотерными называются оксиды,которые в зависимости от условий
проявляют основные или кислотные
свойства.
• Это ZnO, Al2O3, Cr2O3, V2O3
• Амфотерные оксиды с водой
непосредственно не соединяются.
10. По какому признаку солеобразующие оксиды делят на три вида? Осуществите данные превращения!
• Основной оксид— основание--- сольN a 2 O N a OH N a C l
• Амфотерный оксид—амфотерный гидроксид--- соль
2
Zn O Zn
2
OH 2 H 2 Zn
2
2
O 2 N a 2 Zn O 2
• Кислотный оксид--- кислота--- соль
6
6
6
S O 3 H 2 S O 4 C aS O 4
11. Тест №1
1. Среди следующих формул оксидом является:1) НСl
2) Na2SO4 3) Na2O 4) NaOH.
2. Среди следующих оксидов несолеобразующим является:
1) СО2
2) СО
3) Na2O
4) SO3.
3. Среди следующих оксидов кислотным является:
1) СО
2) N2O 3) N2O3
4) Al2O3.
4. Среди следующих оксидов основным является:
1) СО2
2) FeO
3) ZnO
4) N2O.
5. Среди следующих оксидов амфотерным является:
1) SO2
2) CO
3) BeO
4) Mn2O7.
6. Массовая доля (в %) кислорода в оксиде алюминия:
1) 47
2) 52,94 3) 15,68
4) 26, 47.
7. Масса (г) 0,25 моль оксида натрия:
1) 155
2) 9,75
3) 248
4) 15,5.
12. Тест № 2
1. С серной кислотой будет взаимодействовать:1) SO3
2) Mn2O7
3) N2O5
Составьте уравнение реакции
4) MgO.
2. С оксидом натрия будет взаимодействовать:
1) NO
2) MgO
3) SO3
4) K2O.
Составьте уравнение реакции.
3. С водой будет взаимодействовать:
1) FeO
2) Ag2O
3) BaO
Составьте уравнение реакции.
4) CuO
13. Тест № 3
1. С гидроксидом натрия будет реагировать:1) СаО
2) СО
3) SO3
4) K2O
Составьте уравнение реакции.
2. С оксидом азота (V) ,будет реагировать:
1) ВаО
2) Mn2O7
3) CO
4) CO2
Cоставьте уравнение реакции.
3. С водой не будет взаимодействовать:
1) СО2
2) Р2О5
3) SiO2
4) N2O5
14. Тест № 4
1. Коэффициент перед формулой кислорода в уравнении реакции,схема которой
Аl + O2 → Al2O3 : 1) 2 2) 3 3) 4 4) 5.
2. При горении Н2S в избытке кислорода образуется:
SO и H2
2) SO2 и H2O
3) SO3 и H2O
Составьте уравнение реакции.
4) SO2 и H2.
3. При окислении ZnS образуются:
1) Zn и SO2
2) ZnO и SO2
3) ZnO и SO3
Составьте уравнение реакции.
4) Zn и SO3.
4. При разложении гидроксида железа (III) образуются:
1) Fe и H2O
2) FeO и H2O
3) Fe2O3 и H2O
Составьте уравнение реакции.
1)
4) Fe2O3 и H2.
15.
Домашнее заданиеСмотрите в папках Задание!
Задание. 1) Из следующего перечня выписать отдельно химические
формулы оксидов, оснований, кислот, солей:
2) С какими из перечисленных веществ: NaOH , H2SO4 , CO2 , K2CO3 , MgO , CuSO4
реагируют (1 вариант - КОН);
(2 вариант - HCl ). Напишите возможные уравнения реакций:
3) Запишите уравнения реакций, с помощью которых можно осуществить
превращения:
а) Cu –CuO – CuCl2---Cu (OH)2—Cu(NO3)2
б) Si –SIO2 --Na2SiO3 –H2SiO3
16.
Домашнее заданиеДополнительное для высокого уровня!
Ca CaO Ca OH 2 CaCO3
C CO2 CaCO3
S SO2 H 2 SO3 MgSO3
Cl2 HCl AlCl3
Задание по учебнику 11 кл.: Рудзитис Г.Е., Фельдман
Ф.Г. §34, стр.155, §38, стр.173-179, тесты














 Химия
Химия








