Похожие презентации:
Бериллий, магний, щелочноземельные металлы
1.
Бериллий, магний,щелочноземельные металлы
2.
Элементы IIA группыBe Mg Ca Sr Ba Ra
Щелочноземельные
металлы
Ra
― радиоактивный элемент
Радий-226 имеет период полураспада,
равный 1620 лет
3.
BeMg
Me0 -2ē → Me+2
Элементы IIA группы – сильные восстановители.
Во всех соединениях они проявляют степень
окисления +2.
4.
BeMg
В группе сверху вниз:
1. Увеличивается радиус атомов.
2. Увеличиваются металлические свойства.
3. Увеличиваются восстановительные свойства.
5.
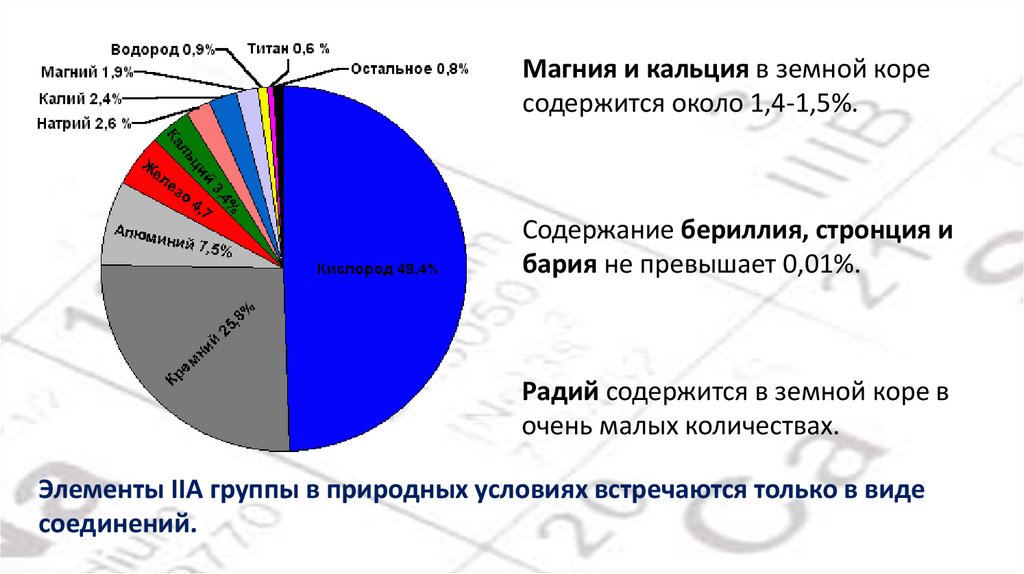
Магния и кальция в земной коресодержится около 1,4-1,5%.
Содержание бериллия, стронция и
бария не превышает 0,01%.
Радий содержится в земной коре в
очень малых количествах.
Элементы IIA группы в природных условиях встречаются только в виде
соединений.
6.
Физические свойства:Это типичные металлы с характерным металлическим блеском.
Представляют собой серебристо-белые металлы, а стронций имеет
золотистый оттенок.
Хорошо проводят теплоту и электрический ток.
Имеют довольно высокие температуры плавления.
Стронций твёрже бария, а барий по мягкости напоминает свинец.
7.
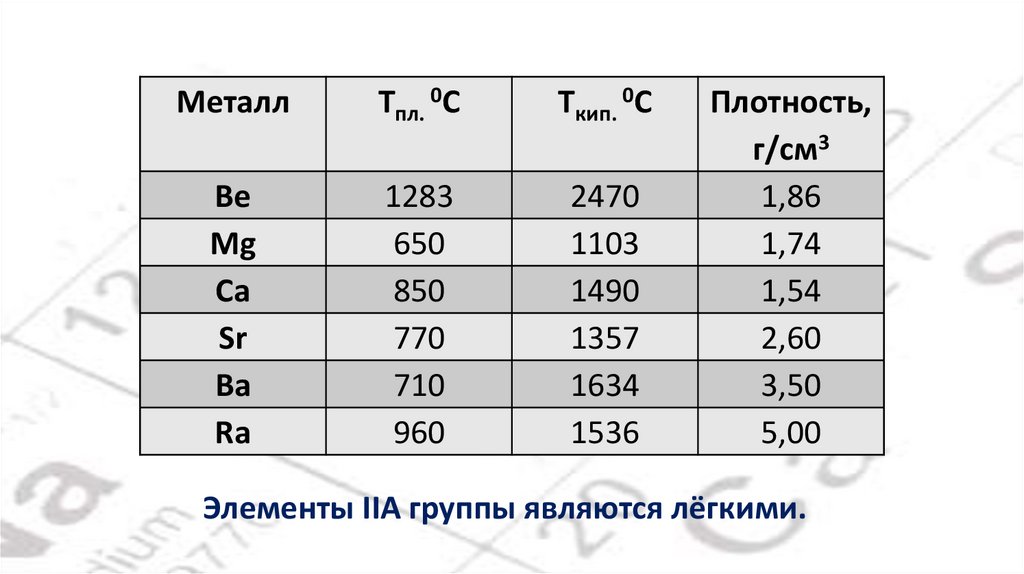
МеталлTпл. 0С
Tкип. 0С
Be
Mg
Ca
Sr
Ba
Ra
1283
650
850
770
710
960
2470
1103
1490
1357
1634
1536
Плотность,
г/см3
1,86
1,74
1,54
2,60
3,50
5,00
Элементы IIA группы являются лёгкими.
8.
Получение:Электролиз расплавов
MgCl2 = Mg + Cl2↑
CaCl2 = Ca + Cl2↑
9.
Химические свойстваРеакции с кислородом
Be
+ O2 = Только при нагревании
Mg
0
0
t
+2 -2
2Ca + O2 = 2CaO
оксид
кальция
10.
Химические свойстваРеакции с азотом
Ra реагирует с азотом при комнатной
температуре.
0
0
t +2 -3
3Ba + N2 = Ba3N2
нитрид
бария
11.
Химические свойстваРеакции с галогенами
0
0
t +2 -1
Ca + Cl2 = CaCl2
хлорид
кальция
0
0
t +2 -1
Ba + Br2 = BaBr2
бромид
бария
12.
Химические свойстваРеакции с
серой
Реакции с
водородом
0
0 t +2 -2
Mg + S = MgS
сульфид
магния
0
0 t +2 -1
Ca + H2 = CaH2
гидрид
кальция
13.
Химические свойстваВе
Mg
Ca
Sr
Реакции с водой
Mg + 2H2O = Mg(OH)2 + H2↑
Ba
Ca + 2H2O = Ca(OH)2 + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑
14.
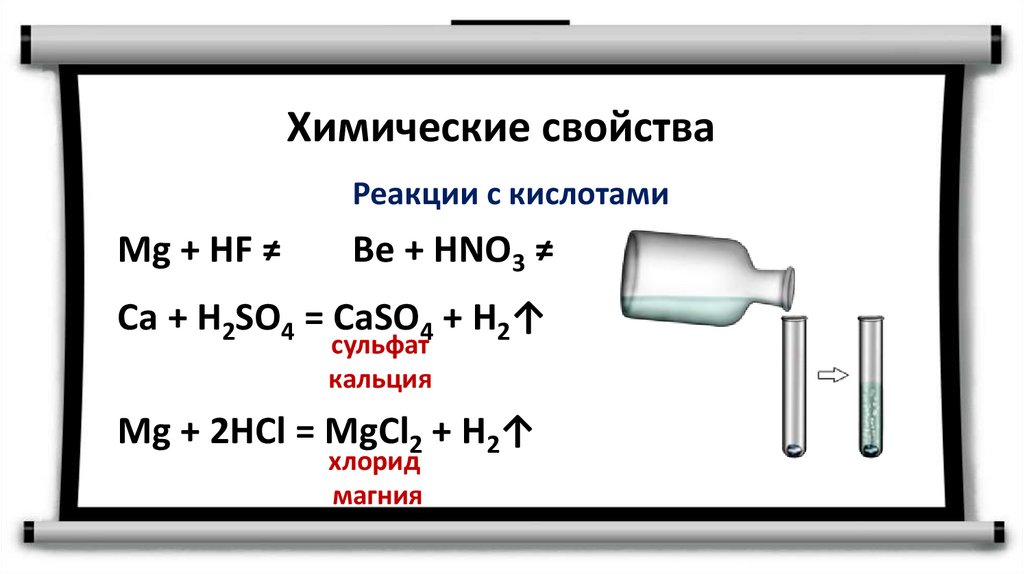
Химические свойстваРеакции с кислотами
Mg + HF ≠
Be + HNO3 ≠
Сa + H2SO4 = CaSO4 + H2↑
сульфат
кальция
Mg + 2HCl = MgCl2 + H2↑
хлорид
магния
15.
Химические свойстваРеакции с растворами солей
Mg + FeSO4 = MgSO4 + Fe
16.
Нахождение в природеВ природе щелочноземельные металлы находятся только в виде
соединений.
Оксиды имеют состав MeO и гидроксиды состав Me(OH)2.
Основный характер оксидов и гидроксидов увеличивается в этой
группе сверху вниз.
Амфотерные BeO и Be(OH)2 → основные RaO и Ra(OH)2.
Гидроксиды бериллия и магния нерастворимы в воде, а гидроксиды
щелочноземельных металлов и радия являются щелочами.













 Химия
Химия








