Похожие презентации:
Научные принципы химического производства
1.
Основные научныепринципы
химического
производства
2.
Современныепроизводства
3.
Аварии на производстве идаже в космосе
4.
Перевозка аммиака и ТБ5.
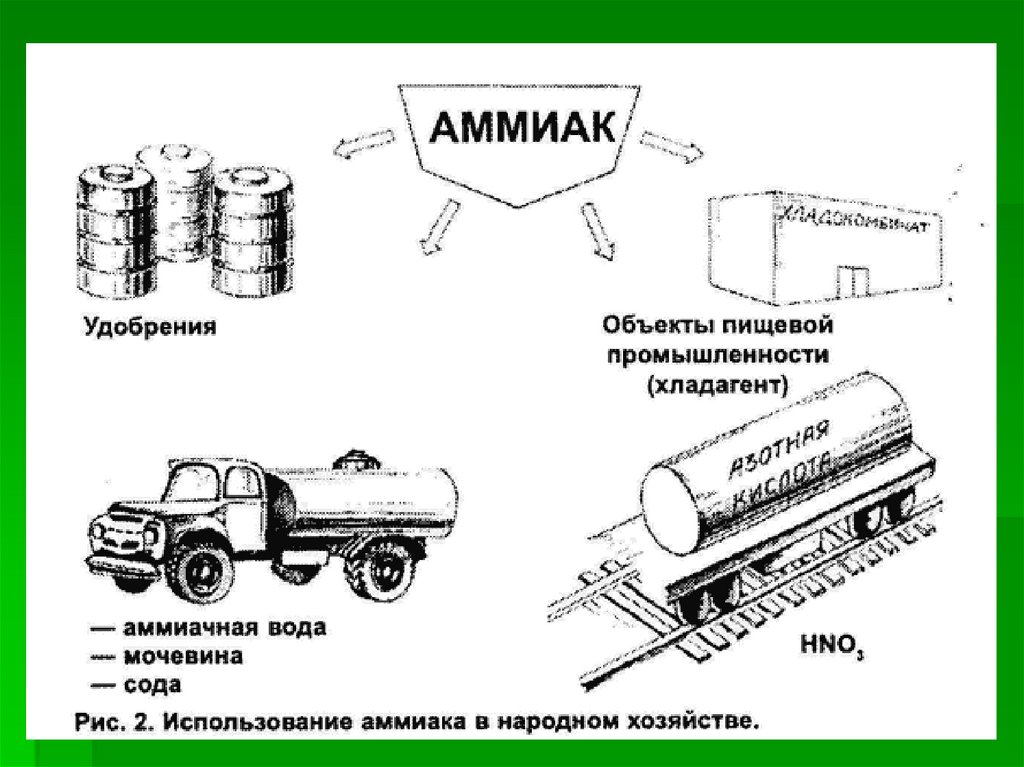
Применение аммиака6.
105 метровая башня дляпроизводства гранул
7.
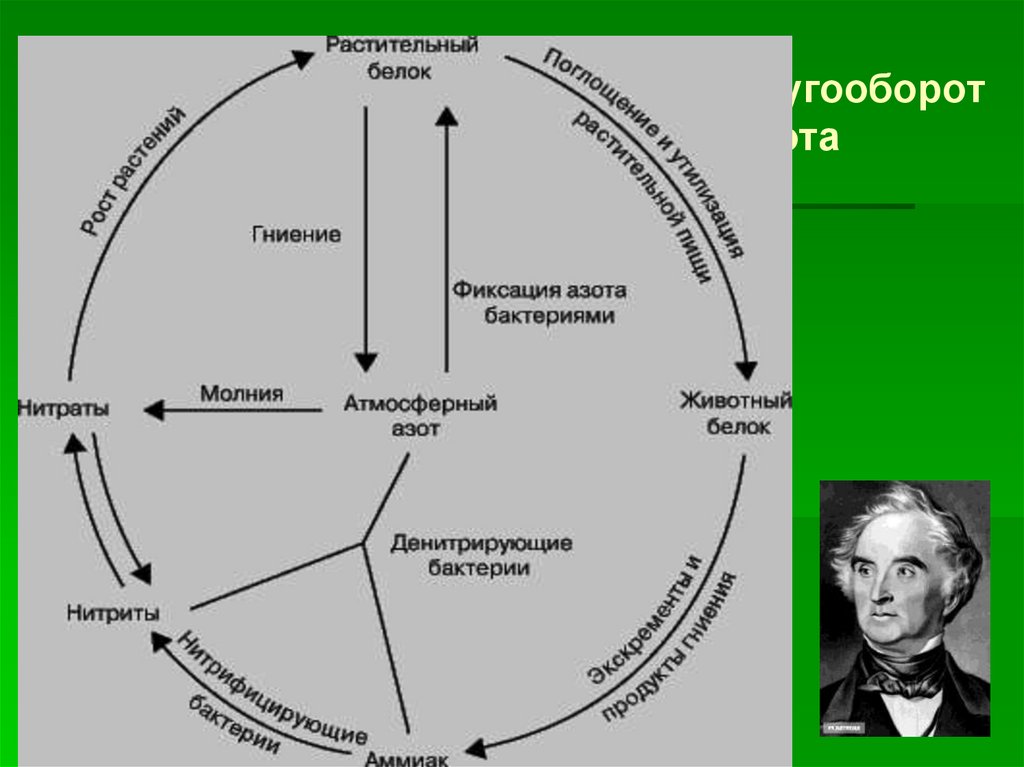
Кругооборотазота
8.
В 1840 выходит книга« Органическая химия в
применении к сельскому
хозяйству и физиологии»
Ю.Либиха.
« Рим выбрасывает в сточные трубы плодородие Сицилии».
Юстус
Либих
9.
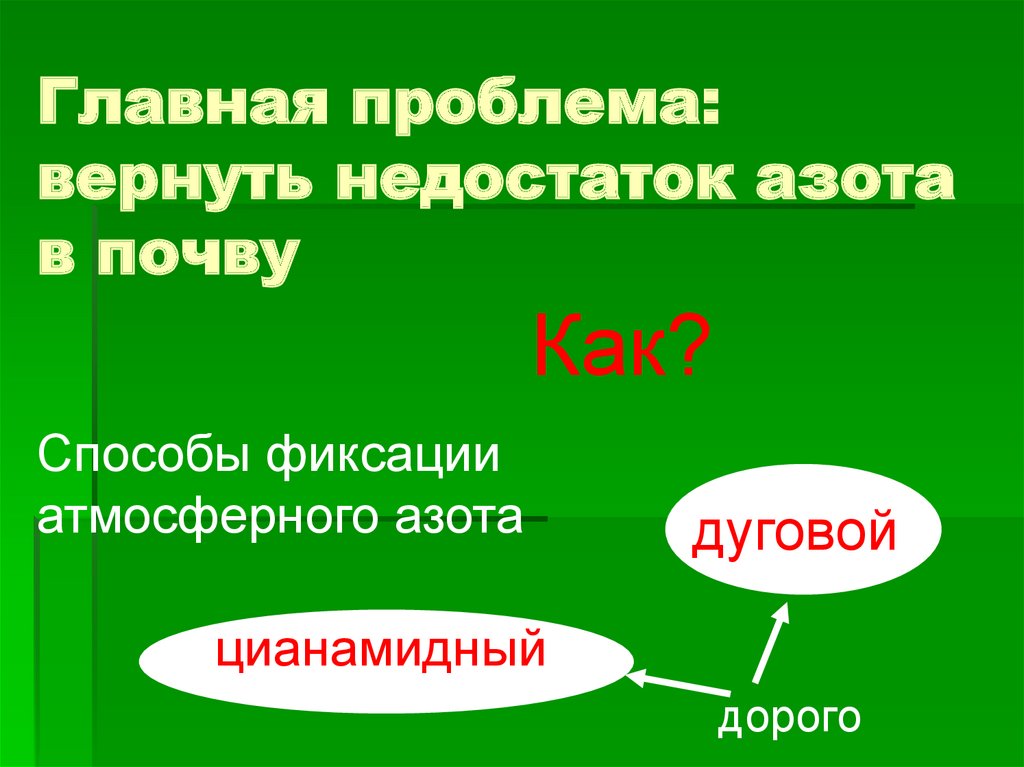
Главная проблема:вернуть недостаток азота
в почву
Как?
Способы фиксации
атмосферного азота
дуговой
цианамидный
дорого
10.
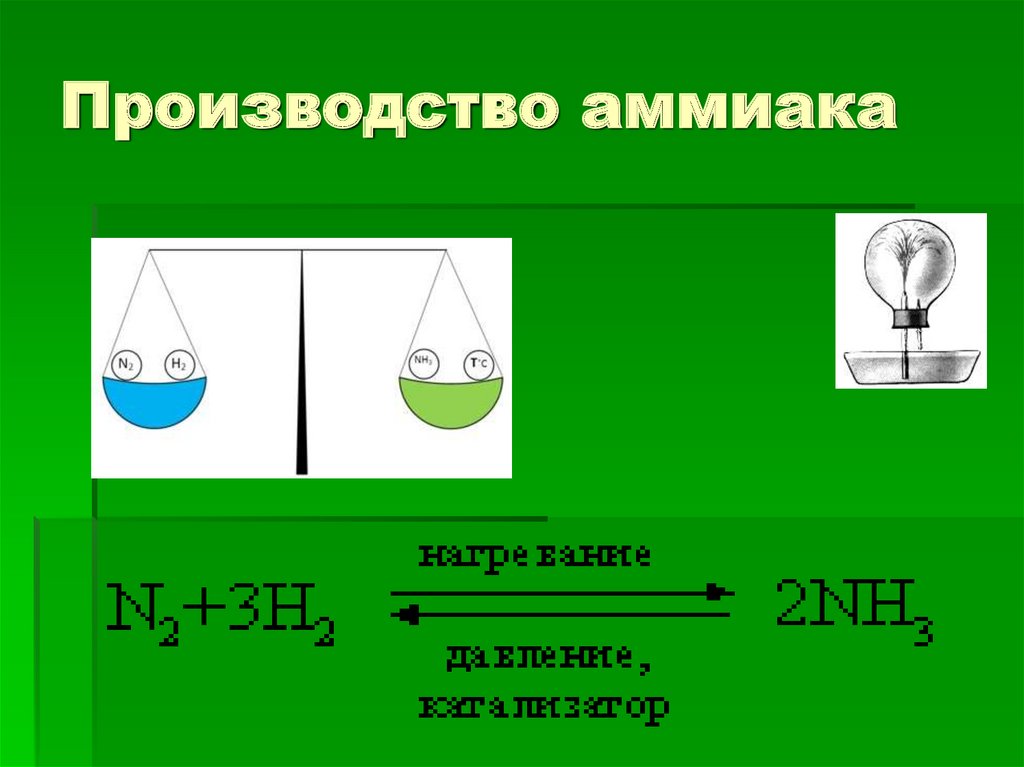
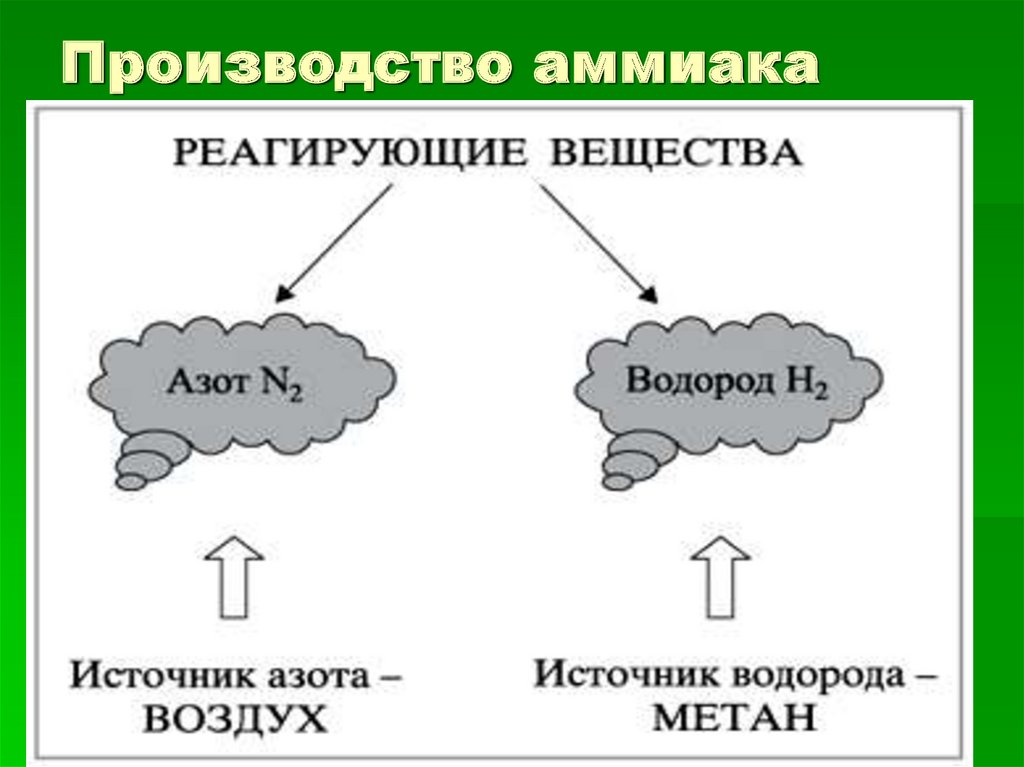
Производство аммиака11.
Историческая справкаЛе Шателье
Фриц Габер 1918
год Нобелевская
премия
Карл Бош
история
12.
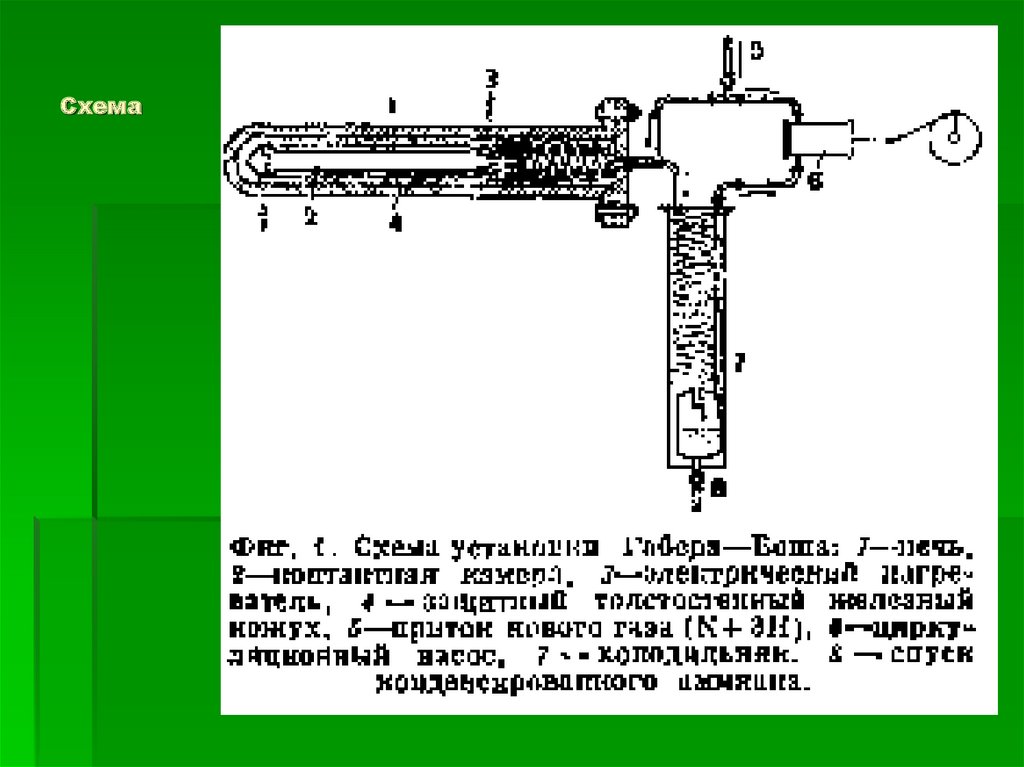
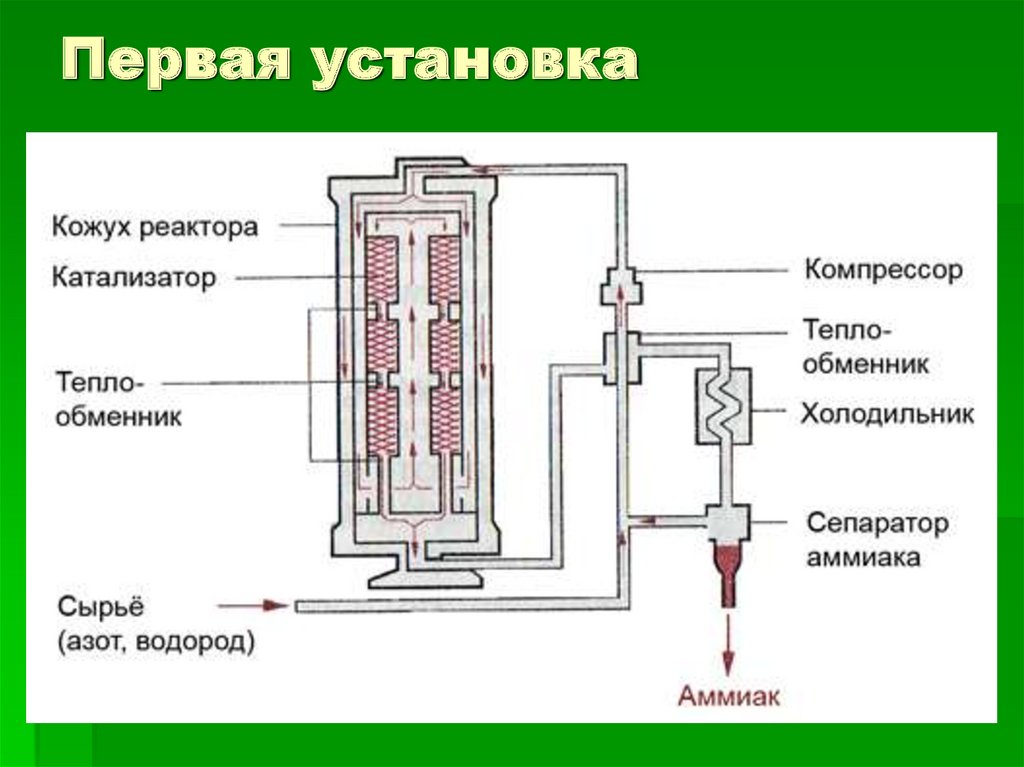
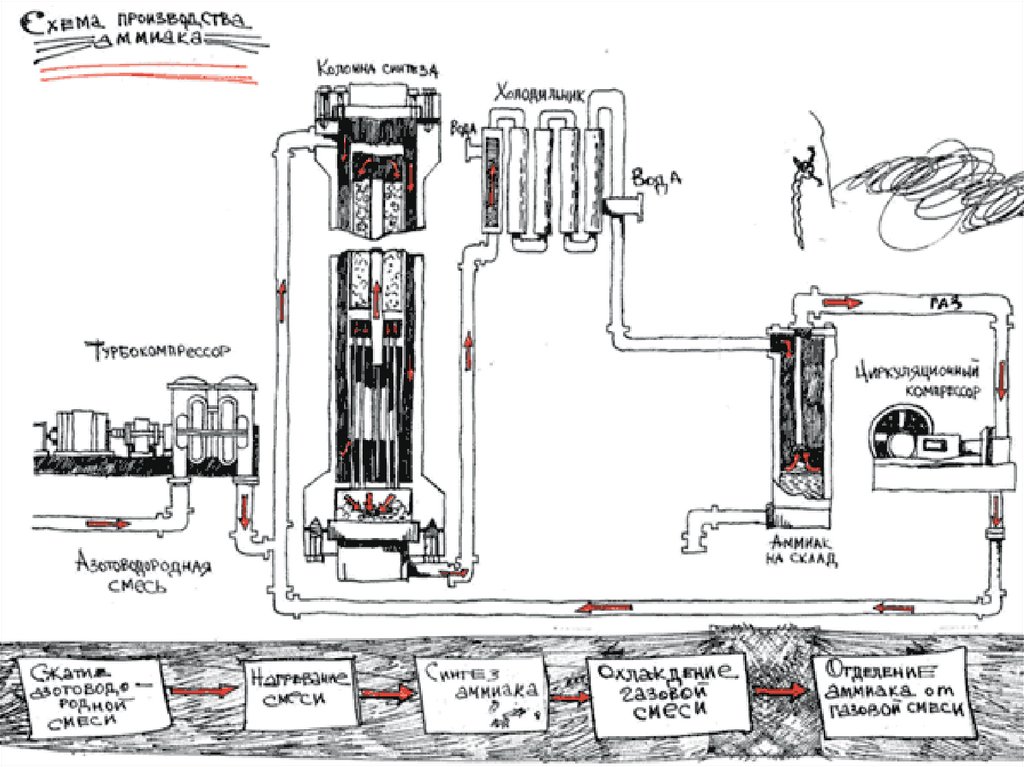
Схема13.
Первая установка14.
Химический процессРеакция Ф. Габера – К.Боша
N2 + 3H2
2 NH3 + O
H = - 92 кДж
15.
10 элементов химическойтехнологии
1 физико-химия процесса и
поиски оптимальных условий
16.
10 элементов2
Сырьё, основные и
побочные продукты,
отходы производства
17.
10 элементов3
Энергетика процесса
4
Аппаратура
18.
10 элементов5
Материалы аппаратуры и
средства их защиты от
коррозии
19.
10 элементов6
Аналитический контроль и
управление процессом.
Включая автоматизацию
и новые технологии
20.
10 элементов7 Организация и охрана труда
8 Защита окружающей среды и
создание экотехнологии
21.
10 элементов9
Экономика производства,
включая
капиталовложения.
Производительность
труда и себестоимость
продукции.
22.
10 элементов10
Развитие принципиально
новых химико –
технологических процессов,
в том числе экстремальных
воздействий(космическая
технология, радиационные,
плазмохимические, криохимические
процессы)
23.
Основные технологическиепринципы
Непрерывность процесса
Противоток
Утилизация теплоты реакции
Теплообмен
Комплексное использование сырья и
отходов производства
Циркуляционный процесс
Принцип кипящего слоя
24.
Основные технологическиепринципы
Теплообменники
25.
26.
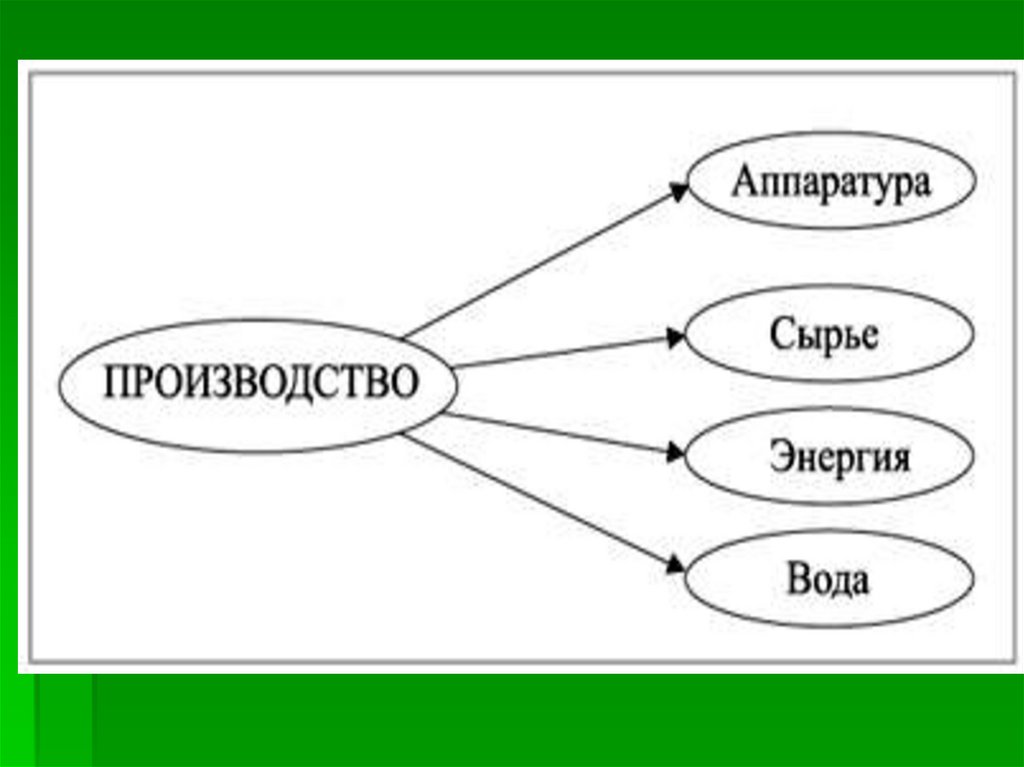
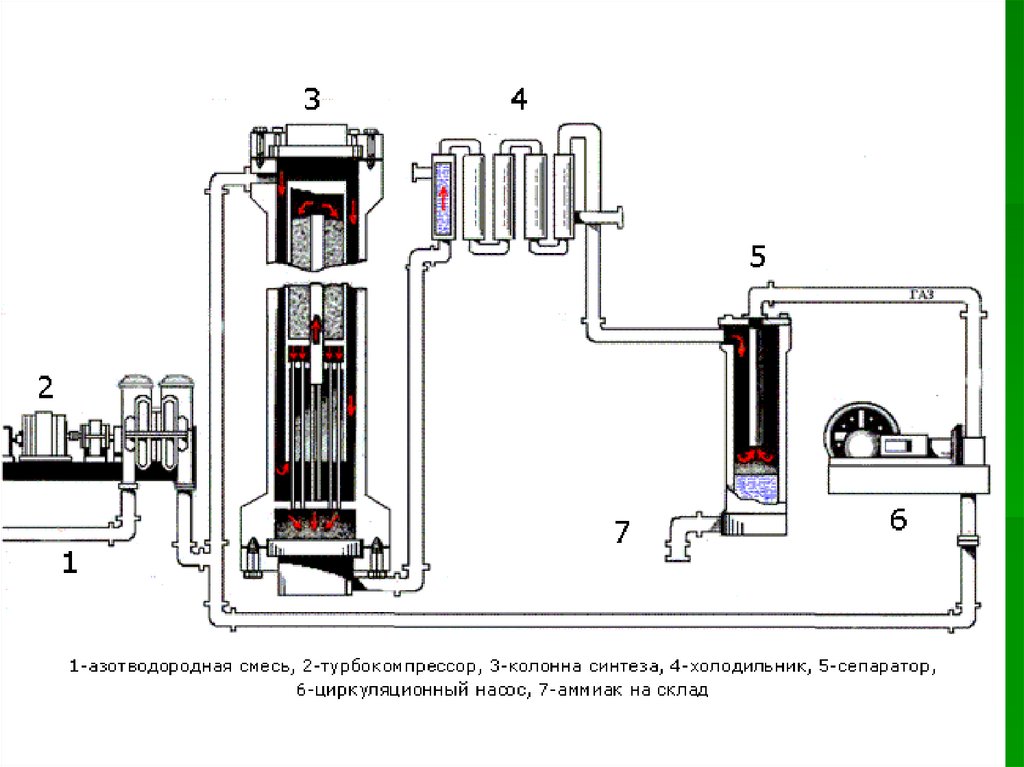
ПланСырьё
Аппаратура
Технологические принципы
Химические процессы и
условия их протекания
Продукт
27.
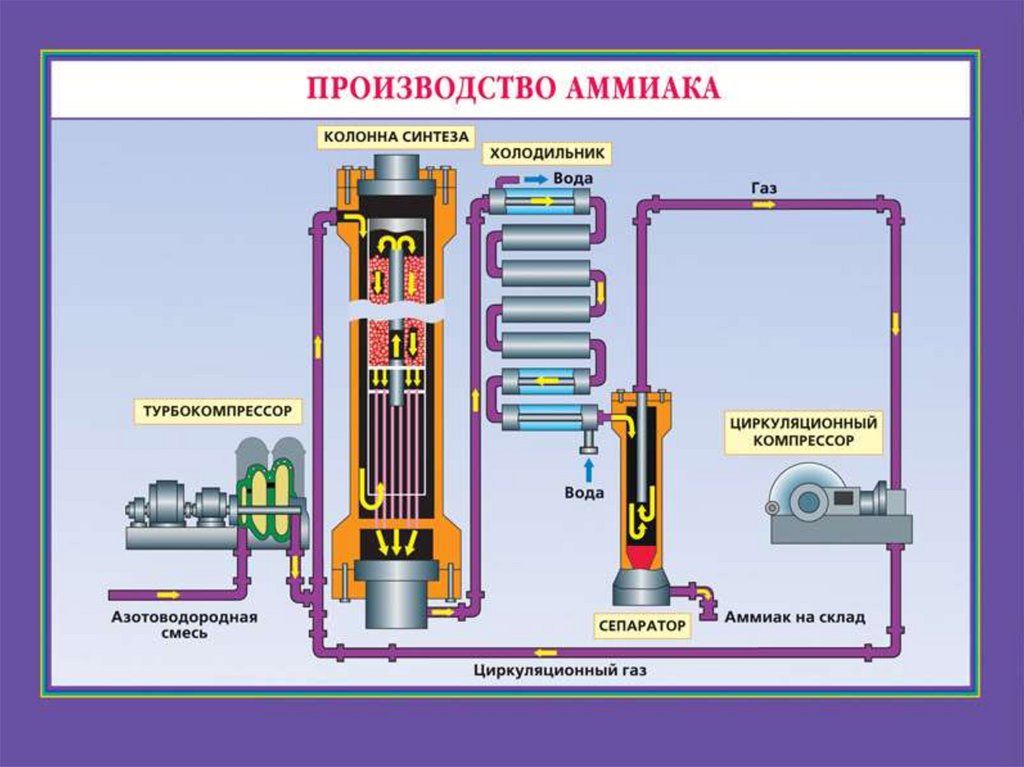
Производство аммиака28.
29.
30.
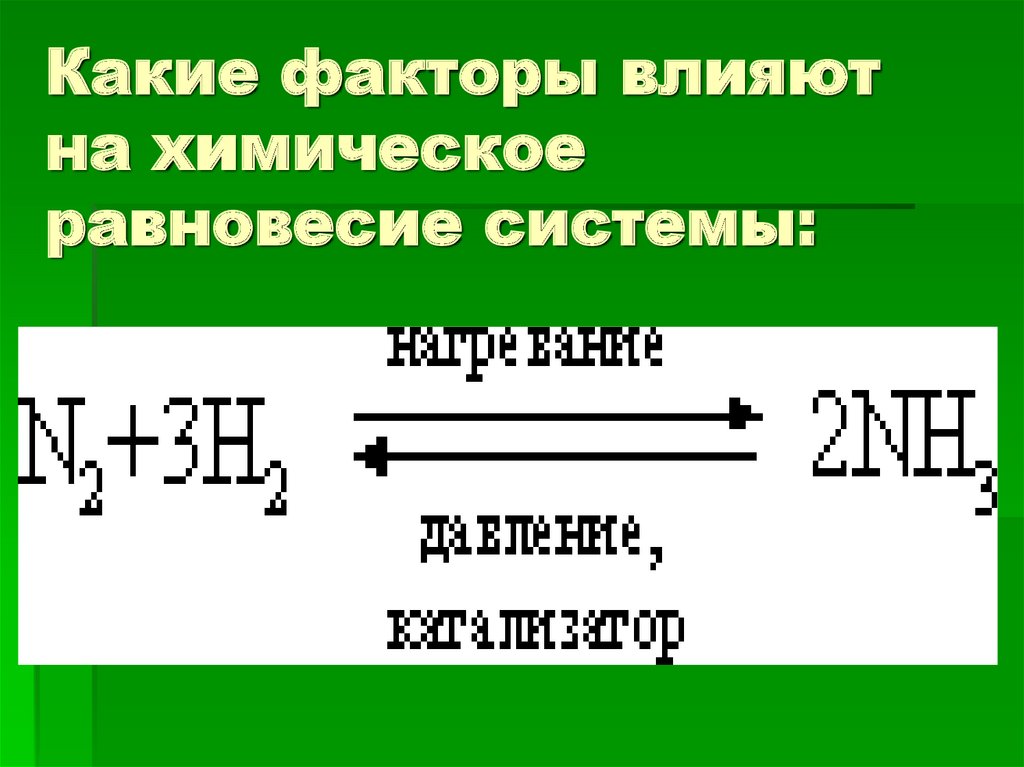
Условия протеканияN2 + 3H2 = 2 NH3 + Q
реакции
Температура 450-550 С
оптимальная
Давление 250-350 атм
или 25-35 Мпа
Катализатор FeO+Fe2O3
Концентрация веществ
31.
Выход продукта15% - 20 %
32.
Какие факторы влияютна химическое
равновесие системы:
33.
ВопросыПочему процесс циркуляционный?
Какое сырьё используют для
производства аммиака?
Какой технологический принцип
используется в колонне синтеза?
Какие факторы смещают
химическое равновесие в сторону
образования продукта реакции?
Какую роль играет катализатор?
34.
Из предложенныхпринципов выберите,
характерные для данного
производства.
35.
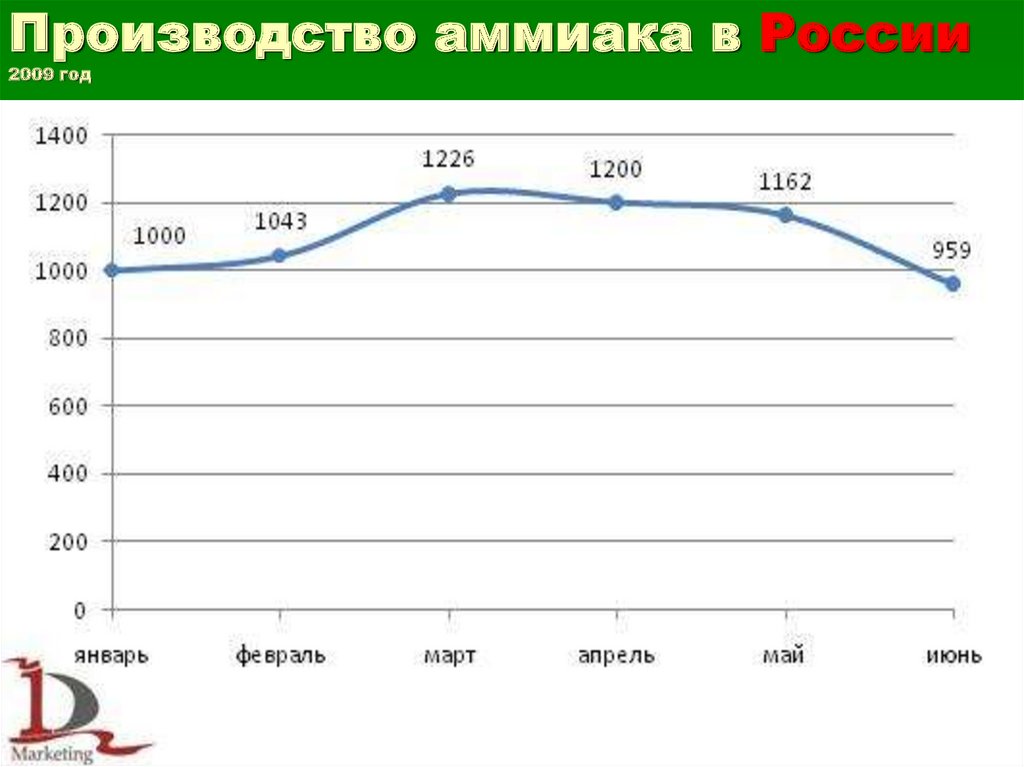
Производство аммиака в России2009 год
36.
37.
38.
Производствосинтетического аммиака
1905-1910 немецкий учёный Ф. Габер
предложил и теоретически обосновал назад
прямой синтез аммиака из простых веществ
1913 при участии К.Боша осуществил
процесс на пилотной установке
1916 реализовал синтез в промышленных
условиях
история



























 Химия
Химия Промышленность
Промышленность








