Похожие презентации:
Электролитическая диссоциация. Электролиты и неэлектролиты
1.
Электролитическаядиссоциация
Электролиты и неэлектролиты
2.
Проводят ли электрическийток вода, соль и раствор соли?
3.
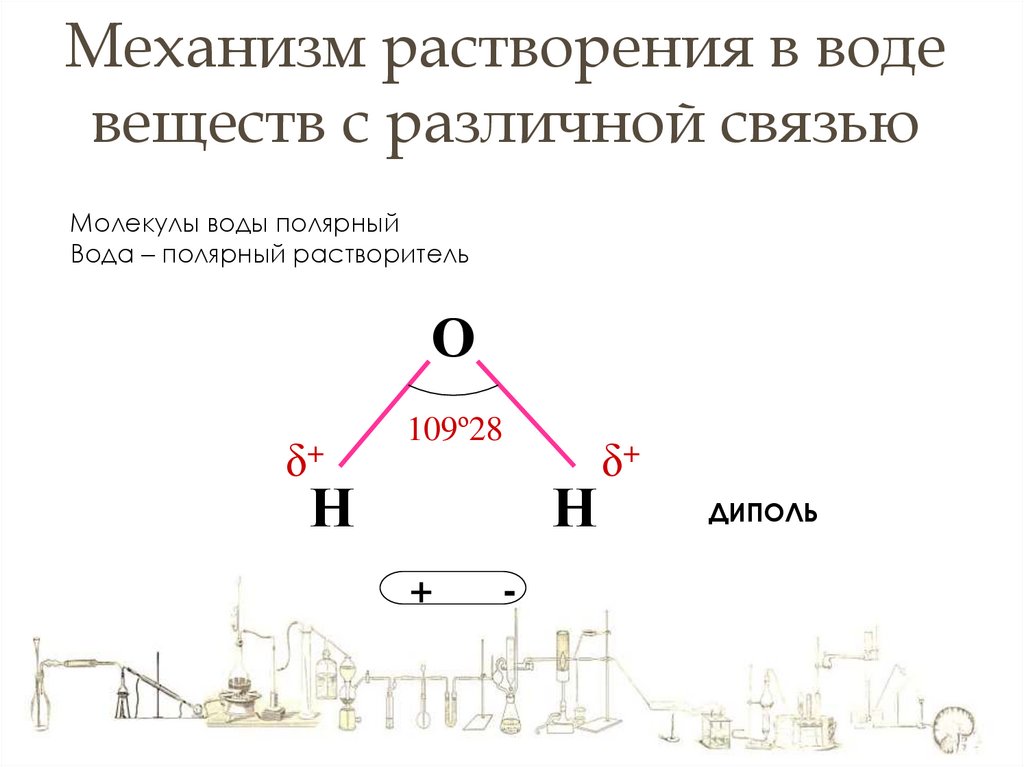
Механизм растворения в водевеществ с различной связью
Молекулы воды полярный
Вода – полярный растворитель
О
δ+
109º28
Н
Н
+
-
δ+
ДИПОЛЬ
4.
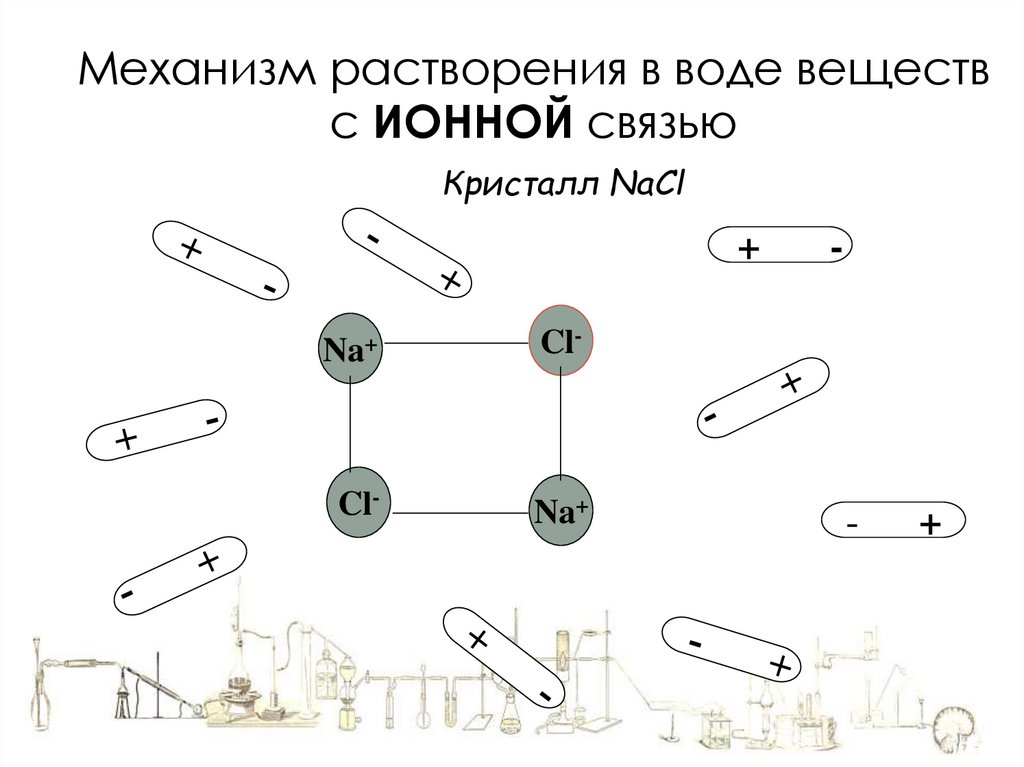
Механизм растворения в воде веществс ИОННОЙ связью
Кристалл NaCl
+
Na+
Cl-
Cl-
Na+
-
-
+
5.
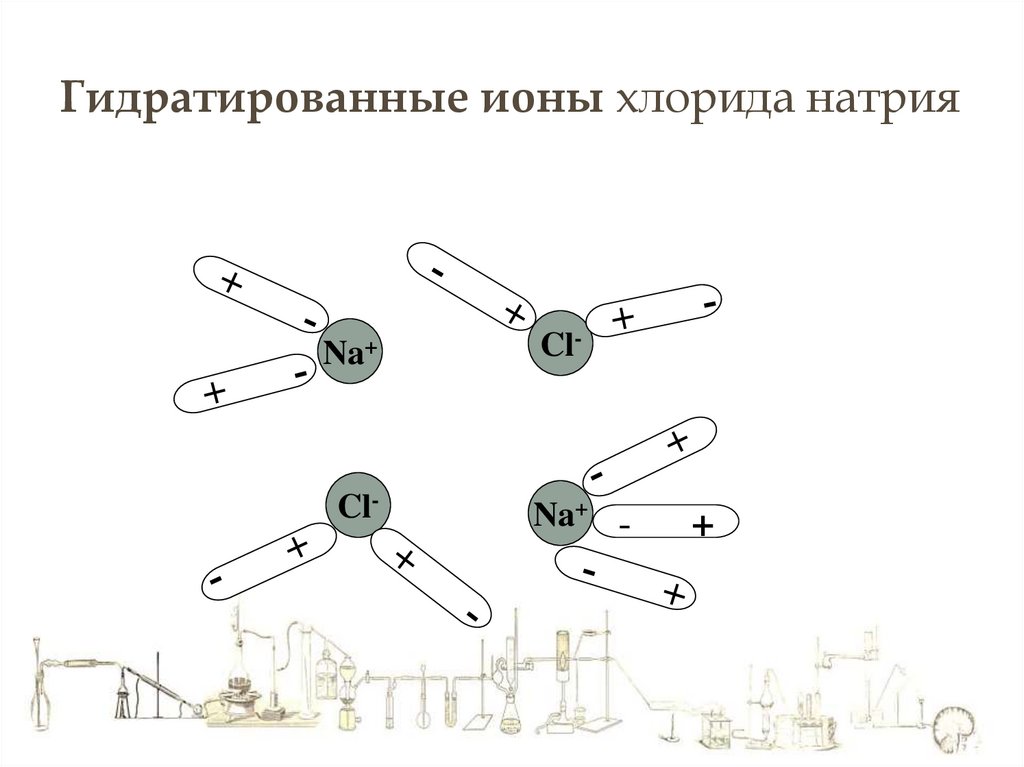
Гидратированные ионы хлорида натрияNa+
Cl-
Cl-
Na+ -
+
6.
Механизм растворения в водевеществ с ИОННОЙ связью
Процессу
гидратации
способствует
большая диэлектрическая проницаемость
воды.
При 20о она равна 81.
Это значить, что химическая связь между
ионами в воде в 81 раз слабее, чем в
вакууме.
7.
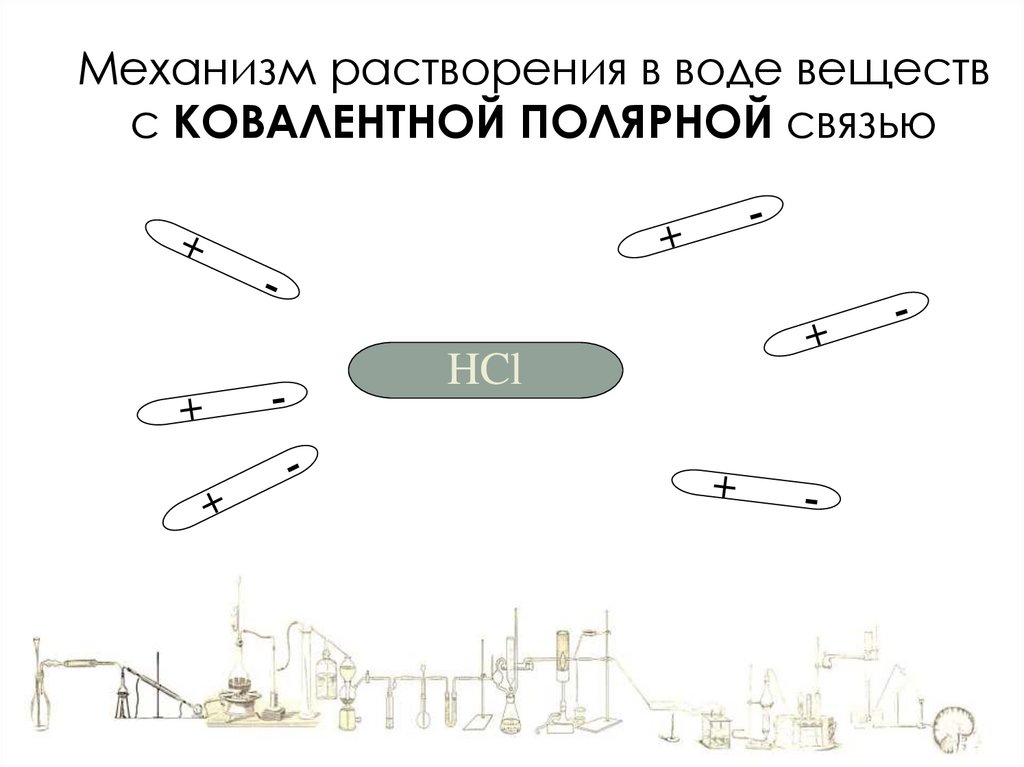
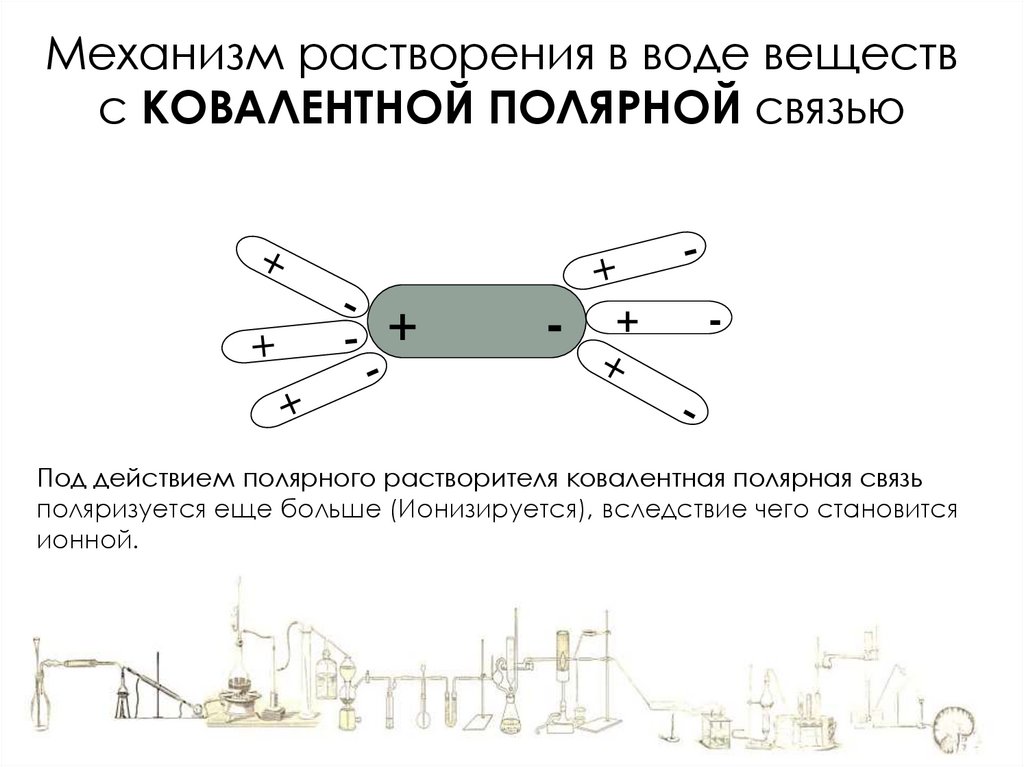
Механизм растворения в воде веществс КОВАЛЕНТНОЙ ПОЛЯРНОЙ связью
HCl
8.
Механизм растворения в воде веществс КОВАЛЕНТНОЙ ПОЛЯРНОЙ связью
+
-
+
-
Под действием полярного растворителя ковалентная полярная связь
поляризуется еще больше (Ионизируется), вследствие чего становится
ионной.
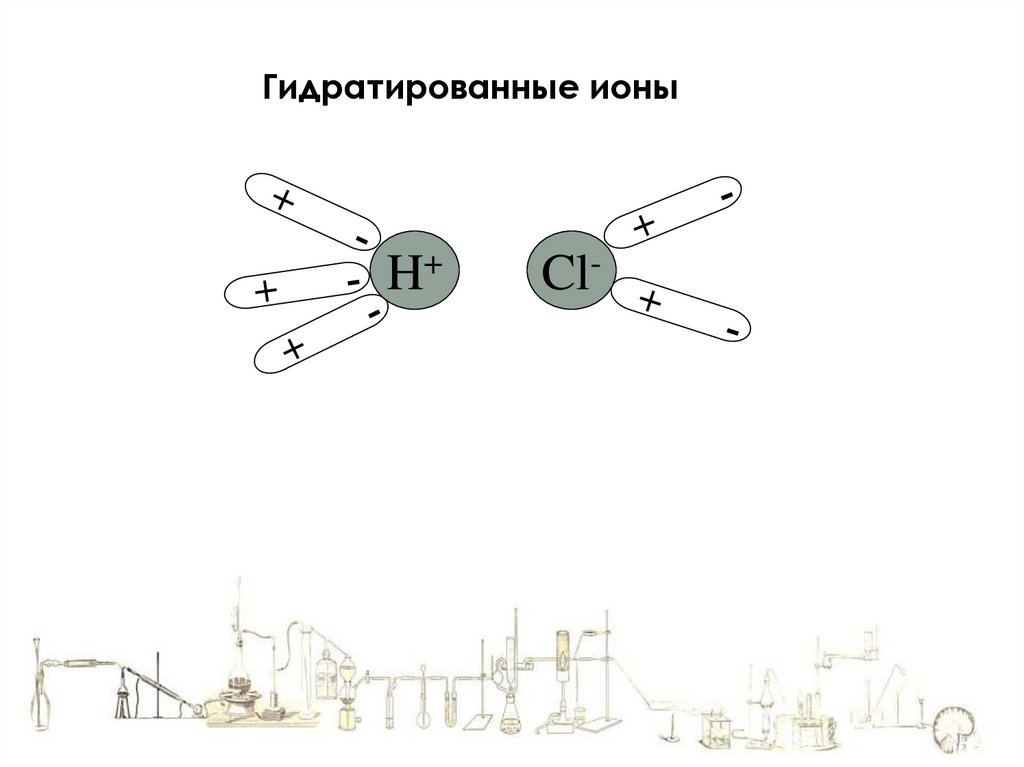
9.
Гидратированные ионыH+
Cl-
10.
Соли и щелочи проводят ток не только врастворах, но и в расплавах.
А сахар, ацетон и спирт ток не
проводят.
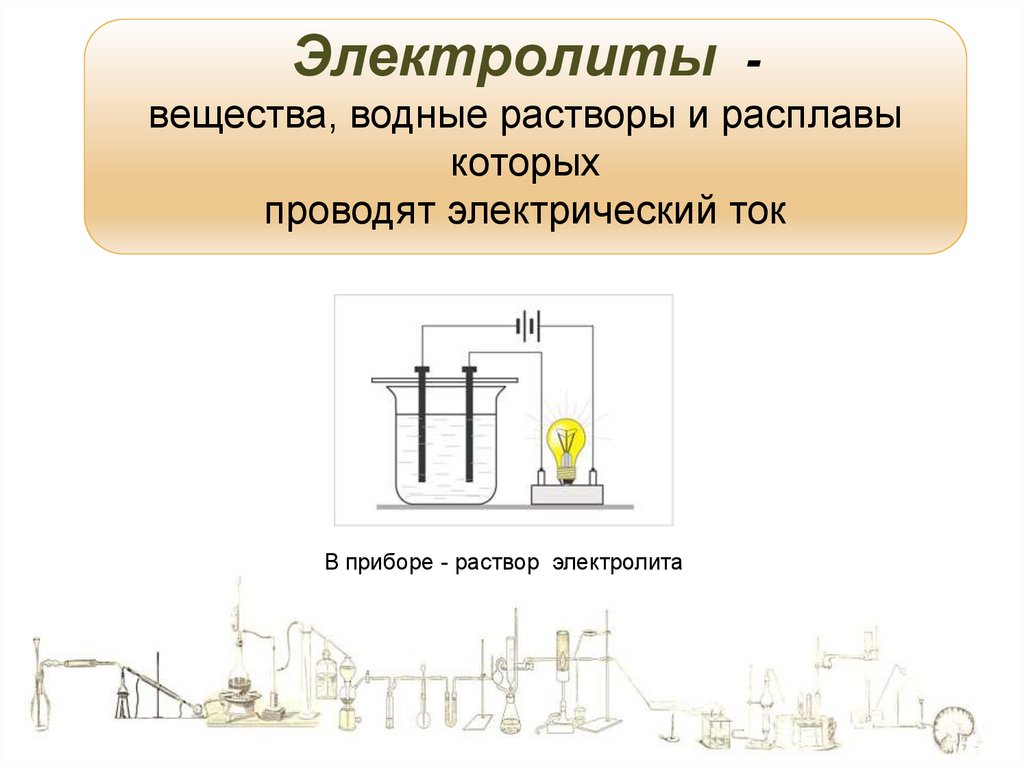
11.
Электролиты вещества, водные растворы и расплавыкоторых
проводят электрический ток
В приборе - раствор электролита
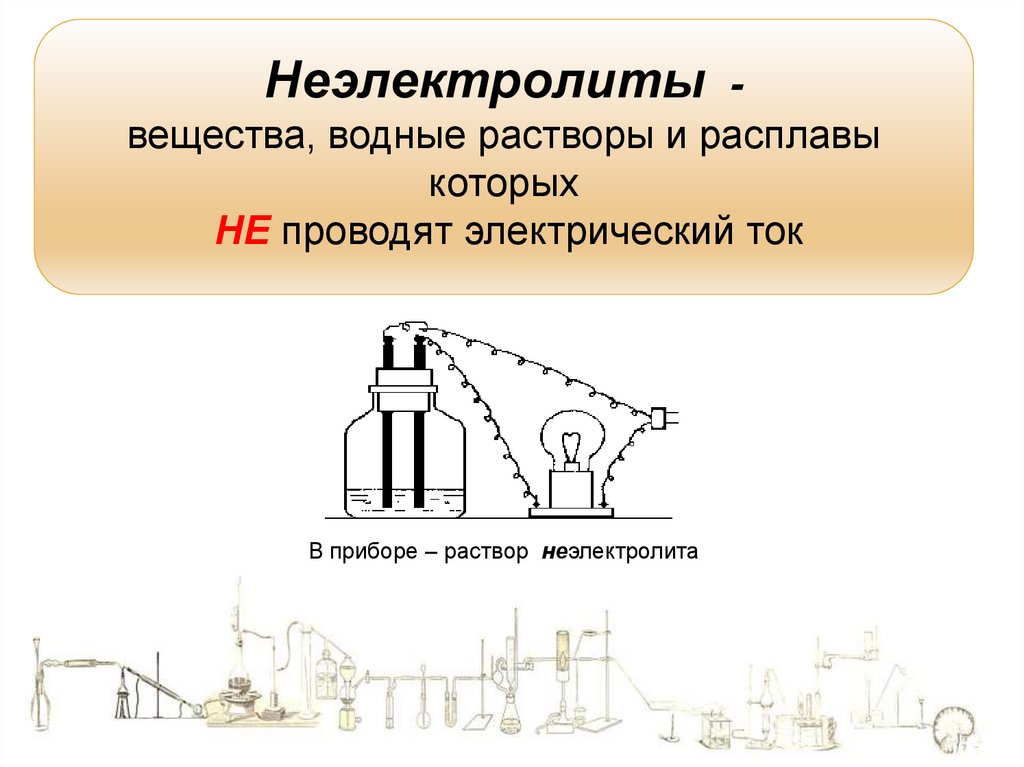
12.
Неэлектролитывещества, водные растворы и расплавы
которых
НЕ проводят электрический ток
В приборе – раствор неэлектролита
13.
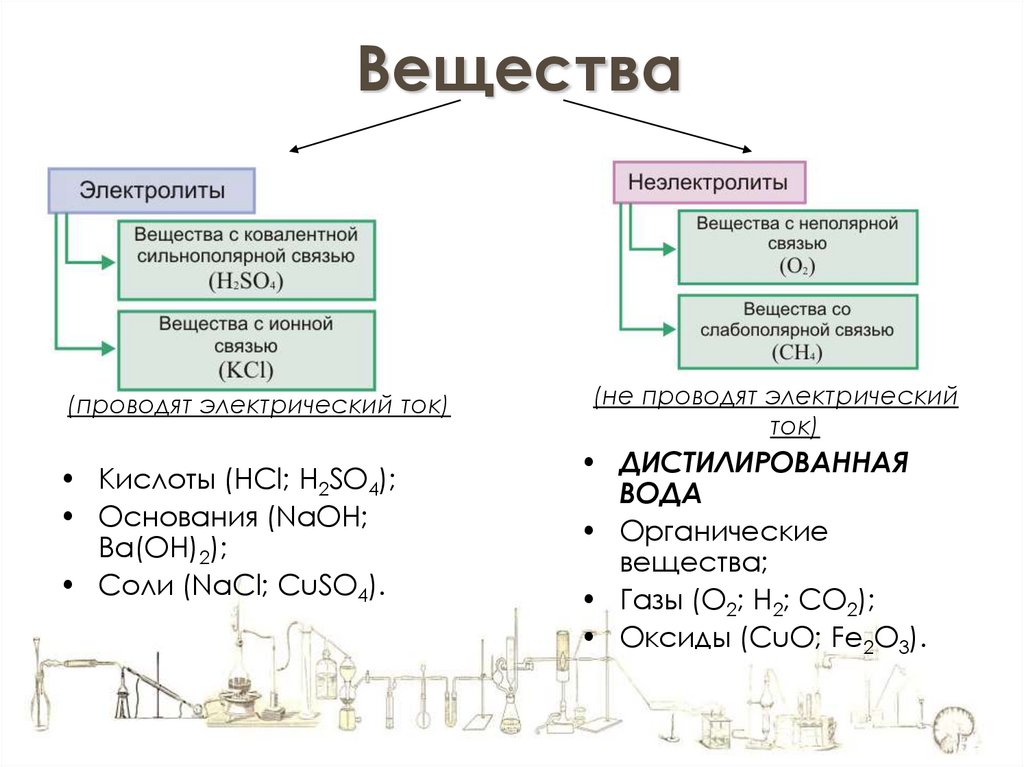
Вещества(проводят электрический ток)
• Кислоты (HCl; H2SO4);
• Основания (NaOH;
Ba(OH)2);
• Соли (NaCl; CuSO4).
(не проводят электрический
ток)
• ДИСТИЛИРОВАННАЯ
ВОДА
• Органические
вещества;
• Газы (O2; H2; CO2);
• Оксиды (CuO; Fe2O3).
14.
Электролитическая диссоциация процесс распада электролита на ионыпри растворении в воде или
расплавлении.
Сванте Август
Аррениус
1859-1927гг.
Шведский физико-химик,
создатель теории
электролитической
диссоциации.
14
15.
Теория электролитической диссоциации1.
Электролиты
при
растворении
в
воде
или
расплавлении
распадаются (диссоциируют) на положительно
заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды гидратированы
16.
Теория электролитической диссоциации1.
Электролиты
при
растворении
в
воде
или
расплавлении
распадаются (диссоциируют) на положительно
заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды гидратированы
Уравнение диссоциации записывают упрощенно
KCl → K+ + Cl-
17.
Теория электролитической диссоциации1.
Электролиты
при
растворении
в
воде
или
расплавлении
распадаются (диссоциируют) на положительно
заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды гидратированы
Уравнение диссоциации записывают упрощенно
KCl → K+ + ClCuSO4 → Cu2+ + SO42-
18.
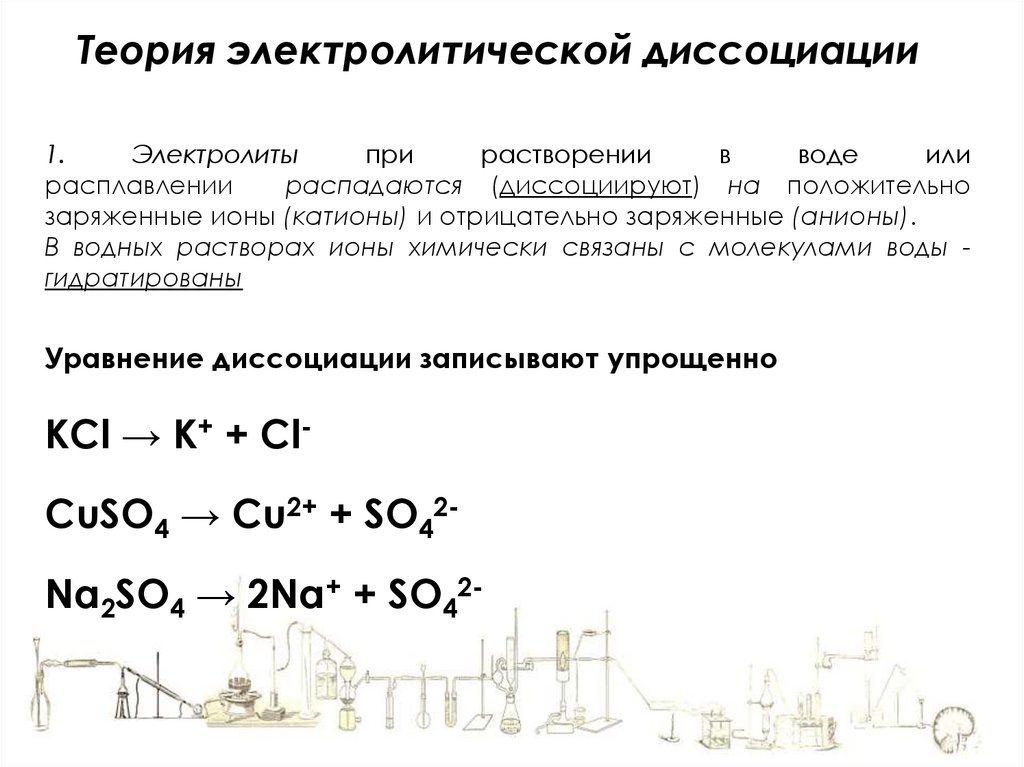
Теория электролитической диссоциации1.
Электролиты
при
растворении
в
воде
или
расплавлении
распадаются (диссоциируют) на положительно
заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды гидратированы
Уравнение диссоциации записывают упрощенно
KCl → K+ + ClCuSO4 → Cu2+ + SO42Na2SO4 → 2Na+ + SO42-
19.
Теория электролитической диссоциации2. Ионы отличаются от атомов по строению и свойствам.
Ионы находятся в более устойчивых электронных состояниях,
чем атомы.
Изобразите электронное строение атома и иона натрия.
Атом
Ион
20.
Теория электролитической диссоциации2. Ионы отличаются от атомов по строению и свойствам.
Ионы находятся в более устойчивых электронных состояниях,
чем атомы.
Изобразите электронное строение атома и иона натрия.
Атом
Ион
21.
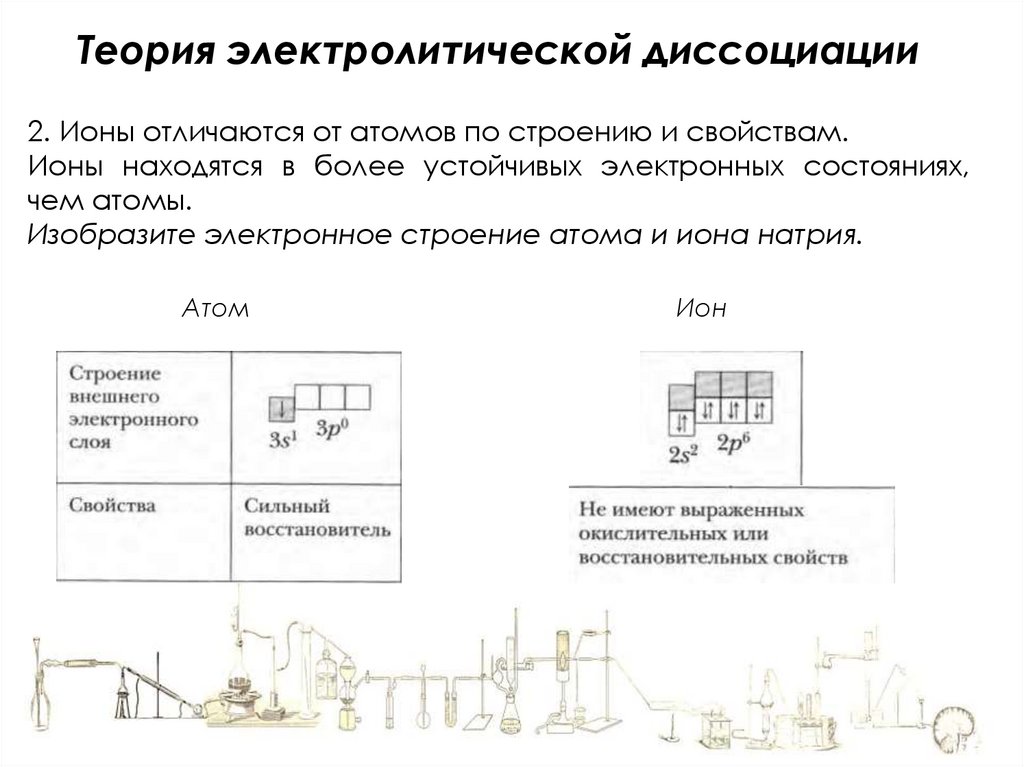
Теория электролитической диссоциации2. Ионы отличаются от атомов по строению и свойствам.
Ионы находятся в более устойчивых электронных состояниях,
чем атомы.
Изобразите электронное строение атома и иона натрия.
Атом
Ион
22.
Теория электролитической диссоциации3.
В
растворах
и
расплавах
электролиты
проводят
электрический ток. При пропускании тока ионы движутся
упорядоченно
катионы к катоду (-)
анионы к аноду (+)
23.
Растворение – физикохимический процессПри растворение в воде серной кислоты
выделяется большое количество тепла.
При растворении аммиачной селитры
(нитрата аммония) NH4NO3 – поглощается
тепло.
Тепловые
явления
являются
признаком
химической реакции.
24.
Гидратированные ионы могутотличаться по окраске от
негидратированных
• CuSO4 – белый порошок
• Гидратированные ионы
раствору голубой цвет
меди
придают
• При выпаривании образуются голубые
кристаллы медного купороса CuSO4*5H2O
25.
Домашнее задание§ 6 – учить!












 Химия
Химия








