Похожие презентации:
Анализ эффективности вакцины Moderna/NIAID (mRNA-1273)
1.
ФГБОУ ВО ОрГМУ МЗ РФКафедра эпидемиологии и инфекционных
болезней
Анализ эффективности вакцины
Moderna/NIAID (mRNA-1273)
Выполнила: Швецова А.А. 4 курс МПФ
Научный руководитель: Доц., к. биол. н. Корнеев А.Г.
Оренбург, 2021 г.
2.
Организации, разрешившиеиспользование вакцины
Вакцина Moderna COVID-19 не была одобрена или лицензирована
управлением по контролю за продуктами и лекарствами США
(FDA), но была разрешена для экстренного использования лиц в
возрасте 18 лет и старше.
EMEA тщательно проанализировало данные о качестве, безопасности
и эффективности вакцины против COVID-19 компании «Модерна»
и выдало разрешение на ее использование во всех
странах Европейского союза.
А также 26 января 2021 г. Стратегическая консультативная группа
экспертов ВОЗ по иммунизации (СКГЭ) выпустила временные
рекомендации по иммунизации лиц в возрасте 18 лет и старше
вакциной против COVID-19 мРНК-1273 компании «Модерна».
Цель работы: изучить свойства и эффективность вакцины
Moderna (mRNA-1273).
https://www.modernatx.com/covid19vaccine-eua/
3.
Основные характеристики вакциныОписание: LNP-инкапсулированная мРНК вакцина, кодирующая sбелок, платформой которой являются липидные наночастицы,
содержащие фрагмент мРНК вируса SARS-CoV-2.
Производитель: Moderna TX, Inc./ Национальный институт аллергии
и инфекционных заболеваний США (NIAID).
Показания к применению: Для экстренной профилактики COVID19, вызванного вирусом SARS-CoV-2, для лиц в возрасте 18-71 год и
старше, а также работники здравоохранения с повышенным риском
заражения.
Эффективность: 94,1% (89,3-96,8%).
https://www.nejm.org/doi/full/10.1056/NEJMoa2035389
4.
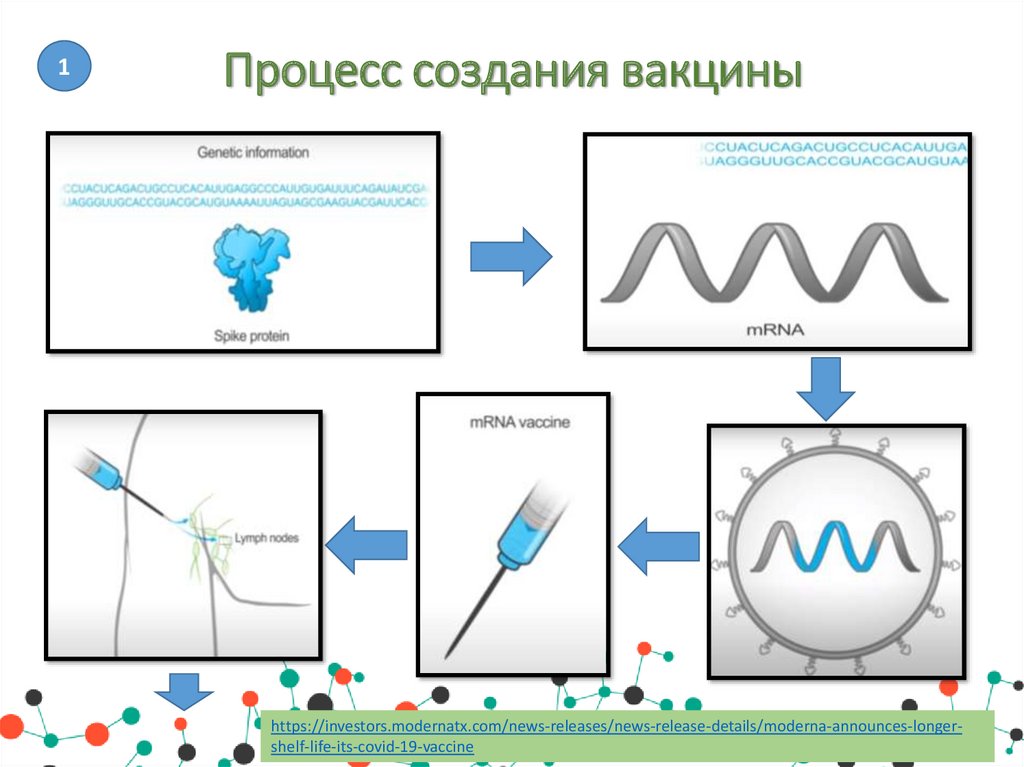
1Процесс создания вакцины
https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-longershelf-life-its-covid-19-vaccine
5.
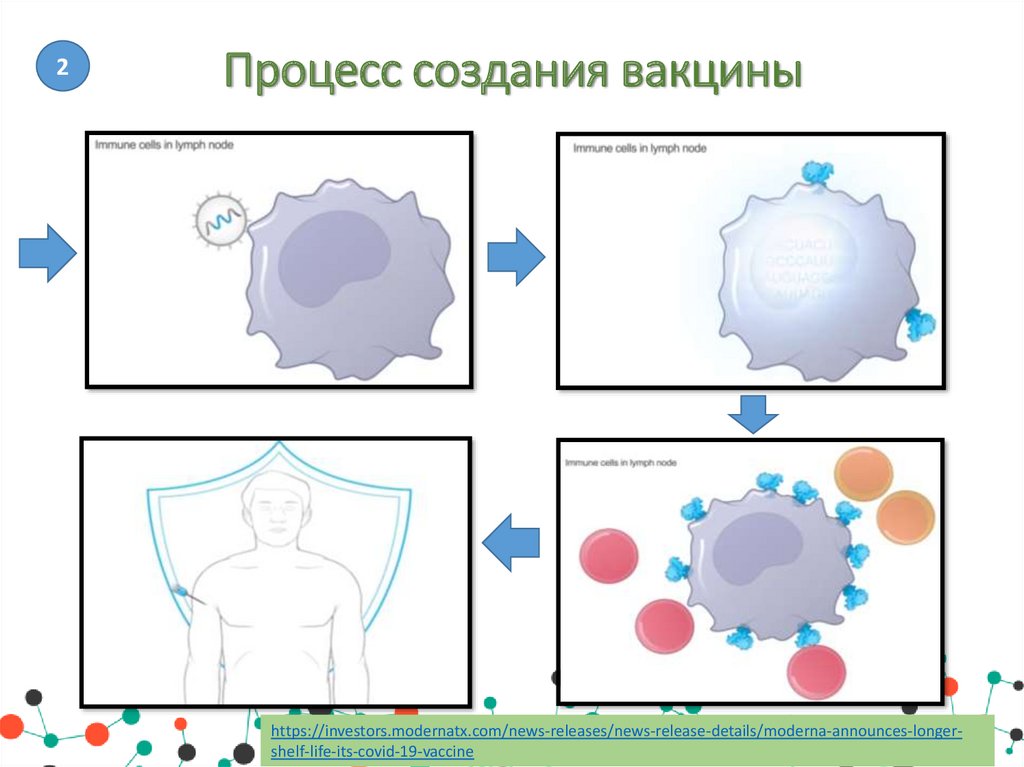
2Процесс создания вакцины
https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-longershelf-life-its-covid-19-vaccine
6.
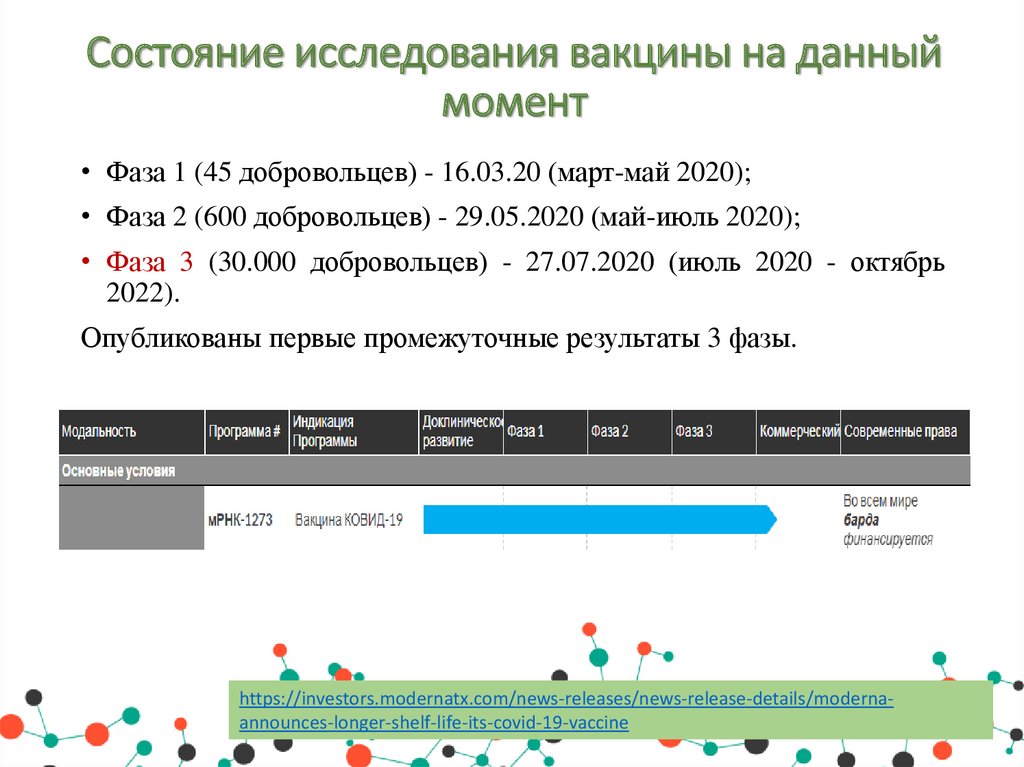
Состояние исследования вакцины на данныймомент
• Фаза 1 (45 добровольцев) - 16.03.20 (март-май 2020);
• Фаза 2 (600 добровольцев) - 29.05.2020 (май-июль 2020);
• Фаза 3 (30.000 добровольцев) - 27.07.2020 (июль 2020 - октябрь
2022).
Опубликованы первые промежуточные результаты 3 фазы.
https://investors.modernatx.com/news-releases/news-release-details/modernaannounces-longer-shelf-life-its-covid-19-vaccine
7.
Преимущества условий храненияУсловия хранения: вакцина стабильна при температуре от 2° до 8°C,
температуре
стандартного
домашнего
или
медицинского
холодильника, в течение 30 дней. мРНК-1273 остается стабильной
при температуре минус 20° C в течение шести месяцев, в
охлажденных условиях - до 30 дней и при комнатной температуре до 12 часов. Перед вакцинацией разведение не требуется.
Способ применения и дозировка:
внутримышечно (100 мкг, 0,5 мл
каждая). Дозы можно держать в
шприцах до 8 часов при комнатной
температуре
перед
введением.
Повторная вакцинация проводится
через 28 дней. Затем 6 раз в течение
2
лет
будет
проводиться
определение уровня антител.
https://investors.modernatx.com/news-releases/news-release-details/modernaannounces-longer-shelf-life-its-covid-19-vaccine
8.
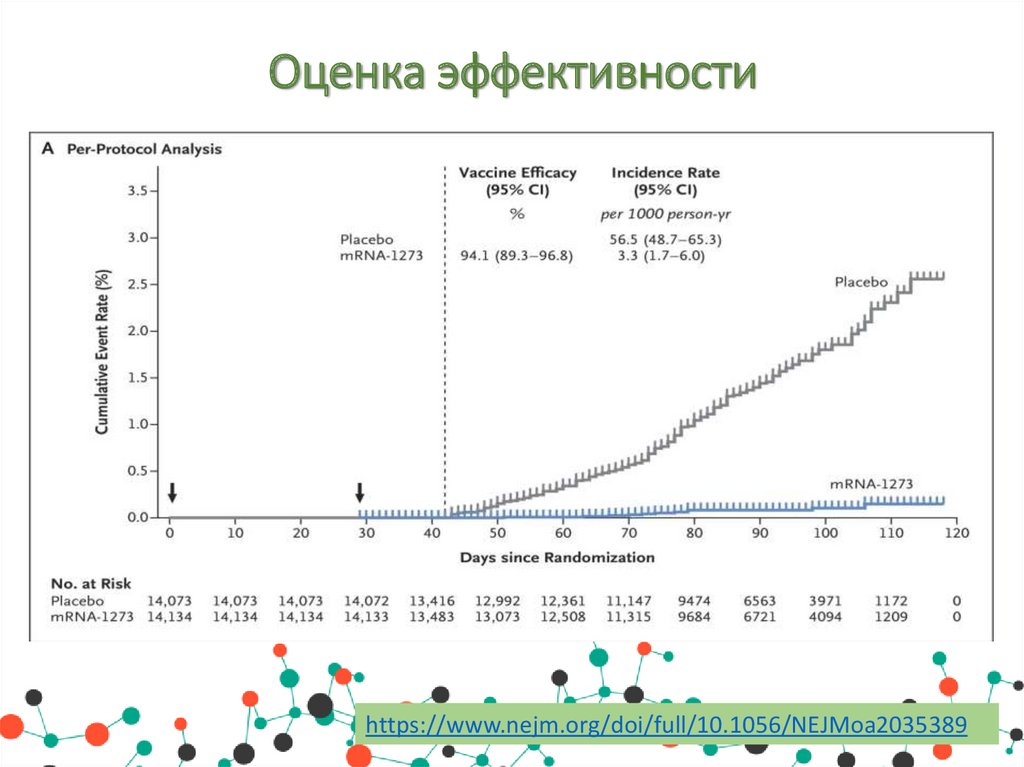
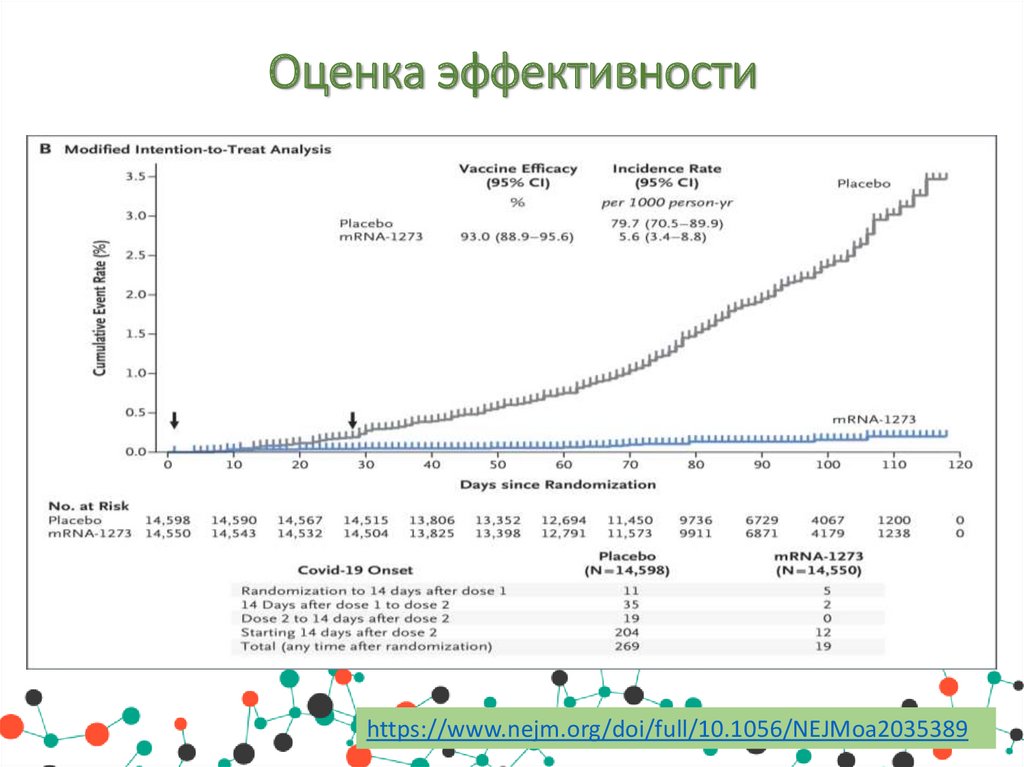
Оценка эффективностиПо результатам 3 фазы рандомизированного, стратифицированного,
двойного
слепого
плацебо-контролируемого
испытания
симптоматическое заболевание Covid-19 было подтверждено у 185
участников в группе плацебо (56,5 на 1000 человеко-лет; 95%
доверительный интервал [Ди], 48,7 - 65,3) и у 11 участников в
группе мРНК-1273 (3,3 на 1000 человеко-лет; 95% Ди, 1,7 6,0); эффективность вакцины составила 94,1% (95% Ди от 89,3
до 96,8%, р<0,001).
Эффективность была одинаковой во всех ключевых вторичных
анализах, включая оценку через 14 дней после первой дозы,
анализы, включавшие участников, у которых были доказательства
инфекции SARS-CoV-2 в исходном состоянии, и анализы у
участников в возрасте 65 лет и старше.
Тяжелая форма Covid-19 наблюдалась у 30 участников с одним
смертельным исходом; все 30 были в группе плацебо. Умеренная,
преходящая реактогенность после вакцинации чаще встречалась в
группе мРНК-1273.
https://pubmed.ncbi.nlm.nih.gov/33378609/
9.
Оценка эффективностиhttps://www.nejm.org/doi/full/10.1056/NEJMoa2035389
10.
Оценка эффективностиhttps://www.nejm.org/doi/full/10.1056/NEJMoa2035389
11.
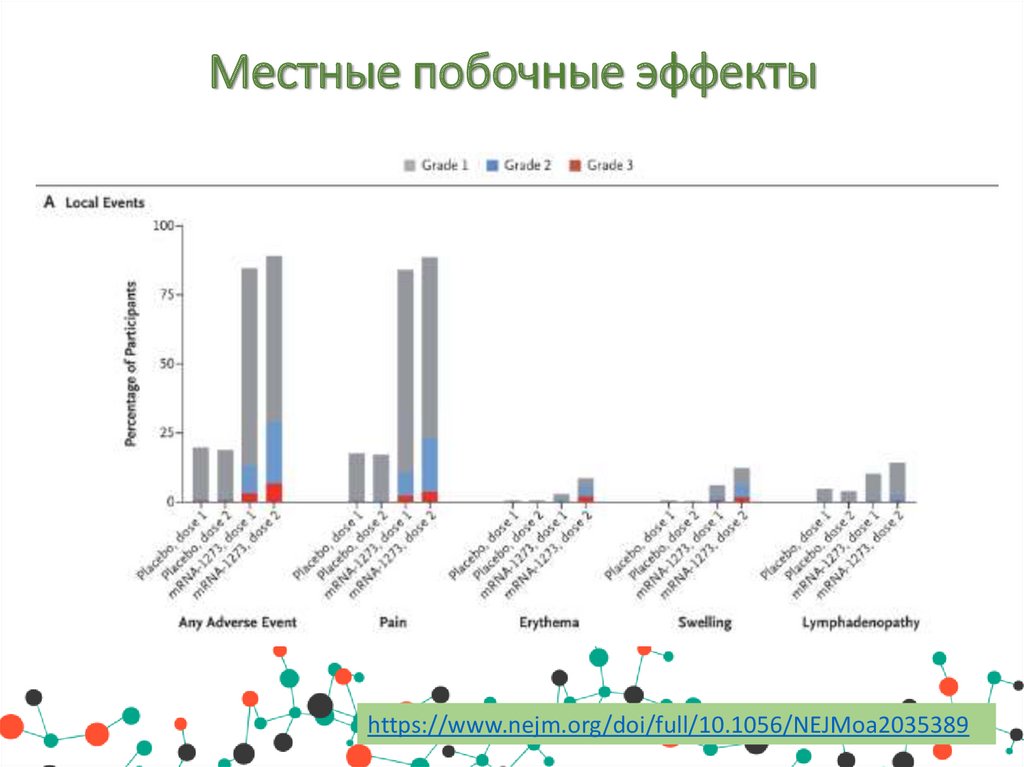
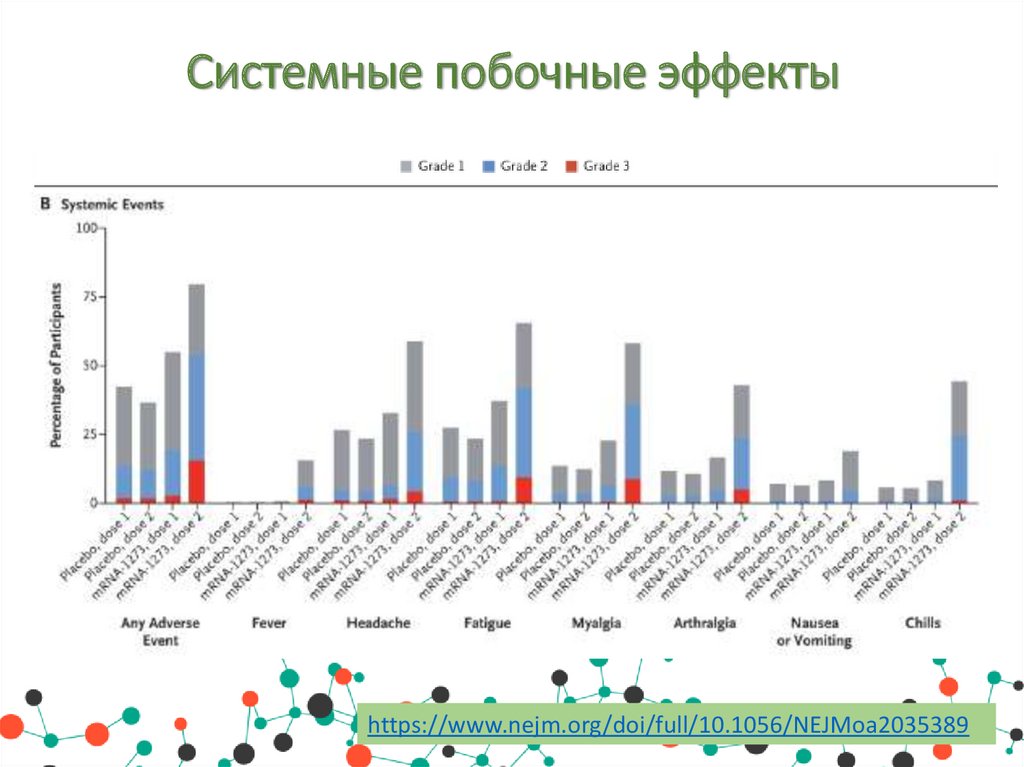
Побочные эффектыНежелательные побочные явления в месте инъекции возникали чаще
в группе мРНК-1273, чем в группе плацебо, как после первой дозы
(84,2% против 19,8%), так и после второй дозы (88,6% против 18,8%),
в основном они были 1-й и 2-й степени тяжести и продолжались в
среднем в среднем 2,6 и 3,2 дня после первой и второй доз
соответственно. Эффекты подразделяются на:
• Местные побочные эффекты: боль, болезненность и увеличение
лимфатических узлов в руке, в которую производилась инъекция,
отек (уплотнение) и покраснение.
• Системные побочные эффекты: утомляемость, головная боль,
мышечная боль, боль в суставах, озноб, тошнота и рвота,
повышение температуры тела.
• Возможна
аллергическая
(анафилактическая)
реакция
(затрудненное дыхание; отек лица и горла; учащенное
сердцебиение; обильная сыпь по всему телу; головокружение и
слабость).
https://www.nejm.org/doi/full/10.1056/NEJMoa2035389
12.
Местные побочные эффектыhttps://www.nejm.org/doi/full/10.1056/NEJMoa2035389
13.
Системные побочные эффектыhttps://www.nejm.org/doi/full/10.1056/NEJMoa2035389
14.
Противопоказания к применениюВакцина Moderna COVID-19 не рекомендуется при наличии:
• отмеченной ранее тяжелой аллергической
предыдущей дозы этой вакцины;
реакции
после
• отмеченной ранее тяжелой аллергической реакции на любые
ингредиенты этой вакцины.
ВОЗ не рекомендует использовать
мРНК-1273 беременным и детям, так
как клинические исследования в
данных группах еще не проводились.
https://www.fda.gov/media/144830/download
15.
ВыводыУчитывая выше описанную эффективность, вакцина мРНК-1273 против
COVID-19, разработанная компанией Moderna:
• имеет эффективность 94,1% среди населения 18-65 лет и старше;
• не требует особых условий холодовой цепи;
• не требует разведения перед вакцинацией;
• вводится в дозе 100 мкг (0,5 мл) дважды (промежуток между
вакцинами 28 дней (максимум 42));
• имеет побочные эффекты, которые относятся к 1 и 2 группе тяжести
(чаще всего – боль в месте инъекции), но они проходят через 2-3 дня;
• проходит 3-й этап клинических испытаний (до октября 2022 г.);
• не может вызвать заболевание (кодирует только s-белок вируса) и
поэтому особенно показана пожилым людям и работникам
здравоохранения в качестве экстренной профилактики.









 Медицина
Медицина








