Похожие презентации:
Оксиды, их классификация и химические свойства. 8 класс
1.
«Оксиды, их классификация ихимические свойства».
Автор учитель химии и биологии
Ильчук Наталья Владимировна
МОКУ «Соболевская средняя школа»
2.
Повторим!!!• Какие соединения мы называем оксидами?.
• Назовите и запишите общую формулу
оксидов.
• Назвать известные оксиды….
• В каких агрегатных состояниях встречаются
оксиды?
• Можно ли назвать оксидами: перекись
водорода, фторид кислорода? Запишите их
формулы.
3.
КЛАССИФИКАЦИЯ ОКСИДОВ №1Несолеобразующие
Солеобразующие
-не взаимодействуют
ни с кислотами, ни с
щелочами и не
образуют солей;
-оксид азота(1)
оксид азота(11)
оксид углерода(11)
-взаимодействуют с
кислотами или
основаниями и
образуют при этом
соль и воду;
- все остальные ;
- Основные и
кислотные.
4.
Классификация оксидов № 2Основные –это такие
оксиды, которым
соответствуют
основания.
Оксиды металлов
главных подгрупп 1 и2
группы ПСХЭ.
Алюминий +3
Твердые вещества.
Кислотные
5.
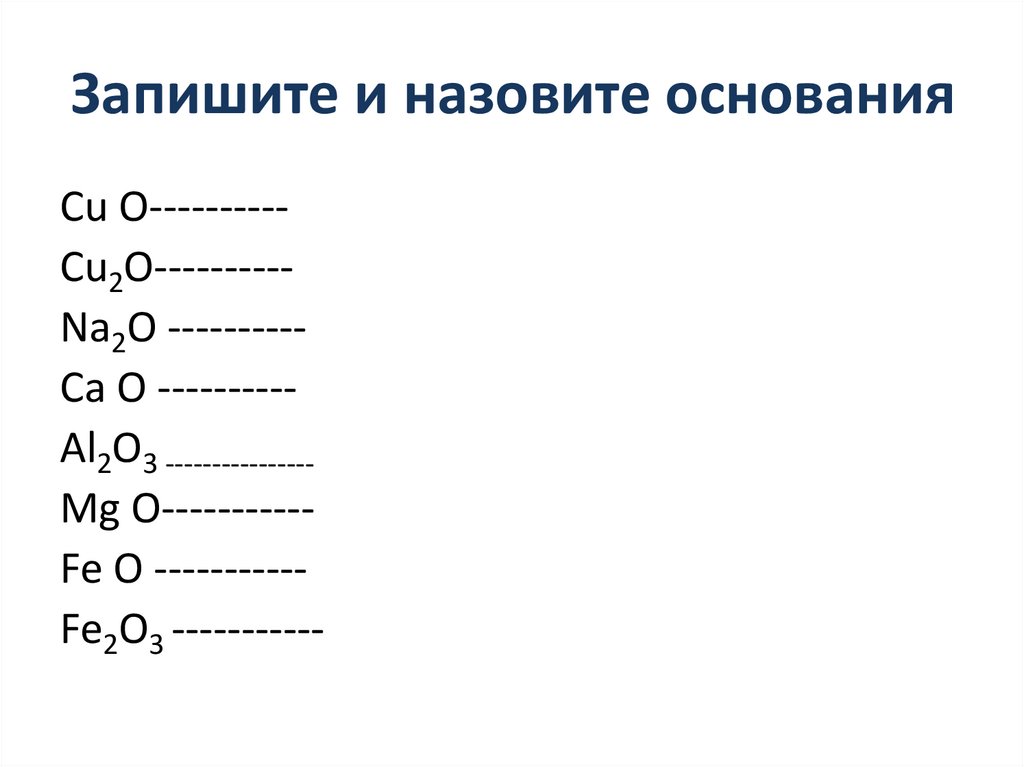
Запишите и назовите основанияCu O---------Cu2O---------Na2O ---------Ca O ---------Al2O3 ---------------Mg O----------Fe O ----------Fe2O3 -----------
6.
Запишите и назовите основанияCu O--------------- Cu (OH)2
Cu2O---------- -----Cu OH
Na2O ---------------- Na OH
Ca O --------------- Ca (OH)2
Al2O3 --------------------- Al (OH)3
Mg O----------------Mg (OH)2
Fe O ---------------- Fe (OH)2
Fe2O3 ---------------- Fe (OH)3
7.
Типичные реакции основныхоксидов
1.Основный оксид + кислота = соль + вода ?
3Na2O +2H3PO4 =
Cu O = 2HNO3 =
2.Основный оксид +кислотный оксид = соль ?
Ca O + N2O5 =
Mg O + SiO2 =
3.Основный оксид + вода = щёлочь ?
K2O + H2O =
Ca O + H2O =
8.
Типичные реакции основныхоксидов
1.Основный оксид + кислота = соль + вода ( обмена)
3Na2O +2H3PO4 = 2Na3PO4 +3H2O
Cu O + 2HNO3 = Cu(NO3)2 +H2O
2.Основный оксид +кислотный оксид = соль ( соединения)
Ca O + N2O5 = Ca(NO3)2
Mg O + SiO2 = MgSiO3
3.Основный оксид + вода = щёлочь ( соединения)
K2O + H2O = 2 KOH
Ca O + H2O = Ca (OH)2
Cu O + H2O = реакция не идет , т.к. нерастворимое основание
Cu(OH)2
9.
Классификация оксидов № 2Кислотные -
это
такие оксиды,
которым
соответствуют
кислоты.
Оксиды неметаллов.
Оксиды металлов с
большим значением
С.О.
Твердые, жидкие, газы.
10.
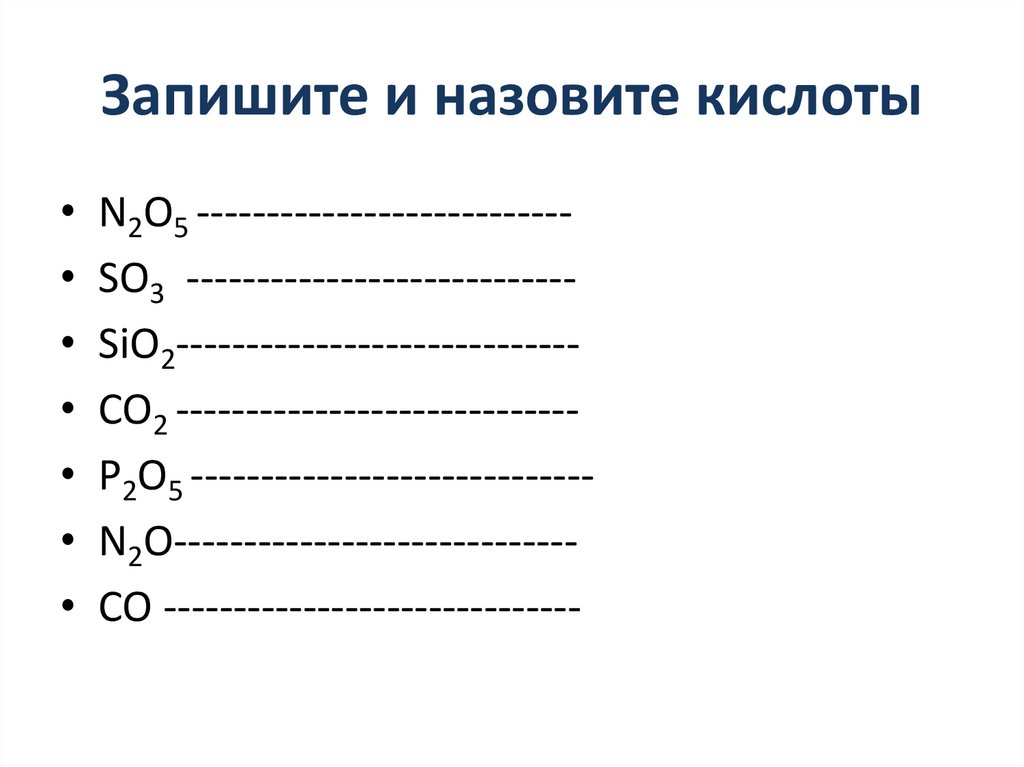
Запишите и назовите кислотыN2O5 --------------------------SO3 ---------------------------SiO2----------------------------CO2 ----------------------------P2O5 ----------------------------N2O----------------------------CO ------------------------------
11.
Запишите и назовите кислотыN2O5 -----------------------------HNO3
SO3 -----------------------------H2SO4
SiO2----------------------------- H2SiO3
CO2 ----------------------------- H2CO3
P2O5 -----------------------------H3PO4
N2O----------------------------- нет
CO ------------------------------ нет
12.
Типичные реакции кислотныхоксидов
1.Кислотный оксид + основание = соль + вода ?
SO2 + 2NaOH =
N2O5 + Ca (OH) 2 =
2.Кислотный оксид + основный оксид = соль ?
K2O + SO3 =
Ca O + CO2 =
3.Кислотный оксид + вода = кислота ?
P2O5 + 3H2O =
Si O2 + H2O =
13.
Типичные реакции кислотныхоксидов
1.Кислотный оксид + основание = соль + вода (обмена)
SO2 + 2NaOH = Na2 SO3 + H2O
N2O5 + Ca (OH) 2 = Ca(NO3)2 +H2O
2.Кислотный оксид + основный оксид = соль
(соединения)
K2O + SO3 = K2SO4
Ca O + CO2 = CaCO3
3.Кислотный оксид + вода = кислота (соединения)
P2O5 + 3H2O = 2 H3PO4
Si O2 + H2O = реакция не идет, т.к. кислотный оксид
нерастворим.
14.
Классификация оксидов № 2Основные –это такие
оксиды, которым
соответствуют
основания.
Оксиды металлов
главных подгрупп 1 и2
группы ПСХЭ.
Алюминий +3
Твердые вещества.
Кислотные -
это
такие оксиды,
которым
соответствуют
кислоты.
Оксиды неметаллов.
Оксиды металлов с
большим значением
С.О.
Твердые, жидкие, газы.
15.
Домашнее задание:П.23,стр.102 упр 4,5.)













 Химия
Химия








