Похожие презентации:
Алканы. Химические свойства, получение и особенности
1.
АлканыХимические свойства, получение и
особенности
2.
Алканы • Предельные углеводороды с общейформулой CnH2n+2
3.
Особенности алканов:• Все атомы углерода в sp-3 гибридном
состоянии;
• Нет межклассовых изомеров;
• Нет качественных реакций;
• Не возможны реакции присоединения.
4.
Химические свойства алканов.• Взаимодействие с галогенами:
CH4+Cl2
CH3Cl+HCl
• Нитрование:
CH4+HNO3
CH3NO2+H2O
5.
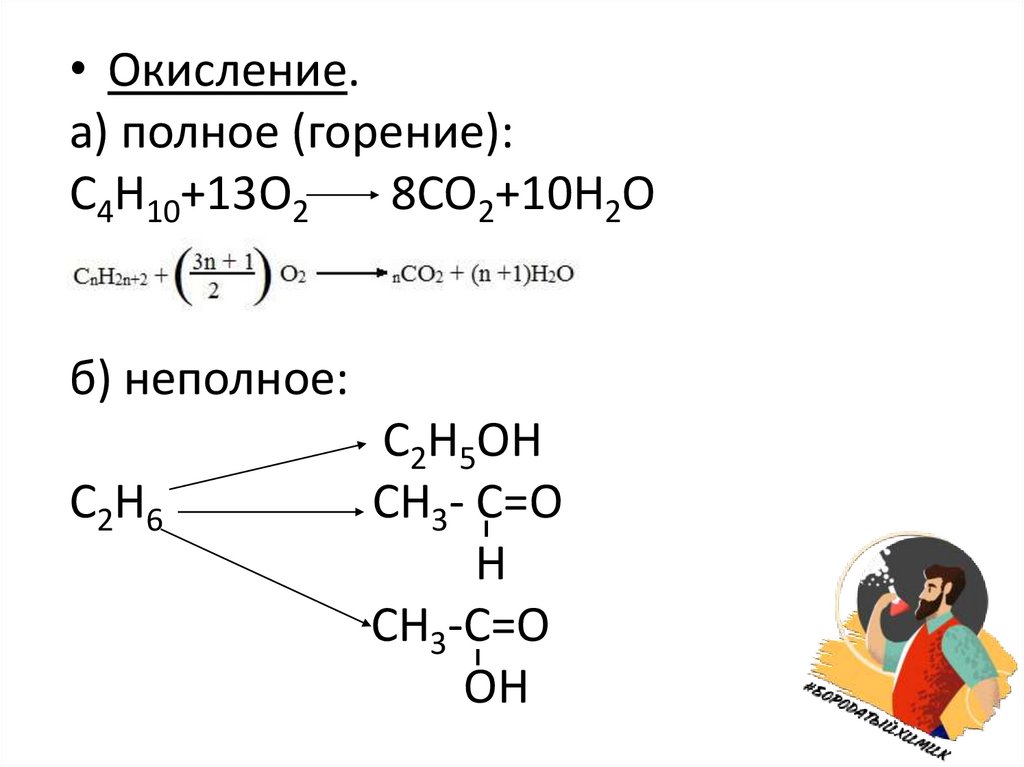
• Окисление.а) полное (горение):
C4H10+13O2
8CO2+10H2O
б) неполное:
C2H6
C2H5OH
CH3- C=О
Н
CH3-C=О
ОН
6.
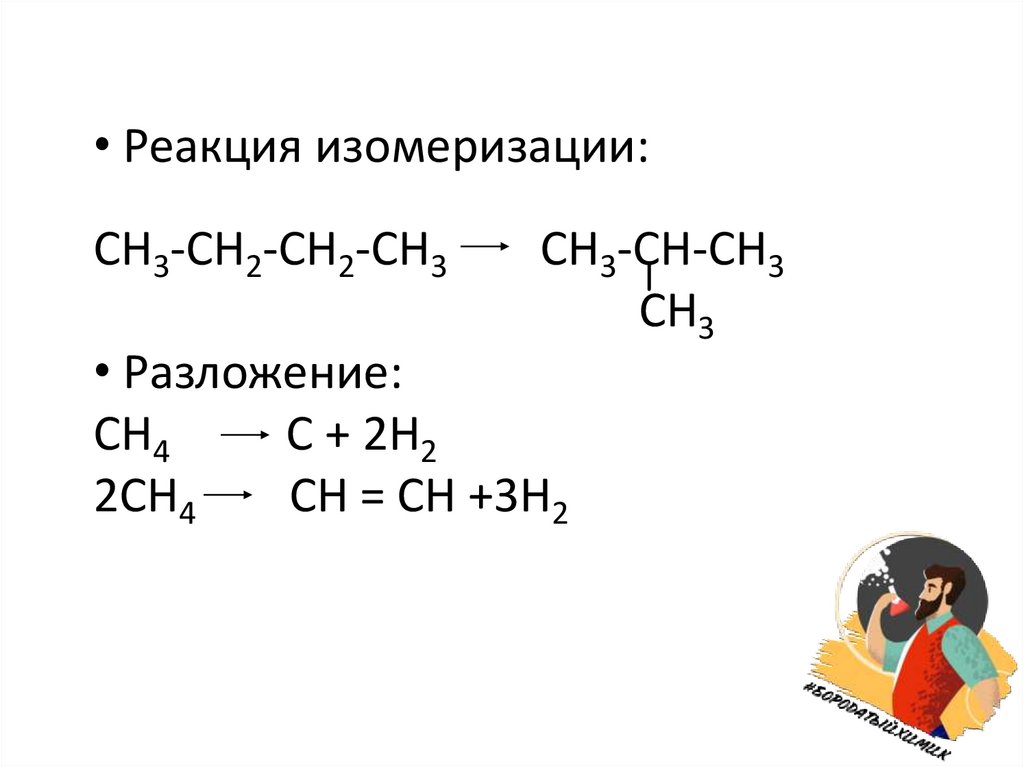
• Реакция изомеризации:CH3-CH2-CH2-CH3
CH3-CН-CH3
СН3
• Разложение:
СН4
С + 2Н2
2СН4
СН = СН +3Н2
7.
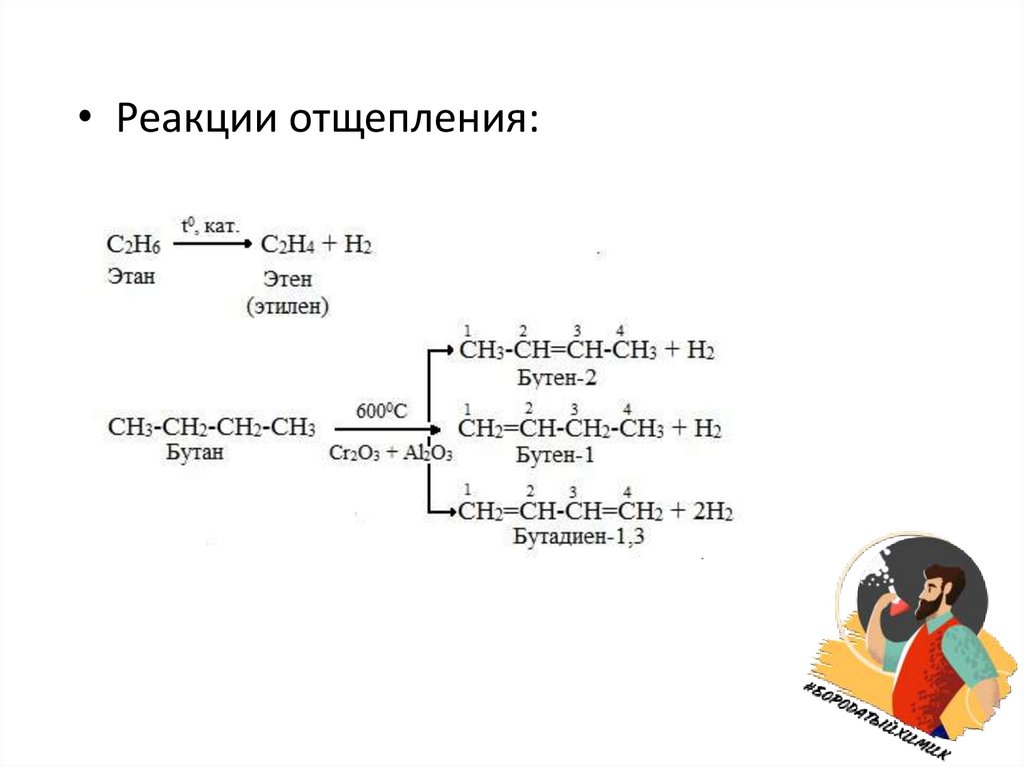
• Реакции отщепления:8.
• Реакции, протекающие с разрывом связи С-С:а)Изомеризация (AlCl3, t)
б)Крекинг (высокотемпературная переработка
нефти и ее фракций с целью получения
продуктов с меньшей молярной массой):
С6Н14 → С3Н8 + С3Н6
9.
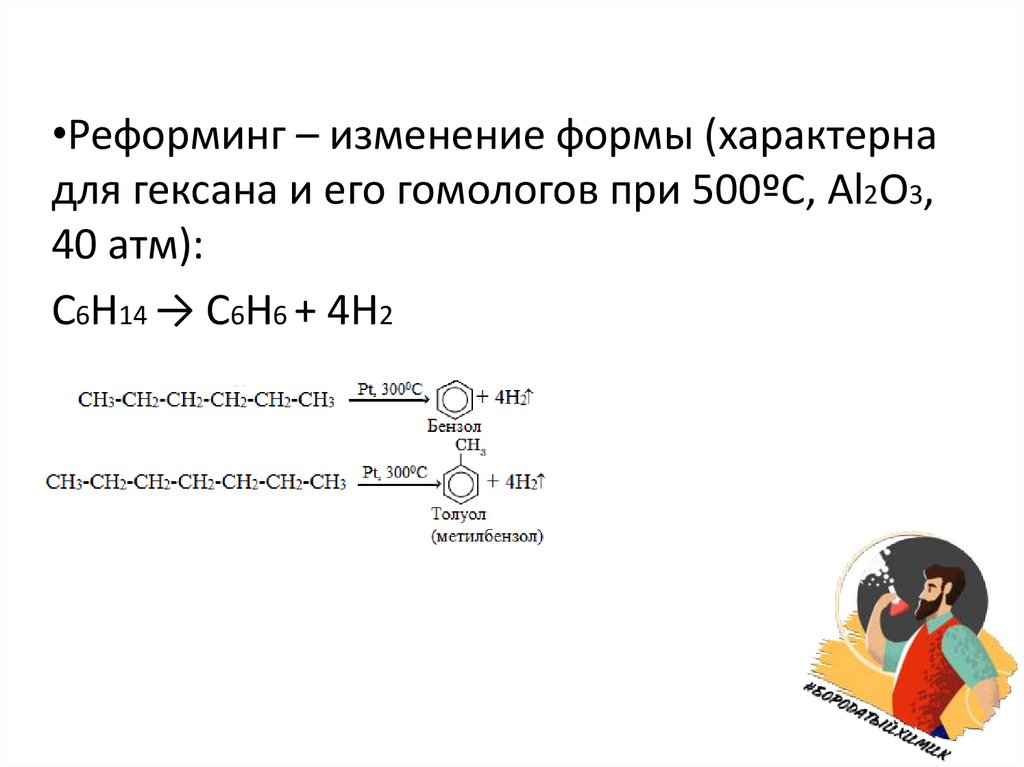
•Реформинг – изменение формы (характернадля гексана и его гомологов при 500ºС, Al2O3,
40 атм):
С6Н14 → С6Н6 + 4H2
10.
Получение алканов:• В промышленности:
а)Крекинг;
б)Из синтез-газа:
СО + Н2 = СН4 + Н2О (катализатор – Ni,
температура 300 ˚С)
11.
Получение алканов:• В лаборатории:
а) Синтез из простых веществ:
С + Н2 = СН4;
б) Гидролиз карбида алюминия:
Al4C3 + 12 H2O = 3 CH4 + 4Al(OH)3;
в) Взаимодействие карбида алюминия с
сильными кислотами:
Al4C3 + 12HCl = 3CH4 + 4AlCl3;
12.
г) Сплавление солей карбоновых кислот сщелочами (деркабоксилорование):
CH3COONa + NaOH = CH4 + Na2CO3;
д) Электролиз солей карбоновых кислот:
2CH3COONa + 2H2O = H2+2NaOH+2CO2+CH3–CH3
13.
е)Каталитическое гидрирование непредельныхуглеводородов:
СnH2n + H2 = CnH2n+2 (kat - Pt);
СnH2n-2 + 2H2 = CnH2n+2 (kat - Pt);
ж) Взаимодействие галогеналканов с
металлическим натрием (реакция Вюрца):
2RHal + 2Na = R–R + 2NaHal
(Hal – Cl2, Br2, I2)









 Химия
Химия








