Похожие презентации:
Алканы. Химические свойства. Применение
1. Органическая химия Лекция №6 АЛКАНЫ Химические свойства. Примененеие
Лаврова О.М.1
2. Алканы. Химические свойства
Алканы – малополярные ислабополяризуемые соединения
Гетеролитический (а) и гомолитический (б) разрыв связей С–Н в метане:
а) СН4 СН3+ + Н + Нº
Нº = 1313 кДж/моль
б) СН4 СН3 + Н + Нº
Нº = 435 кДж/моль
в) H3C-CH3 СН3 + СН3 + Нº
Нº = 365 кДж/моль
Характерными реакциями алканов является
свободнорадикальное замещение SR незаряженного атома
водорода при действии незаряженных свободнорадикальных
реагентов: атомов хлора и брома при галогенировании, NO2 при
нитровании и т.д.
2
3.
Свободными радикалами называютсячастицы, имеющие один или несколько
неспаренных электронов. Наибольшее
значение в органической химии имеют
свободные радикалы с неспаренным
электроном на атоме углерода.
3
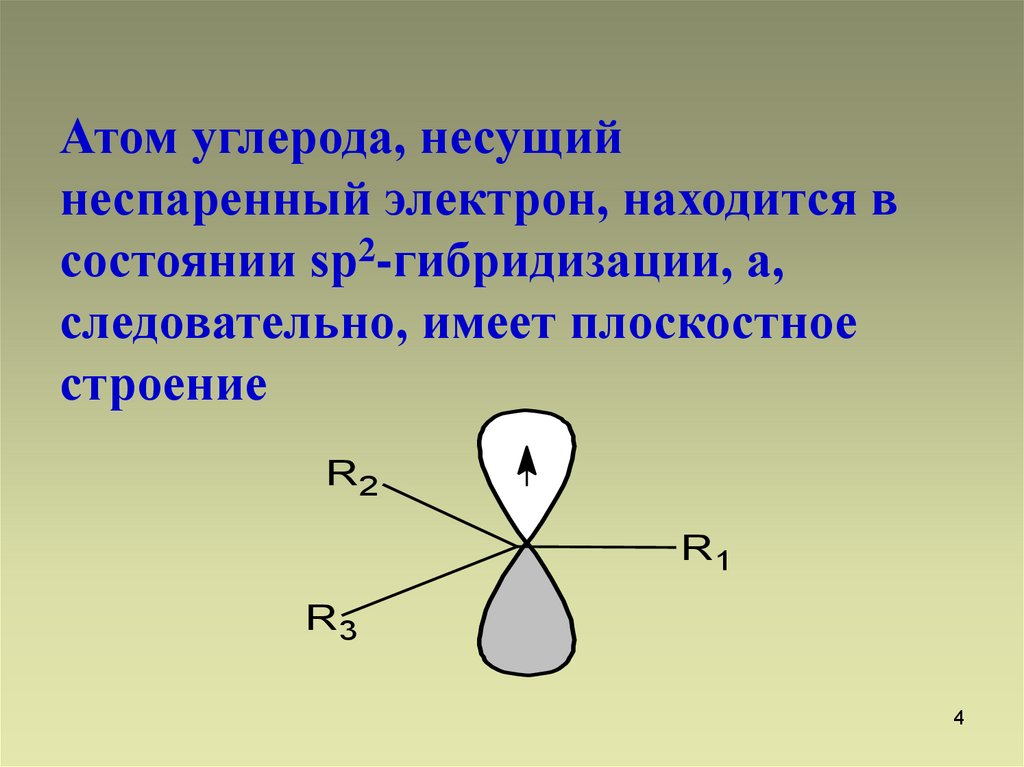
4.
Атом углерода, несущийнеспаренный электрон, находится в
состоянии sp2-гибридизации, а,
следовательно, имеет плоскостное
строение
R2
R1
R3
4
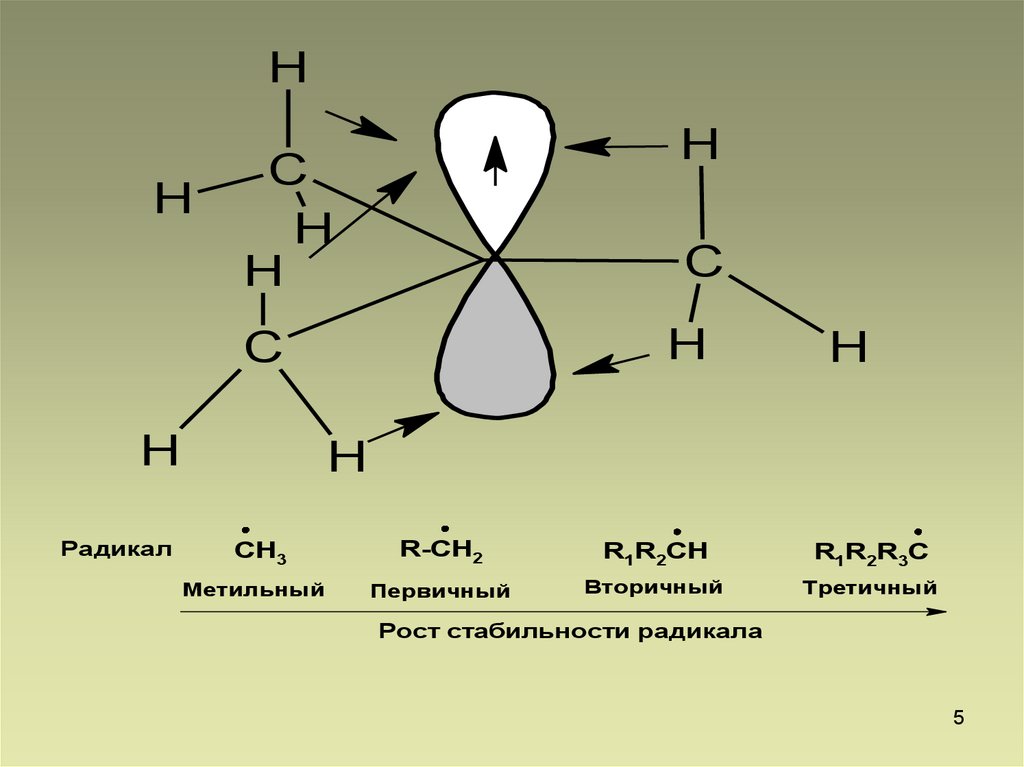
5.
НН
Н
С
Н
Н
С
Н
С
Н
Радикал
Н
Н
СН3
Метильный
R-СН2
R1R2СН
R1R2R3С
Первичный
Вторичный
Третичный
Рост стабильности радикала
5
6.
НН
Н
Н
Н
R
С R
R
R
R С
R
Н
R
R
С R
R
R С
R
R С
R R
R
С
R
6
R
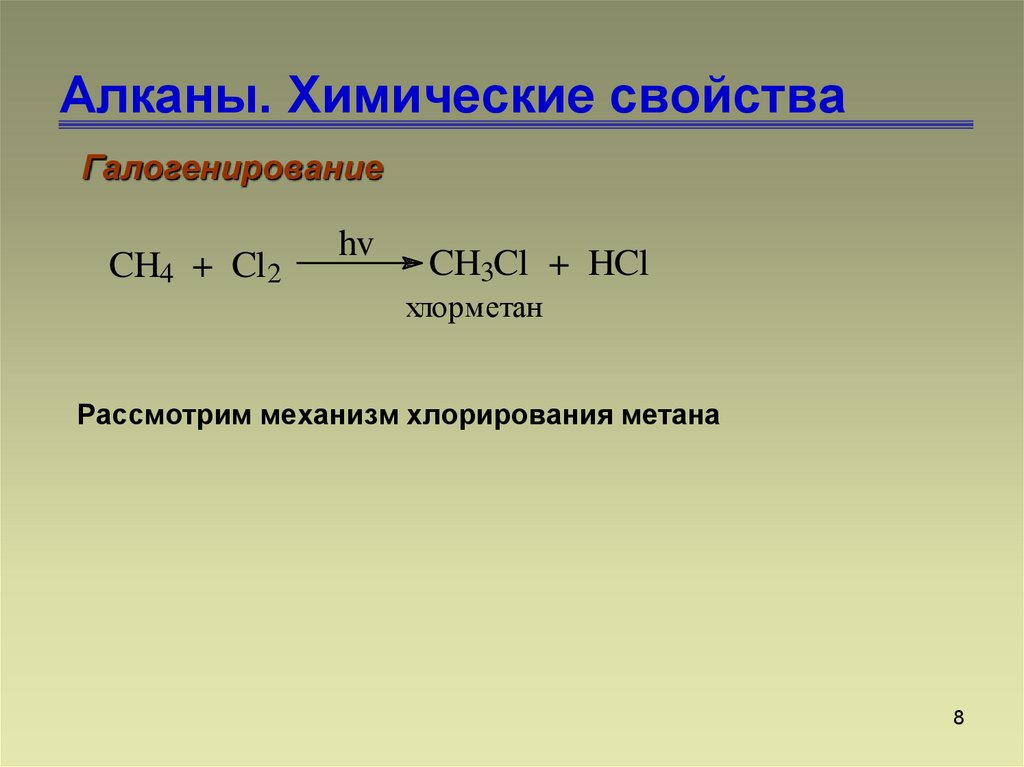
7. Алканы. Химические свойства
ГалогенированиеCH4 + Cl2
hv
CH3Cl + HCl
хлорметан
CH3Cl + Cl2
CH2Cl2 + Cl2
CHCl3 + Cl2
hv
CH2Cl2 + HCl
дихлорметан
hv
CHCl3 + HCl
трихлорметан
hv
CCl4 + HCl
тетрахлорметан
7
8. Алканы. Химические свойства
ГалогенированиеCH4 + Cl2
hv
CH3Cl + HCl
хлорметан
Рассмотрим механизм хлорирования метана
8
9. Алканы. Химические свойства
Галогенирование (Механизм реакции)Инициирование
Cl : Cl
hv
2Cl
Стадия инициирования
(зарождения ) цепи,
= 243 кДж/моль
......Cl....Cl....
......Cl.. +......Cl
= 1130 кДж/моль
9
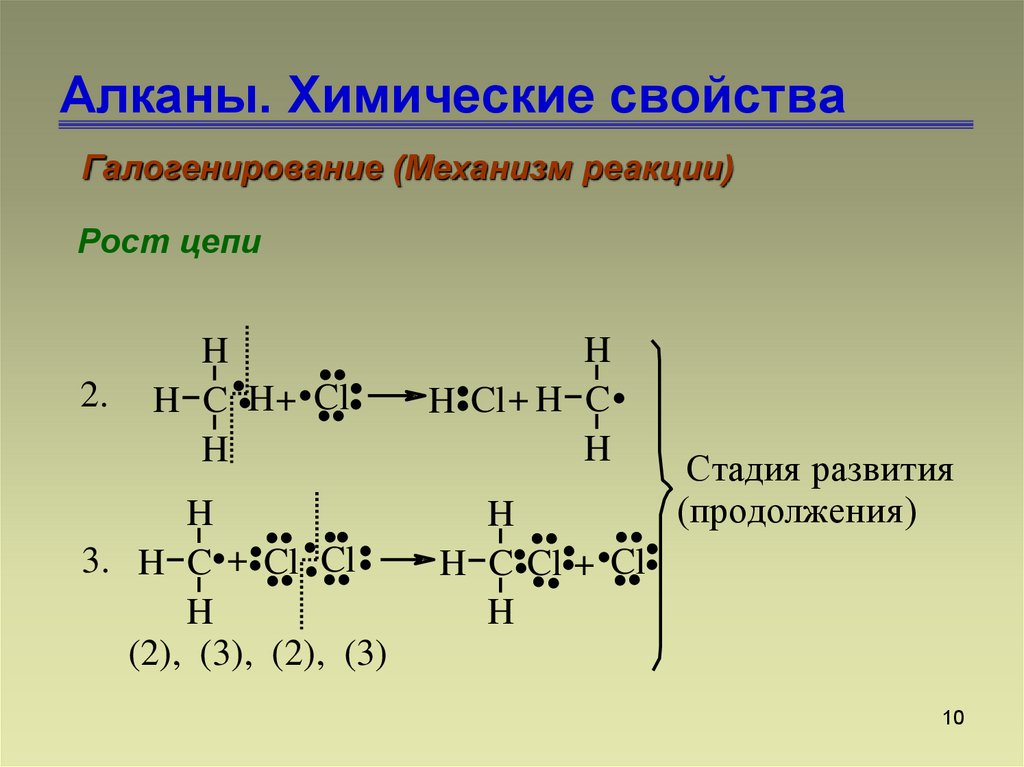
10. Алканы. Химические свойства
Галогенирование (Механизм реакции)Рост цепи
2.
. ...... . .
. ............ ...... ......
H
H C H+ Cl
H
H
3. H C + Cl Cl
H
(2), (3), (2), (3)
H
H Cl + H C
H
H
H C Cl + Cl
H
Стадия развития
(продолжения )
10
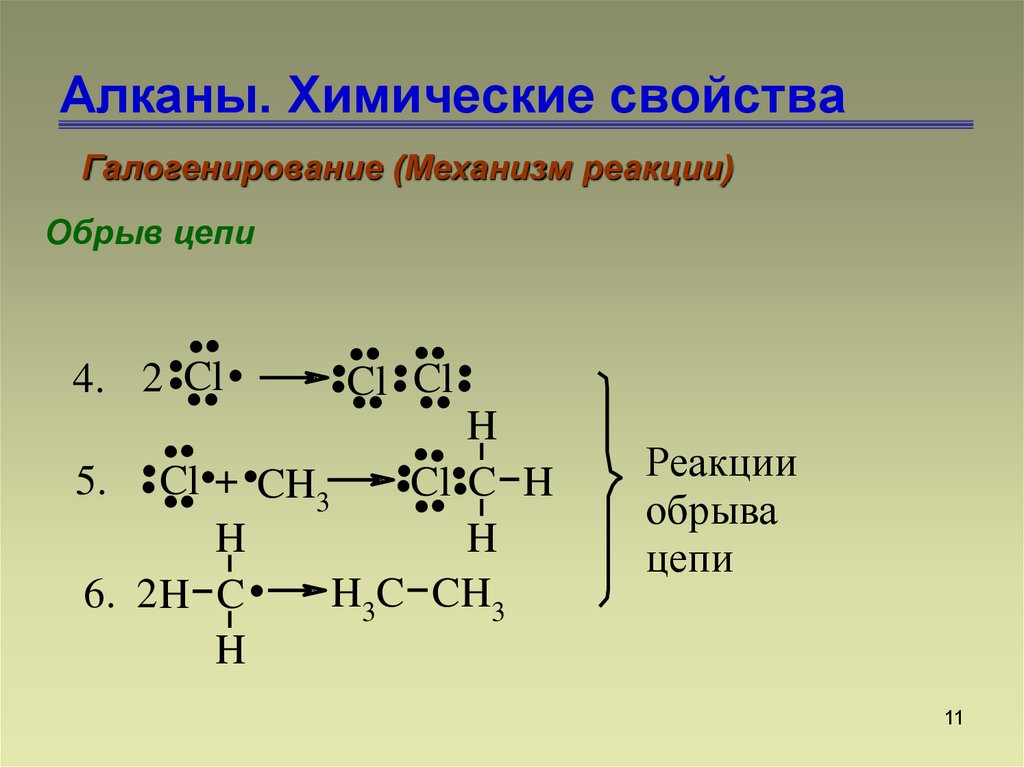
11. Алканы. Химические свойства
Галогенирование (Механизм реакции)Обрыв цепи
......
...... .
.
4. 2 Cl
...........
......
Cl Cl
H
5. Cl + CH3
Cl C H
H
H
H3C CH3
6. 2H C
H
Реакции
обрыва
цепи
11
12. Алканы. Химические свойства
Галогенирование (Механизм реакции)Скорость цепной реакции сильно снижается в
присутствии соединений, которые
взаимодействуют с радикалами и превращают их в
малореакционноспособные частицы. Такие
вещества называют ингибиторами. Например,
кислород действует как ингибитор. Радикал
СН3-О-О значительно менее реакционноспособен,
чем радикал Н3C , и не может продолжать цепь.
12
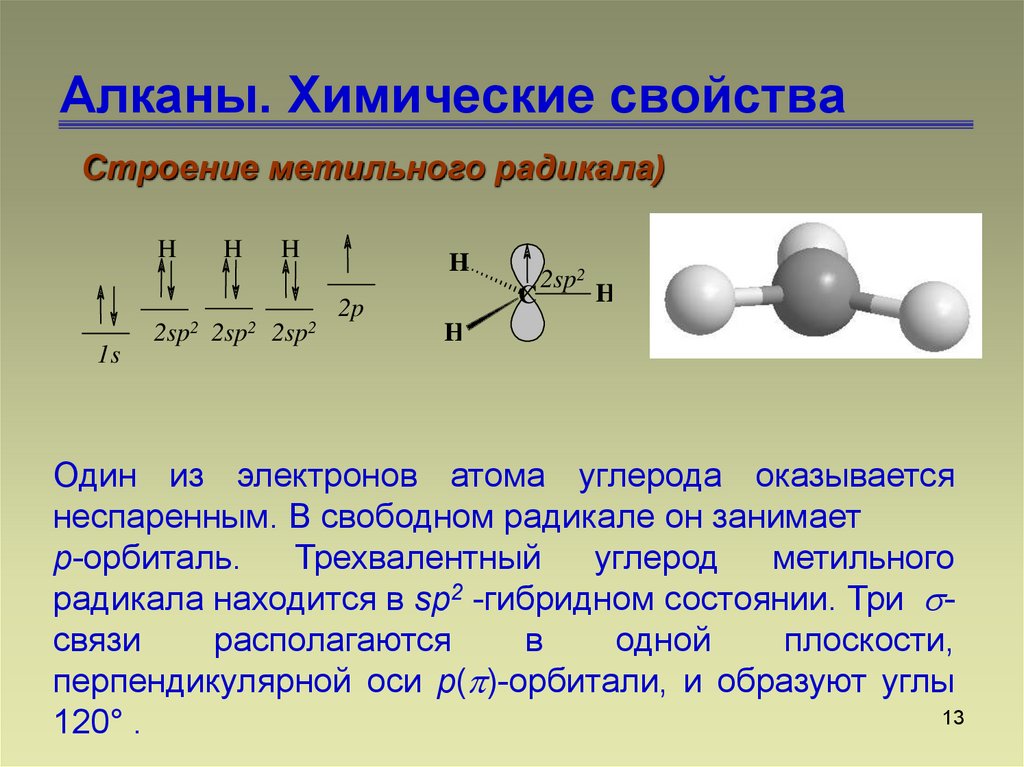
13. Алканы. Химические свойства
Строение метильного радикала)H
1s
H
H
2sp2 2sp2 2sp2
H
C
2p
2sp2
H
H
Один из электронов атома углерода оказывается
неспаренным. В свободном радикале он занимает
р-орбиталь.
Трехвалентный
углерод
метильного
радикала находится в sр2 -гибридном состоянии. Три связи
располагаются
в
одной
плоскости,
перпендикулярной оси р( )-орбитали, и образуют углы
13
120° .
14. Алканы. Химические свойства
Галогенирование (Механизм реакции)1.Галогенирование начинается только под
действием инициатора радикальных реакций (УФсвет, радикальные реагенты, нагревание).
2. Реакционная способность в ряду галогенов
уменьшается в ряду:
F2 > Cl2 > Br2 > I2
3. Галогенирование под действием фтора может
выйти из под контроля и приобрести взрывной
характер.
14
15. Алканы. Химические свойства
Галогенирование (Механизм реакции)Изменение энергии в ходе реакции
Реакция хлорирования метана
(2)
H3C H + Cl
427.
затрачено
.
CH.3 + H Cl
431
H = - 4
выделилось
(3) CH3 + Cl Cl
H3C Cl + Cl
= - 96.
339.
243.
затрачено выделилось
Реакция бромирования метана
(2) H3C H + Br
CH.3 + H Br
427.
затрачено
.
(3) CH3 + Br Br
192.
затрачено
= 63.
364.
выделилось
.
H3C Br + Br
280.
= - 88.
выделилось
15
16. Алканы. Химические свойства
Галогенирование (Механизм реакции SR )Реакция хлорирования – обе стадии экзотермичны,
бромирование – стадия 2 эндотермична, стадия 3 – экзотермична
Экэотермические реакции сопровождаются выделением тепла.
Эндотерми́ческие реакции — химические реакции,
сопровождающиеся поглощением теплоты. Для эндотермических
реакций изменение энтальпии и внутренней энергии имеют
положительные значения (ΔH > 0, ΔЕ > 0), таким образом, продукты
реакции содержат больше энергии, чем исходные компоненты.
16
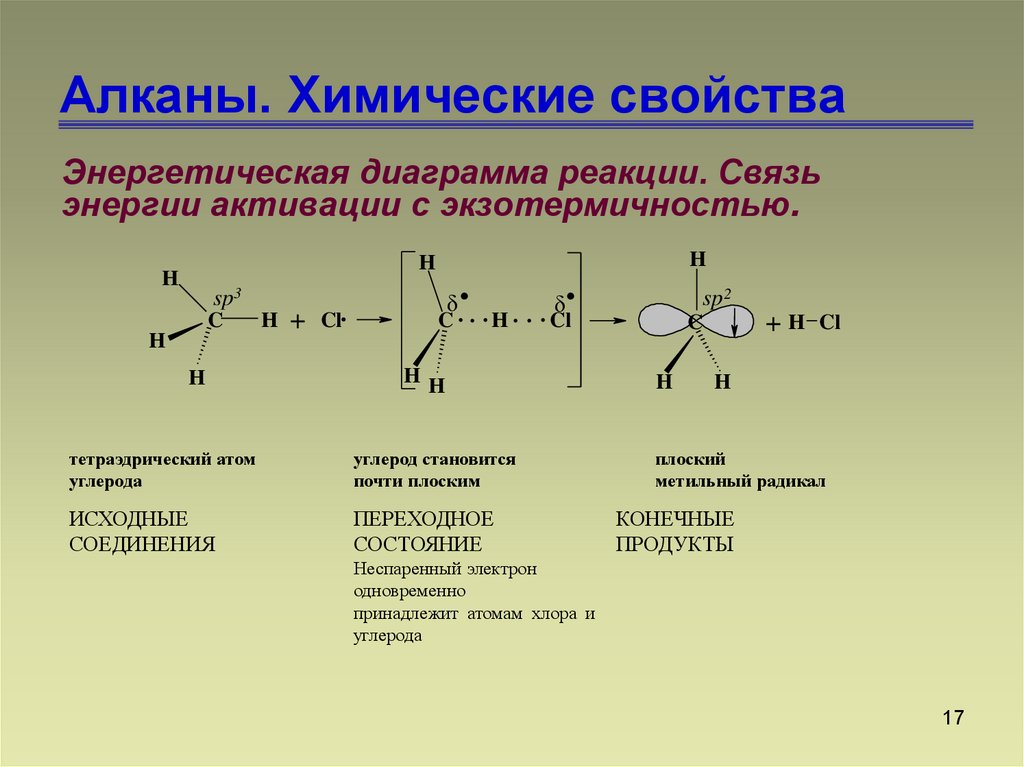
17. Алканы. Химические свойства
Энергетическая диаграмма реакции. Связьэнергии активации с экзотермичностью.
H
H
sp3
C
H
H
H
+
Cl
.
.. .
C
H
H
.
...
Cl
HH
тетраэдрический атом
углерода
углерод становится
почти плоским
ИСХОДНЫЕ
СОЕДИНЕНИЯ
ПЕРЕХОДНОЕ
СОСТОЯНИЕ
sp2
+H
C
H
Cl
H
плоский
метильный радикал
КОНЕЧНЫЕ
ПРОДУКТЫ
Неспаренный электрон
одновременно
принадлежит атомам хлора и
углерода
17
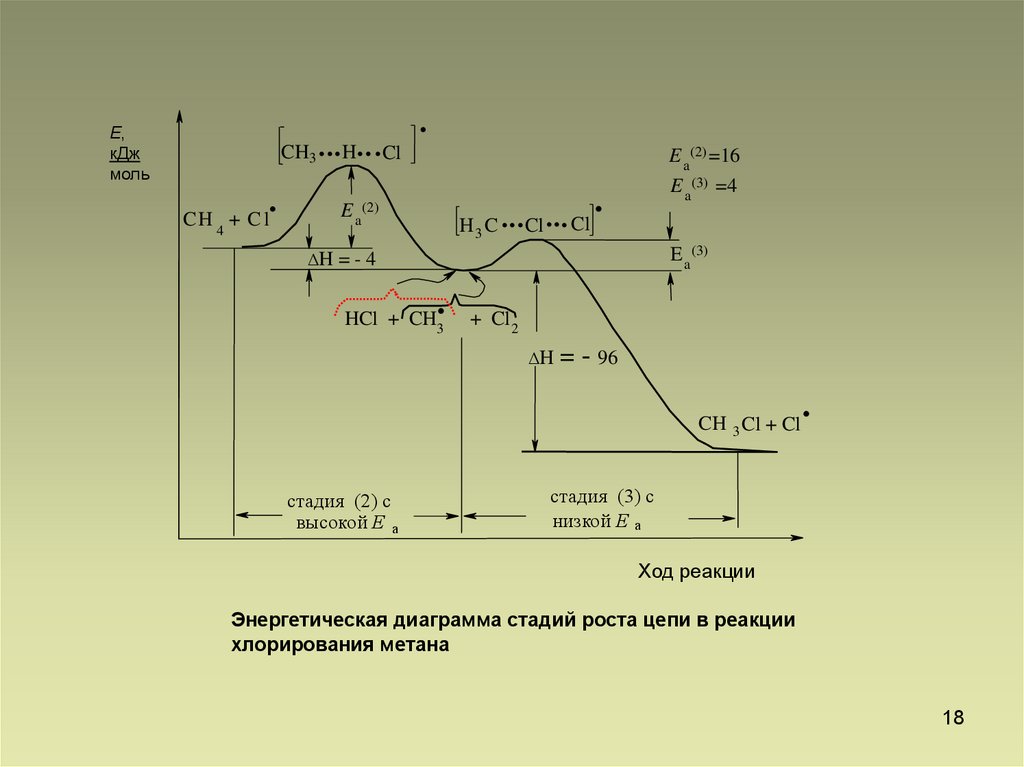
18.
Е,кДж
моль
CH3
.
CH 4 + Cl
...H...Cl
.
E a(2) =16
E a (2)
H3 C
...Cl... Cl .
E a(3) =4
E a (3)
ΔH = - 4
.
HCl + CH3
+ Cl 2
ΔH
= - 96
.
CH 3 Cl + Cl
стадия (2) с
высокой Е а
стадия (3) с
низкой Е а
Ход реакции
Энергетическая диаграмма стадий роста цепи в реакции
хлорирования метана
18
19. Алканы. Химические свойства
Галогенирование (Механизм реакции SR )В свободнорадикальных процессах, протекающих
без участия заряженных частиц, фактором,
определяющим легкость протекания реакции,
является различие в энергии разрываемых и
образующихся связей.
Сравните энергии активации и тепловые эффекты медленных реакций в
процессах хлорирования и бромирования.
В свободнорадикальных реакциях углеводородов
энергия активации уменьшается с увеличением
экзотермичности.
19
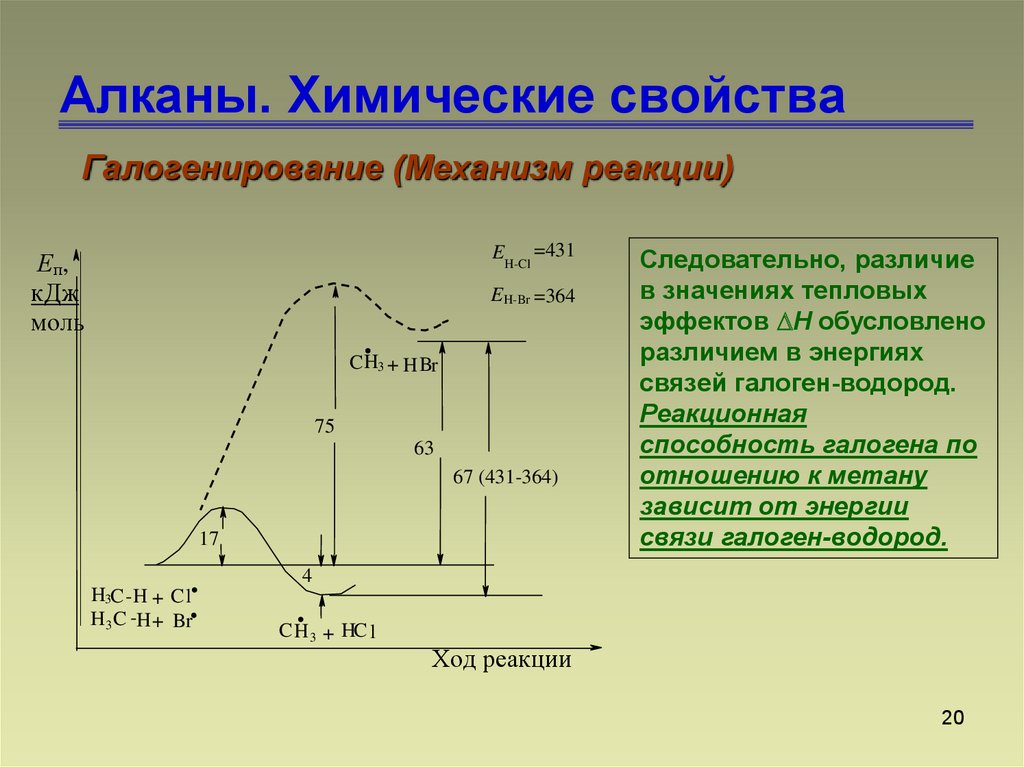
20. Алканы. Химические свойства
Галогенирование (Механизм реакции)EH-Cl =431
Еп,
кДж
моль
E H-Br =364
.
C H3 + H Br
75
63
67 (431-364)
17
H3C - H + C l.
H 3 C -H + Br.
Следовательно, различие
в значениях тепловых
эффектов Н обусловлено
различием в энергиях
связей галоген-водород.
Реакционная
способность галогена по
отношению к метану
зависит от энергии
связи галоген-водород.
4
.
C H 3 + HC l
Ход реакции
20
21. Алканы. Химические свойства
ГалогенированиеЗависимость реакционной способности галогенов от энергии связи H–Hal
Энергия связи H–Hal,
кДж/моль
H–F
560
Реакционная
способность
F2
>
H–Cl
431
H–Br
364
H–I
297
Cl2 >
Br2 >
I2
не реагирует
21
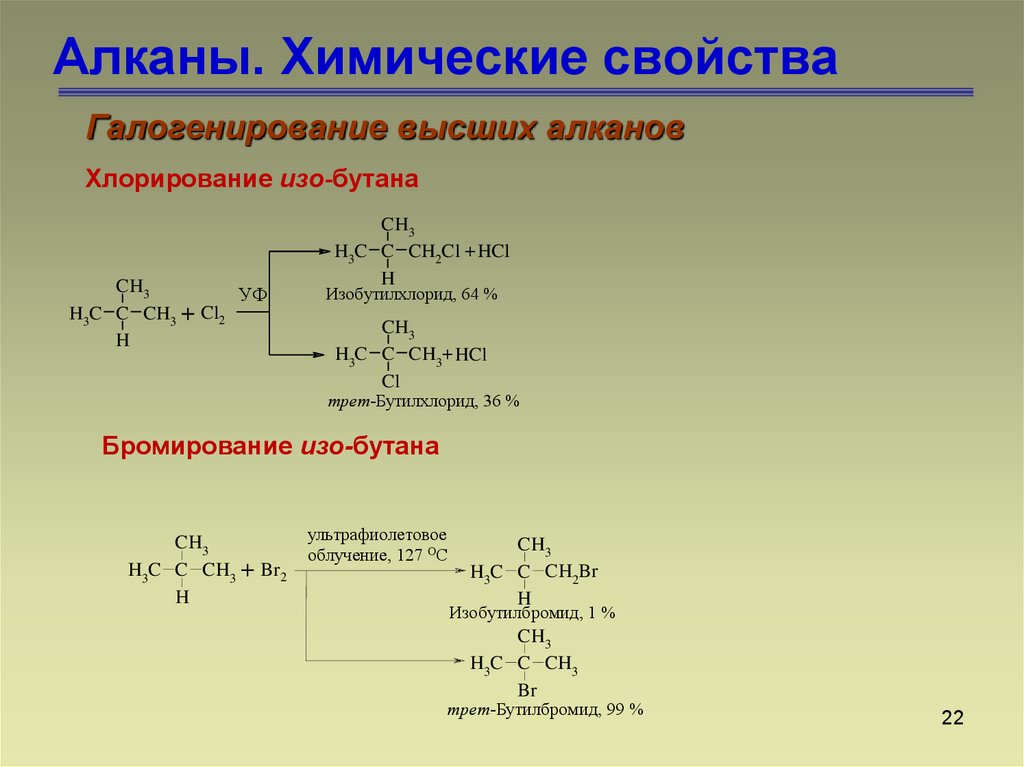
22. Алканы. Химические свойства
Галогенирование высших алкановХлорирование изо-бутана
CH3
УФ
H3C C CH3 + Cl2
H
CH3
H3C C CH2Cl + HCl
H
Изобутилхлорид, 64 %
CH3
H3C C CH3+ HCl
Cl
трет-Бутилхлорид, 36 %
Бромирование изо-бутана
CH3
H3C C CH3 + Br2
H
ультрафиолетовое
облучение, 127 ОС
CH3
H3C C CH2Br
H
Изобутилбромид, 1 %
CH3
H3C C CH3
Br
трет-Бутилбромид, 99 %
22
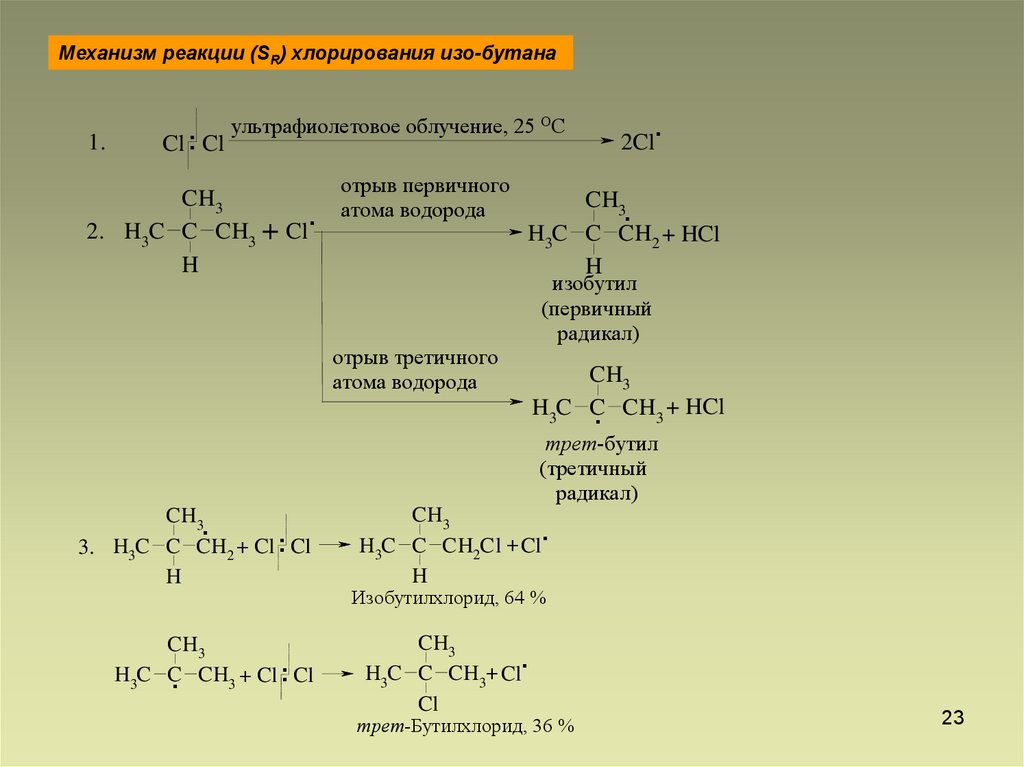
23.
Механизм реакции (SR) хлорирования изо-бутана1.
ультрафиолетовое облучение, 25
Cl .. Cl
CH3
2. H3C C CH3 + Cl
H
.
отрыв первичного
атома водорода
.
ОС
2Cl
.
CH3
H3C C CH2 + HCl
H
изобутил
(первичный
радикал)
отрыв третичного
атома водорода
CH3
H3C C CH3 + HCl
.
трет-бутил
(третичный
радикал)
.
CH3
3. H3C C CH2 + Cl Cl
H
..
CH3
H3C C CH3 + Cl Cl
.
..
CH3
H3C C CH2Cl + Cl
H
.
Изобутилхлорид, 64 %
CH3
H3C C CH3+ Cl
Cl
.
трет-Бутилхлорид, 36 %
23
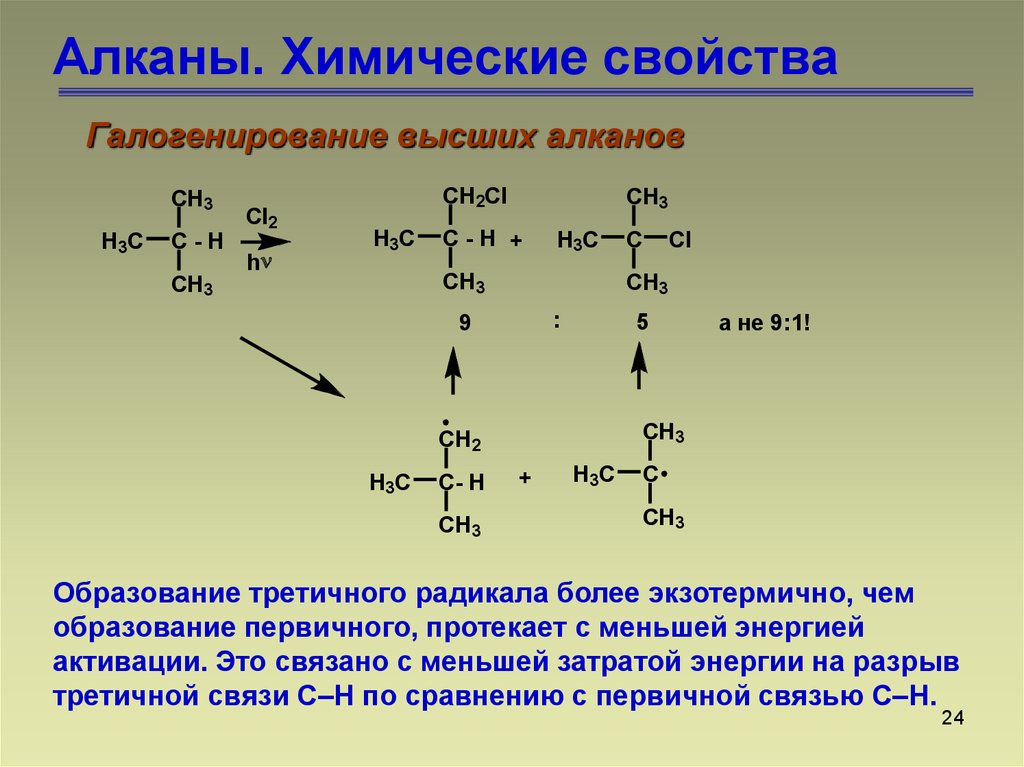
24. Алканы. Химические свойства
Галогенирование высших алкановCH3
H3C
C-Н
Cl2
hn
CH2Cl
H3C
CH3
C-H +
H3C
CH3
CH3
:
5
CH3
а не 9:1!
CH3
CH2
C- H
Cl
CH3
9
H3C
C
+
H3C
C
CH3
Образование третичного радикала более экзотермично, чем
образование первичного, протекает с меньшей энергией
активации. Это связано с меньшей затратой энергии на разрыв
третичной связи C–H по сравнению с первичной связью C–H.
24
25. Алканы. Химические свойства
Галогенирование высших алкановРяд легкости образования радикалов:
третичный > вторичный > первичный > Н3С
Образование третичного
радикала более экзотермичо,
протекает с меньшей энергией
активации , меньше
затрачивается энергии на
разрыв третичной связи
25
26.
Алканы. Химические свойстваЭнергии разрыва связей С–Н в алканах
Тип связи
H3C – H
Энергия связи, кДж/моль
427
H
C C H
H
первичная
406
H
C C H
C
вторичная
393
C
C C H
C
третичная
381
26
27. Алканы. Химические свойства
Галогенирование высших алкановРяд устойчивости радикалов:
третичный > вторичный > первичный > СН3 .
Чем устойчивее радикал, тем легче он
образуется.
Региоселективными называются такие реакции, в ходе которых
различные положения в молекуле подвергаются химическим
превращениям с различными скоростями.
27
28. Алканы. Химические свойства
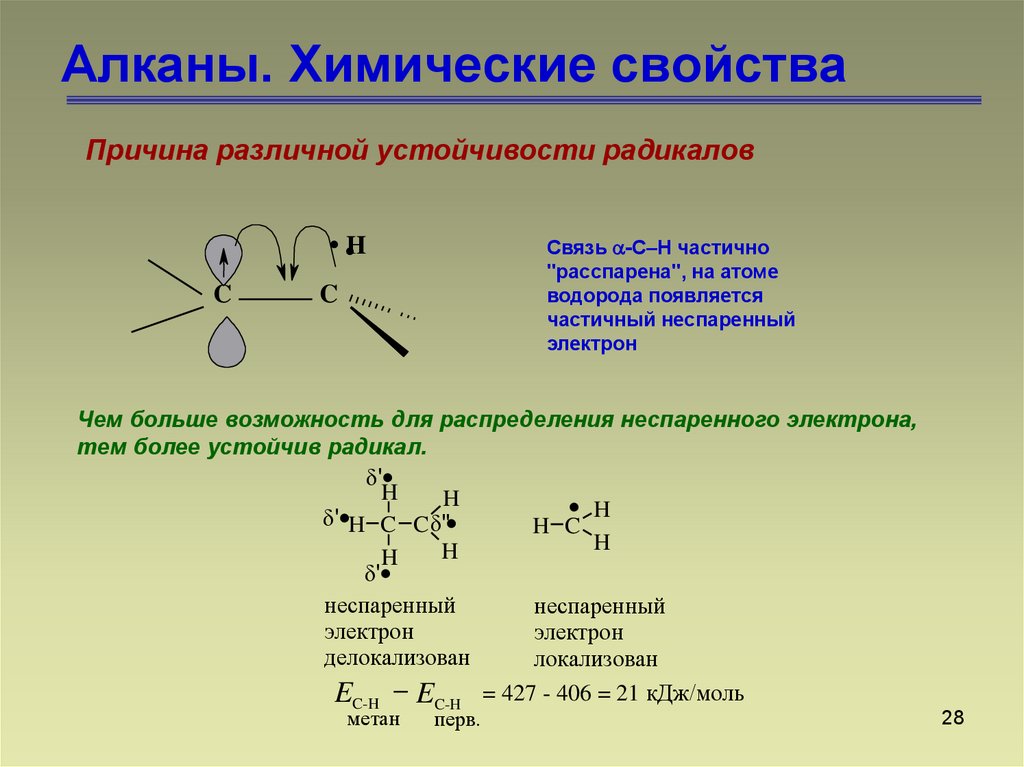
Причина различной устойчивости радикалов..
Связь -C–H частично
"расспарена", на атоме
водорода появляется
частичный неспаренный
электрон
H
C
C
Чем больше возможность для распределения неспаренного электрона,
тем более устойчив радикал.
'
H
H
H
' H C C ''
H C
H
H
H
'
неспаренный
неспаренный
электрон
электрон
делокализован
локализован
.
. .
.
EC-H
метан
EC-H
перв.
.
= 427 - 406 = 21 кДж/моль
28
29. Алканы. Химические свойства
Галогенирование высших алкановВо всех случаях, когда в молекуле присутствует
«нештатное» количество электронов: радикал, катион,
анион – молекула тем более устойчива, чем
в большей степени эта «нештатность» распределена
(делокалазована)!
29
30. Алканы. Химические свойства
Селективность в реакциях хлорирования ибромирования
Энергия активации медленной стадии реакции (SR) RH + Х• R•+HX
Еа, кДж/моль
R
X = Cl
X = Br
CH3
16
75
Первичный
4
54
Вторичный
2
42
Третичный
1
31
Чем меньше реакционная способность реагента, тем больше его
избирательность (селективность).
30
31. Алканы. Химические свойства
Увеличение устойчивости радикала приводит кснижению величины энергии активации и, как
следствие, к увеличению скорости реакции!
Реакционная способность первичной, вторичной, третичной связей С–Н в
алканах:
в реакции хлорирования 1: 3,8 : 5,0 (25 0С)
в реакции бромирования 1 : 82 : 1600 (127 ОС)
При температуре около 300 ºС соотношение скоростей реакций различных
С–Н связей с хлором приближается к 1:1:1, т.е. состав продуктов
монохлорирования будет соответствовать
статистическому распределению.)
31
32.
Иодирование алканов не происходит,при фторировании алканов происходит разрыв всех связей С-С
CH4 + F2
CoF2
CnH2n+2
F2
взрыв!
CoF3
CoF3
nCF4 + (2n+2)HF
32
33.
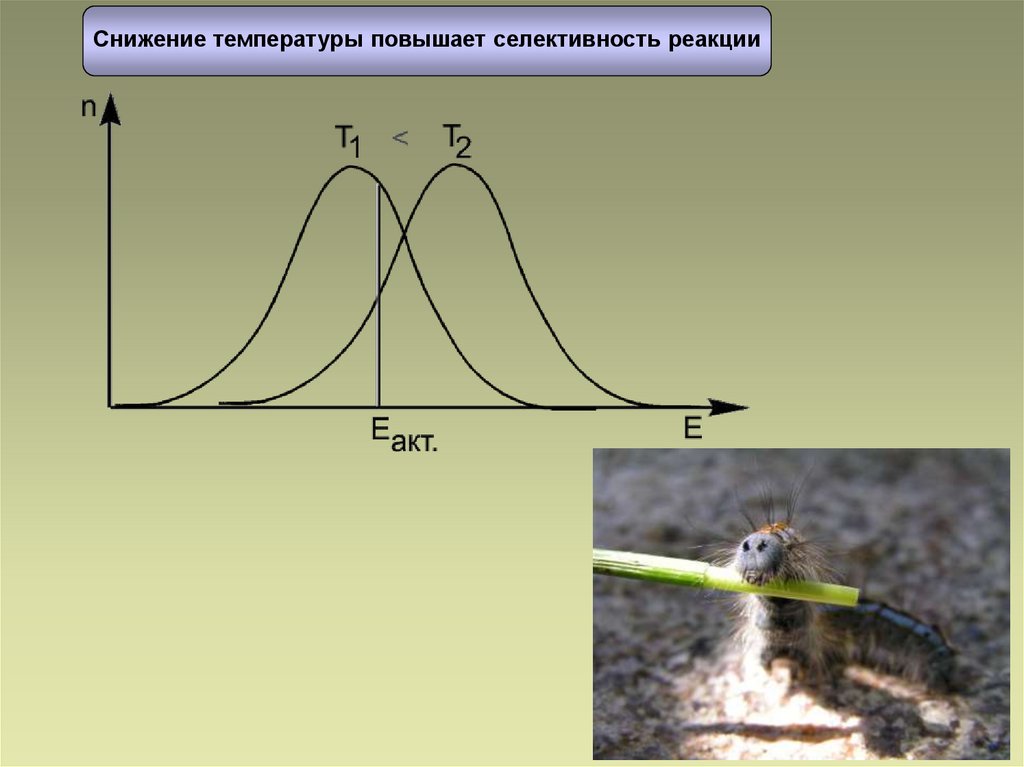
Снижение температуры повышает селективность реакции33
34.
Алканы. Химические свойстваПример расчета состава продуктов хлорирования н-бутана.
H3C
CH2
CH2
CH3 + Cl2
25 OC, hn
H3C
CH2
CH2
CH2
Cl
Cl
CH3
H3C CH2 CH
Общая активность шести первичных связей С–Н молекулы бутана
равна
6 х 1 = 6, а четырех вторичных связей 4 х 3,8 = 15,2. Активность всех
химических связей 6 + 15,2 = 21,2 - принимается за 100 %. Массовая доля
1-хлорбутана в продуктах реакции составляет
(6:21,2) х100 = 28,3 %,
остальные (15,2:21,2) х 100 = 71,7 % приходятся на долю 2-хлорбутана.
34
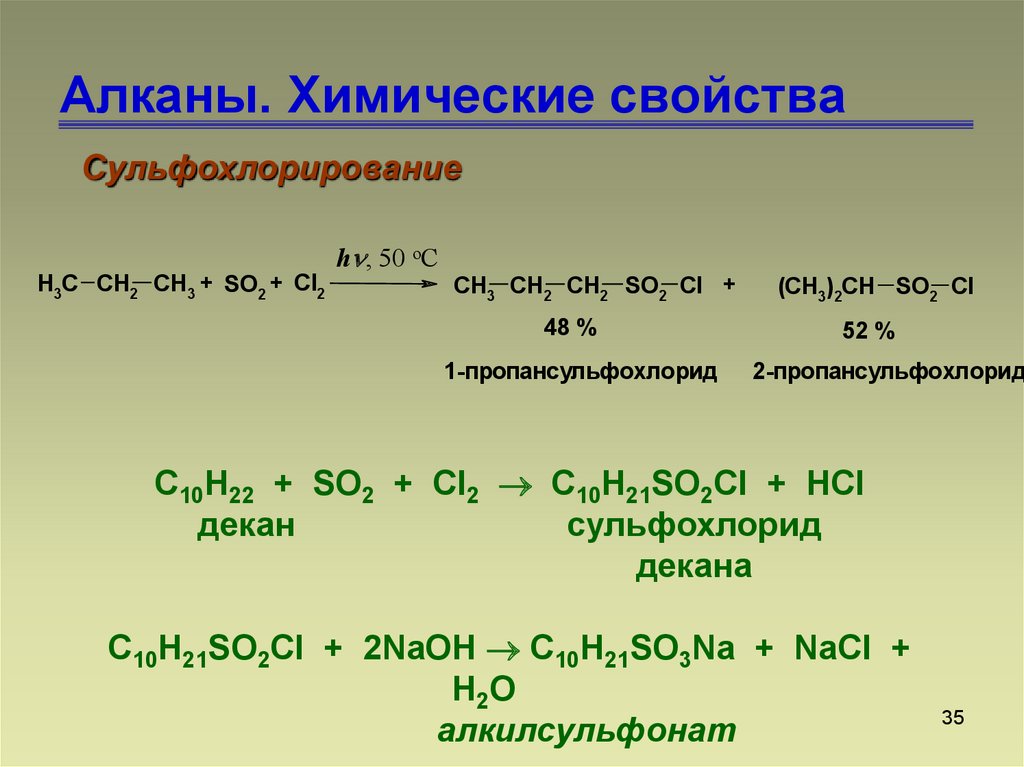
35. Алканы. Химические свойства
СульфохлорированиеH3C CH2 CH3 + SO2 + Cl2
hn, 50 oC
CH3 CH2 CH2 SO2 Cl +
48 %
1-пропансульфохлорид
(CH3)2CH SO2 Cl
52 %
2-пропансульфохлорид
С10H22 + SO2 + Cl2 C10H21SO2Cl + HCl
декан
сульфохлорид
декана
C10H21SO2Cl + 2NaOH C10H21SO3Na + NaCl +
H2O
алкилсульфонат
35
36. Алканы. Химические свойства
СульфоокислениеCH3 CH3 + SO2 + O2
hn
CH3 CH2 SO2 OH
этансульфокислота
В реакциях сульфоокисления и сульфохлорирования
замещению не подвергаются атомы водорода при
третичном углероде из-за пространственных затруднений
для подхода реагента с большим объемом.
36
37. Алканы. Химические свойства
НитрованиеЖидкофазное нитрование: 10-20%-ная HNO3, 150 ОС (М.И.Коновалов, 1888г.
Парофазное нитрование: HNO3(конц.), 420-430 ОС (Хесс, 1936г.)
Реакция М.И. Коновалова
37
38. Алканы. Химические свойства
КоноваловМихаил Иванович
1858 - 1906
38
39. Алканы. Химические свойства
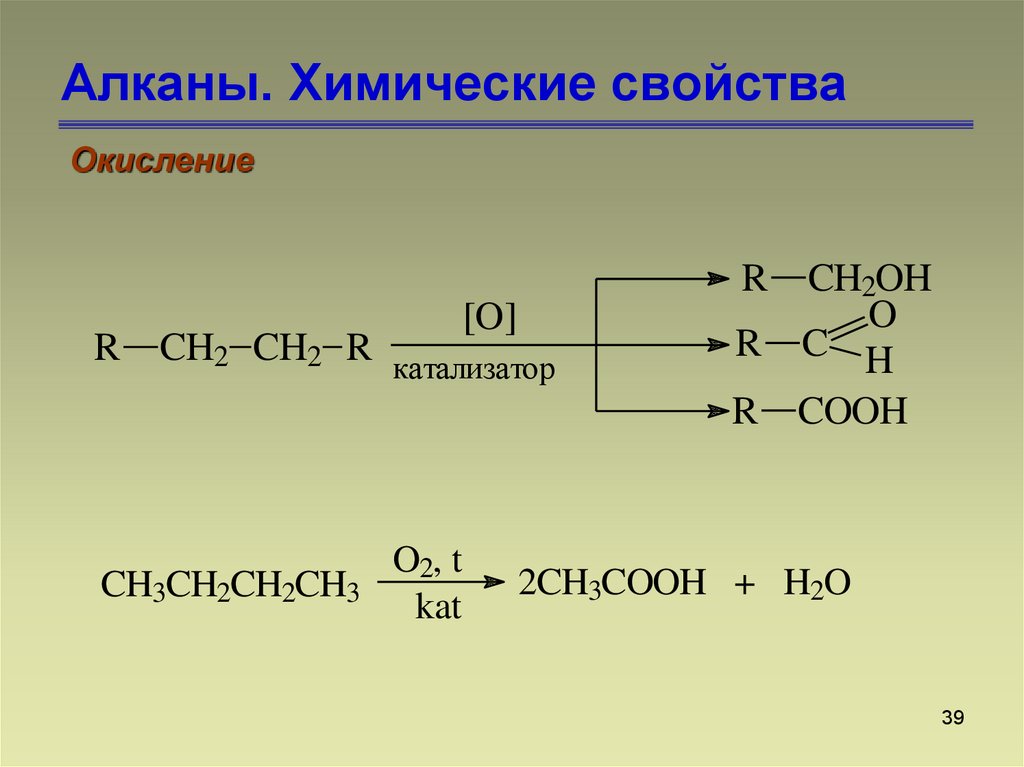
ОкислениеR
R
[O]
CH2 CH2 R катализатор
CH3CH2CH2CH3
O2, t
kat
CH2OH
O
R C H
R COOH
2CH3COOH + H2O
39
40. Алканы. Химические свойства
ОкислениеCH4 + H2O CO + 3H2
CH4 + ½O2 CO + H2
CH4 + CO2 2CO + 2H2
CH4 + 2O2 CO2 + H2O + 890 кДж/моль
40
41. Алканы. Химические свойства
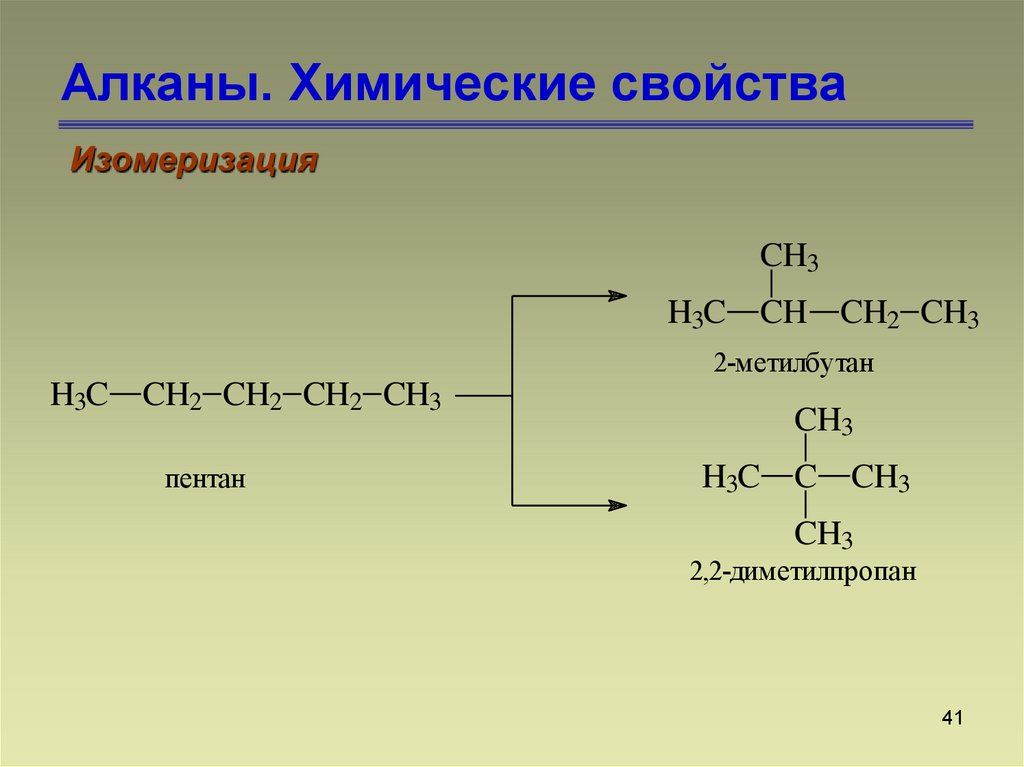
ИзомеризацияCH3
H3C
CH CH2 CH3
2-метилбутан
H3C
CH2 CH2 CH2 CH3
пентан
CH3
H3C C
CH3
CH3
2,2-диметилпропан
41
42. Алканы. Химические свойства
Термическое разложение (Крекинг)Температура – 470—650°С;
В.Г. Шухов (1891)
Давление – 7 МПа
CH3CH3 + H2C CH2
H2C CH CH3 + CH4
H2C CH CH2 CH3 + H3C CH CH CH3 + H2
CH3CH2CH2CH3
H2C CH CH CH2 + 2H2
H3C CH3 + CH4 + C
2HC CH + 3H2
42
43. Алканы. Химические свойства
Каталитический крекингКатализаторы – АlСl3, Сr2О3, алюмосиликаты;
Температура – 470—500°С;
Давление 0,01—0,1 МПа
Пиролиз и риформинг
43

































 Химия
Химия








