Похожие презентации:
Kyseliny. Vlastnosti
1.
KYSELINY2.
VLASTNOSTIUž
v minulosti ľudia zistili, že niektoré látky
majú kyslú chuť a nazvali ich kyseliny.
Indikátory
sú látky, ktorých sfarbenie závisí
od kyslosti prostredia. Môžu byť vo forme:
prášku
roztoku
indikátorového
papierika
3.
VLASTNOSTIIndikátory
sú napr.:
lakmus
metyloranž
metylčerveň
fenolftaleín
4.
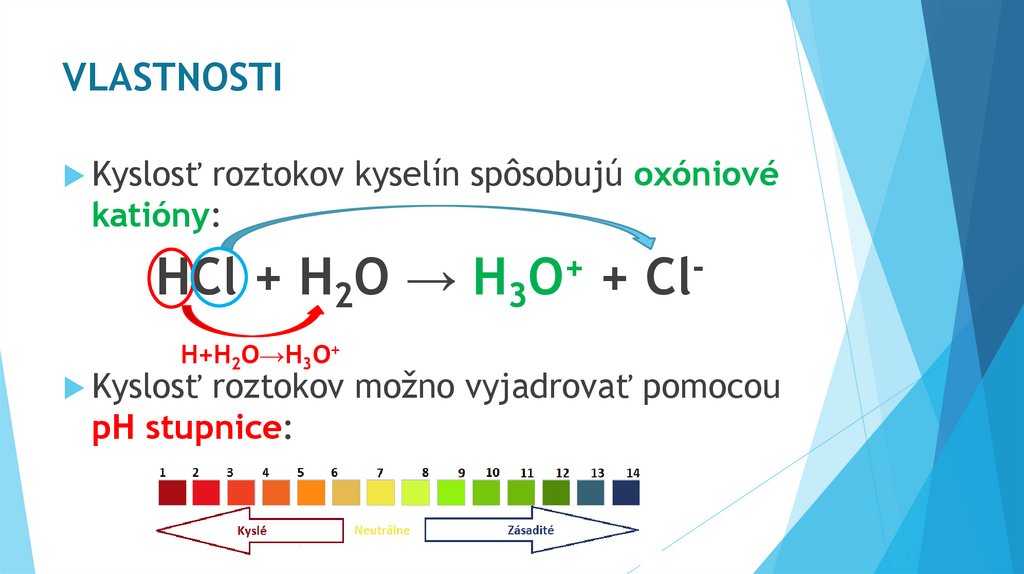
VLASTNOSTIKyslosť
roztokov kyselín spôsobujú oxóniové
katióny:
HCl + H2O →
H+H2O→H3O+
Kyslosť
+
H3O
+
Cl
roztokov možno vyjadrovať pomocou
pH stupnice:
5.
6.
KYSELINY V DOMÁCNOSTISú
to napr.:
kyselina
citrónová (citrusové ovocie)
kyselina
octová (ocot)
kyselina
askorbová (=vitamín C,šípky)
kyselina
sorbová (konzervačný prípravok)
kyselina
uhličitá (sýtené nápoje)
7.
ROZDELENIE KYSELÍN1. BEZKYSLÍKATÉ KYSELINY
sú
dvojprvkové zlúčeniny vodíka a nekovového
prvku, v ktorých je to napr. halogén:
HI F-I
HI Cl-I
HI Br-I
HI I-I
kyselina fluorovodíková
kyselina chlorovodíková
kyselina bromovodíková
kyselina jodovodíková
výnimka! H2S-II – kyselina sírovodíková (sulfánová)
8.
ROZDELENIE KYSELÍN2. KYSLÍKATÉ KYSELINY
sú
trojprvkové zlúčeniny vodíka a nekovového
prvku a kyslíka, napr:
HNO3
kyselina dusičná
H2SO4
kyselina sírová
9.
NÁZOVje
dvojslovný:
podstatné meno + prídavné meno
Podstatné meno = kyselina
Prídavné meno = názov katiónu nekovového prvku
+ oxidačná prípona
10.
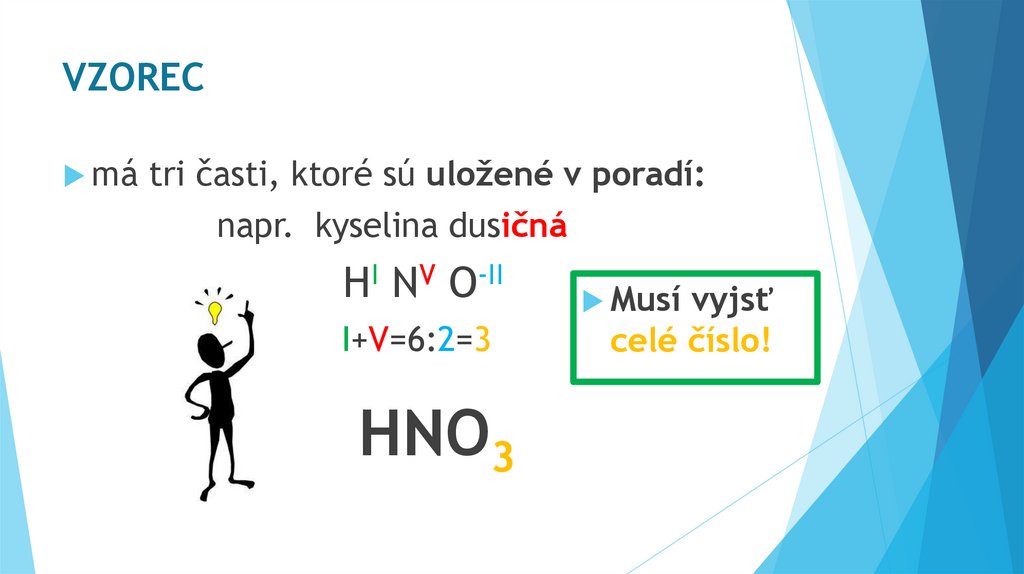
VZORECmá
tri časti, ktoré sú uložené v poradí:
napr. kyselina dusičná
HI NV O-II
I+V=6:2=3
HNO3
Musí
vyjsť
celé číslo!
11.
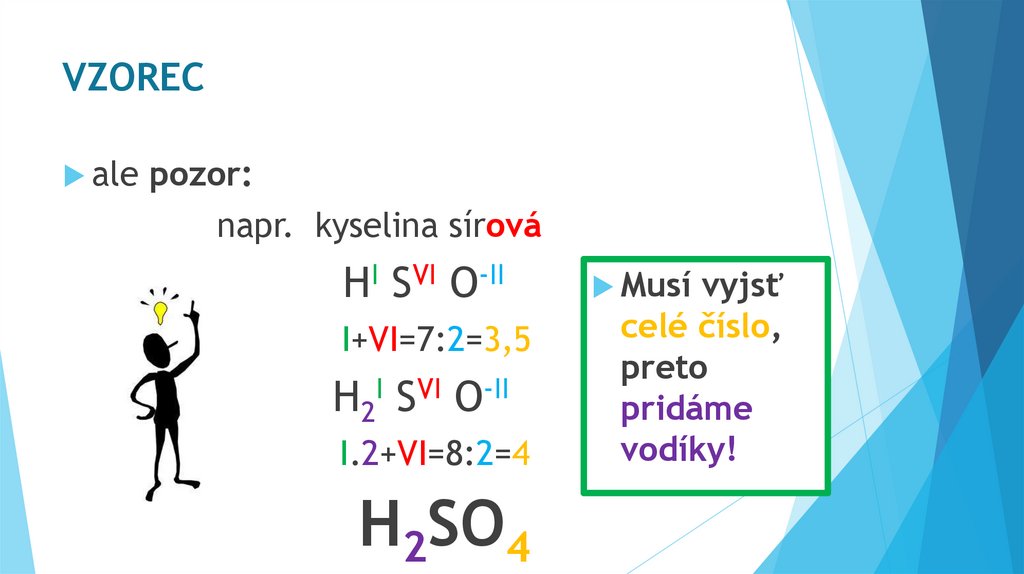
VZORECale
pozor:
napr. kyselina sírová
HI SVI O-II
I+VI=7:2=3,5
H2I SVI O-II
I.2+VI=8:2=4
H2SO4
Musí
vyjsť
celé číslo,
preto
pridáme
vodíky!
12.
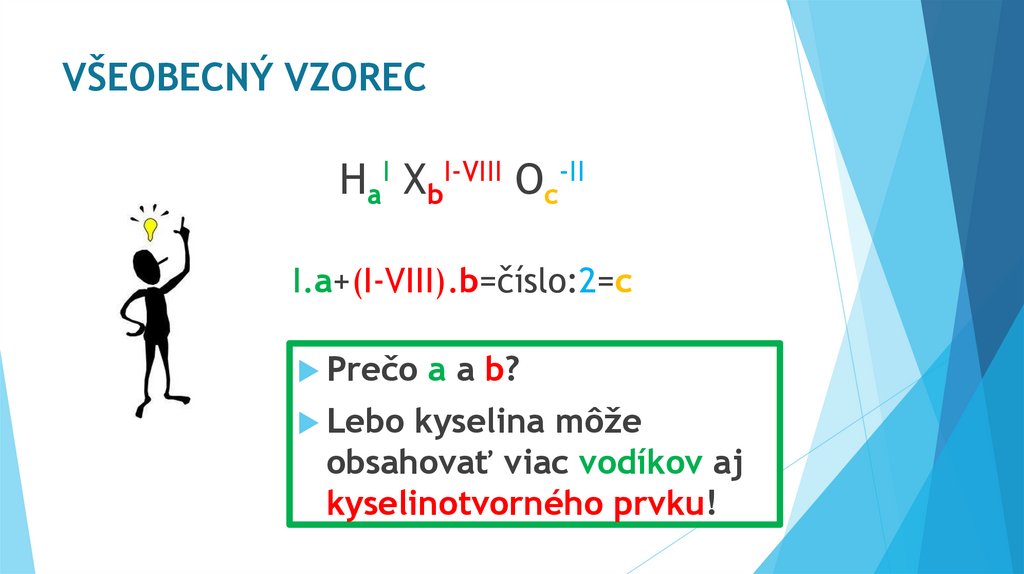
VŠEOBECNÝ VZORECHaI XbI-VIII Oc-II
I.a+(I-VIII).b=číslo:2=c
Prečo
Lebo
a a b?
kyselina môže
obsahovať viac vodíkov aj
kyselinotvorného prvku!
13.
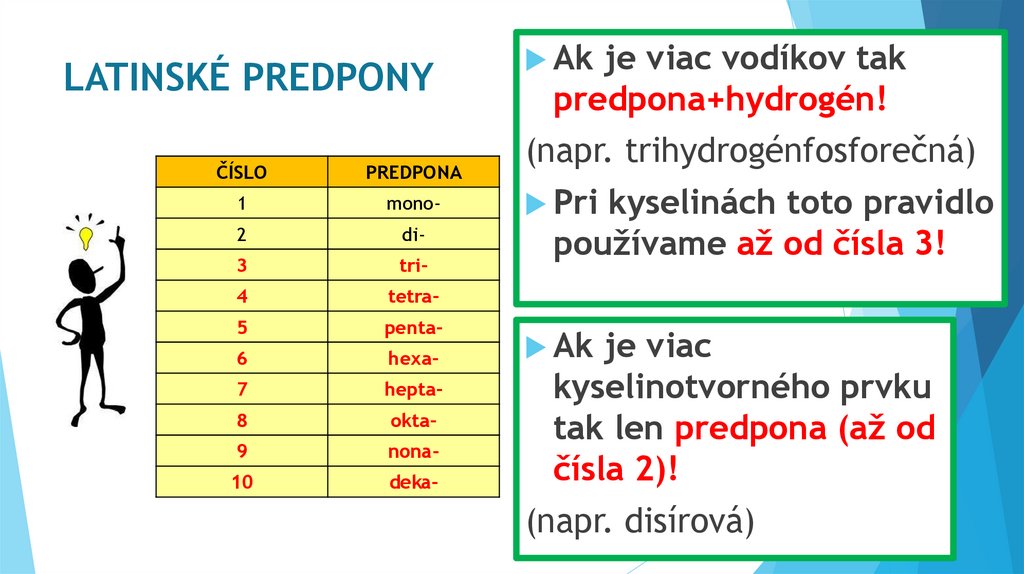
LATINSKÉ PREDPONYČÍSLO
PREDPONA
1
mono-
2
di-
3
tri-
4
tetra-
5
penta-
6
hexa-
7
hepta-
8
okta-
9
nona-
10
deka-
Ak
je viac vodíkov tak
predpona+hydrogén!
(napr. trihydrogénfosforečná)
Pri
kyselinách toto pravidlo
používame až od čísla 3!
Ak
je viac
kyselinotvorného prvku
tak len predpona (až od
čísla 2)!
(napr. disírová)
14.
VZORECnapr. kyselina trihydrogénfosforečná
H3I PV O-II
I.3+V=8:2=4
H3PO4
15.
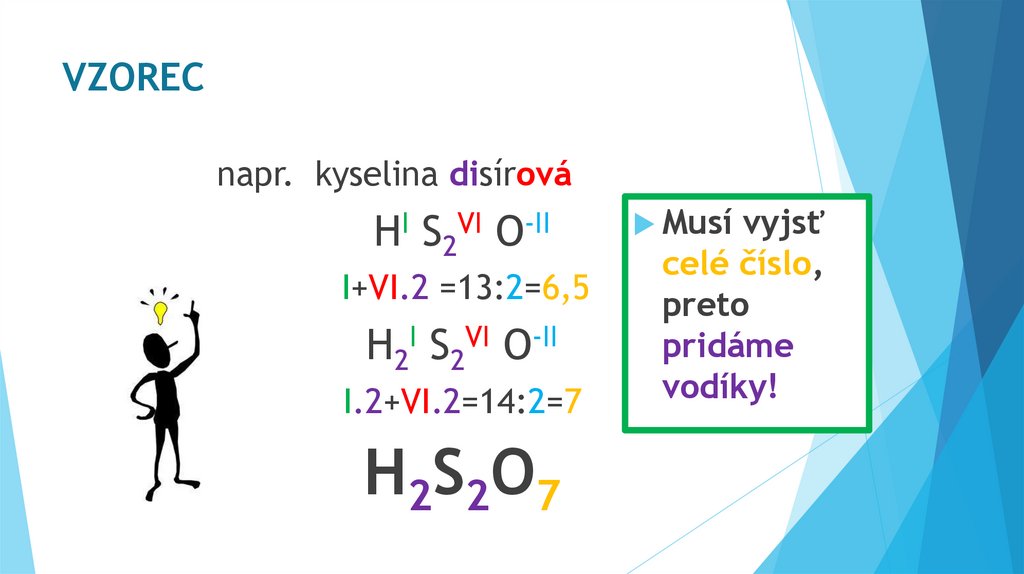
VZORECnapr. kyselina disírová
HI S2VI O-II
I+VI.2 =13:2=6,5
H2I S2VI O-II
I.2+VI.2=14:2=7
H2S2O7
Musí
vyjsť
celé číslo,
preto
pridáme
vodíky!
16.
VÝZNAMNÉ KYSELINYKyseliny
sú žieraviny, preto sa pri práci s nimi
musia dodržiavať bezpečnostné opatrenia.
17.
VÝZNAMNÉ KYSELINYKyselina chlorovodíková HCl
na
čistenie kovov, výrobu
farieb, liekov, plastov
veľmi
zriedený roztok HCl
obsahuje žalúdočná šťava,
ktorá má význam pri trávení
potravy
18.
VÝZNAMNÉ KYSELINYKyselina dusičná HNO3
VÝROBA:
výbušnín
liekov
farieb
hnojív
19.
VÝZNAMNÉ KYSELINYKyselina sírová H2SO4
VÝROBA:
výbušnín
liekov
farieb
hnojív
v
textilnom priemysle, výroba papiera, náplň
akumulátorov do áut, spracovanie ropy, ...












 Химия
Химия

