Похожие презентации:
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
1. Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
2. Электролитическая теория
• первая научная ионная теория кислот иоснований (Оствальд, Аррениус, 1890 год).
Согласно этой теории, кислоты - это
водородсодержащие соединения,
способные при электролитической
диссоциации выступать в роли источника
протонов (ионов Н+), а основания
рассматривались как источник ионов
гидроксила (ОН-).
3. Амфотерность
• А. Ганч в 1917-1927 годах ввел понятие обамфотерности - способности некоторых
соединений проявлять как кислотные, так и
основные свойства в зависимости от условий и
природы реагентов, участвующих в кислотноосновном взаимодействии.
• Как оказалось позже, соединений,
проявляющих амфотерность, подавляющее
большинство. В зависимости от природы
партнера по взаимодействию кислота может
выступать в роли основания, и наоборот.
4. Теории кислот и оснований
• протолитическая (И. Бренстед и Т. Лоури) иэлектронная (Г. Льюис) теории кислот и
оснований были предложены одновременно в
1923 году.
• По Бренстеду-Лоури, кислоты представляют
собой вещества, способные отдавать протон, а
основания - вещества, присоединяющие
протон. Кислота – понятие относительное.
CH3COOH + H2O = H3O+ + CH3COOH2SO4 + CH3COOH = CH3C(OH)2+ + HSO4-
5. В протолитической теории
• Вода принята за своеобразный стандарт дляоценки кислотно-основных свойств веществ стандарт нейтральной среды.
• Если в аналогичных условиях
рассматриваемое вещество способно отдавать
протон легче, чем вода, то его относят к группе
кислот. Если вещество по способности
присоединять (связывать) протон превосходит
воду - это основание (основность выше, чем у
воды).
6. Почему вода?
• Вода - одно из самых распространенных на Землесоединений.
• Ее кислотно-основные свойства определяют
естественный фон (атмосфера, почва, моря и
океаны).
• Вода хорошо растворяет многие полярные и
диссоциирующие на ионы вещества.
• По физическим характеристикам вода хорошо
сольватирует как недиссоциированные молекулы,
так и свободные ионы.
• Кроме того, молекулы воды способны к
автопротолизу - передаче протона между
молекулами одного и того же вещества:
H2O + H2O = H3O+ + OH-
7. Количественная мера кислотности и основности
• Кислотность соединений количественнооценивается долей ионизированной формы
вещества в растворе (воде) или константой
равновесия (К) реакции переноса протона
от кислоты к воде как основанию.
8. Принцип ЖМКО Пирсона (1963)
Кислоты и основания Льюиса делятся нажёсткие и мягкие, причём мягкие кислоты
преимущественно реагируют с мягкими
основаниями, а жёсткие кислоты — с жёсткими
основаниями.
Жёсткость кислоты или основания означает его
склонность образовывать связи
преимущественно ионного характера, а
мягкость кислоты или основания — склонность к
образованию связей ковалентного характера
9.
Жесткие кислотыЖесткие основания
-низкая поляризуемость
-малый объем
-высокое сродство к электрону
-высокая НСМО
-большой (+) заряд
-низкая поляризуемость
-малый объем
-высокий потенциал иониз.
-низкая ВЗМО
-малый (-) заряд
10.
Мягкие кислотыМягкие основания
-высокая поляризуемость
-высокая поляризуемость
-большой объем
-большой объем
-низкая НСМО
-высокая ВЗМО
-малое сродство к электрону -малый потенциал иониз.
-малый (+) заряд
-большой (-)заряд
Поляризуемость мягких кислот и оснований:
в большом атоме (или ионе с малым эффективным зарядом ядра)
относительно легко «искажается» электронное облако
(частица поляризуется)
11. Классификация кислот и оснований в рамках принципа ЖМКО
Жёсткие кислотыПромежуточные
кислоты
Мягкие кислоты
H+, Li+, Na+, K+, Mg2+, Ca2+,
Al3+, Cr3+, Fe3+, BF3, B(OR)3,
AlR3, AlCl3, SO3, RCO+, CO2,
RSO2+
Cu2+, Fe2+, Zn2+, SO2, R3C+,
C6H5+, NO+
Ag+, Cu+, Hg2+, RS+, I+, Br+,
Pb2+, карбены
Жёсткие основания
Промежуточные
основания
Мягкие основания
OH-, RO-, F-, Cl-, RCOO-,
Br-, C6H5NH2, NO2-, C5H5N
NO3-, NH3, RNH2, H2O,
ROH, SO42-, CO32-, R2O, NR2, NH2-
RS-, RSH, I-, H-, R3C-,
алкены, C6H6, R3P, (RO)3P
12.
• Помимо условного деления на три типа, можнотакже проследить зависимость жёсткости или
мягкости в рядах отдельных кислот и оснований
Льюиса. Например, при движении по группе
периодической системы сверху вниз жёсткость
оснований уменьшается: F- > Cl- > Br- > I• При движении по группе сверху вниз жёсткость
кислот тоже уменьшается :
Li+ > Na+ > K+;
Zn2+ > Cd2+ > Hg2+
• Для изоэлектронных соединений жёсткость
возрастает при движении по группе слева
направо:
СH3- < NH2- < OH- < F-
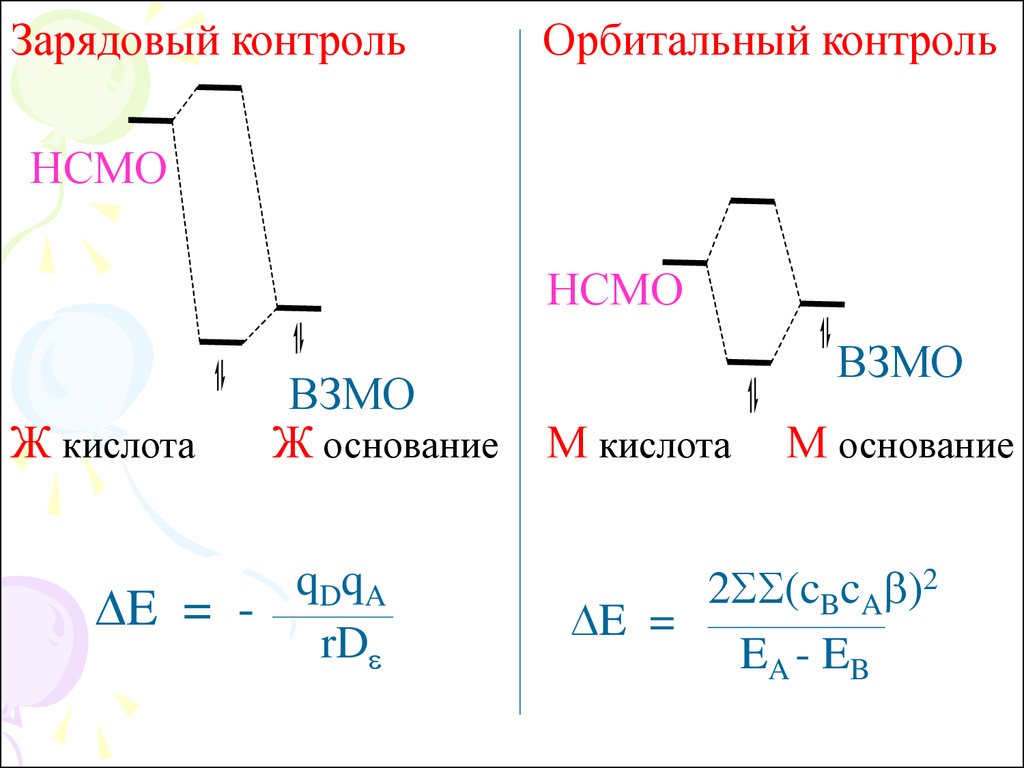
13. Ж. кис.+ Ж. осн. = Зарядовый контроль
Высоколежащая НСМО к-ты + низколежащая ВЗМОосн-я. Определяющая роль – возмущение II
порядка, зарядовое взаимодействие, определяемое
кулоновскими силами (~ q1q2/r2)
М. кис.+ М. осн. = Орбитальный
контроль
Низколежащая НСМО к-ты + высоколежащая ВЗМО
основания. Определяющая роль – возмущение I
порядка, орбитальное взаимодействие
14.
Зарядовый контрольОрбитальный контроль
НСМО
НСМО
Ж кислота
ВЗМО
Ж основание
qDqA
DE = rDe
ВЗМО
М кислота
М основание
2SS(cBcAb)2
DE =
EA - EB
15. Применение в органической химии
В органической химии принцип ЖМКО широкоприменяется для предсказания или объяснения
протекания химических реакций.
Например, реакцию между тиоэфиром CH3COSR и
алкоголят-ионом RO– можно представить как
переход ацильного катиона CH3CO+ (жёсткой
кислоты Льюиса) от мягкого основания Льюиса RS–
к жёсткому основанию Льюиса RO–. Согласно
принципу ЖМКО, аддукт жёсткой кислоты и
жёсткого основания более устойчив, поэтому
равновесие в реакции сдвинуто вправо.
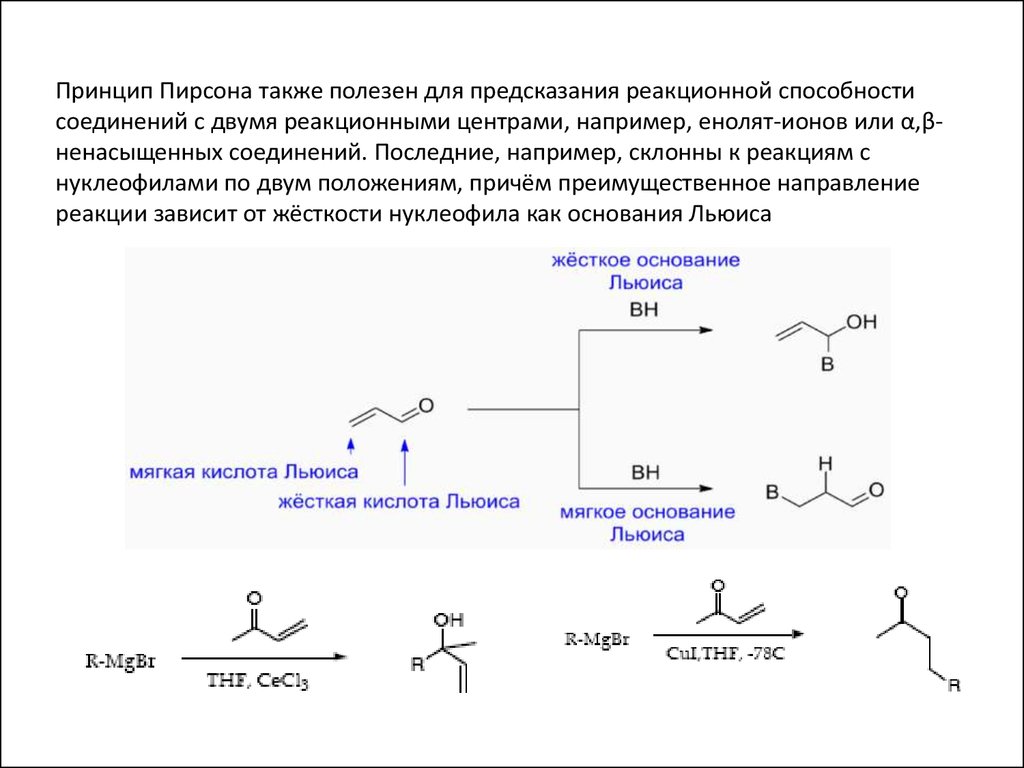
16.
Принцип Пирсона также полезен для предсказания реакционной способностисоединений с двумя реакционными центрами, например, енолят-ионов или α,βненасыщенных соединений. Последние, например, склонны к реакциям с
нуклеофилами по двум положениям, причём преимущественное направление
реакции зависит от жёсткости нуклеофила как основания Льюиса
17.
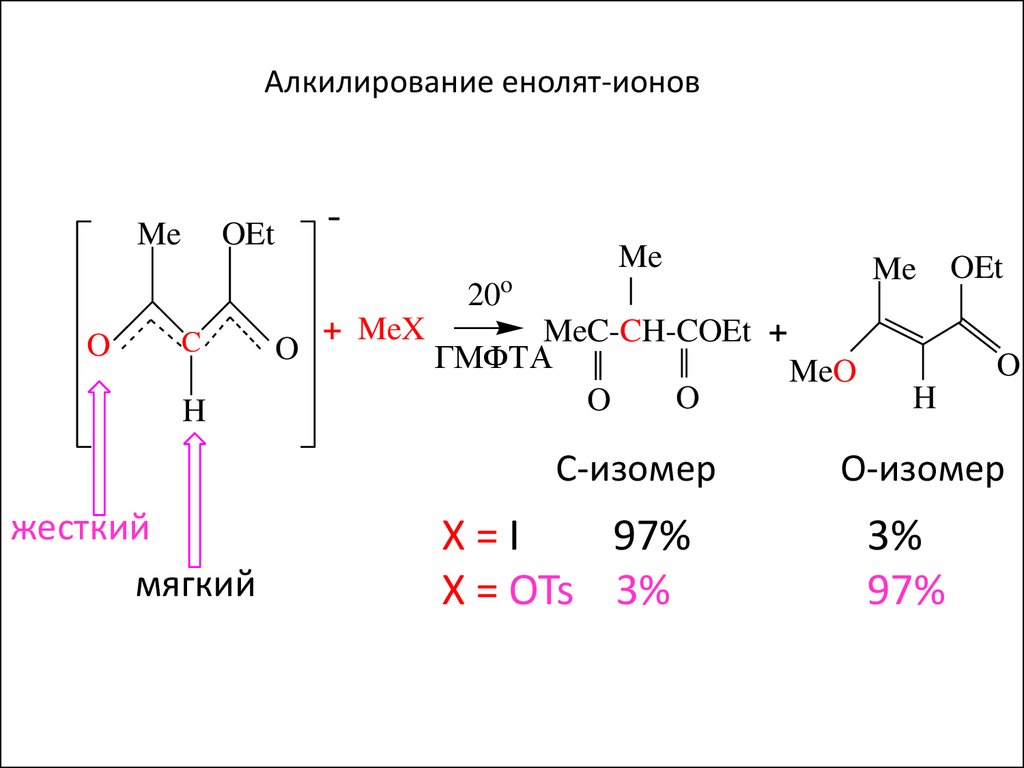
Алкилирование енолят-ионовMe
-
OEt
Me
Me
o
20
O
C
O
H
+ MeX
MeC-CH-COEt +
ГМФТА
MeO
O
O
С-изомер
Жесткий
основный
Мягкий
центр
основный
центр
Х=I
97%
X = OTs 3%
OEt
O
H
О-изомер
3%
97%
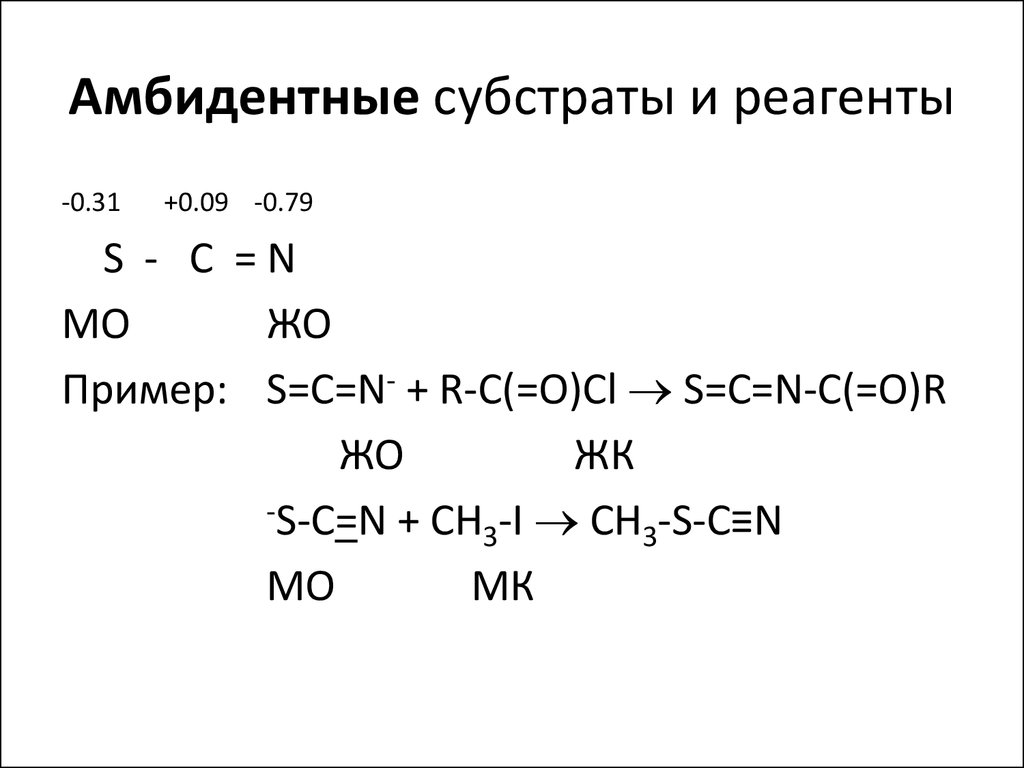
18. Амбидентные субстраты и реагенты
-0.31+0.09 -0.79
S - C =N
MО
ЖО
Пример: S=C=N- + R-C(=O)Cl S=C=N-C(=O)R
ЖО
ЖК
-S-C=N + СH -I CH -S-C≡N
3
3
МО
МК
19. Амбидентность нитрит – иона
O- – N = OЖО
МО
С8H17Br + AgNO2 C8H17O-N=O + AgBr
Мягкая кислота Ag+ координируется с мягким
основанием N и освобождает O
С8H17Br + NaNO2 C8H17NO2 + NaBr
Жесткая кислота Na+ координируется с
жестким основанием О и освобождает N
20. Амбидентность енолят-аниона
• (С2H5)3OF (фторид триэтилоксония) – оченьжесткий реагент – алкилирует енолят –
анион по атому О (жесткому основному
центру)
• С2Н5I – очень мягкий реагент – алкилирует
енолят-анион по атому С (мягкому
основному центру)
21.
Алкилирование енолят-ионовMe
-
OEt
Me
Me
o
20
O
C
H
O
+ MeX
MeC-CH-COEt +
ГМФТА
MeO
O
O
С-изомер
жесткий
мягкий
Х=I
97%
X = OTs 3%
OEt
O
H
О-изомер
3%
97%
22.
В газовой фазе:Me-OH + H-I
М-Ж Ж-М
Kp =
[H2O] [MeI]
[HI] [MeOH]
MeI + H-OH
М-М
Ж-Ж
Kp > 109
Симбиоз лигандов во внутренней сфере комплекса
[Co(NH3)5F]2+ более стабилен, чем [Co(NH3)5I]2+
[Co(CN)5I]2+ более стабилен, чем [Co(CN)5F]2+


















 Химия
Химия








