Похожие презентации:
Кислоты и основания
1. Кислоты и основания
Лекция 16 по курсу «Общая и неорганическаяхимия»
2. Инь и Ян химии
ОснованиеКислота
3. Теория электролитической диссоциации: недостатки
• Применимо только к водным растворам,исключая:
а) реакции в газовой и твердой фазе
б) неводные растворы
• Не все вещества, ведущие себя как
кислоты, подходят под описание с точки
зрения ТЭД.
4. Протолитическая теория (1923)
Т.М.Лоури
Й.Н.Брёнстед
Кислота – донор протона, основание – акцептор протона.
У каждой кислоты есть сопряженное ей основание
(кислота минус протон): HF => F–
Чем > доля переданных (принятых) протонов, тем
сильнее кислота (основание).
Равновесие смещено в сторону более слабых кислот и
оснований
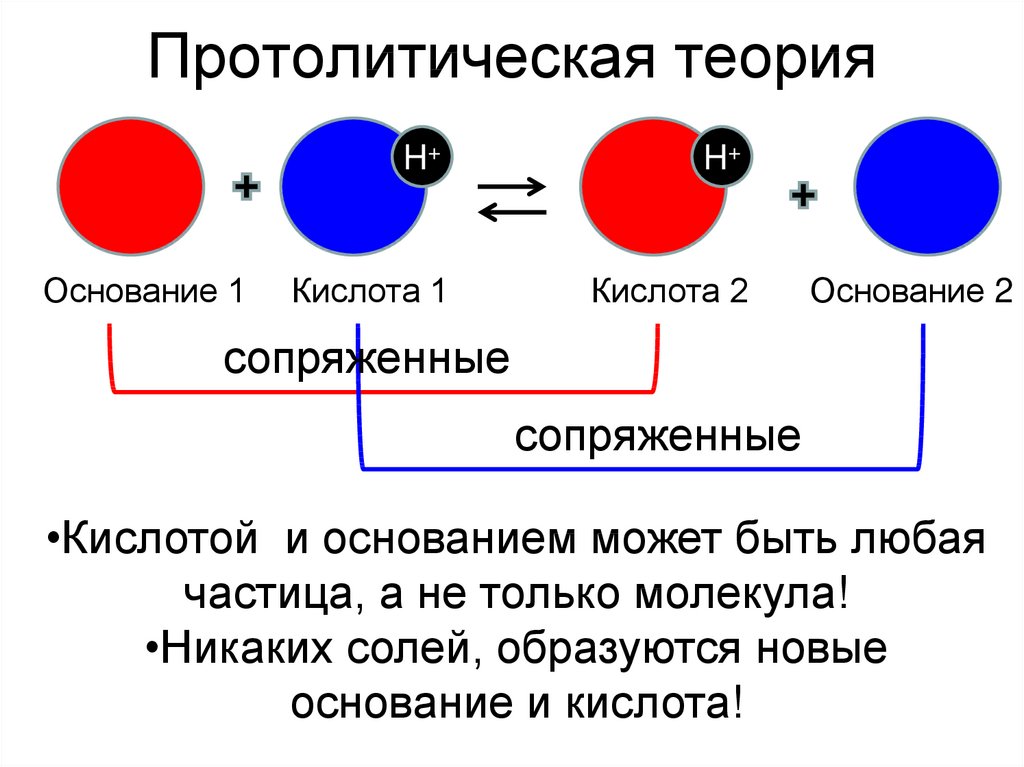
5. Протолитическая теория
Основание 1H+
H+
Кислота 1
Кислота 2
Основание 2
сопряженные
сопряженные
•Кислотой и основанием может быть любая
частица, а не только молекула!
•Никаких солей, образуются новые
основание и кислота!
6. Автопротолиз
H2O + H2O ⇄ H3O+ + OH–Сопряженная
кислота воды
Сопряженное
основание воды
K [ H 3O ][OH ] K w 10
14
Аналогично для других протонных жидкостей:
HF + HF ⇄ H2F+ + F–
CH3COOH + CH3COOH ⇄ CH3COOH2+ + CH3COO–
т.е. применимо не только к водным растворам!
7. Константы ионизации для сопряженных кислот и оснований
HF + H2O ⇄ H3O+ + F–F– + H2O ⇄ HF + OH–
K a ( HF )
[ H 3O ][ F ]
[ HF ]
Kb ( F )
[OH ][ HF ]
[F ]
K a ( HF ) Kb ( F ) [ H 3O ][OH ] K w
Аналогично для других растворителей!
8. Относительность кислотно-основных свойств
CH3COOH + NH3CH3COO– + NH4+
Кислота
Основание
CH3COOH + H2SO4
CH3COOH2+ + HSO4–
Основанием может быть даже HNO3!
HNO3 + H2SO4
H2NO3+
H2NO3+ + HSO4–
H2O + NO2+
9. Суперкислоты (1968)
Соединения, исключительносклонные отдавать протон
HF + SbF5 = H+[SbF6]–
HSO3F + SbF5 = HSO3+[SbF6]–
«Магическая кислота»
Дж.А.Ола
В суперкислотах протонируются даже алканы!
CH4 + H+ → CH5+
CH5+ → CH3+ + H2
CH3+ + 3CH4 → (CH3)3C+ + 3H2
???
10. Ограничения протолитической теории
• Неприменима к реакциям без растворителя;• Неприменима к полностью апротонным (не
содержащим катионов водорода и их
источников) средам
• Не объясняет некоторых наблюдаемых
фактов (см. следующий слайд)
11. Что за вещество?
• Тяжелая жидкость с едким, раздражающимзапахом;
• «Дымит» на воздухе;
• Бурно реагирует со щелочами и NH3;
SnCl4!!!
• Дает солеобразные кристаллические
соединения с органическими основаниями
• Растворяется в воде с сильным выделением
тепла;
• Раствор имеет pH << 7;
12. Электронная теория (1923)
Кислоты – акцепторыпары электронов
(имеют вакантные орбитали)
BF3, AlCl3, NO2+, H+,
катионы металлов…
Основания – доноры
пары электронов
(имеют неподеленные пары)
OH–,
Cl–,
F–,
NH3, H2O,
CH3COO– и т.д.
Г.Н.Льюис
13. Кислота или основание по Льюису: как узнать?
Неподеленнаяпара электронов
N
2p
2s
Вакантная
орбиталь
B*
2p
2s
+ –
H3N: + BF3 = H3N–BF3
14. Применение теории Льюиса
Химия координационных соединенийКислоты
AlCl3 + Cl– = [AlCl4]–
Основания
Zn2+ + 4H2O = [Zn(H2O)4]2+
Органическая химия
(кислоты Льюиса – катализаторы)
Кислота Льюиса
Br2
AlBr3
Br
HBr
15. Ограничения теории Льюиса
• Не работает для некоторых протонныхкислот: HF + NH3 = NH4F – но у HF нет
вакантных орбиталей!
• Не всегда может объяснить амфотерность
(H2O амфотерна, но у нее только
неподеленные пары!)
• Не учитывает взаимного влияния атомов и
групп: Неподеленная пара
Кислота
Льюиса
Cl
As
Cl
Cl
???
N
Cl
N As Cl
Cl
16. Теория реакций в расплаве Лукса – Флуда
• Применяется для реакций междукислородсодержащими соединениями
• Хорошо описывает взаимодействия в
расплаве
• Кислота – акцептор аниона O2–, основание –
донор аниона O2–.
SiO2 + CaO = CaSiO3
Кислота Основание
17. Теория «ониевых солей» Ганча
• Главный признак кислотноосновной реакции –солеобразование;
• То, что превращается в
анион – кислота, то, что в
катион – основание:
Теория пригодна как для водных,
так и для неводных сред
А.Р.Ганч
(C2H5)2O + HClO4 = (C2H5)2OH+ClO4–
Основание Кислота
18. Теория сольвосистем Кэди – Элслея
Почти любое вещество в жидком состояниичастично ионизировано:
2HF ⇄ H2
F+
+
F–
Ион лиония
I2 ⇄ I+ + I–
Ион лиата
KOH + HF = KF + H2O
в расплаве KF
Кислота KOH – источник ионов лиония K+
Основание HF – источник ионов лиата F
–
Если ни то, ни другое – соль H2O
19. Обобщенная теория кислот и оснований Усановича (1938 г.)
•Кислота – донор катионаО сладкий
плоданиона
твоих исканий или
акцептор
Закон суровый и простой:
•Основание – донор аниона
Нет ни кислот, ни оснований!
или
акцептор
катиона
И кислоту
без оснований
Всегда
считали
кислотой.
Анион
– в том
числе ē:
2+ + I
А.А.Гухман
2Fe3+ + 2I– = 2Fe
2
Окислитель Восстановитель
Акцептор ē Донор ē
Кислота
Основание
М.И.Усанович
(1896–1981)
«Кислоты и основания – это не классы соединений;
кислотность и основность – это функции вещества. Будет ли
вещество кислотой или основанием, зависит от партнера».
20. Теория ЖМКО: жестких и мягких кислот и оснований Пирсона (1963)
Жесткие частицы:• Маленький радиус (объем)
• Высокая степень окисления
• Высокая
электроотрицательность
Мягкие частицы:
• Большой радиус (объем)
• Низкая степень окисления
• Низкая
электроотрицательность
Р.Г.Пирсон
Жесткое с жестким, мягкое с мягким!
21. Жесткие и мягкие: примеры
КислотыОснования
Жесткие
H+, Li+, Na+,
CO32–, ClO4–, OH–,
Mg2+, Cr3+, BF3, F–, Cl–, CH3COO–,
AlCl3
NH3
Средние
Fe2+, Co2+, Pb2+ SO42–, NO3–, Br–,
SO2
N2, анилин
Мягкие
Pt2+, Pd2+, Ag+, H–, SCN–, I–, CO
Au+, Hg2+,
Hg22+, Cd2+, BH3
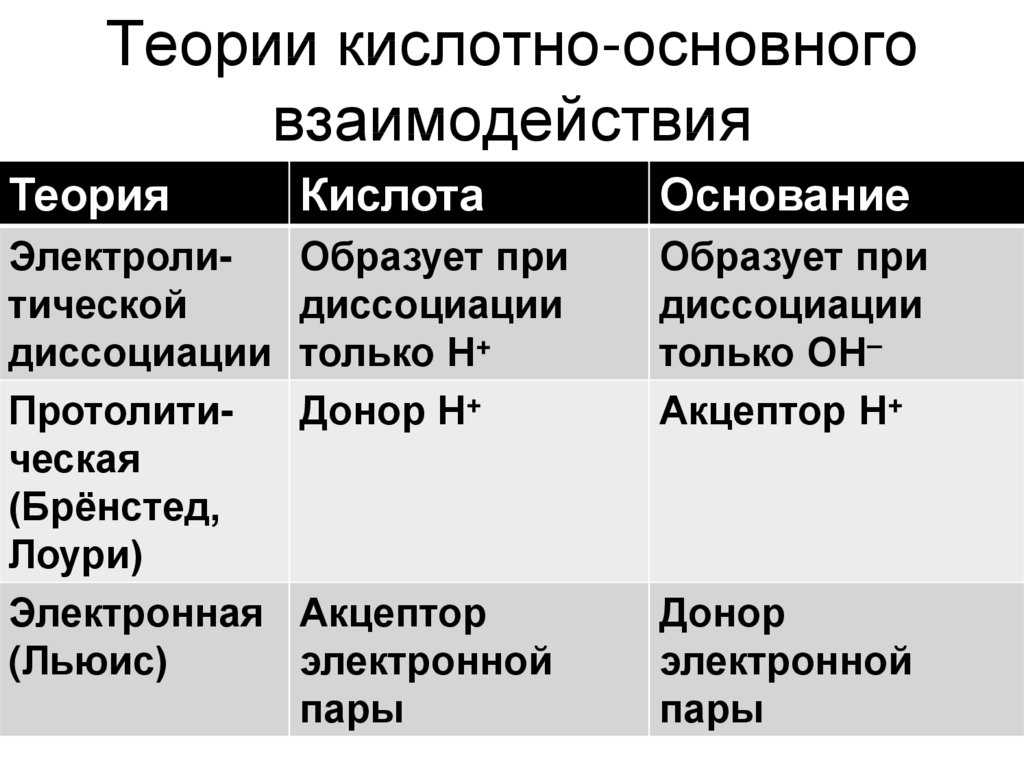
22. Теории кислотно-основного взаимодействия
ТеорияКислота
Основание
Электролитической
диссоциации
Протолитическая
(Брёнстед,
Лоури)
Электронная
(Льюис)
Образует при
диссоциации
только Н+
Донор Н+
Образует при
диссоциации
только ОН–
Акцептор Н+
Акцептор
электронной
пары
Донор
электронной
пары
23. Теории кислотно-основного взаимодействия (окончание)
ТеорияКислота
Основание
Реакций в расплаве (Лукс,
Флуд)
Акцептор O2–
Донор O2–
Ониевых солей
(Ганч)
Превращается в анион в Превращается в катион
составе продукта
в составе продукта
Сольвосистем
(Кэди, Элслей)
Образует тот же катион,
что и растворитель
Обобщенная
(Усановича)
Донор катиона/акцептор Донор аниона/акцептор
аниона
катиона
ЖМКО
(Пирсона)
Акцептор электронной
плотности
Образует тот же анион,
что и растворитель
Донор электронной
плотности





















 Химия
Химия








