Похожие презентации:
Фармаконадзор. Нормативная база
1.
ФармаконадзорАбрамова Н.Н.
08.07.2021г
2.
Фармаконадзор- вид деятельности по мониторингу эффективности и безопасности лекарственных
препаратов
- осуществляется Федеральной службой по надзору в сфере здравоохранения
(Росздравнадзор)
- путем анализа представляемой информации о представляющих угрозу жизни или здоровью
человека: -побочных действиях лекарственных средств,
-нежелательных реакциях,
-серьезных нежелательных реакциях,
-непредвиденных нежелательных реакциях,
-об индивидуальной непереносимости,
-отсутствии эффективности
-иных фактах и обстоятельствах
3.
Нормативная базаМИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В
СФЕРЕ ЗДРАВООХРАНЕНИЯ
ПРИКАЗ
от 15 февраля 2017 г. N 1071
«ОБ УТВЕРЖДЕНИИ ПОРЯДКА
ОСУЩЕСТВЛЕНИЯ ФАРМАКОНАДЗОРА»
Регламентируется внутренним приказом
4.
Фармаконадзор осуществляется на основании :1) сообщений субъектов (медицинских организаций) обращения лекарственных
средств;
2) периодических отчетов по безопасности лекарственных препаратов (от
держателей или владельцев регистрационных удостоверений лекарственных
препаратов);
3) периодических отчетов по безопасности разрабатываемого (исследуемого)
лекарственного препарата от юридических лиц, проводимых клинические
исследования;
4) информации, полученной в ходе осуществления государственного контроля
(надзора) в сфере обращения лекарственных средств.
5.
Как направляются сообщения в РосздравнадзорКак заполнить : по рекомендуемому образцу "Извещения о нежелательной реакции или
отсутствии терапевтического эффекта лекарственного препарата»
Кто выявляет / заполняет: врач выявляет / отдел лекарственного обеспечения заполняет
Как отправить: через Автоматизированную информационную систему Росздравнадзора, либо
по электронной почте pharm@roszdravNadzor.ru
Кто отправляет: отдел лекарственного обеспечения
N.B: копии сообщений, направленных в Росздравнадзор, сохраняются в медицинской
документации пациентов.
6.
Какие сведения о нежелательной реакции илиособой ситуации заполняются:
1) информация по физическому лицу / юридическому лицу, выявившему нежелательную
реакцию или особую ситуацию (кто выявил);
2) информация по физическому лицу, у которого наблюдалась нежелательная реакция (у кого
выявлено);
3) Информация по лекарственному препарату (на каком лекарственном препарате выявлено);
4) Информация по симптомам нежелательной реакции (что выявили).
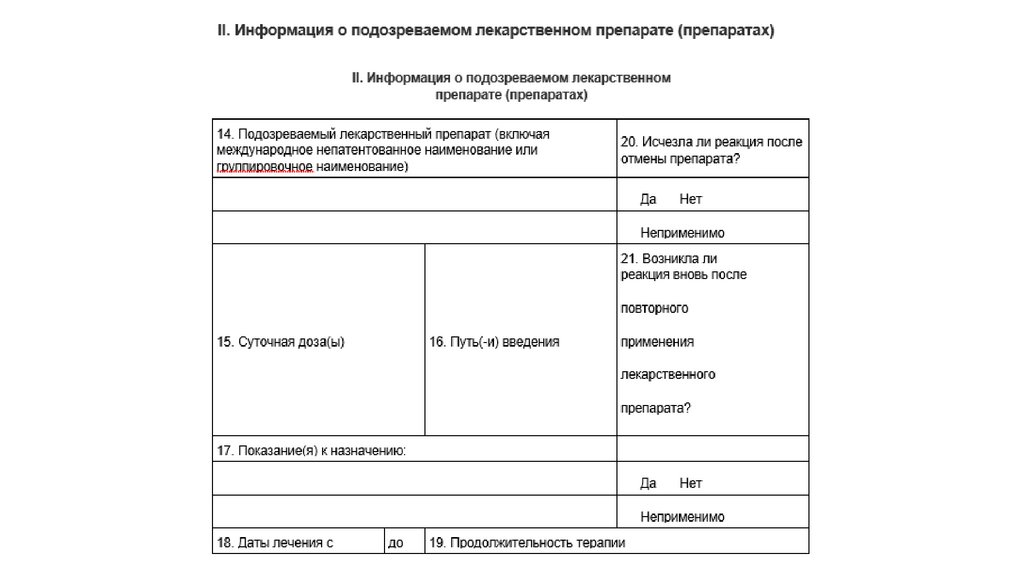
7.
8.
9.
10.
Медицинские организации обязаны сообщать в срок-не более 3 рабочих дней о серьезных нежелательных реакциях с летальным исходом или
угрозой жизни
-не более 15 календарных дней о следующих нежелательных реакциях и иной информации:
1) серьезных нежелательных реакциях на лекарственные препараты;
2) случаях передачи инфекционного заболевания через лекарственный препарат;
3) случаях отсутствия заявленной эффективности лекарственных препаратов (при
заболеваниях, представляющих угрозу для жизни человека, вакцин, для предотвращения
беременности, когда отсутствие клинического эффекта не вызвано индивидуальными
особенностями пациента и (или) спецификой его заболевания);
4) нежелательных реакциях вследствие злоупотребления препаратом, умышленной
передозировки, при воздействии, связанном с профессиональной деятельностью, или в целях
умышленного причинения вреда жизни и здоровью человека.
11.
В рамках программ льготного лекарственногообеспечения
- сообщения в срок не более 5 дней
- в случае индивидуальной непереносимости лекарственных средств
- поэтому выписки лекарственных препаратов врачебными комиссиями по торговому
наименованию
12.
Информация по безопасности препаратов• Любое нежелательное явление, связанное с отменой препарата
• Любое подозрение на передачу инфекционного возбудителя через лекарственный препарат
• Любой случай передозировки (случайный или преднамеренный), злоупотребления,
неправильного применения и применения не в соответствии с инструкцией
• Любая ошибка в отношении лекарственного препарата (включая ошибки при
выписывании/назначении, отпуске или применении препарата, в т.ч. связанные с названием,
лекарственной формой, дозировкой)
• Любой случай недостаточной эффективности (отсутствия ожидаемого фармакологического
эффекта)
• Прием препарата во время беременности или грудного вскармливания
• Любое воздействие препарата, связанное с родом занятий
• Любое нежелательное явление, связанное с отклонением в качестве или с
фальсифицированным лекарственным препаратом
13.
Нежелательная реакцияСерьезная
• Является летальной
• Является жизнеугрожающей
• Требует госпитализации или продления
текущей госпитализации
• Приводит к стойкой или значимой
нетрудоспособности или инвалидности
• Врожденный дефект / порок развития
• Является значимой с медицинской точки
зрения
Непредвиденная
• Характер, степень тяжести или исход
которой не соответствуют информации,
указанной в инструкции по медицинскому
применению
















 Медицина
Медицина








