Похожие презентации:
Реакции обмена
1.
2.
Определите тип химической реакции• Реакции соединения
– это такие реакции, в
результате которых из нескольких простых или
сложных веществ образуется одно более сложное.
А+В=АВ
• Реакции замещения
– это такие реакции,
в результате которых атомы простого вещества
замещают атомы одного из химических элементов
в сложном веществе.
АВ + С= АС +В
3. Определите тип химической реакции
• Реакции разложения – это такиереакции, в результате которых из
одного сложного вещества
образуется два и более новых
веществ.
АВ = А + В
4. Сравните уравнения химических реакций
1. Fe + H2SO4 → FeSO4 + H2↑2. FeO + H2SO4 → FeSO4 + H2O
5. Тема урока: « Реакции обмена»
AB+CD = AD+CBСложные вещества обмениваются
своими составными частями
6.
• Реакции обмена – это такиереакции, в результате которых два
сложных вещества обмениваются
своими составными частями
(атомами или группами атомов).
7. Эксперимент №1: Взаимодействие соляной кислоты с карбонатом натрия
1. Вспомним правила техникибезопасности при работе с кислотами.
Наблюдайте. Сделайте выводы о
признаке протекания реакций.
Na2CO3
+ HCl→
8.
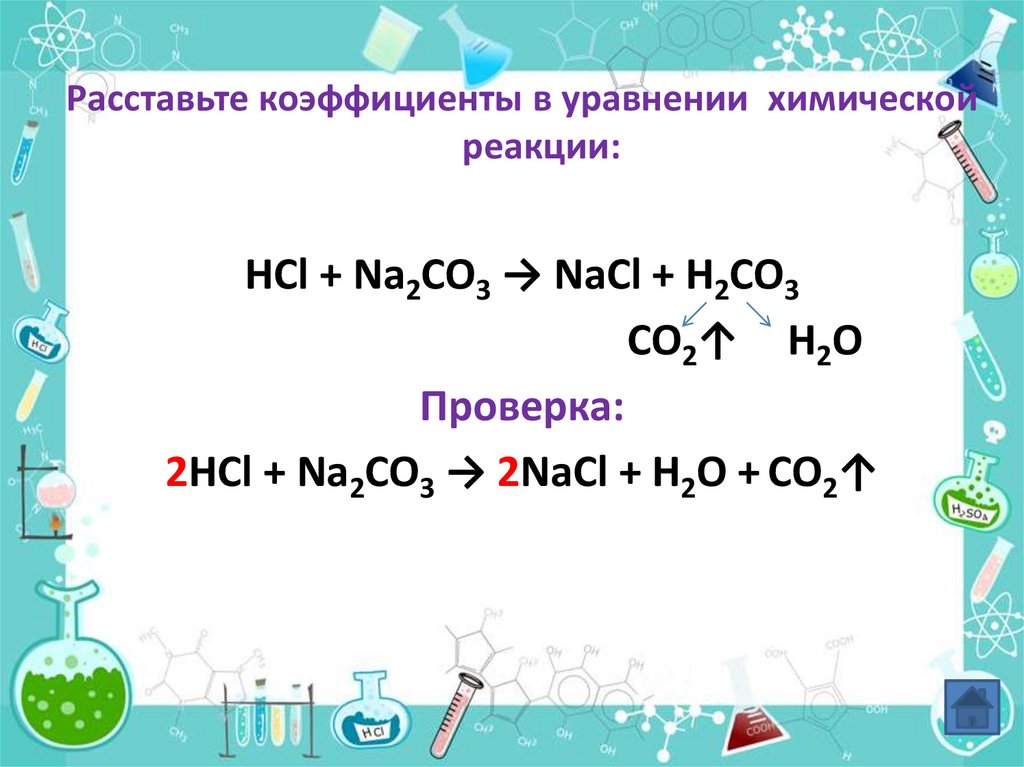
Расставьте коэффициенты в уравнении химическойреакции:
HCl + Na2CO3 → NaCl + H2CO3
CO2↑ H2O
Проверка:
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
9. Эксперимент № 2 Взаимодействие раствора гидроксида натрия с сульфатом меди.
1. Что наблюдаем?2. Сделайте выводы.
Расставьте коэффициенты в уравнении
химической реакции:
CuSO4 + NaOH → Cu(OH)2↓ + Na2SO4
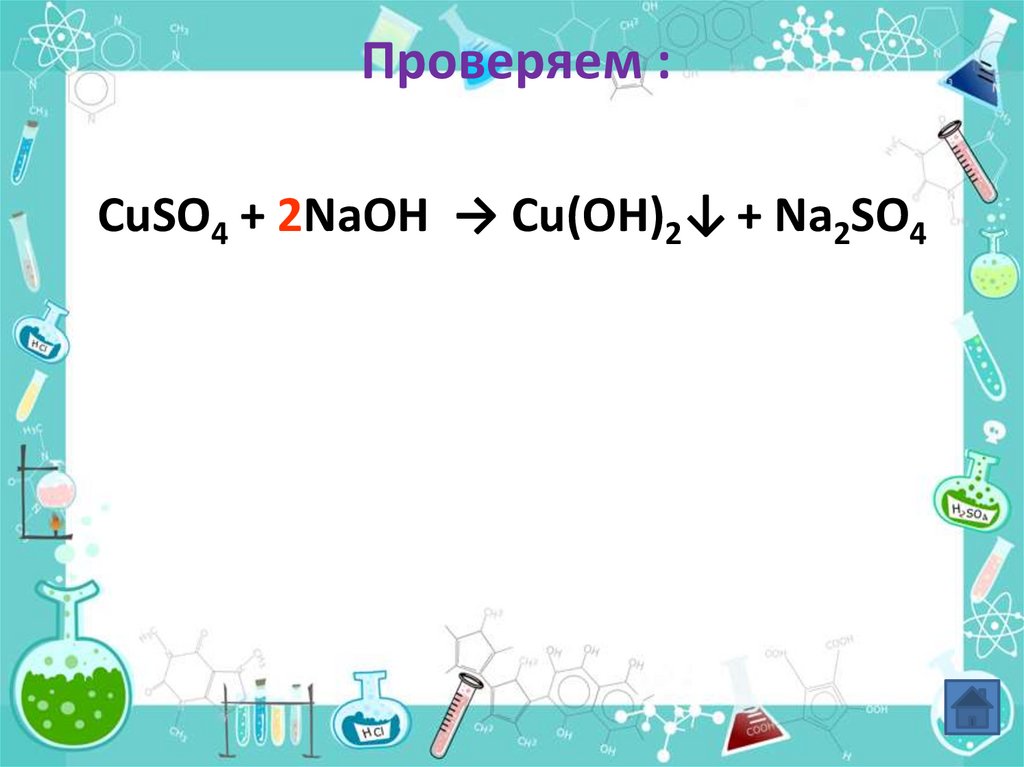
10. Проверяем :
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO411. Эксперимент №3: Взаимодействие серной кислоты с раствором хлорида бария
Наблюдайте. Сделайте выводы опризнаке протекания реакций.
Расставьте коэффициенты
BaCl2
BaCl2 + H2SO4→ BaSO4 ↓+ 2HCl
+H2SO4→
12. Эксперимент №3: Взаимодействие соляной кислоты с раствором гидроксида натрия
Наблюдайте. Сделайте выводы о признакепротекания реакций. Расставьте
коэффициенты
NaOH + HCl → NaCl + H2O
13.
Если выделится газЭто раз;И получится вода Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
14. Реакции обмена в быту
Разрыхлители теста.
Определение качества воды.
Устранение жесткости воды.
Определение качества продуктов
питания.
• Определение массовой доли уксусной
кислоты в ее растворе.
15. Решите проблему, работая в парах
Какие из реакции обмена, схемы которых:1. BaCl2 + AgNO3 →
2. Cu(NO3)2 +NaCl →
3. CaCO3 + HCl →
4. NaOH + HCl →
будут протекать до конца?
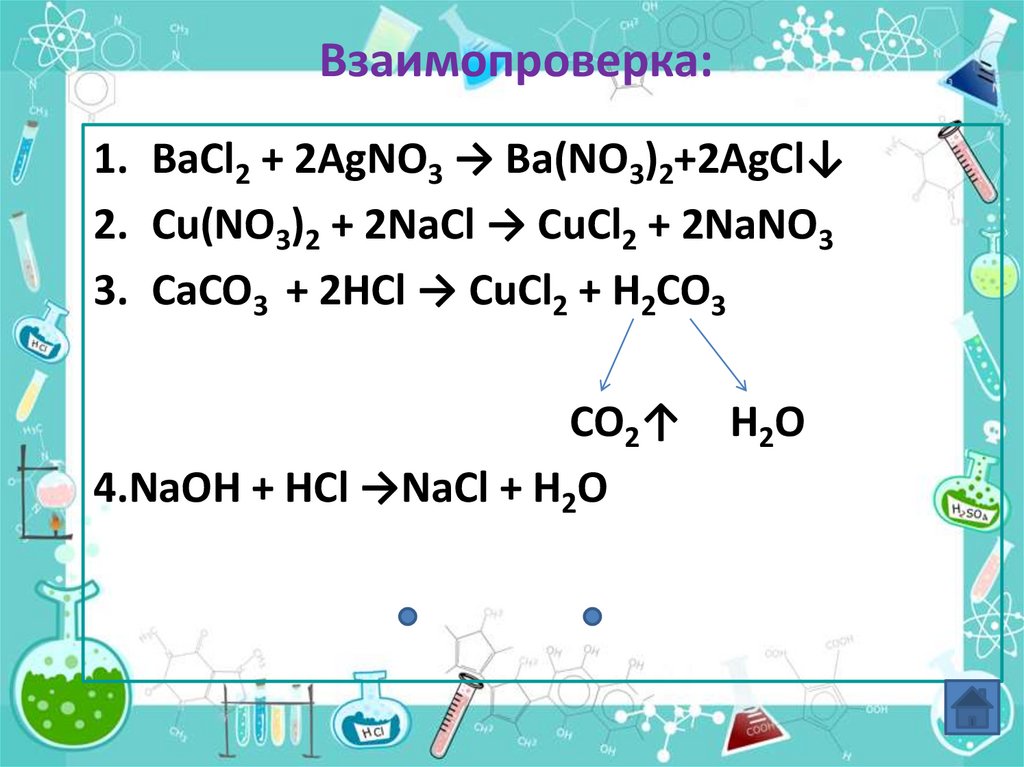
16. Взаимопроверка:
1. BaCl2 + 2AgNO3 → Ba(NO3)2+2AgCl↓2. Cu(NO3)2 + 2NaCl → CuCl2 + 2NaNO3
3. CaCO3 + 2HCl → CuCl2 + H2CO3
CO2↑
4.NaOH + HCl →NaCl + H2O
H2O
17. Допишите уравнения реакций и укажите их тип по признаку « число и состав исходных веществ и продуктов реакции»
А)K2O + N2O5 → KNO3 реакция…Б)Fe2O3 + C → Fe + CO2 реакция…
В) Fe2O3 + HCL →…………………… реакция…
Г) Fe(OH)3 → Fe2O3 + H2O -реакция…
Д) AI(OH)3 + H2SO4 → ……………- реакция…
E) N2O5 + H2O → HNO3 реакция……
18. Рефлексия
«Суди себя сам. Это самое трудное. Себясудить куда труднее, чем других. Если ты
сумеешь правильно судить себя, значит,
ты поистине мудр.»
Антуан де Сент-Экзюпери
19. Домашнее задание
«§ 32 №4-6 с.168Исследовательская работа» (на
карточках)
20. Желаю вам успехов в изучении химии ! Спасибо за внимание!
21. Задание 1 Укажите тип химической реакции
Расставьте коэффициенты в уравненияххимических реакций, назовите образовавшиеся
соединения:
Ca + O2 = CaO
Li + O2 = Li2O
SO2 + O2 = SO3
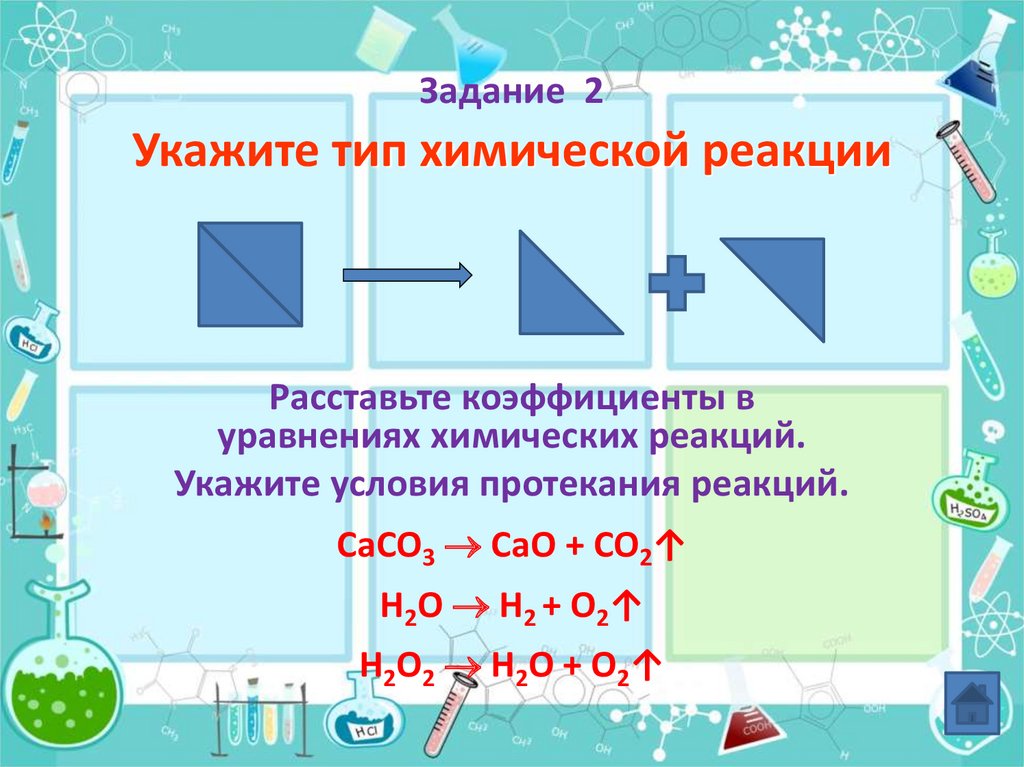
22. Задание 2 Укажите тип химической реакции
Расставьте коэффициенты вуравнениях химических реакций.
Укажите условия протекания реакций.
CaCO3 CaO + CO2↑
H2O H2 + O2↑
H2O2 H2O + O2↑
23. Задание 3. Укажите тип химической реакции
H Cl+
Zn = Zn Cl2 + H2↑
Какие вещества принимают участие
в химической реакции?
Расставьте коэффициенты в уравнении реакции.
2 HCl + Zn = Zn Cl2 + H2↑
сложное + простое = сложное + простое
вещество вещество вещество вещество
24.
Задание 4для самостоятельного выполнения
10
90
8
7
6
5
4
3
2
1
2 Na + Cl2 → 2 Na Cl
H2CO3 → H2O + CO2 ↑
2 Fe(OH)3 → Fe2O3 + 3 H2O
4 Al + 3 O2 → 2 Al2O3
Na2O + H2O → 2 Na OH
3 K2O + P2O5 → 2 K3PO4
2 Ag Br → 2 Ag + Br2
Расставьте коэффициенты в уравнениях химических реакций,
определите тип реакции (время выполнения 3 минуты).
25. Задание 5
Используя ряд активности металлов,Li K Ba Ca Na Mg Al Mn Zn Cr Co Fe Sn Pb H2 Cu Hg Ag Au
продолжите возможные уравнения реакций:
• Mg + HCl =
• Fe + HCl =
• Cu + HCl =
• NaOH + HCl =





















 Химия
Химия








