Похожие презентации:
Химические реакции. Типы химических реакций
1.
ХИМИЧЕСКИЕ РЕАКЦИИ.ТИПЫ ХИМИЧЕСКИХ
РЕАКЦИЙ
2.
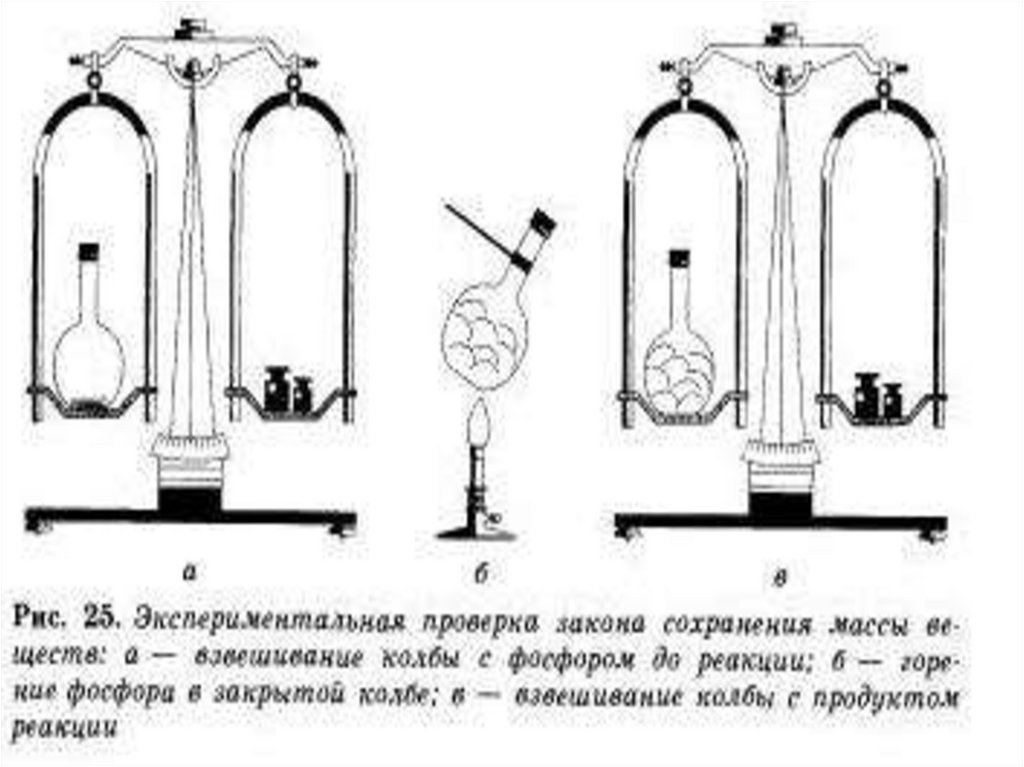
М.В.Ломоносов в1748 г. впервые
сформулировал и
экспериментально
доказал закон
сохранения массы
веществ
3.
4. Формулировка закона:
Масса веществ,вступивших в химическую
реакцию, равна массе
образовавшихся веществ.
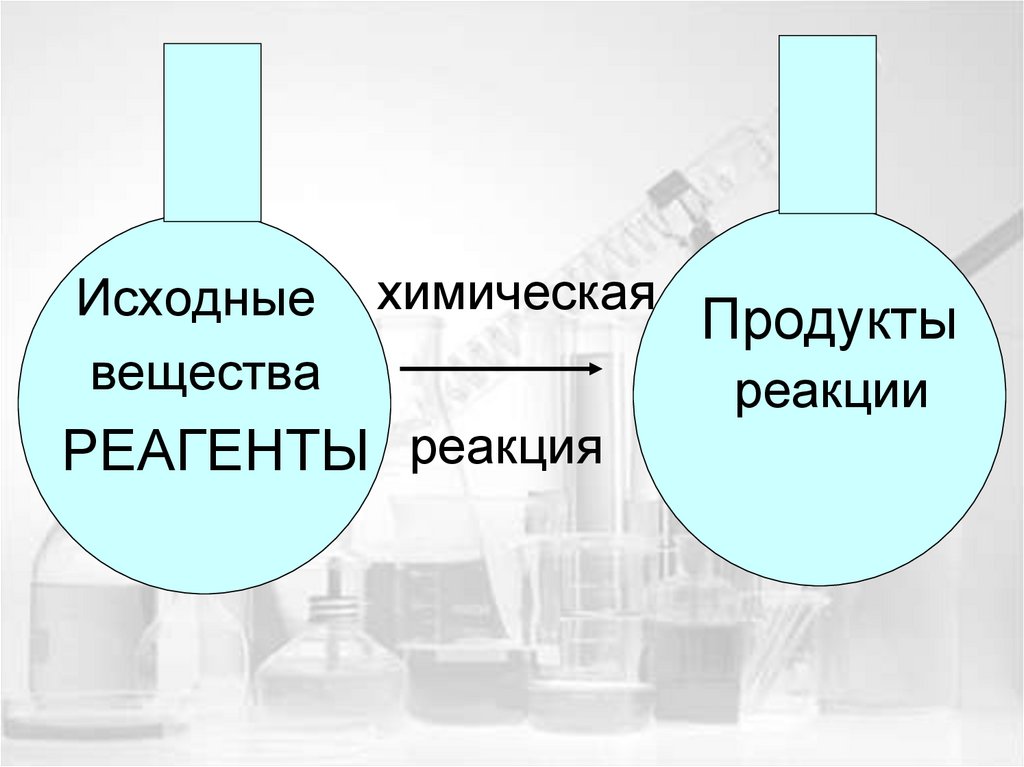
5.
Исходныевещества
химическая
РЕАГЕНТЫ реакция
Продукты
реакции
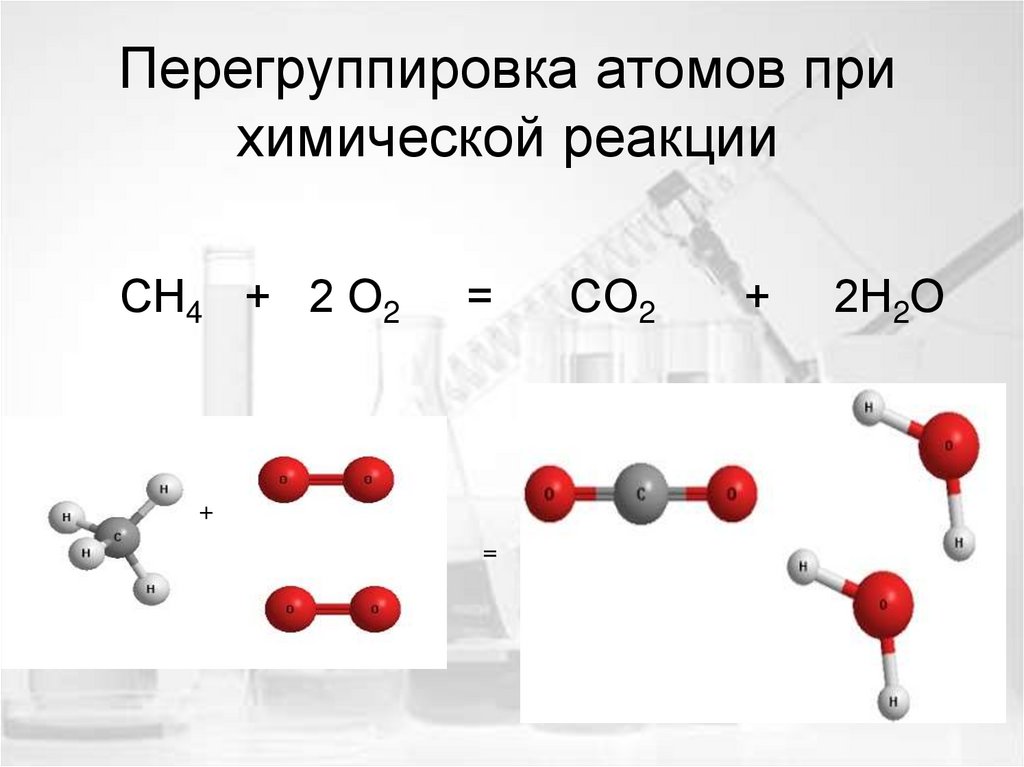
6. Атомы не появляются и не исчезают при химической реакции
7. Перегруппировка атомов при химической реакции
СН4 + 2 О2=
+
СО2
+
2Н2О
=
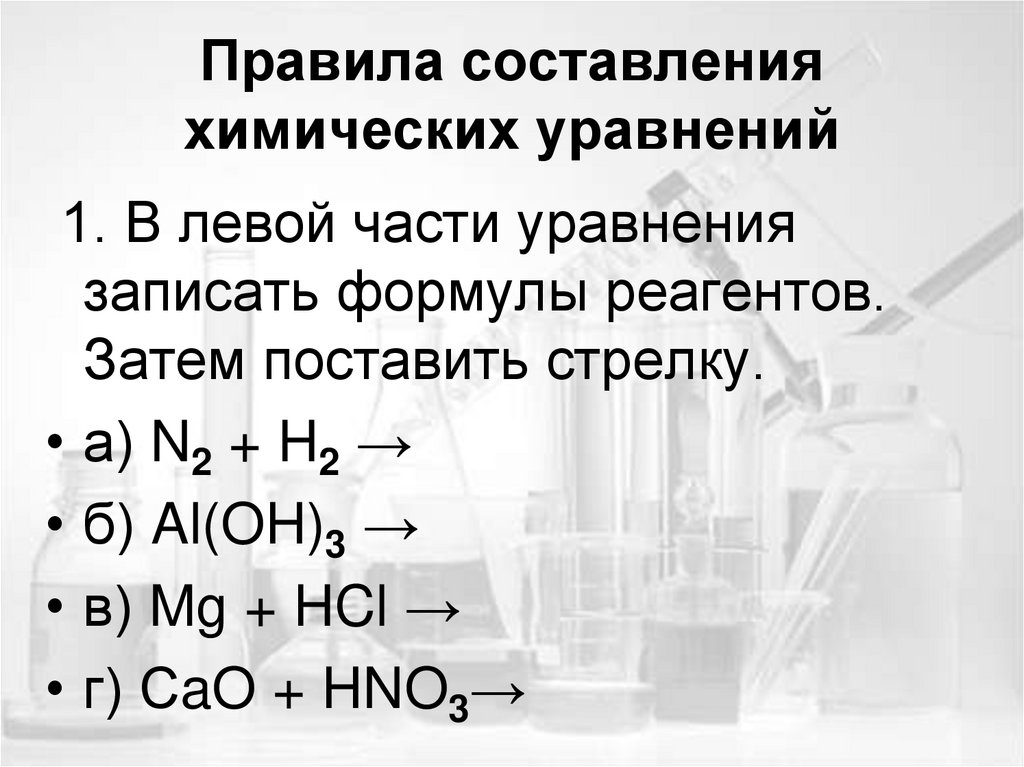
8. Правила составления химических уравнений
1. В левой части уравнениязаписать формулы реагентов.
Затем поставить стрелку.
• а) N2 + H2 →
• б) Al(OH)3 →
• в) Mg + HCl →
• г) СaO + HNO3→
9.
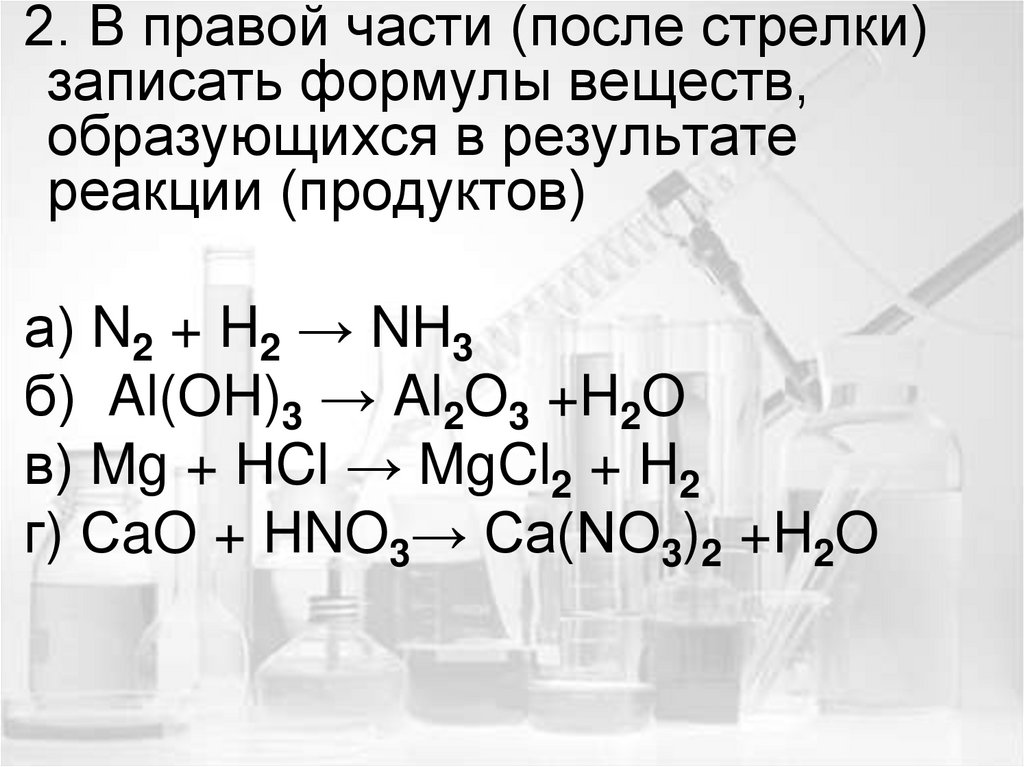
2. В правой части (после стрелки)записать формулы веществ,
образующихся в результате
реакции (продуктов)
а) N2 + H2 → NH3
б) Al(OH)3 → Al2O3 +H2O
в) Mg + HCl → MgCl2 + H2
г) СaO + HNO3→ Ca(NO3)2 +H2O
10.
3. Уравнение реакции составляетсяна основе закона сохранения
массы веществ, т. е. слева и
справа должно быть равное
число атомов. Это достигается
расстановкой коэффициентов
перед формулами веществ.
11.
а) N2 + 3H2 → 2NH3б) 2Al(OH)3 → Al2O3 + 3H2O
в) Mg + 2HCl → MgCl2 + H2
г) СaO + 2HNO3→ Ca(NO3)2 + H2O
12.
Выводы:• Новые вещества не получаются из
ничего и не могут обратиться в ничто.
• При химических реакциях происходит
перегруппировка атомов
• Масса веществ, вступивших в реакцию
равна массе образовавшихся веществ
• При составлении уравнений нужно
соблюдать закон сохранения массы
веществ
13.
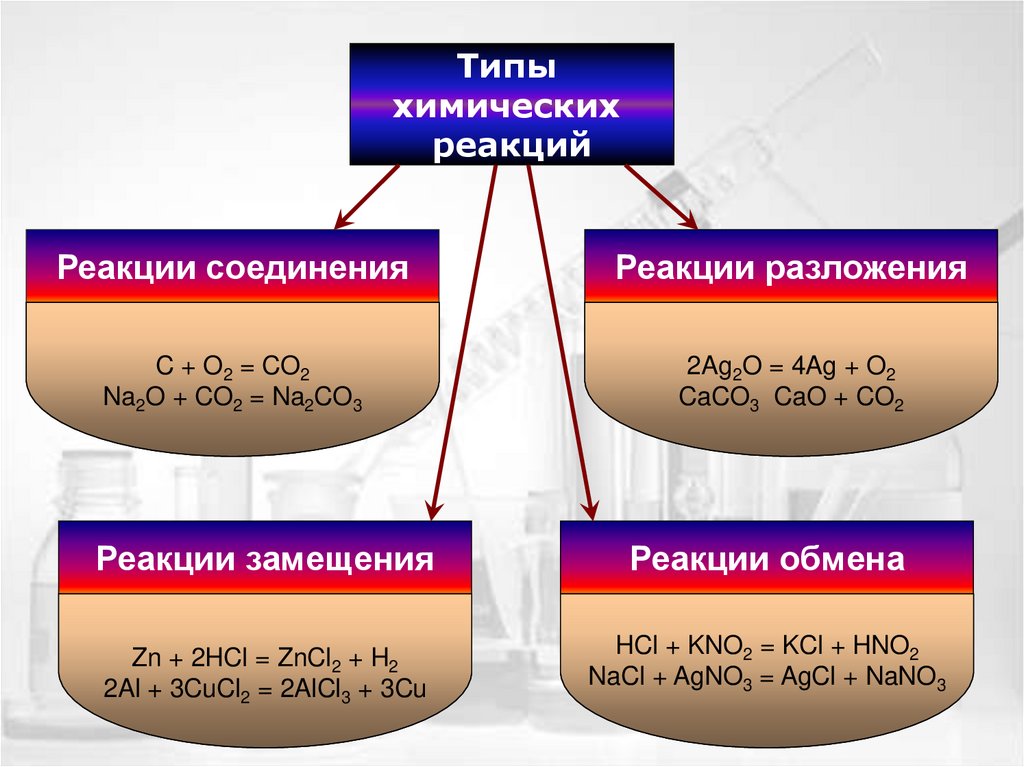
Типыхимических
реакций
Реакции соединения
Реакции разложения
это реакции, в ходе которых
из нескольких простых или
C веществ
+ O2 = CO
2
сложных
образуется
Na2O
+ COвещество
сложное
2 = Na2CO3
это реакции, в ходе которых
из сложного вещества образуется
2Ag2O = 4Ag + O2
несколько
других простых или
CaCO
+ CO2
сложных
3 CaO
веществ
Реакции замещения
Реакции обмена
это реакции, в ходе которых
в результате взаимодействия
Zn + 2HCl
= ZnCl
простого
и сложного
вещества
2 + H2
простое
2Alобразуются
+ 3CuCl2другое
= 2AlCl
3 + 3Cu
и другое сложное вещества
это реакции, в ходе которых
в результате взаимодействия
HCl
+ KNO2 = KCl + HNO2
двух сложных
веществ
NaCl
+
AgNO
=
AgCl
+ NaNO3
образуются два
3 других сложных
вещества
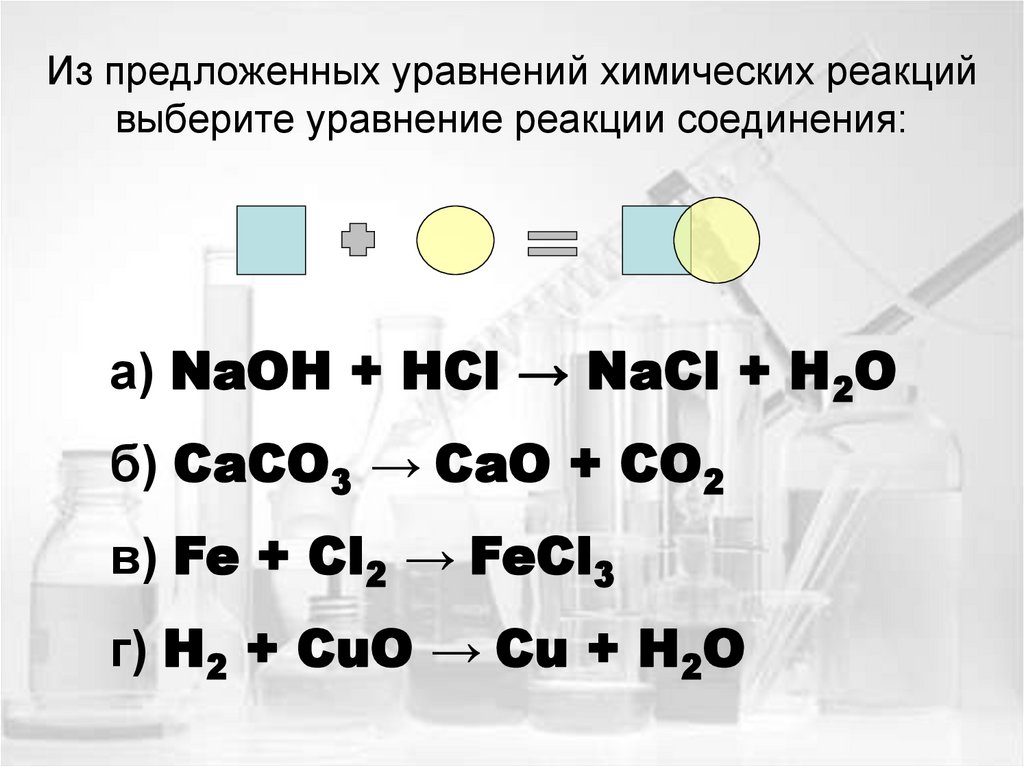
14. Из предложенных уравнений химических реакций выберите уравнение реакции соединения:
а) NaOH + HCl → NaCl + H2Oб) CaCO3 → CaO + CO2
в) Fe + Cl2 → FeCl3
г) H2 + CuO → Cu + H2O
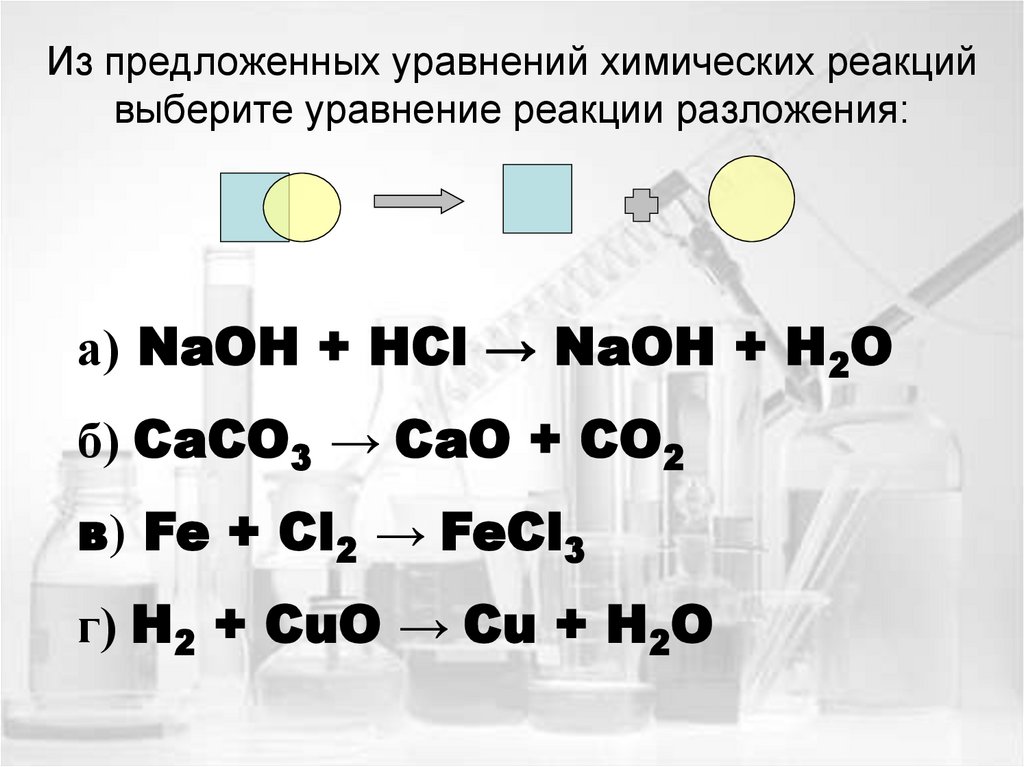
15. Из предложенных уравнений химических реакций выберите уравнение реакции разложения:
а) NaOH + HCl → NaOH + H2Oб) CaCO3 → CaO + CO2
в) Fe + Cl2 → FeCl3
г) H2 + CuO → Cu + H2O
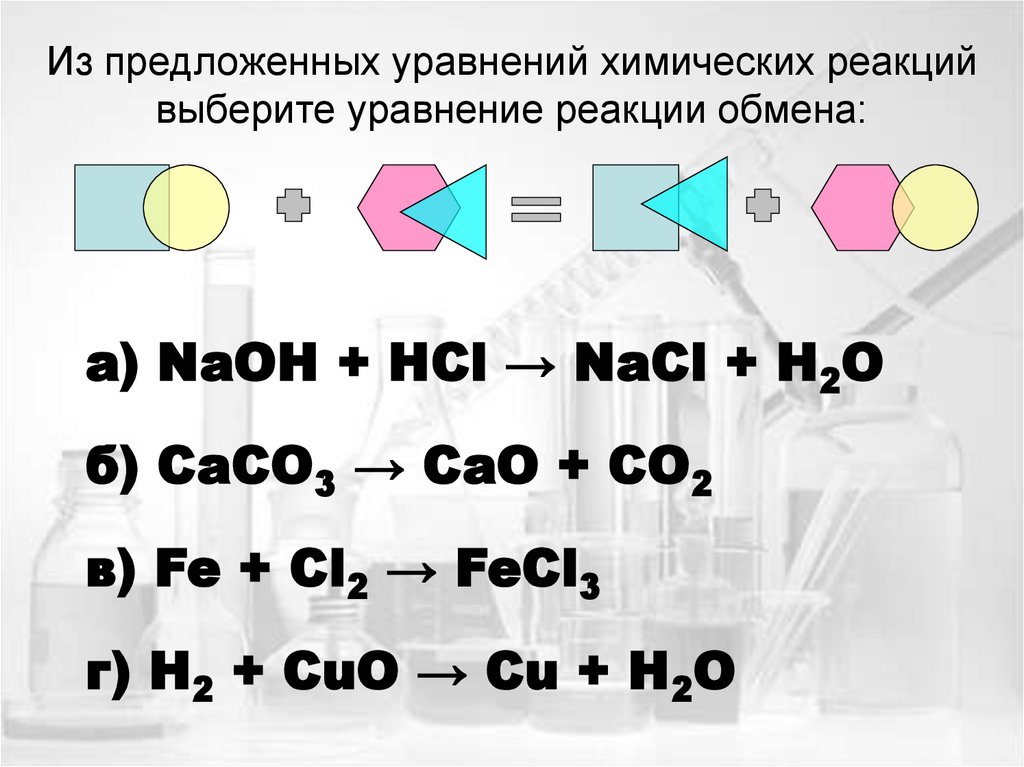
16. Из предложенных уравнений химических реакций выберите уравнение реакции обмена:
а) NaOH + HCl → NaСl + H2Oб) CaCO3 → CaO + CO2
в) Fe + Cl2 → FeCl3
г) H2 + CuO → Cu + H2O
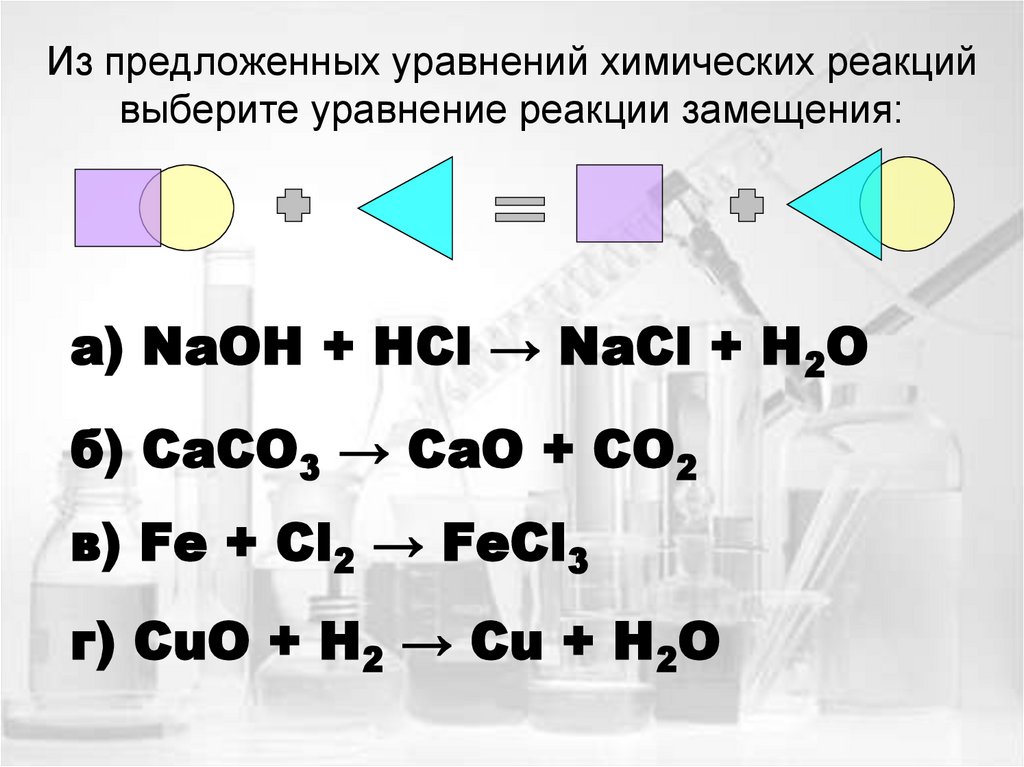
17. Из предложенных уравнений химических реакций выберите уравнение реакции замещения:
а) NaOH + HCl → NaCl + H2Oб) CaCO3 → CaO + CO2
в) Fe + Cl2 → FeCl3
г) CuO + H2 → Cu + H2O
18. Расставьте коэффициенты, преобразовав схемы в уравнения реакций
1) Ca + S CaS6) Mg + Cl2 MgCl2
2) Al + S Al2S3
7) H2 + Cl2 HCl
3) Al + P AlP
8) N2 + O2 NO
4) Ca + P Ca3P2 9) Na + H2 NaH
5) K + O2 KO2
10) P + O2 P2O5
19.
20. Расставьте коэффициенты, преобразовав схемы в уравнения реакций
1) Fe2O3 + H2 H2O + Fe2) PbO + Al Al2O3 + Pb
3) Cr2O3 + Mg MgO + Cr
4) Al + H2O Al(OH)3 + H2
5) H2O + K H2 + KOH
6) I2 + H2S S +HI
21. Расставьте коэффициенты, преобразовав схемы в уравнения реакций
1) KClO3 KCl + O22) Al(OH)3 Al2O3 + H2O
3) NaNO3 NaNO2 + O2
4) NaOH + H2SO4 Na2SO4 + H2O
5) LiOH + H3PO4 Li3PO4 + H2O
6) FeCl3 + NaF FeF3 + NaCl





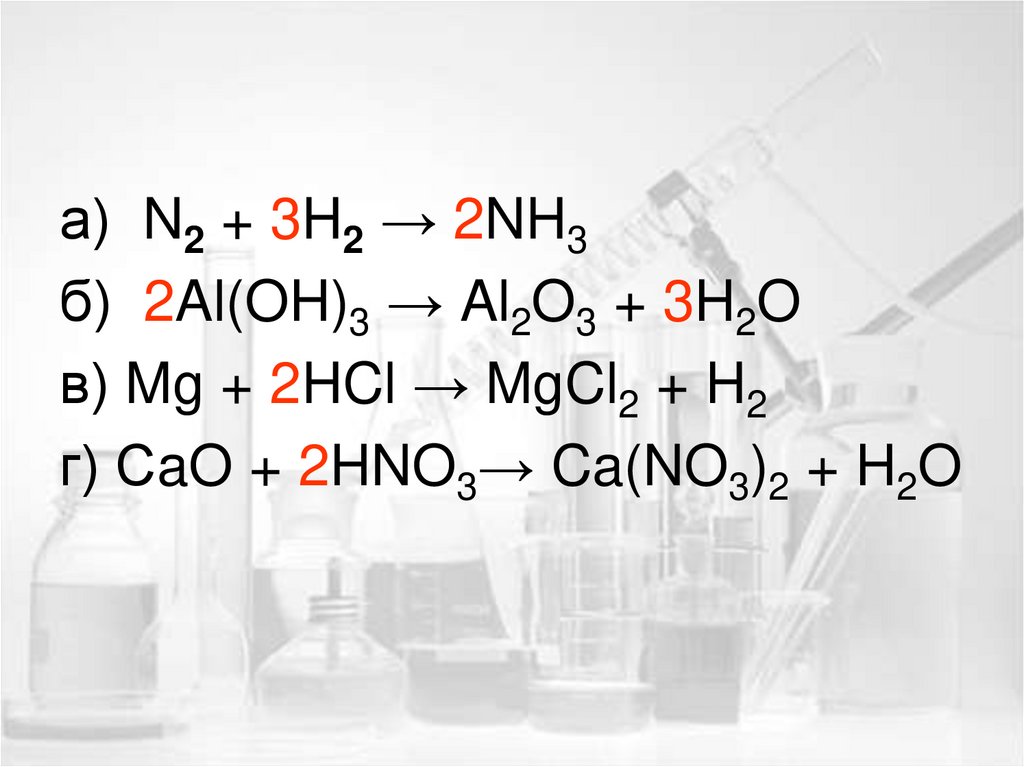





 Химия
Химия








