Похожие презентации:
Фосфор. История открытия
1.
Фосфор2. История открытия.
Фосфор открыт гамбургским алхимикомХеннигом Брандом в 1669 году. Подобно
другим алхимикам, Бранд пытался
отыскать эликсир жизни или философский
камень, а получил светящееся вещество.
Существуют данные, что фосфор умели
получать еще арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал
Лавуазье.
3.
4. Название элемента.
Название «фосфор» происходит отгреческих слов «фос» — свет и
«феро» — несу.
В древнегреческой мифологии имя
Фосфор (или Эосфор, греч.
Φώσφορος) носил страж Утренней
звезды.
5. Строение атома фосфора.
Фосфор – элемент №15 – расположенв 3 периоде, в V группе
Периодической системы элементов.
Схема строения атома:
Р +15 ) ) )
2 8 5
6. Фосфор – простое вещество.
В обычных условиях фосфор – этонесколько аллотропных
модификаций:
белый, красный и черный фосфор.
7. Белый фосфор.
Это белая прозрачнаявоскообразная масса (при
охлаждении становится хрупкой)
или прозрачные кристаллы похожие на
алмазы. Светится в темноте.
Белый фосфор химически активеное
вещество. Белый фосфор – яд!!!
(поражение костей, костного мозга,
некроз челюстей)
8. Свечение белого фосфора.
9. Применение белого фосфора.
Основная часть фосфора (около 90%) идетна производство фосфорной кислоты
Н3РО4.
Для получения соединений фосфора.
Дымообразующее и зажигательное
средство; для изготовления боеприпасов.
10. Красный фосфор.
Это красно-коричневыекристаллы. Загорается
в воздухе при поджигании.
Не ядовитый!
Красный фосфор используется в
металлургии, производстве
полупроводниковых материалов и ламп
накаливания, используется производстве
спичек.
11. Горение красного фосфора.
12.
13. Чёрный фосфор.
Это чёрные кристаллыс металлическим
блеском, не растворим в
воде и органических растворителях.
Хорошо проводит электрический ток.
Используется как полупроводник.
14. Химические свойства фосфора.
ОкислительВосстановитель
1. С металлами — окислитель, 1. Фосфор легко окисляется
кислородом:
образует ФОСФИДЫ:
2P + 3Ca → Ca3P2
4P + 5O2 → 2P2O5
(с избытком кислорода),
4P + 3O2 → 2P2O3
(при медленном окислении или при
недостатке кислорода).
2. С неметаллами — восстановитель:
2P + 3S → P2S3,
2P + 3Cl2 → 2PCl3.
! Не взаимодействует с водородом.
3. Сильные окислители превращают фосфор в
фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
4. Реакция окисления также происходит при
поджигании спичек, в качестве окислителя
выступает бертолетова соль:
15. Нахождение фосфора в природе.
В земной коре содержится около 0,08%фосфора. В природе фосфор содержится
в виде соединений – минералов
(апатиты и фосфориты).
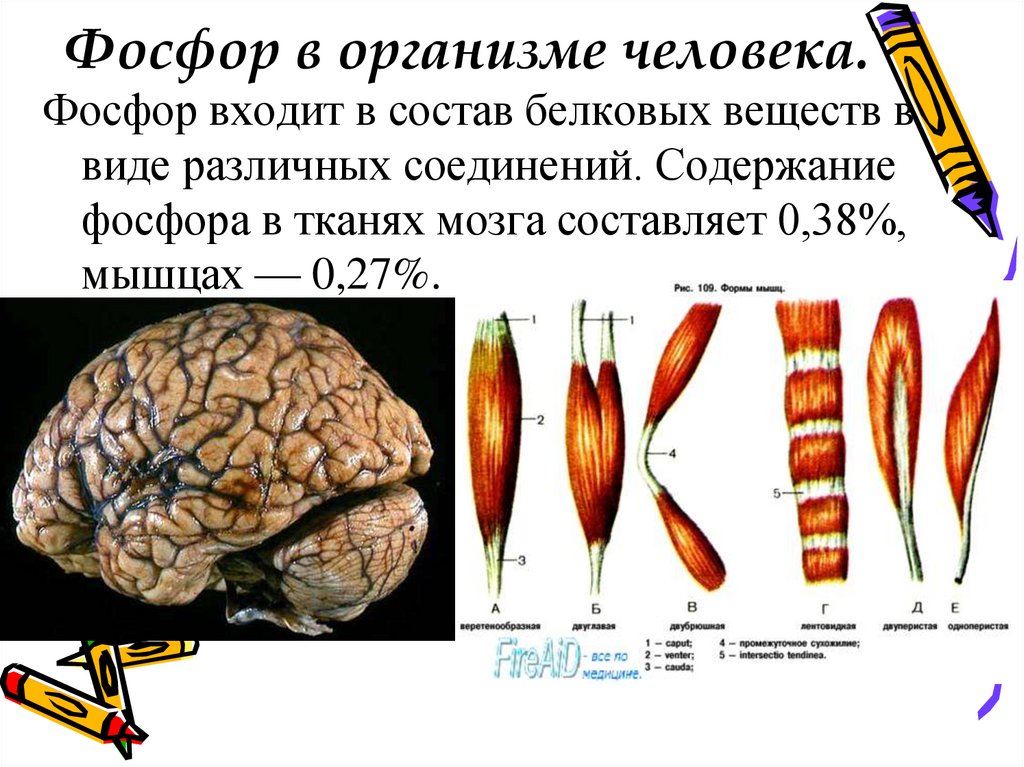
16. Фосфор в организме человека.
Фосфор входит в состав белковых веществ ввиде различных соединений. Содержание
фосфора в тканях мозга составляет 0,38%,
мышцах — 0,27%.
17.
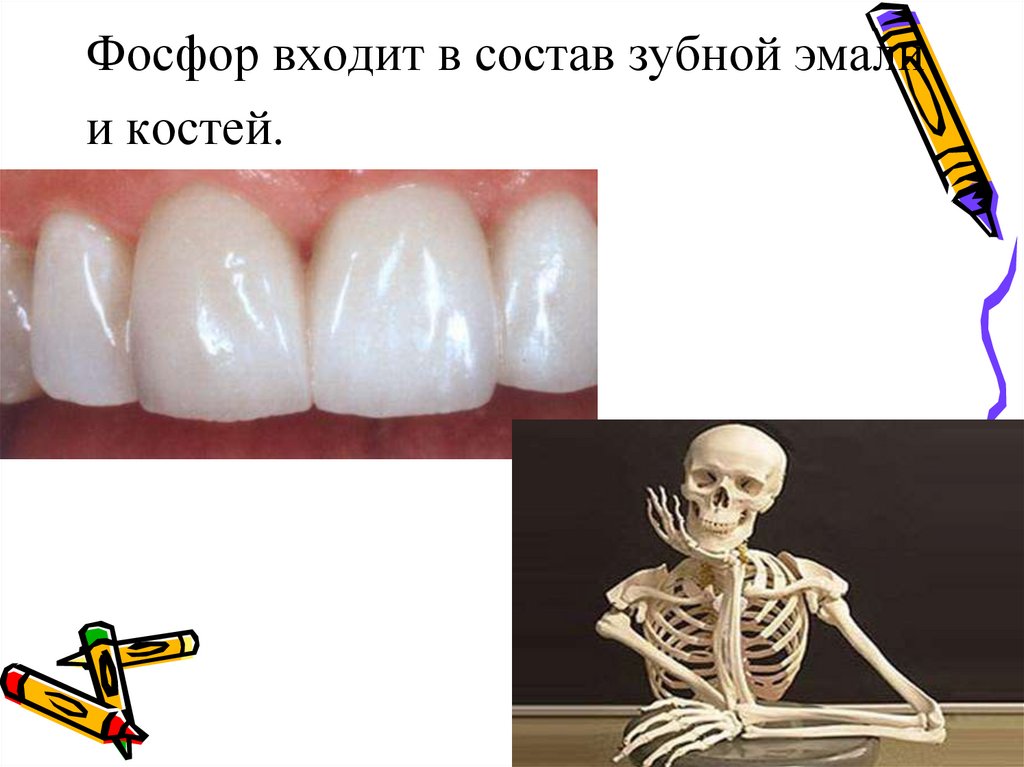
Фосфор входит в состав зубной эмалии костей.
















 Химия
Химия








